Corona-Virus
Neutralisierende Antikörper bei COVID-19
Die European Medicines Agency (EMA) hat am 12. November 2021 für Casirivimab/Imdevimab (Ronapreve©) sowie Regdanvimab (Regkirona©) eine Zulassungsempfehlung für die Europäische Union ausgesprochen. Ronapreve© ist auch zur Prä- und Postexpositionsprophlyaxe (PreP und PEP) zugelassen. Neben der parenteralen Applikation ist auch eine subkutane Gabe möglich, was eine PrEP und PEP bei Risikopatienten erstmals auch im ambulanten Bereich mit geringem Aufwand ermöglicht. In Deutschland stehen derzeit die Kombinationspräparate Casirivimab/Imdevimab und das nicht zugelassene Bamlanivimab/Etesevimab durch die Beschaffung im Rahmen der Bundesnotfallreserve zur Verfügung. Für letzteres Präparat wurde der Antrag auf Zulassung durch den Hersteller zurückgezogen, die Verwendung ist nach Vorgaben des Paul-Ehrlich-Instituts (PEI) und des Bundesministeriums für Gesundheit (BMG) jedoch weiterhin auf Boden des § 79 (4) Arzneimittelgesetz möglich. Zudem könnten zwei weitere nMABs in naher Zukunft zur Verfügung stehen: Für das Präparat Sotrovimab ist inzwischen ein Zulassungsantrag bei der EMA gestellt, die Kombination aus Tixagevimab/Cilgavimab befinden sich ebenso im Rolling-Review-Verfahren [1].
Einsatz nMABs zur Prä- und Postexpositions-prophlyaxe gegen SARS-CoV-2
Die Gabe von nMAB als PrEP ist bei Patienten denkbar, die aufgrund einer Immunsuppression oder eines Immundefekts trotz dreifacher aktiver Immunisierung serologisch nicht oder nur unzureichend auf eine aktive Immunisierung ansprechen und zudem ein deutlich erhöhtes Risiko für einen schweren Verlauf vorweisen [2]. Die Überlegung zum Einsatz basiert einerseits auf Ergebnissen einer bereits veröffentlichten Studie, die eine relative Risikoreduktion für eine symptomatische SARS-CoV-2-Infektion von 81,4 Prozent durch die subkutane Gabe von 600/600 mg Casirivimab/Imdevimab bei ambulanten Patienten mit häuslicher SARS-CoV-2-Exposition zeigen konnte [3]. In der Studie konnten außerdem auch 28 Tage nach Applikation noch hohe Serumspiegel nachgewiesen werden, was für einen primärpräventiven Effekt spricht [3]. Zudem liegen mittlerweile Daten als Preprint vor, die eine bis zu hundertprozentige Reduktion laborchemisch nachgewiesener SARS-CoV-2-Infektionen durch die monatliche, subkutane Gabe von 600/600 mg Casirivimab/Imdevimab in nicht infizierten Risikopersonen zeigt [4]. Die durch die EMA empfohlene Initialdosis zur PrEP beträgt 600/600 mg, bei anhaltender Exposition werden monatlich 300/300 mg (intravenös oder subkutan) appliziert, wobei die Erfahrung bislang auf 24 Wochen limitiert ist [5]. Weitere Informationen finden sich in einem Positionspapier, das auf der Internetseite der AWMF abrufbar ist (www.awmf.org/fileadmin/user_upload/Dokumente/20211125_Positionspapier_zur_passiven_Immunisierung_mit_nMABs_Konsensversion_final.pdf).
Eine PEP ist für Ausbrüche im ambulanten und nosokomialen Bereich sowie für Kontaktpersonen bei fehlendem oder unzureichendem Impfschutz bei Vorliegen von Risikofaktoren für einen schweren Verlauf möglich. Die Gabe des nMAB (600/600 mg Casirivimab/Imdevimab intravenös) sollte innerhalb von 96 Stunden nach Exposition erfolgen [5].
Einsatz nMABs zur Behandlung einer SARS-CoV-2-Infektion
Für nMABs konnte eine Wirksamkeit gegen schwere COVID-19-Verläufe gezeigt werden [6 bis 10]. Eine doppelt-verblindete, randomisierte Phase-III-Studie ergab bei ambulanten Patientinnen/Patienten für die Gabe von 2.400 bzw. 1.200 mg Casirivimab/Imdevimab eine relative Risikoreduktion von 71,3 Prozent bzw. 70,4 Prozent für Hospitalisierung oder Tod [7]. Für die kombinierte Gabe von Bamlanivimab/Etesevimab betrug die relative Risikoreduktion für die gleichen Endpunkte 70 Prozent bei ambulanten Patienten mit mildem bis moderatem COVID-19 und Risiko für schweren Verlauf [6]. Insbesondere Patienten mit serologisch nicht nachweisbaren neutralisierenden Antikörpern (anti-Spike oder anti-RBD IgG-Antikörper) profitieren von einer monoklonalen Antikörpertherapie, wohingegen der klinische Nutzen bei Patienten mit Nachweis von neutralisierenden anti-Spike oder anti-RBD IgG-Antikörpern nicht erwiesen ist. Erschwerend hinzu kommt, dass zum gegenwärtigen Zeitpunkt noch kein quantitativer Titergrenzwert für neutralisierende Antikörper etabliert ist, der eine wahrscheinlich ausreichende Immunität vor schweren COVID-19-Verläufen definiert. In den aktuellen Leitlinien zur monoklonalen Antikörpertherapie (bei stationären Patienten) wird deshalb die SARS-CoV-2-Serologie nur qualitativ (anti-Spike IgG oder anti-RBD seronegativ/seropositiv) und nicht quantitativ für die Entscheidungsfindung zum Einsatz bewertet [11].
Insgesamt ist festzuhalten, dass die Behandlung mit nMABs vor allem in der frühen Erkrankungsphase bei seronegativen SARS-CoV-2-Infizierten mit asymptomatischem bis moderatem COVID-19 und Vorliegen mindestens eines Risikofaktors für einen schweren COVID-19-Verlauf sinnvoll ist und von Experten empfohlen wird [12]. Auch bei hospitalisierten, seronegativen Patienten mit maximal low-flow-Sauerstoffbedarf ist die frühe Gabe von Casirivimab/Imdevimab gemäß S3-Leitlinie empfohlen, wobei es sich hierbei zwischenzeitlich aufgrund des Sauerstoffbedarfs formal um eine Off-Label-Anwendung handelt [11]. Die Leitlinien-Empfehlung basiert unter anderem auf einer Cochrane Meta-Analyse, welche 3.153 seronegative Patienten umschließt [13]. Als Einzelfallentscheidung kann auch bei seronegativen Patienten mit kritischem Krankheitsverlauf eine Therapie mit Casirivimab/Imdevimab diskutiert werden [14], wobei beachtet werden muss, dass im Einzelfall schwere Reaktionen mit klinischer Verschlechterung in dieser Population beschrieben sind (siehe unten).
Praktische Aspekte der Verabreichung
Die in Deutschland verfügbaren Präparate der Bundesnotfallreserve werden derzeit über ausgewählte Apotheken bereitgestellt [15]. Im Allgemeinen ist in ambulanten Studien eine gute Verträglichkeit der verschiedenen Wirkstoffe beschrieben worden [6 bis 10, 13, 16], wobei gelegentlich infusions-bedingte Reaktionen (beispielsweise Übelkeit, Schwindel, Hautausschlag oder Hypersensibilitätsreaktionen) auftreten [17]. Die Datenlage zur Sicherheit bei der Anwendung hospitalisierter Patienten ist jedoch ausbaufähig. Potenziell besteht das Risiko einer hyperinflammatorischen Reaktion im Sinne eines Antibody-dependent disease enhancement. Die Gabe sollte daher nur von medizinischem Fachpersonal unter geeigneten Rahmenbedingungen durchgeführt werden, zudem müssen die Patienten anschließend mindestens eine Stunde überwacht werden. Bei Verdacht einer Nebenwirkung sollte eine Meldung an das PEI erfolgen, zudem ist die Dokumentation von Basisdaten und dem Ausgang der Erkrankung ratsam. Die Erstattung der Kosten für den therapeutischen Einsatz ist in der Monoklonale-Antikörper-Verordnung (MAKV) des Bundes geregelt. Seit der Änderung der MAKV vom 23. November 2021 sind auch die Rahmenbedingungen für den prophylaktischen Einsatz von nMAB geschaffen. Für den klinisch regelhaften therapeutischen Einsatz bei nachgewiesener SARS-CoV-2-Infektion empfehlen die Autoren:
» Sofern eine tagesaktuelle anti-Spike IgG-oder anti-RBD-Antiköperdiagnostik nicht verfügbar ist, kann gemäß der S3-Leitlinie zur stationären Therapie von Patienten mit COVID-19 bei unvollständiger Immunisierung oder Vorliegen einer schweren Immunsuppression sowie früher Infektion (PCR < 3 Tage positiv oder ≤ 7 Tage Symptombeginn) bei stationärer Behandlung auf eine Antikörperdiagnostik verzichtet werden [11], was auch auf ambulante Patienten übertragbar sein dürfte.
» Die empfohlene Dosierung für die therapeutische Anwendung beträgt nach Fachinformation 600/600 mg Casirivimab/Imdevimab für Erwachsene > 40 kg. Für höhere Dosen besteht keine Zulassung und in Studien konnte kein eindeutiger klinischer Zusatznutzen gezeigt werden. Die im Rahmen der Bundesnotfallreserve zur Verfügung gestellten Dosen (Casirivimab/Imdevimab) können in Absprache mit den Apotheken für Multidosing genutzt werden. Eine DosisWirkunsgbeziehung höherer Dosierungen ist nicht gezeigt, weshalb diese aus Sicht der Autoren nicht zum Einsatz kommen sollten.
» Die Applikation kann subkutan oder intravenös erfolgen [5]. Gemäß Fachinformation zur Therapie einer SARS-CoV-2-Infektion wird empfohlen, die subkutane Applikation nur dann zu präferieren, wenn eine intravenöse Anwendung nicht möglich ist bzw. zu einer Verzögerung der Behandlung führen würde. Hintergrund ist die insuffiziente Studienlage zur klinischen Wirksamkeit der subkutanen Gabe und Hinweise für eine geringere Serumexposition im Vergleich zur parenteralen Gabe. Bei parenteraler Infusion muss die Infusionsdauer mindestens 20 Minuten betragen. Im Anschluss sollten die Patienten mindestens 60 Minuten auf seltene anaphylaktische Reaktionen überwacht werden.
» Im Vergleich zu anderen monoklonalen Antikörpern (Bamlanivimab) weist die Kombination aus Casirivimab/Imdevimab eine gute wirksame Neutralisationsaktivität gegen die derzeit in Deutschland vorherrschende Delta-Variante auf.
» Bezüglich der Sicherheit und Effektivität von SARS-CoV-2-Imfpstoffen nach passiver Immunisierung mit nMAB gibt es noch wenig Daten, die Centers for Disease Control and Prevention (CDC) empfiehlt, nach therapeutischer Anwendung 90 Tage Abstand zur Impfung einzuhalten [18].
Beispiel eines Antikörpertherapiezentrums am Klinikum rechts der Isar
Am Klinikum rechts der Isar wurde eine Ambulanz zur monoklonalen Antikörpertherapie bei SARS-CoV-2-Infizierten eingerichtet, mit dem Ziel schwere Verläufe und Hospitalisierungen vorzubeugen. Nach ärztlicher Indikationsstellung werden ambulanten, adulten SARS-CoV-2-infizierten Patienten (Symptome und/oder Erregernachweis ≤ 7 Tage) mit asymptomatischem oder mildem Verlauf, Vorhandensein mindestens eines Risikofaktors für einen schweren Verlauf und fehlendem Nachweis neutralisierender Antikörper gegen SARS-CoV-2 als Einmalgabe derzeit das Kombinationspräparat Casirivimab/Imdevimab (600/600 mg) appliziert.
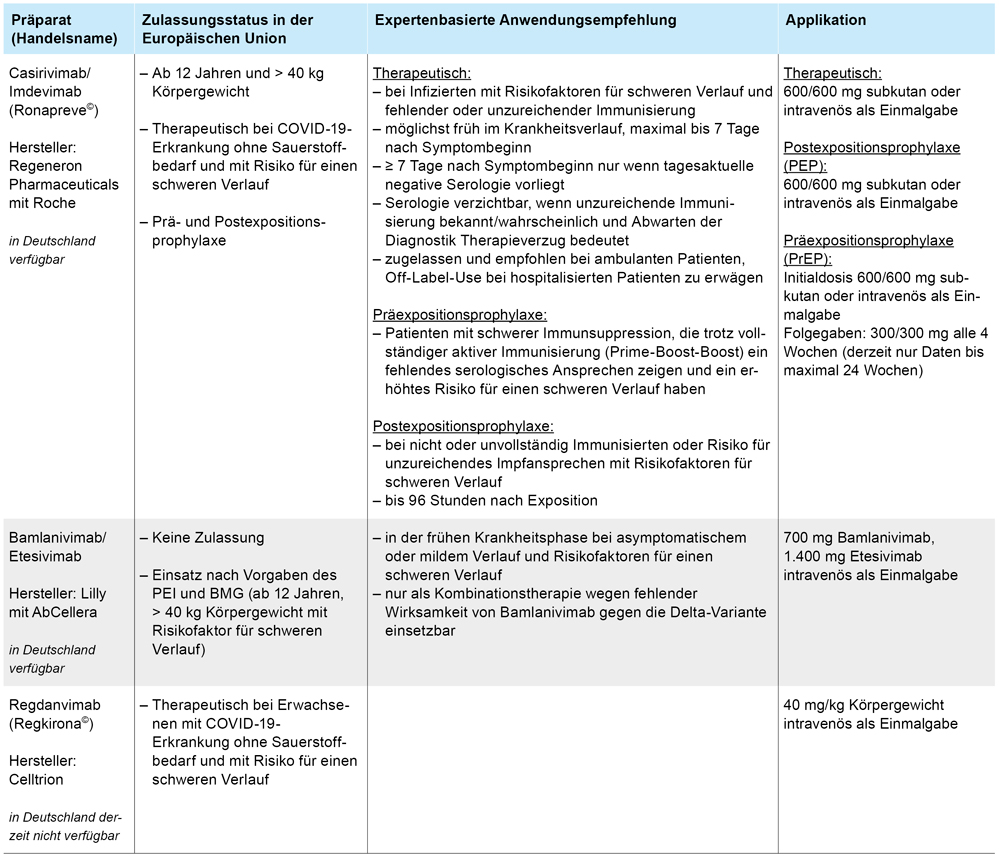
Zugelassene oder in Deutschland verfügbare neutralisierende monoklonale Antikörper und ihre Einsatzbereiche (Stand: 25. November 2021)
Zusammenfassung
Der Einsatz monoklonaler Antikörper ist eine effektive und gut verträgliche Therapie für Patienten in der frühen (viralen) Phase der SARS-CoV-2-Infektion zur Prävention einer schweren COVID-19-Erkrankung. Insbesondere Patienten mit Risikofaktoren für einen schweren Verlauf und serologisch nicht nachweisbaren neutralisierenden Antikörpern profitieren von dieser Behandlungsmöglichkeit. Da Patienten während der frühen SARS-CoV-2-Infektion aufgrund milder Beschwerdesymptomatik in der Regel noch nicht hospitalisiert sind, ist der Aufbau weiterer ambulanter Antikörpertherapiezentren wünschenswert und sinnvoll. Auch der Einsatz monoklonaler Antikörper zur Prä- und Postexpositionsprophylaxe in Deutschland erscheint perspektivisch eine wirksame Option für Patienten, die nach aktiver Immunisierung keine ausreichende Immunität aufbauen können und im Falle einer SARS-CoV-2-Infektion ein stark erhöhtes Risiko für einen schweren COVID-19-Verlauf haben.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Erklärung zu Interessenskonflikten:
Privatdozent Dr. Christoph D. Spinner gibt an, Honorare für Vorträge und Gelder für Sachmittel von Eli Lilly, Roche, Gilead, AbbVie, GSK, MSD, SOBI, Formycon, B. Braun, Apeiron und AstraZeneca erhalten zu haben.
Privatdozent Dr. Jochen Schneider gibt an, Honorare für Vorträge von Gilead, AbbVie und Dr. Falk Pharma GmbH erhalten zu haben.
Die anderen Autoren erklären keine Interessenskonflikte.
Autoren
Dr. Johanna Erber
Dr. Roman Iakoubov
Universitätsprofessor Dr. Roland M. Schmid
Privatdozent Dr. Fabian Geisler
Privatdozent Dr. Christoph D. Spinner
Privatdozent Dr. Jochen Schneider
Technische Universität München, Fakultät für Medizin, Klinikum rechts der Isar, Klinik und Poliklinik für Innere Medizin II, Ismaninger Str. 22, 81675 München
Korrespondenzadresse:
Privatdozent Dr. Jochen Schneider, Oberarzt Infektiologie, Klinikum rechts der Isar, Technische Universität München, Ismaninger Str. 22, 81675 München, Telefon 089 4140-7553, Fax 089 4140-7555


 Corona-Virus
Corona-Virus