Seltene Erkrankungen – Differenzialdiagnose und Suchstrategien
 Differenzíaldiagnose und Suchtstrategien
Differenzíaldiagnose und Suchtstrategien
In der Europäischen Union (EU) gilt eine Erkrankung als selten, wenn nicht mehr als fünf von 10.000 Menschen in der EU von ihr betroffen sind. Das „Bayerische Ärzteblatt“ greift in der Serie „Seltene Erkrankungen“ sowohl methodische und systematische Aspekte auf und berichtet auch über einzelne seltene Erkrankungen (SE). Ziel ist es, durch die verschiedenen Beiträge, die Befassung mit diesem heterogenen Thema anzuregen und eine Sensibilisierung zu erreichen.
Im fünften Teil der Serie schreibt Privatdozent Dr. Philipp Moog über Differenzialdiagnose und Suchstrategien.
Die Diagnostik seltener Erkrankungen gewinnt in allen medizinischen Disziplinen zunehmend an Bedeutung. Dabei stehen dem niedergelassenen oder im Krankenhaus tätigen Arzt eine Vielzahl moderner diagnostischer Methoden zur Verfügung. Erschwert wird der Prozess der Diagnosestellung jedoch durch Faktoren wie Kostendruck und Zeitmangel. Auch die zunehmende und sicherlich notwendige Spezialisierung führt gerade in internistischen Fachbereichen dazu, dass zum Beispiel Erkrankungen mit Multiorganbeteiligung häufig nicht erkannt werden, obwohl mehrere Experten parallel oder sequenziell daran arbeiten. Der vorliegende Beitrag soll anhand eines Fallbeispiels Besonderheiten bei der Diagnostik seltener Erkrankungen erläutern. Er soll dabei auch Einblicke in klinische Entscheidungsprozesse ermöglichen, die auf einer Kombination aus intuitiver und analytischer Denkweise basieren.
Fallbeschreibung
Ein 45-jähriger Dialysepatient wurde zur Vervollständigung der Diagnostik für eine geplante Transplantationslistung auf die nephrologische Station aufgenommen. Die rasch fortschreitende chronische Nierenerkrankung war fünf Jahre zuvor aufgefallen, konnte aber trotz Nierenbiopsie keiner spezifischen Erkrankung zugeordnet werden (Diagnose: „globale Glomerulosklerose und interstitielle Fibrose“). Zudem hatte der Patient etwa im gleichen Zeitraum auch eine langsam progrediente Belastungsdyspnoe entwickelt, die auf eine idiopathische Kardiomyopathie mit zum Aufnahmezeitpunkt bereits hochgradig eingeschränkter linksventrikulärer Pumpfunktion zurückzuführen war.
Weitere Vorerkrankungen waren
• ein insulinpflichtiger Diabetes mellitus seit ca. zehn Jahren
• eine Innenohrschwerhörigkeit seit dem 25. Lebensjahr
• eine Hyperthyreose mit Zustand nach Radioiodtherapie ein Jahr vor dem aktuellen Aufenthalt
• eine fibrosierende schmerzhafte Gynäkomastie
• ein Reizdarmsyndrom.
Der Patient war im Vorfeld in mehreren Kliniken zur diagnostischen Aufarbeitung und zur Evaluation einer kombinierten Organtransplantation (Herz/Niere). Nach umfangreicher apparativer Diagnostik und Nierenbiopsie wurde keine erklärende Diagnose gefunden. Ein Morbus Fabry war als mögliche Ursache einer Kardiomyopathie und einer Nephropathie ausgeschlossen worden. Sowohl die Nieren- als auch die Herzerkrankung wurden als idiopathisch klassifiziert, und eine kombinierte Organtransplantation wurde als zu risikoreich erachtet.
1. Analyse des bisherigen Krankheitsverlaufs
Der wahrscheinlich wichtigste Schritt bei der Diagnose einer seltenen Erkrankung ist die Entwicklung des Verdachts, es mit einer solchen zu tun zu haben. Dann erst entsteht die Bereitschaft, diagnostische Wege einzuschlagen, die außerhalb der Routine liegen.
Auch wenn in diesem Fall der Auftrag für das Stationsteam vermeintlich einfach war, nämlich das Abarbeiten einer Liste von technischen Untersuchungen für eine Transplantationslistung, fielen doch einige Ungereimtheiten in der Vorgeschichte auf, die zu einer erneuten Aufarbeitung führten.
Zur Art des Diabetes mellitus gab es verschiedene Angaben. Er wurde mal als Typ 1 und mal als Typ 2 aufgeführt. Der Patient gab an, dass er anfangs für eine kurze Zeit mit oralen Antidiabetika behandelt worden war, dann aber recht bald Insulin benötigte. Ungewöhnlich war für einen Typ 2-Diabetes ein eher kachektischer Habitus und für einen Typ 1 die späte Manifestation und die Initialtherapie ohne Insulin.
Dass die Genese der Hyperthyreose ungeklärt war, störte ebenso wie die persistierende Innenohrschwerhörigkeit nach einem vermeintlichen beidseitigen Hörsturz.
Auch berichtete der Patient in der systematischen Anamnese von Symptomen, die noch gar keiner organspezifischen Diagnose zugeordnet werden konnten: rezidivierende generalisierte Myalgien, eine ungewollte Gewichtsabnahme von 10 kg in den vergangenen beiden Jahren und anfallsweise auftretende abdominelle Schmerzen mit wechselnder Obstipations- und Diarrhoeneigung. Besonders bemerkenswert war jedoch eine positive Familienanamnese für Diabetes mellitus, und Innenohrschwerhörigkeit bei Verwandten ersten Grades.
Kognitiver Bias und systembedingte Ursachen erschweren die Diagnose seltener Erkrankungen
Verschiedene individuelle und systembedingte Faktoren können einen Diagnoseprozess bei einer seltenen Erkrankung wie in unserem Fall behindern [2]. Bei den individuellen Faktoren, die zu einer Unter- und somit Fehldiagnose führen, spielen kognitive Verzerrungen die größte Rolle [5]. Gerade in der Inneren Medizin sind schätzungsweise bis zu 75 Prozent der diagnostischen Fehler durch kognitiven Bias des Arztes verursacht, und das auch bei eher häufigeren Erkrankungen [6]. Bei seltenen Erkrankungen dürfte dieser Anteil noch höher sein. Für einen Überblick über die Arten von kognitiven Fehlern sei an der Stelle auf weiterführende Literatur verwiesen [2, 5]. Erwähnt werden sollen lediglich beispielhaft „confirmation bias“ und „search satisfying“. Beim „confirmation bias“ sucht man unbewusst nach Fakten, die die eigene Verdachtsdiagnose unterstützen. „Search satisfying“ bezeichnet den Umstand, dass man bei der Ursachensuche dazu neigt, die erste gut passende Erklärungsursache zu akzeptieren ohne nach weiteren Differenzialdiagnosen zu suchen. Solche kognitiven Verzerrungen schränken die Vollständigkeit und die Objektivität eines Diagnoseprozesses ein, und gerade das „search satisfying“ ist besonders hinderlich bei undiagnostizierten seltenen Erkrankungen.
Systembezogene Gründe für Unterdiagnostik bei einer seltenen Erkrankung sind beispielsweise die durch das DRG-System ökonomisierte Arbeitsweise bei einer spezifischen Aufnahme-diagnose und die immer weitere Spezialisierung einzelner Fachbereiche auf bestimmte organbezogene Erkrankungsgruppen. Durch letztere wird der differenzialdiagnostische „Tellerrand“ immer höher.
In unserem Fall wurden die Kardiomyopathie in der Kardiologie aufgearbeitet, die Nierenerkrankung in der Nephrologie, die Hyperthyreose und der Diabetes in der Endokrinologie usw. Die bei häufigen Erkrankungen meist sinnvolle Checklistendiagnostik führt bei fehlender Klassifizierbarkeit eines Erkrankungsbildes zur Etikettierung mit Attributen wie „idiopathisch“ oder „... unklarer Ätiologie“ und genügt als Ansatz bei seltenen Erkrankungen nicht. Nach ausführlicher Abklärung in mehreren Krankenhäusern kam es dann zu einem Abschluss der Diagnostik mit der Bezeichnung „idiopathisch“, und es wurde sich auf therapeutische Anstrengungen (Organtransplantation) fokussiert.
Für einen Patienten mit einer undiagnostizierten seltenen Erkrankung ist es also von enormer Bedeutung, dass sich seine Ärzte ihrer möglichen kognitiven Fehler bewusst sind (Metakognition), eine Fertigkeit, die noch zu wenig systematisch in Studium und Beruf trainiert wird.
Verdachtsentwicklung durch intuitives und analytisches Denken
Grundsätzlich tragen zwei Arten von Denkweisen im klinischen Alltag zu Diagnoseprozessen bei: eine schnelle, intuitive, die auf Mustererkennung beruht, und eine langsamere, analytische [2]. Die intuitive Denkweise ist besonders hilfreich bei häufigen Erkrankungen, bei denen unter hohem Zeitdruck gearbeitet wird, zum Beispiel in einer Notaufnahme. Bei seltenen Erkrankungen spielt die analytische Denkweise vermutlich eine wesentlich größere Rolle.
Damit also ein Verdacht entstehen kann, muss man als Betrachter des Krankheitsbildes in der Regel erst gedanklich einen Schritt zurücktreten und mit einem gesunden Maß an Skepsis die Vorberichte auf Plausibilität hin analysieren. Dabei helfen induktive und deduktive Analysen der bereits vorliegenden Befunde:
• Induktion: Welche Erkrankungen können die vorliegenden Symptome/Befunde erklären?
• Deduktion: Welche weiteren Symptome oder Befunde sind bei einer angenommenen Verdachtsdiagnose noch zu erwarten?
Bildlich formuliert könnte man alle Symptome, Befunde, Vordiagnosen, Vorberichte auch als Mosaiksteine betrachten, die teilweise schon vorliegen, aber noch nicht in der richtigen Anordnung zueinander liegen. Durch zusätzliche Diagnostik (als Konsequenz aus dem deduktiven Ansatz) vervollständigen weitere Mosaiksteine das Bild. Dabei bedient man sich dann zunächst intuitiv einer Mustererkennung, die mit schon Gesehenem (klinische Erfahrung) oder Erlerntem (theoretisches Wissen) verglichen wird. Bei einer seltenen Erkrankung kommt erschwerend hinzu, dass man diese möglicherweise bisher weder gesehen noch davon gehört hat. Entscheidend ist dann nur, dass man das Vorliegen eines Musters bemerkt, auch wenn man es nicht ätiologisch einordnen kann.
Wichtig ist auch die Berücksichtigung des Parsimonie-Prinzips (auch „Ockhams Rasiermesser“ oder „Sparsamkeitsprinzip“), wonach die einfachste Theorie für die Erklärung eines Sachverhaltes allen anderen vorzuziehen ist. Übertragen auf einen Patienten mit einer Multiorgansymptomatik bedeutet das, dass eine einzige Erkrankung (auch wenn sie selten ist) als Ursache wahrscheinlicher ist, als das simultane Auftreten mehrerer verschiedener Erkrankungen beim selben Patienten.
Besonders der analytische Teil erfordert Zeit, Geduld, ein hohes Maß an Motivation und Interesse sowie die Bereitschaft, sich mit diagnostischen Tests auseinanderzusetzen, mit denen man noch wenig vertraut ist. Zudem benötigt man eine einigermaßen systematische Suchstrategie, um die wichtigsten Differenzialdiagnosen zu erfassen. Im Beispielfall war offensichtlich noch nicht gründlich genug das Vorliegen einer hereditären Systemerkrankung mit Multiorganmanifestation in Betracht gezogen worden. Der Verdacht war entstanden.
2. Suchstrategien
Zunächst müssen der Verdacht und somit die Differenzialdiagnosen genauer eingegrenzt werden. Um passende Suchbegriffe und -strategien zu entwickeln, sollte man versuchen, den klinischen Phänotyp zu beschreiben und in medizinische Begriffe zu übersetzen. Man kann auch versuchen, die Erkrankung nach klinischer Analyse einer groben ätiologischen Kategorie zuzuordnen, wie zum Beispiel „maligne/neoplastisch“, „infektiologisch“, „kardiovaskulär“, „autoimmun“, „endokrin“, „toxisch“, „metabolisch“, „hämostaseologisch“, „hereditär“. Auch der bisherige Verlauf und das Erkrankungsalter können in hilfreiche Adjektive übersetzt werden, wie zum Beispiel „akut“, „chronisch“, „rezidivierend“, „intermittierend“, „progredient“, „zyklisch“, „juvenil“, „erworben“, usw. Mit ein bisschen Übung ist so eine Syndrombeschreibung auch ohne Kenntnis der genauen Diagnose möglich. Dieser Prozess hilft bei der Eingrenzung der Literatursuche. Diese beginnt üblicherweise in vertrauten Quellen, in denen man sich schnell zurechtfindet, wie zum Beispiel Lehrbüchern. Danach bieten sich digitale Datenbanken an, wie zum Beispiel UpToDate®, bevor eine kombinierte Schlagwortsuche in großen Datenbanken wie Medline erfolgt [1]. Zunehmend werden auch spezialisierte Suchmaschinen für eine computerunterstützte Diagnosefindung bei seltenen Erkrankungen angeboten [4].
In unserem Fall bot sich eine langsam progrediente, nicht-entzündliche, wahrscheinlich hereditäre Multiorganerkrankung mit Manifestation im Erwachsenenalter. Mutmaßlich betroffen waren Herz, Nieren, Schilddrüse, Pankreas, Darm, Muskulatur, das Hörorgan und möglicherweise auch die Brustdrüse. Es entstand zudem der Eindruck, dass vor allem Organe mit einem hohen Energiebedarf betroffen waren.
Folgende Suchbegriffe ließen sich generieren: „Hereditary“; „adult-onset“; „cardiomyopathy“; „nephropathy“; „diabetes“; „sensorineural hearing loss“; „hyperthyreoidism“; „non-inflammatory“; „chronic“; „progressive“.
Kombinationen der Schlagwörter können in PubMed mit der Konjunktion „AND“ erzeugt werden, zum Beispiel „Hereditary cardiomyopathy AND nephropathy“. So kann durch verschiedene Kombinationen eine erste orientierende Literatursuche gestartet werden. Titel und Abstracts der jeweils ersten fünf bis zehn Ergebnisse liefern dann gelegentlich weitere Schlagwörter, die in die Suche integriert werden können. Manchmal stößt man auch bereits im ersten Durchlauf auf Fallberichte, die ganz ähnliche Fälle beschreiben und dann bereits zu konkreten Verdachts- oder Differenzialdiagnosen werden können. In unserem Fall wurde die Aufmerksamkeit durch das gehäufte Erscheinen des Adjektivs „mitochondrial“
in Titeln von Suchergebnissen auf die Gruppe der mitochondrialen Zytopathien gelenkt, und im Besonderen auf das MELAS-Syndrom (siehe auch Kasten) [3].
3. Diagnosesicherung
Aus mehreren Gründen kann dieser Schritt am anspruchsvollsten sein. Man muss bei seltenen Erkrankungen oft Testverfahren veranlassen und beurteilen, mit denen man selbst und die Kollegen wenig Erfahrung haben. Es ist deshalb besonders wichtig, Testmerkmale wie Sensitivität und Spezifität zu recherchieren und in die Interpretation miteinzubeziehen. Es kann auch passieren, dass man sich erheblichen Zweifeln an der geäußerten Verdachtsdiagnose durch Kollegen und Konsilärzte anderer Fachrichtungen entgegenstellen muss, vor allem wenn man selbst weniger Berufserfahrung hat. Diagnosen entstehen durch Wichtung und Bewertung aller Befunde und den einen beweisenden Test gibt es oft nicht. Und schließlich gibt es auch bei seltenen Erkrankungen untypische Verläufe und Manifestationen, die aus den Mustern der bisher publizierten Erfahrungen herausfallen und die Diagnosestellung nochmals erschweren. Auch bei der Beurteilung der Testergebnisse muss wieder die eigene Tendenz zu „search satisfying“ und „confirmation bias“ berücksichtigt werden. Man darf sich nicht zu sehr von der eigenen Idee überwältigen lassen, einen besonders intelligenten Einfall gehabt zu haben.
In unserem Fall fielen die Laborbestimmungen (Laktat zu wiederholten Zeitpunkten, Arginin, Carnitin, CK) unauffällig aus. In der Elektromyografie zeigten sich keine Hinweise für eine Myopathie, weshalb eine Mitochondriopathie vom neurologischen Konsiliarius für sehr unwahrscheinlich gehalten wurde. So entstanden nach der ersten Diagnostikrunde Zweifel an der Verdachtsdiagnose. Obwohl der Patient kein akutes neurologisches Ereignis während des Aufenthaltes bot, veranlassten wir zusätzlich ein Schädel-CT, in dem sich eine generalisierte Hirnatrophie sowie bilaterale Basalganglienverkalkungen darstellten (Abbildung 1). Daraufhin entschieden wir uns trotz der bis dahin überwiegend unauffälligen Screeninguntersuchungen bei fortbestehendem hohem klinischen Verdacht zu einer Mutationsanalyse aus dem peripheren Blut. Dabei konnte die Variante 3243A>G in der mitochondrialen DNA von 20 Prozent der Granulozyten heteroplasmatisch nachgewiesen werden und somit molekulargenetisch die Diagnose eines MELAS-Syndroms gestellt werden.
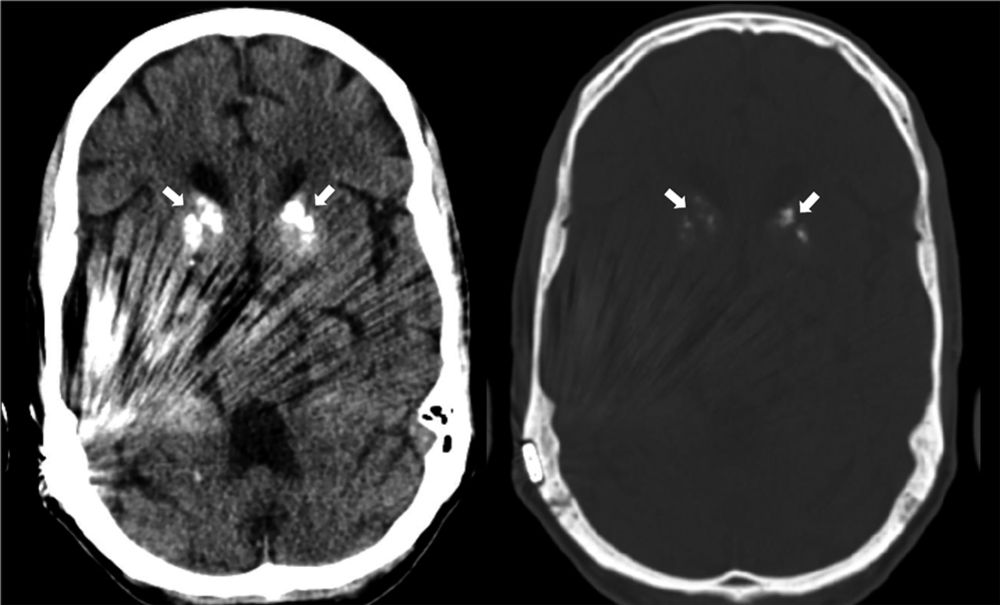
Abbildung 1: Nativ-CT des Hirnschädels mit Nachweis von bilateralen Verkalkungen der Basalganglien (Pfeile).
Es wurde ein Therapieversuch mit Carnitin und Coenzym Q10 begonnen, und im weiteren Verlauf wurde auch bei den Geschwistern die Mutation nachgewiesen. Inwieweit die Therapie zu einer Stabilisierung der Organfunktionen und Besserung des Beschwerdebildes beitragen konnte, muss leider an dieser Stelle offen bleiben, da sich der Patient nach einigen kurzfristigen Verlaufskontrollen schließlich nicht mehr in unserer Ambulanz vorstellte. Von der ursprünglich angedachten Doppelorgantransplantation wurde aber aufgrund des neu diagnostizierten und potenziell therapierbaren Krankheitsbildes zunächst Abstand genommen.
Zusammenfassung
„Häufige Erkrankungen sind häufig und seltene Erkrankungen sind selten. Und wer häufig seltene Erkrankungen diagnostiziert, liege selten richtig und häufig falsch.“ (Professor Dr. phil. Dr. med. Gustav Bodechtel). Mit diesem Leitsatz werden junge Ärzte, die noch kein verlässliches Gefühl für die tatsächlichen Häufigkeiten von Erkrankungen haben, gerne von älteren Kollegen davon abgehalten, zu viel – meist teure – Diagnostik zu veranlassen. Obwohl diese Aussage zweifelsfrei richtig ist, kann ihr jedoch eine andere zutreffende Aussage entgegengehalten werden: „Seltene Erkrankungen sind selten, aber Menschen mit seltenen Erkrankungen gibt es viele.“ Deshalb sollte Ärzten aller Fachrichtungen und jeden Ausbildungsstands bewusst sein, dass ihnen Patienten mit noch nicht diagnostizierten seltenen Erkrankungen begegnen können. Am geschilderten Fall sollte verdeutlicht werden, dass neben dem Überwinden von systembezogenen Hindernissen im ökonomisierten Krankenhaus- und Praxisbetrieb bestimmte ärztliche Eigenschaften erforderlich sind, um einen erfolgreichen Diagnoseprozess bei seltenen Erkrankungen zu entwickeln:
• Sorgfalt in der klinischen Routine und strukturierte Diagnostikprozesse.
• Bereitschaft zum kritischen Überprüfen der Vorberichte und Vorbefunde auch bei vermeintlich abgeschlossenen Diagnoseprozessen (Skepsis bei Ergänzungen wie „idiopathisch“
oder „unklarer Genese“).
• Metakognitives Denken: Kenntnis der eigenen Erfahrungs- und Wissensgrenzen und aktives Bewusstmachen, dass Erkrankungen existieren, von denen man noch nie gehört hat,
und dass kognitiver Bias häufig die richtige Diagnosestellung behindert.
• Mut, einen klinischen Verdacht zu äußern und ihm nachzugehen, auch wenn Vorbehandler oder Kollegen mit formal höherer Expertise diesen Verdacht nicht hatten.
Neben multi- und interdisziplinären Expertenrunden sind sicherlich professionelle web-basierte Suchmaschinen und Datenbanken künftig die wichtigsten Ressourcen für eine effektive und umfassende Suchstrategie, da der stetige Wissenszuwachs in der Medizin nicht mehr von einem menschlichen Gehirn überblickt werden kann. Zur Generierung von passenden Schlagwortkombinationen kann neben dem Zerlegen des Krankheitsbildes in Einzelkomponenten auch eine Fallanalyse auf der Basis grundlegender physiologischer und biochemischer Prinzipien hilfreich sein. Am beschriebenen Fall war das in erster Linie die Auffälligkeit, dass besonders energieverbrauchende Organe betroffen waren, was einen Hinweis auf eine Störung im zellulären Energiestoffwechsel lieferte.
Somit stellt die Diagnose seltener Erkrankungen zweifelsohne einen enorm aufwendigen und anspruchsvollen Aspekt ärztlichen Handelns dar. Jedoch kann im besten Fall ein solcher „Dr. House-Moment“ einem schon lange kranken Menschen vielleicht zu einer kurativen oder zumindest die Lebensqualität verbessernden Therapie verhelfen. Und in solchen Situationen kann ganz unmittelbar die Faszination am eigenen Beruf erlebbar werden.
MELAS -Syndrom (Mitochondriale Enzephalomyopathie – Laktatazidose-Schlaganfall-ähnliche Episoden)
Epidemiologie:
• Prävalenz ca. 1 bis 9/1.000.000
• Manifestationsalter meist 1. oder 2. Lebensjahrzehnt
Klinisches Syndrom:
• Neurologische Manifestationen:
• Im Jugendalter häufig verzögerte Entwicklung, Lernschwäche, Aufmerksamkeitsstörungen
• Meist progrediente neurodegenerative Veränderungen mit im Verlauf auch demenzieller Entwicklung
• Intermittierende Episoden mit schlaganfallähnlicher Symptomatik bei metabolischer Entgleisung, zum Beispiel bei Infektionen (Übelkeit, Erbrechen, Kopfschmerz, Krampfanfälle,
Hemiparesen, Hemianopsie, Rindenblindheit)
• Psychiatrische Manifestationen möglich (Angststörung, Depression, bipolare Störungen, Autismus)
• Myopathie mit Belastungsintoleranz und Muskelatrophie
• Häufig Innenohrschwerhörigkeit
Andere Organbeteiligungen:
• Endokrinopathie
• Diabetes mellitus (meist Typ 2, gelegentlich Typ 1)
• Hypo- oder Hyperthyreose
• Kardiomyopathie
• Gastrointestinale Symptome (Pseudobstruktion, Diarrhoen, abdominelle Krämpfe)
• Selten nephrotisches Syndrom (histologisch meist fokal segmentale Glomerulosklerose) mit Fortschreiten zur chronischen Niereninsuffizienz
• retinale Pigmentdegeneration
Ätiologie:
• Mutation in Genen der mitochondrialen DNA (mtDNA) führen zu Störungen der mitochondrialen Energiegewinnung durch defekte Atmungsketten-Komplexe
• Organe mit hohem Energiebedarf besonders betroffen häufigste Mutation A>G an Position 3243 (A3243G), aber auch weitere Defekte identifiziert
Diagnostik (Auszug):• Klinik (siehe „Klinisches Syndrom“) und Familienanamnese!
• Laktatbestimmung (rezidivierende Laktaterhöhungen) Blut und ggf. Liquor
• Serum-Aminosäuren (Alanin) und Serum-Acyl-Carnitin
• Audiometrie (Hochtonschwerhörigkeit)
• ZNS-Bildgebung (MRT, CT): Signalanhebungen weiße und graue Substanz, Basalganglienverkalkungen, Hirnatrophie
• Elektromyographie (unspezifisch, myopathisches Muster)
• Muskelhistologie (spezifische Befunde, z. B. „ragged-red-fibres“)
• Mutationsanalyse der mtDNA aus Blut und Muskelgewebe möglich
Behandlung:• Substitution von L-Arginin, Coenzym Q10
• Symptomatische Therapie der Organmanifestationen
• keine kurative Therapie verfügbar
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autor
Privatdozent Dr. Philipp Moog
Oberarzt, Leiter Rheumatologie,
Klinikum rechts der Isar der Technischen Universität München, Abteilung für Nephrologie,
Ismaninger Str. 22, 81675 München,
E-Mail: philipp.moog(at)mri.tum.de
Teilen:
Das könnte Sie auch interessieren:






