
S3-Leitlinie Palliativmedizin für erwachsene Patienten mit einer nicht heilbaren Krebserkrankung
Krebserkrankungen stellen in Deutschland die zweithäufigste Todesursache dar, mit zunehmender Inzidenz und Prävalenz in den nächsten Jahren und Jahrzehnten. Trotz Fortschritten in der onkologischen Behandlung steigt der Bedarf an palliativmedizinischer Behandlung und Begleitung von Patienten mit einer nicht heilbaren Krebserkrankung. Dabei haben sich besonders die Konzepte palliativmedizinischer Betreuung in den vergangenen Jahren, auch aufgrund der verbesserten Evidenzlage, deutlich geändert. Palliativversorgung ist in der Zwischenzeit zu einem festen Bestandteil unseres Gesundheitswesens geworden mit vielfältigen Versorgungsangeboten im ambulanten und stationären Bereich. Aus diesem Grund ist es notwendig, entsprechende Empfehlungen für den klinischen Alltag und die Versorgung der Patienten zu formulieren. Die Deutsche Gesellschaft für Palliativmedizin hat dazu die S3-Leitlinie „Palliativmedizin für erwachsene Patienten mit einer nicht heilbaren Krebserkrankung“ entwickelt, die im Rahmen des Onkologischen Leitlinienprogramms gefördert und begleitet wurde (http://leitlinienprogramm-onkologie.de/Palliativmedizin.80.0.html). Zielgruppe der Leitlinie sind alle Ärzte und nicht-ärztlichen Personen, die an der Behandlung von Patienten mit einer nicht heilbaren Krebserkrankung beteiligt sind. Entsprechend bestand die repräsentative Konsensusgruppe aus Mandatsträgern von 53 Fachgesellschaften, Patientenverbänden sowie weiteren Institutionen. Nach Konsentierung von Schlüsselfragen wurde zunächst nach bestehenden Leitlinien, systematischen Literaturübersichten und Primärstudien in entsprechenden Datenbanken gesucht. Auf dieser Evidenzgrundlage entwickelten sieben, aus Mandatsträgern und weiteren Experten bestehenden Arbeitsgruppen Empfehlungen und Begleittexte. Die formale Konsentierung der Empfehlungen erfolgte im Rahmen von drei Konsensuskonferenzen. Insgesamt enthält die Leitlinie 13 Statements und 217 Empfehlungen, von denen 100 evidenzbasiert sind (Empfehlungs- und Evidenzgrad nach Tabelle 1 sind im Text in Klammern angegeben). Die übrigen Empfehlungen beruhen auf Expertenkonsens (EK). Dabei ist EK nicht automatisch, aber meistens mit Level of Evidence (LoE) 4 gleichzusetzen. EK bezieht sich auf die Konsentierung in der Leitliniengruppe, basierend auf der zur Verfügung stehenden Evidenz. Zudem wurden zehn Qualitätsindikatoren nach einer definierten Methodik abgeleitet und konsentiert.
Die höchste Studienqualität wurde für Atemnot, Schmerzen und Depressionen identifiziert. Für Obstipation, Kommunikation und Sterbephase war die Evidenzgrundlage von moderater bis niedriger Qualität. Die Evidenzqualität für Versorgungsstrukturen variierte je nach Struktur mit den besten Ergebnissen für die spezialisierte ambulante Palliativversorgung.
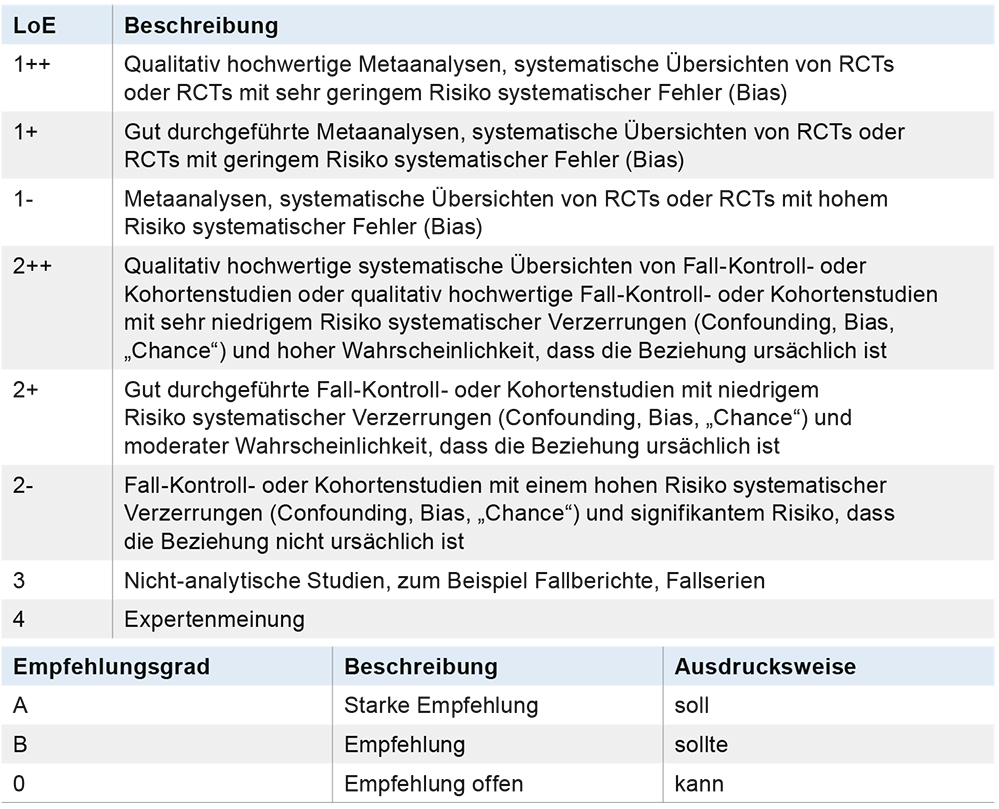
Tabelle 1: Schema der Evidenzgraduierung nach SIGN und der Empfehlungsgraduierung. (Quelle: www.sign.ac.uk/pdf/sign50.pdf und www.awmf.org/leitlinien/awmf-regelwerk/ll-entwicklung/awmf-regelwerk-03-leitlinienentwicklung/ll-entwicklung-graduierung-der-empfehlungen.html)
AWMF – Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften; SIGN – Scottish Intercollegiate Guidelines Network; LoE – Level of Evidence; RCT – randomisierte kontrollierte Studie
Atemnot
Atemnot soll als „subjektive Erfahrung einer unangenehmen Atmung“ [1] durch den Patienten selbst erfasst werden (EK). Wenn möglich und sinnvoll, soll vor oder parallel zu einer symptomatischen Therapie eine kausale Therapie der Atemnot erfolgen (EK).
Grundlegend für die Behandlung der Atemnot sind Allgemeinmaßnahmen wie Aufklärung, Beruhigungs-, Entspannungs- und Atemübungen (EK) [2]. Moderate Wirksamkeit für die Linderung von Atemnot konnte in einem Cochrane Review [3] und zwei randomisierten kontrollierten Studien („randomized controlled trials“ – RCTs) [4, 5] für die folgenden nicht-medikamentösen Maßnahmen gezeigt werden: ein auf das Gesicht gerichteter kühler Luftzug (zum Beispiel durch Handventilator [4]) und Gehhilfen zur Unterstützung der Mobilität (B/1-).
Orale oder parenterale Opioide sollen als Substanzgruppe der ersten Wahl mit gut belegter Effektivität zur symptomatischen Linderung von Atemnot eingesetzt werden (A/1+) [6, 7]. Eine klinisch relevante Atemdepression wurde in keiner der Studien beobachtet (Statement 1+). Bei einer schweren Niereninsuffizienz ist besondere Vorsicht geboten. Dosis bzw. Wahl des Opioids sollte bei Zunahme der Nebenwirkungen angepasst werden (B/3) (Tabelle 2).
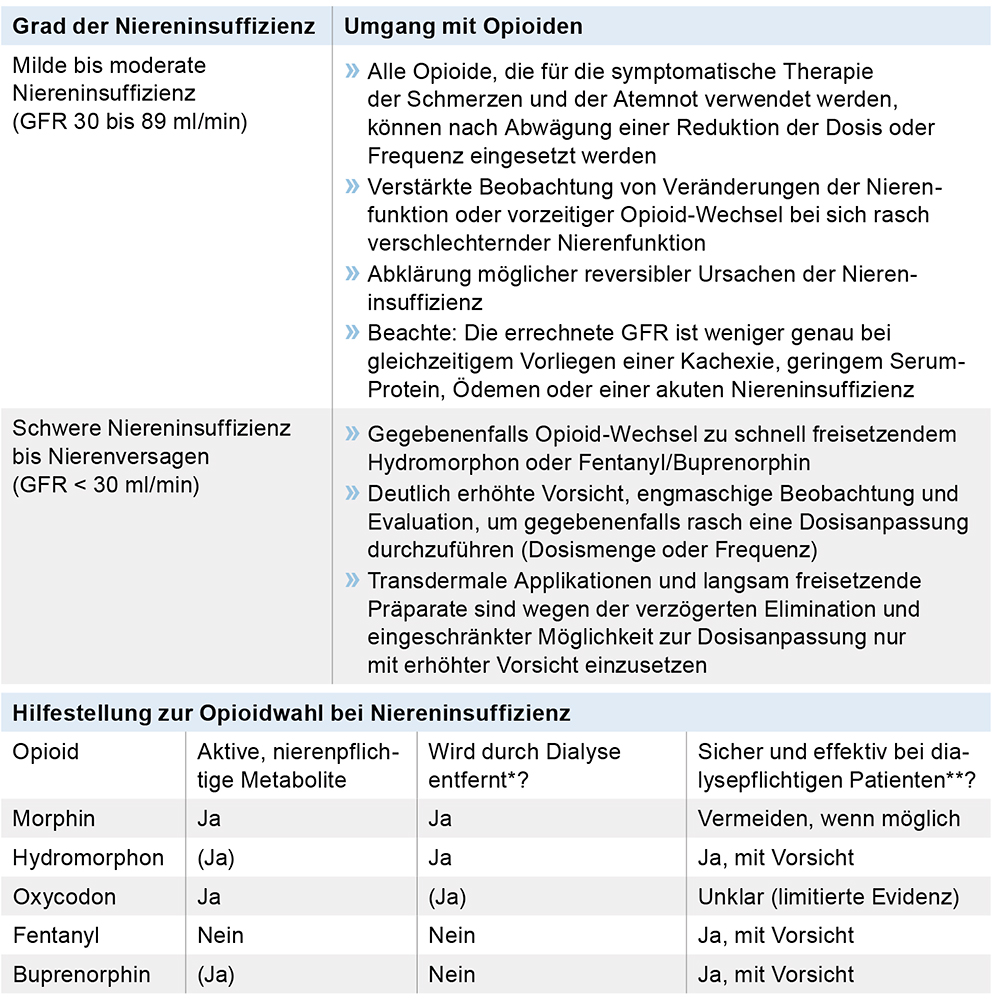
Tabelle 2: Umgang mit Opioiden in Abhängigkeit des Schweregrades der Niereninsuffizienz und Hilfe zur Wahl des Opioids. * Ob ein Opioid dialysegängig ist oder nicht, ist ein sehr viel komplexeres Geschehen als es die Ja-Nein-Einteilung ausdrückt, und es muss unter anderem zusätzlich berücksichtigt werden, ob auch Metabolite durch die Dialyse entfernt werden. ** Die hier genannte Einteilung zur Anwendung eines Opioids bei dialysepflichtigen Patienten ist eine Verallgemeinerung und kann von Patient zu Patient variieren. Deshalb sollten alle Opioide mit erhöhter Vorsicht angewendet werden. Die Einteilung basiert überwiegend auf Fallberichten und klinischer Erfahrung. GFR – glomeruläre Filtrationsrate (Quelle: „S3-Leitlinie Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung“ [2], adaptiert nach [e2–e4]).
Für andere Medikamentengruppen ist die Wirksamkeit nicht nachgewiesen. Nur für Benzodiazepine wurde wegen der positiven klinischen Erfahrung eine offene Empfehlung formuliert. So können sie in Kombination mit Opioiden eingesetzt werden, insbesondere bei Patienten in einem fortgeschrittenen Krankheitsstadium oder in der Sterbephase (0/1-) und bei ausgeprägter Angstkomponente. Der Einsatz von Phenothiazinen, Antidepressiva, Buspiron und Glucocorticoiden wird nicht empfohlen (B/1- bzw. 1+ für Glucocorticoide).
Es gibt Evidenz mit guter Qualität, dass Sauerstoff bei nicht-hypoxämischen Patienten nicht wirksam ist für die Linderung von Atemnot [8, 9]. Deshalb kann Sauerstoff bei Patienten mit nicht heilbaren Krebserkrankungen nicht pauschal empfohlen werden (B/1+).
Tumorschmerz
Dieses Kapitel basiert auf einer Adaptation der EAPC-Leitlinie (EACP – „European Association for Palliative Care“) zur Opioidbehandlung von Patienten mit Tumorschmerzen, die auf eine umfangreiche Literatursuche gründet [10]. Ergänzt wurde das Kapitel durch eine systematische Literaturrecherche für das Nicht-Opioid-Analgetikum Metamizol [11].
Ähnlich wie bei Atemnot soll die Schmerzerfassung, zum Beispiel durch einfache eindimensionale Schmerzintensitätsskalen, möglichst durch den Patienten selbst erfolgen (EK).
Bei leichten bis mittleren Schmerzen bzw. bei unzureichenderer Symptomkontrolle durch Nicht-Opioid-Analgetika sollten Stufe-II-Opioide oder alternativ niedrig dosierte Stufe-III-Opioide angewendet werden (B/1-; Tabelle 3).
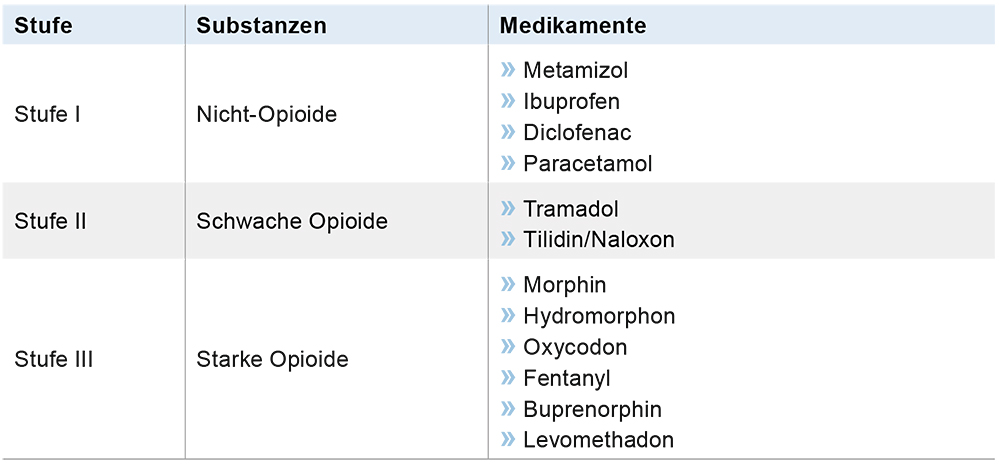
Tabelle 3: Stufenschema zur Schmerztherapie.
Als Substanz der ersten Wahl können die Stufe-III-Opioide Morphin, Oxycodon und Hydro-morphon eingesetzt werden (0/1-). Es besteht keine klare Überlegenheit der Wirksamkeit bzw. des Toleranzprofils einer Substanz gegenüber der anderen [12, 13, 14].
Orale, schnell freisetzende Opioide oder transmucosales Fentanyl sollen bei Durchbruchschmerzen verordnet werden (A/1+). Die transdermalen Trägersysteme Fentanyl oder Buprenorphin können als Alternative zu oralen Opioiden verwendet werden (0/1-), zum Beispiel bei Schluckstörungen oder Präferenz des Patienten.
Wenn Opioid-Analgetika keine ausreichende Schmerzlinderung bei neuropathischen Tumorschmerzen bringen, werden Amitriptylin, Gabapentin oder Pregabalin empfohlen (A/1+) [15].
Für die Wirksamkeit von Metamizol liegt begrenzte Evidenz vor [11, 16, 17, 18]. In Verbindung mit der klinischen Erfahrung begründet dies eine offene Empfehlung für Metamizol in der Monotherapie bei leichten Schmerzen bzw. in Kombinationstherapie mit Opioiden bei mittleren bis starken Schmerzen (0/1-).
Metamizol ist in der klinischen Praxis im Vergleich zu nichtsteroidalen Antirheumatika (NSAR) vorteilhaft wegen der geringer ausgeprägten toxischen Effekte auf den Gastrointestinaltrakt und die Nieren. Risiko und Relevanz der sehr selten auftretenden Agranulozytose (Fachinformation < 0,01 Prozent) müssen im Einzelfall abgewogen werden (gegebenenfalls Blutbildkontrollen alle drei Monate).
Bei Beginn einer Therapie mit Opioiden können zur Dosistitration sowohl schnell als auch langsam freisetzende orale Präparate verwendet werden (0/1-).
Bei mangelnder Schmerzkontrolle oder schweren Nebenwirkungen kommt ein Opioid-Wechsel in Betracht (0/3). Bei Nebenwirkungen einer Opioid-Therapie kann eine Dosisreduktion notwendig sein.
Obstipation
Bei einer Therapie mit Opioiden soll eine medikamentöse Obstipationsprophylaxe begonnen werden (EK).
Die Therapie der Obstipation sollte entsprechend einem Stufenschema erfolgen (EK). Die erste Stufe beinhaltet osmotische (zum Beispiel Macrogol) oder stimulierende (zum Beispiel Bisacodyl, Natriumpicosulfat) Laxantien (A/1) [19]. Bei mangelnder Kontrolle der Obstipation wird eine Kombination aus diesen beiden Laxantienklassen empfohlen. Periphere Opioidantagonisten (zum Beispiel Methylnaltrexon, A/1+) [20] werden in der dritten Stufe zusätzlich zu Stufe-II-Laxantien eingesetzt. Stufe IV sieht den Einsatz von zusätzlichen medikamentösen (Rizinus, Erythromycin, Amidotrizoe-säure, wie beispielsweise Gastrolux® oder Gastrografin® etc.) oder nicht-medikamentösen (Einläufe, manuelle Ausräumung) Maßnahmen vor.
Depression
Das Vorliegen einer Depression soll aktiv und regelmäßig geprüft werden, da depressive Patienten sich über ihren seelischen Zustand oft nicht spontan äußern (A/4). Dazu sollte ein Screeningverfahren eingesetzt werden (B/1+) wie zum Beispiel ein einfaches Zwei-Fragen-Instrument: „Fühlten Sie sich im letzten Monat häufig niedergeschlagen, traurig, bedrückt oder hoffnungslos?“ und „Hatten Sie im letzten Monat deutlich weniger Lust und Freude an Dingen, die Sie sonst gerne tun?“ [21]. Bei auffälligem Screening, das heißt, wenn eine oder zwei der genannten Fragen positiv beantwortet werden, sollte die Diagnose einer Depression und ihr Schweregrad nach den ICD-10-Kriterien geprüft bzw. gestellt (EK) sowie das Suizidrisiko eingeschätzt werden.
Die Behandlung soll sich am Schweregrad der depressiven Symptomatik orientieren (Adap-tation der Nationalen VersorgungsLeitlinie Unipolare Depression [22]). Eine Psychotherapie soll bereits bei einer leichten, aber auch bei mittelgradigen und schweren Depressionen angeboten werden (EK), wobei verhaltenstherapeutische oder tiefenpsychologische Verfahren eingesetzt werden sollten (EK). Eine medikamentöse Therapie soll bei mittelgradiger und schwerer Depression angeboten werden (EK) und sollte gemäß den Empfehlungen der oben genannten Nationalen VersorgungsLeitlinie erfolgen (EK). Evidenz hoher Qualität zeigt, dass Antidepressiva in der Palliativsituation wirksam sind, aber dass es keine klare Überlegenheit eines Antidepressivums gegenüber den anderen gibt (Statement 1-) [23, 24, 25]. Mirtazapin, Sertralin und Citalopram werden im Begleittext der Leitlinie genannt, da sie im palliativmedizinischen Kontext aufgrund klinischer sowie pharmakologischer Kriterien und Aussagen eines Systematic Reviews [23] bevorzugt angewandt werden.
Aufgrund mangelnder Effektivität sollten Psychostimulanzien zur Therapie der Depression nicht eingesetzt werden (B/1-).
Auch wenn die Lebenszeit bei Palliativpatienten nur wenige Wochen beträgt, soll eine Therapie begonnen werden (EK). Psychotherapeutische Kurzzeitinterventionen sind vorzuziehen, je näher das Lebensende rückt.
Kommunikation
Die Übermittlung schlechter Nachrichten hinsichtlich der Krebserkrankung selbst oder deren Rezidiv bzw. Progression soll primär über den behandelnden Arzt (zum Beispiel Hausarzt, Onkologe) erfolgen (EK). Informationen sollen schrittweise übermittelt und der Patient zu Fragen ermutigt werden (EK). Die Angehörigen sollen in die Aufklärungsgespräche möglichst eingebunden werden (EK).
Die meisten Patienten möchten über Themen zum Lebensende sprechen, auch wenn sie dies nicht immer von sich aus thematisieren. Die Bereitschaft, diesem Wunsch zu entsprechen, soll von den an der Behandlung Beteiligten vermittelt werden, wobei Worte wie „Sterben“ und „Tod“ einfühlsam ausgesprochen werden sollten (EK).
Wenn der Patient einen Sterbe- bzw. Todeswunsch äußert, soll diesem mit Empathie und Gesprächsbereitschaft begegnet werden (EK). Ein solcher Wunsch bedeutet nicht automatisch aktive Lebensverkürzung, sondern kann zum Beispiel auch einen Hilferuf mit Lebenswunsch verbergen [26, 27]. Deshalb sollen mögliche Ursachen eines Sterbe- bzw. Todeswunsches im Gespräch eruiert werden (EK).
Die vorausschauende Versorgungsplanung („Advance Care Planning“) bietet dem Patienten in der Palliativsituation die Möglichkeit, seine Präferenzen für die letzte Lebensphase im Voraus zu reflektieren und festzulegen. Patienten sollen ein solches Angebot frühzeitig und wiederholt erhalten (EK).
Sterbephase
Die Sterbephase wird in der Leitlinie als die letzten drei bis sieben Lebenstage definiert. Der Beginn der Sterbephase kann anhand von Veränderungen der Atmung, der Emotionen (zum Beispiel Angst) und des Bewusstseins, zunehmender Schwäche und reduziertem Allgemeinzustand, Hautveränderungen, Verwirrtheit, Verlust des Interesses an Nahrungs- und Flüssigkeitszufuhr sowie Intuition der an der Behandlung Beteiligten festgestellt werden (0/4). Die Einschätzung sollte im interprofessionellen Team erfolgen (B/4).
Ein Delir ist relativ häufig in der Sterbephase. Für die Behandlung sind beruhigende Allgemeinmaßnahmen wichtig. Haloperidol ist das Medikament der Wahl, wenn eine medikamentöse Therapie notwendig ist (B/1) [28]. Für die Behandlung der Rasselatmung können Lagerungsmethoden (0/4) und/oder Anticholinergika (0/1-) eingesetzt werden [29]. Tracheales Sekret sollte nicht abgesaugt werden (B/4). Mundtrockenheit kann belastend sein. Die Mundschleimhaut sollte regelmäßig befeuchtet werden (B/4). Bei Unruhe in der Sterbephase sollen mögliche Auslöser wie Schmerzen, Obstipation, Delir etc. eruiert werden. Sterbende mit Angst sollen mit Allgemeinmaßnahmen unterstützt werden (EK). Benzodiazepine können zusätzlich eingesetzt werden (EK).
Auch in der Sterbephase ist die bestmögliche Lebensqualität ausschlaggebendes Therapieziel für das Ansetzen oder Weiterführen von Medikamenten und Maßnahmen. Tumorspezifische Therapien sollen beendet (EK) und alle anderen Maßnahmen, die nicht dem oben genannten Therapieziel dienen, nicht eingeleitet oder beendet werden, zum Beispiel Beatmung, Dialyse/Hämofiltration, Intensivtherapie, Lagerung zur Dekubitus- oder Pneumonieprophylaxe (EK). Palliative Sedierung ist als Ultima Ratio bei refraktärem Leid zu erwägen, die von erfahrenen und kompetenten Ärzten und Pflegefachkräften durchzuführen ist (EK).
Künstliche Ernährung und Flüssigkeitszufuhr wird von der Leitliniengruppe bei Sterbenden nicht empfohlen (B/2), wobei die Entscheidung individuell und nach sorgfältiger Abwägung, zum Beispiel Stillen von Hunger und Durst, zu treffen ist.
Versorgungsstrukturen
Ab dem Zeitpunkt der Diagnose einer nicht heilbaren Krebserkrankung soll Palliativversorgung angeboten werden, wobei eine tumorspezifische Therapie parallel durchgeführt werden kann (EK). Die Strukturen der Palliativversorgung, die Patienten und Angehörigen im Krankheitsverlauf angeboten werden können, sind in einem eigens für die Leitlinie entwickelten Behandlungspfad dargestellt (Abbildung 1).
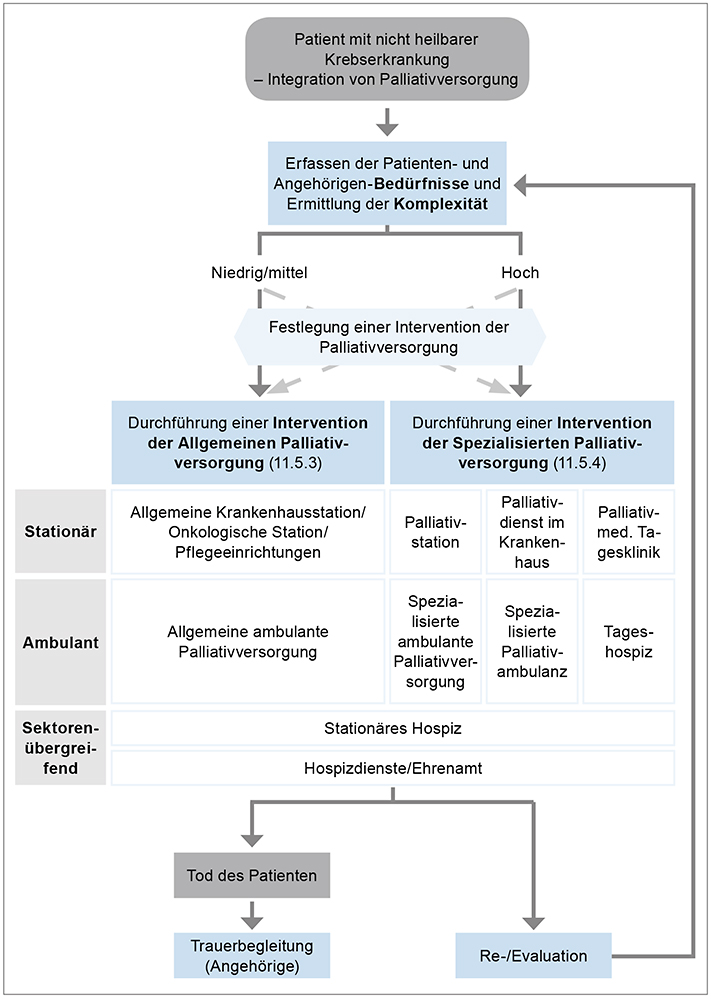
Abbildung 1: Behandlungspfad für Patienten und Angehörige
Die Komplexität der Patientensituation bestimmt, ob allgemeine oder spezialisierte Palliativversorgung eingesetzt wird. Die folgenden Kriterien sind für die Ermittlung der Komplexität in der Palliativsituation relevant [30]: Patienten- und Angehörigenbedürfnisse (die auf physischer, psychischer, sozialer und spiritueller Ebene wiederholt erfasst werden sollen; EK), Funktionsstatus des Patienten und Krankheitsphase (stabil, instabil, verschlechternd, sterbend; EK). Allgemeine Palliativversorgung ist für Patienten mit niedriger bis mittlerer Komplexität und spezialisierte Palliativversorgung bei hoher Komplexität der Patientensituation indiziert (EK). Eine hohe Komplexität liegt zum Beispiel bei ausgeprägten und schwer kontrollierbaren körperlichen Symptomen, bei psychischer Labilität mit fehlender Krankheitsbewältigung oder fehlender familiärer Unterstützung vor. Der Behandlungsplan muss dann immer wieder neu an die wechselnden Umstände angepasst werden.
Für die Allgemeine Palliativversorgung (APV), die von jedem in der Versorgung von Patienten mit einer Krebserkrankung Tätigen erfolgen kann, soll eine Basisqualifikation in Palliativ-versorgung erworben werden (EK). Neben dem Erkennen des palliativen Bedarfs und Einleitung der Versorgung (EK) sollen die in der allgemeinen Palliativversorgung Tätigen unter anderem Symptome und Probleme niedriger bis mittlerer Komplexität behandeln und betreuen, Therapieziele festlegen und die Versorgung koordinieren sowie Spezialisierte Palliativversorgung einbeziehen, wenn indiziert (EK).
Ein Team der Spezialisierten Palliativversorgung soll aus Mitgliedern von mindestens drei Berufsgruppen (Arzt, Pflege, weitere Berufsgruppe) bestehen, wobei mindestens Arzt und Pflege eine spezialisierte palliativmedizinische Qualifikation aufweisen sollen (A/1-) [31-34].
Fazit
Erstmals wurden evidenz- und konsensbasierte Empfehlungen auf S3-Niveau zu sieben Kernthemen der Palliativmedizin für Deutschland formuliert, die für alle an der Behandlung von Patienten mit einer nicht heilbaren Krebserkrankung Beteiligten in der allgemeinen oder spezialisierten Palliativversorgung handlungsorientierend sein sollen.
Eine Erweiterung der Leitlinie wurde bereits mit folgenden Themen begonnen: Maligne intestinale Obstruktion, Übelkeit und Erbrechen (unabhängig von einer Chemotherapie), Schlaf-störungen/Nächtliche Unruhe, Wundpflege, Fatigue, Angst, Therapiezielfindung, Umgang mit Todeswunsch. Der Abschluss dieses zweiten Teils der Leitlinie ist für das Jahr 2018 geplant.

Das Literaturverzeichnis kann bei den Verfassern angefordert oder im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.

Professorin Dr. Claudia Bausewein

Privatdozent Dr. Steffen T. Simon

Dr. Anne Pralong

Professor Dr. Raymond Voltz






 S3-Leitlinie Palliativmedizin für erwachsene Patienten mit einer nicht heilbaren Krebserkrankung
S3-Leitlinie Palliativmedizin für erwachsene Patienten mit einer nicht heilbaren Krebserkrankung









