S3-Leitlinie „Antibiotic Stewardship“
Historie
Schon die ersten Forschungsarbeiten bei Substanzen zur Bekämpfung von Infektionserregern zeigten, dass Mikroorganismen in der Lage sind, sich der Einwirkung dieser Antiinfektiva durch unterschiedliche Mechanismen zu entziehen. Gleichzeitig erkannten Forscher aber auch, dass dieser Resistenzentwicklung durch Einhalten einiger klarer Therapieprinzipien entgegengewirkt werden kann. So führte Paul Ehrlich bereits 1910 in einer Veröffentlichung im Lancet über die „Therapia sterilisans magna“ aus, dass die wirksamste Infektionsbehandlung grundsätzlich nach dem Prinzip des „Frapper fort et frapper vite“ erfolgen muss. (Dass es fast 100 Jahre dauerte, bis uns dieser Grundsatz als „Hit early, hit hard“ als neueste Erkenntnis der Sepsistherapie verkauft wurde, könnte einen fast zum Schmunzeln bringen.) In ähnlicher Weise äußerte sich Paul Fleming in seiner Nobelpreisrede 1945, als er das Problem der Unterdosierung von Antibiotika und der daraus folgenden Resistenzentwicklung darstellte und davor warnte, dass ein unkontrollierter Einsatz von Penicillin dieses Medikament früher oder später unwirksam mache.
In den im wahrsten Sinne des Wortes fortschrittstrunkenen 60er- und 70er-Jahren des vergangenen Jahrhunderts, als man geradezu glaubte, der wissenschaftliche Fortschritt überwinde alle Naturgesetze, gerieten diese Erkenntnisse aber mehr oder weniger in Vergessenheit. Als Beleg hierfür steht die Aussage, die dem US-Surgeon General W. H. Stewart 1967 zugeschrieben wird: „It is time to close the book on infectious diseases. We have basically wiped out infection in the US.“ Unabhängig von der Belegbarkeit dieses Zitates drückt es doch in eindrucksvoller Weise aus, wie die Entwicklung ständig neuer Antibiotikasubstanzklassen die Einstellung von Ärzten und die Allgemeinheit den Umgang mit diesen Medikamenten beeinflusst hat. Es gibt bis heute keine andere Medikamentenklasse, die – ohne Berücksichtigung des Schadens für den Einzelnen und die Allgemeinheit – dauerhaft so unkritisch und irrational wie Antibiotika eingesetzt wurde. Dass hier irgendetwas grundsätzlich falsch gelaufen ist und uns die postantibiotische Ära mit der Zunahme nicht mehr behandelbarer Infektionen aufgrund multiresistenter Bakterienstämme droht, hat sich ja mittlerweile bis in die allerhöchste Politik herumgesprochen und war sogar auf der Agenda beim sogenannten G7-Gipfel 2015 im deutschen Schloss Elmau. Dass diese Entwicklung abzusehen war, haben ja bereits zu den Hochzeiten der Antibiotikaneuentwicklung einsame Warner immer wieder gesagt, doch nichts ist schwerer als ernsthafte Probleme wahrzunehmen und im ersten Schritt sein persönliches Verhalten zu ändern, wenn ein übermächtiger Player wie die Pharmaindustrie den Ärzten und der Öffentlichkeit suggeriert, dass alles ja nur halb so schlimm sei. Dass hierbei selbst die Weltgesundheitsorganisation (World Health Organization – WHO) bei der Umsetzung von Gegenstrategien an ihre Grenzen stieß, belegt die Tatsache, dass sie im Rahmen ihrer Millenium-Ziele im Jahr 2000 einen Maßnahmenkatalog zur Bekämpfung des weltweiten Antibiotikamissbrauchs und der Resistenzentwicklung vorgeschlagen hatte und dann 2007 in einem „Progress Report“ mehr oder weniger frustriert feststellte, dass – global gesehen – nichts passiert ist.
Nun, „nichts passiert“ ist natürlich nicht ganz richtig. Es gab schon immer engagierte Kliniker, Pharmazeuten und Mikrobiologen, die versucht haben, gegen dieses vielfach unkritische Verhalten im Umgang mit Antibiotika durch Aufklärung, Beratung und Weiterbildung vorzugehen. Letztendlich waren es die Infectious Diseases Society of America (IDSA) und die Society for Healthcare Epidemiology of America (SHEA), die 2007 in den „Guidelines for Developing an Institutional Programme to Enhance Antimicrobial Stewardship“ diese auf lokaler Ebene vielfach erfolgreich belegten Erfahrungen zusammengefasst veröffentlichten [1, 2]. Diese Empfehlungen waren wiederum die Grundlage für eine deutsch-österreichische Arbeitsgruppe, die sich 2009 unter der Federführung der Deutschen Gesellschaft für Infektiologie (DGI) zusammenfand, um eine entsprechende deutschsprachige Leitlinie zu erstellen. Diese wurde schließlich am 1. Dezember 2013 unter der AWMF-Registriernummer 092/001 als S3-Leitlinie „Strategien zur Sicherung der rationalen Antibiotika-Anwendung im Krankenhaus“ veröffentlicht.
Erstellung der Leitlinie
Die Arbeitsgruppe umfasste 21 medizinische und pharmazeutische Kolleginnen und Kollegen, die neben der federführenden DGI sieben weitere Fachgesellschaften, Verbände bzw. Institutionen vertraten.
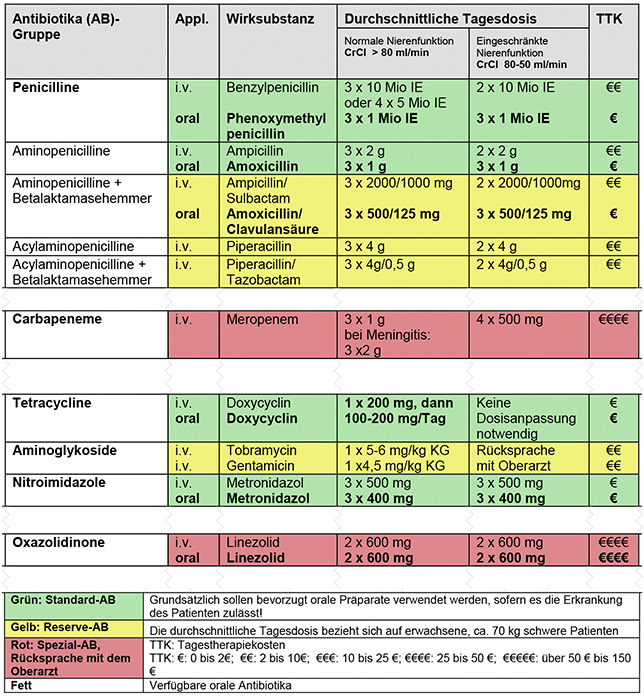
Tabelle 1: Beispiel für eine Antibiotika-Hausliste [www.awmf.org/uploads/tx_szleitlinien/092-001l_S3_Antibiotika_Anwendung_im_Krankenhaus_2013-12.pdf].
Neben der vorgenannten IDSA/SHEA-Leitlinie basierte die Arbeit auf einem Cochrane-Review von Davey et al. aus dem Jahre 2005 (mit einem entsprechenden Update 2013) zu „Interventions to improve antibiotic prescribing practices for hospital inpatients“, zudem wurde die entsprechende Literatur zu dem Themenkomplex „rationaler Antibiotikaeinsatz im Krankenhaus“ aus dem Zeitraum 2007 bis April 2012 systematisch gesichtet und bewertet. Die Erstellung der Leitlinie erhielt während ihrer Bearbeitung einen zusätzlichen Stellenwert, als in der Novellierung des Infektionsschutzgesetzes im Juli 2011 ausgeführt wurde, dass Krankenhäuser sicherzustellen haben, dass „Daten (…) des Antibiotikaverbrauchs unter Berücksichtigung der lokalen Resistenzsituation bewertet und sachgerechte Schlussfolgerungen hinsichtlich des Einsatzes von Antibiotika gezogen werden, und dass die erforderlichen Anpassungen des Antibiotikaeinsatzes dem Personal mitgeteilt und umgesetzt werden“ (Infektionsschutzgesetz – IfSG § 23 Abs. 4). Über die gleichzeitig am Robert Koch-Institut (RKI) einzurichtende Kommission Antiinfektiva, Resistenz und Therapie (ART), deren Aufgabe es ist, entsprechend den Empfehlungen der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) allgemeingültige Empfehlungen zum Einsatz von Antibiotika zu erstellen, wird die Bedeutung des Antibiotic Stewardship auch vom Gesetzgeber klar hervorgehoben.
Definition „Antibiotic Stewardship“ und Ziele
AntiBiotic Stewardship (ABS)-Programme sollen und können in Kombination mit Maßnahmen und Programmen zur Infektionsprävention die im Infektionsschutzgesetz genannten Aufgaben übernehmen.
ABS-Programme im Krankenhaus haben das Ziel, die Qualität der Verordnung von Antiinfektiva bezüglich Auswahl der Substanzen, Dosierung, Applikation und Anwendungsdauer kontinuierlich zu verbessern, um beste klinische Behandlungsergebnisse unter Beachtung einer Minimierung von Toxizität für den Patienten sowie von Resistenzentwicklung und Kosten zu erreichen.
Inhalte der Leitlinie
Die Leitlinie gliedert sich in fünf Blöcke: Strukturelle Voraussetzungen für ABS im Krankenhaus, ABS-Kernstrategien, ergänzende ABS-Strategien, Literatur mit insgesamt 435 Zitaten und ABS-Qualitätsindikatoren.
Voraussetzungen für ABS im Krankenhaus
Der rationale Umgang mit Antiinfektiva im Krankenhaus ist im Gegensatz zur weitverbreiteten Ansicht vieler Ärzte keine Selbstverständlichkeit, sondern erfordert ein spezielles Wissen und es zeigt sich, dass für eine systematische Optimierung des Antibiotikaeinsatzes entsprechend geschulte Spezialisten vorhanden sein müssen. Aus diesem Grunde ist die wichtigste Voraussetzung für die wirksame Durchführung von ABS-Programmen ein multidisziplinäres Team, das von der Krankenhausleitung den Auftrag und Ressourcen erhalten soll, im Konsensus mit den Anwendern Leitlinien zur Behandlung von Infektionserkrankungen zu erstellen und deren Umsetzung durch ABS-Maßnahmen zu sichern. Das Team soll mindestens aus einem Infektiologen (bzw. infektiologisch ausgebildeten, klinisch tätigen Facharzt) und erfahrenen Fachapotheker für klinische Pharmazie sowie einem für die mikrobiologische Diagnostik und klinisch-mikrobiologische Beratung zuständigen Facharzt für Mikrobiologie, Virologie und Infektionsepidemiologie und dem für die Krankenhaushygiene lokal verantwortlichen Arzt bestehen. Die Mitglieder des Teams sollen im Bereich Antibiotic Stewardship fortgebildet sein oder bereits über entsprechende Erfahrung verfügen. Für das ABS-Team ist ein Zeitkontingent fest vorzusehen, das im Idealfall 0,5 Vollzeitstellen pro 250 Akutbetten betragen soll.
Eine Grundvoraussetzung für den vernünftigen Umgang mit Antiinfektiva ist die Kenntnis von und regelmäßige Informationen über die lokale Verteilung des Erregerspektrums, der Resistenzsituation sowie Verbrauchsdaten von Antiinfektiva. Beides erfordert eine enge Kooperation mit der klinischen Mikrobiologie bzw. Pharmazie. Während bisher allerdings einheitliche Vorgaben zu mikrobiologisch-epidemiologischen Datenerhebungen und Auswertungen fehlen, existieren zu den Verbrauchsanalysen dezidierte Vorgaben, die vom RKI im Rahmen ihrer gesetzlichen Vorgaben genau festgelegt sind. Diese Vorgaben werden zum Beispiel in dem seit einigen Jahren existierenden bundesweiten Surveillance-Programm „ADKA-if“ – gemeinsame Initiative des Bundesverbandes Deutscher Krankenhausapotheker (ADKA) und der Abteilung Infektiologie (if) der Universitätsklinik Freiburg; www.antiinfektiva-surveillance.de – erfüllt [3]. Hierbei werden Apothekenverbrauchsdaten elektronisch an die Infektiologie der Universität Freiburg übermittelt, dort auf Konsistenz und Plausibilität überprüft und schließlich ausgewertet und grafisch aufbereitet als bundesweite Vergleichsdaten den Einsendern zur Verfügung gestellt (Abbildung 1).
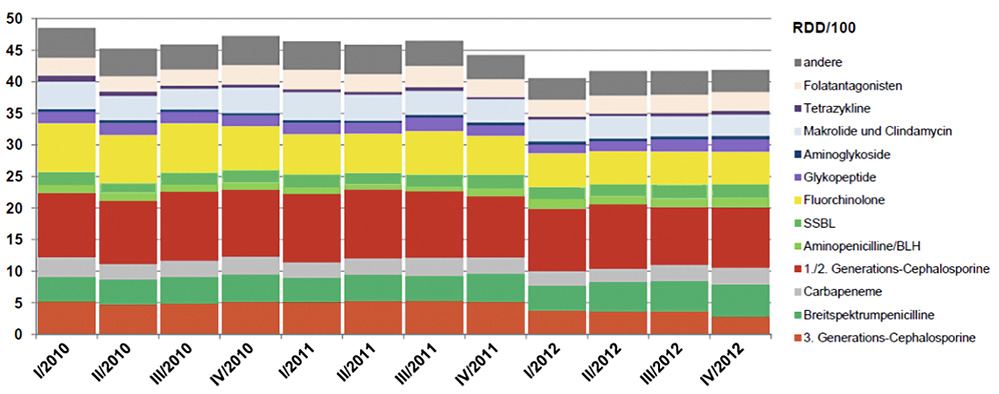 Abbildung 1: Grafische Darstellung der quartalsweisen Verbrauchsdichten (in RDD/100) für die verschiedenen Antibiotikaklassen, gemäß den Vorgaben des Infektionsschutzgesetzes § 23 Abs. 4 und den Ausführungsbestimmungen des Robert Koch-Instituts. „Recommended daily dose“ (RDD) als Maß der Verbrauchsdichte entspricht den in Deutschland gültigen täglichen Dosierungen bei Erwachsenen bezogen auf 100 Patienten-(Pflege-)tage [www.awmf.org/uploads/tx_szleitlinien/092-001l_S3_Antibiotika_Anwendung_im_Krankenhaus_2013-12.pdf].
Abbildung 1: Grafische Darstellung der quartalsweisen Verbrauchsdichten (in RDD/100) für die verschiedenen Antibiotikaklassen, gemäß den Vorgaben des Infektionsschutzgesetzes § 23 Abs. 4 und den Ausführungsbestimmungen des Robert Koch-Instituts. „Recommended daily dose“ (RDD) als Maß der Verbrauchsdichte entspricht den in Deutschland gültigen täglichen Dosierungen bei Erwachsenen bezogen auf 100 Patienten-(Pflege-)tage [www.awmf.org/uploads/tx_szleitlinien/092-001l_S3_Antibiotika_Anwendung_im_Krankenhaus_2013-12.pdf].
ABS-Kernstrategien
Drei Strategien bilden das Fundament für ein erfolgreiches ABS-Programm. Sie umfassen im Sinne einer
» Strukturqualität: durch das ABS-Team konsentierte und verbindliche Vorgaben zur Verfügbarkeit definierter Substanzen (Antibiotika-Hausliste – Tabelle 1), der lokalen Resistenzsituation angepasste leitliniengerechte Vorgaben zum prophylaktischen und therapeutischen Einsatz von Antiinfektiva (Behandlungsempfehlungen/-pfade) sowie Verschreibungsvorgaben bzw. Sonderrezeptregelungen zum Einsatz spezieller Substanzen („Reserveantibiotika“),
» Prozessqualität: regelmäßige Fort- und Weiterbildungen auf dem Gebiet der Infektionsprophylaxe und -behandlung sowie Bereitstellung von entsprechenden Informationen in schriftlicher oder elektronischer Form. Wichtigster Punkt, der über Erfolg und Misserfolg eines ABS-Programms entscheidet, sind sogenannte proaktive Antibiotika-Analysen. Hierunter wird die systematische Beratung und Kontrolle des Antibiotikaeinsatzes am Krankenbett, die Etablierung eines Konsiliardienstes sowie die Surveillance bei der Umsetzung verstanden, und schließlich
» Ergebnisqualität: anhand definierter Indikatoren kann und soll der Effekt eines ABS-Programms regelmäßig überprüft werden. Dies dient zum einen der Erfolgskontrolle und zum anderen dem Erkennen von Schwachpunkten und Defiziten.
Ergänzende ABS-Strategien
Ergänzend werden diese Programme genannt, weil ihre Anwendung vor allem der Therapie-optimierung dient und situationsbedingt umgesetzt werden sollen.
» Unter Deeskalation wird die Vereinfachung der Therapie nach einer initialen Breitspektrumtherapie verstanden. Grundlage hierfür ist in der Regel das Vorliegen einer definitiven Infektionsdiagnose und eines mikrobiologischen Befundes einschließlich Antibiogramm, sodass die Therapie entsprechend angepasst werden kann: „so breit wie nötig und so schmal wie möglich“.
» Die Verkürzung der Behandlungsdauer mit Antibiotika ist eine evidenzgesicherte Maßnahme, die im klinischen Alltag sehr häufig auf Unverständnis stößt und der häufig zu hörenden (und völlig widersinnigen) Aussage „man muss doch immer über einen bestimmten Zeitraum hinweg Antibiotika geben, weil bei zu kurzer Gabe Resistenzen entstehen“ scheinbar zuwiderläuft.
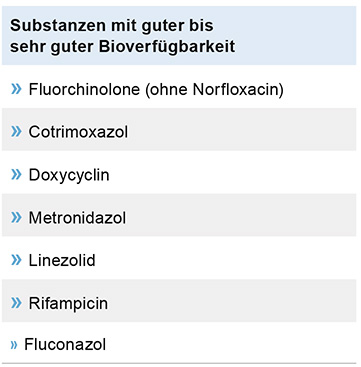
» Ähnliches gilt für die Oralisierung (Tabelle 2) von Antibiotika, weil vielen Kollegen nicht bewusst ist, dass bei vielen Substanzklassen auch bei oraler Gabe ähnliche Wirkspiegel erreicht werden können.
» Nicht empfohlen wird das sogenannte „Cycling“, das heißt, der periodische Wechsel einzelner Substanzklassen innerhalb einer Abteilung. Die Vorstellung, dass auf diese Weise eine Resistenzentwicklung verhindert werden kann, hat sich in klinischen Studien nicht belegen lassen.
Die Bedeutung der mikrobiologischen Infektionsdiagnostik und die Einhaltung der Präanalytik, das heißt die Indikationsstellung, korrekte Probengewinnung und zeitnaher Transport in das Labor, wird in einer Reihe von Studien belegt, stößt aber im klinischen Alltag vielfach aufgrund der Verlagerung der labormedizinischen Versorgung in weiter entfernte Großlabore immer wieder auf Probleme. Umso wichtiger ist, dass ein enger Kontakt zwischen dem ABS-Team und der klinischen Mikrobiologie besteht, sodass sichergestellt wird, dass relevante Befunde zeitnah erstellt und dem Kliniker mitgeteilt werden.In ähnlicher Weise ist das Problem beim Management von Patienten mit multiresistenten Erregern und Clostridium difficile gelagert. Für ein ganzheitliches Vorgehen genügt es nicht, eine Diagnose zu stellen und eine entsprechende Antibiotikatherapie zu beginnen. Hier sind in Zusammenarbeit mit dem verantwortlichen Krankenhaushygieniker infektionspräventive Maßnahmen einzuleiten, um eine kritische Verbreitung dieser häufig auch hochvirulenten Erreger zu verhüten. Die Bedeutung von ABS-Maßnahmen für das Management von Patienten mit multiresistenten Erregern und Clostridium difficile durch das ABS-Team ist vor allem für Clostridium difficile nach mehreren systematischen Reviews und in entsprechenden Studien gut dokumentiert [4]. Insbesondere Vorbehandlung mit Drittgenerations-Cephalosporinen und Fluorchinolonen stellt ein Risiko für die Entwicklung der Clostridium-difficile-Infektion dar, letztendlich aber auch für die Zunahme ESBL-produzierender gramnegativer Erreger (ESBL – Extended-Spectrum-Betalaktamasen), Methicillin-resistenter Staphylococcus aureus (MRSA) und Vancomycin-resistenter Enterokokken (VRE) [5]. Substanzielle Verordnungsbeschränkungen besonders von Drittgenerations-Cephalosporinen und Fluorchinolonen, aber auch von Makroliden und Clindamycin führten in Vorher-Nachher-Untersuchungen zu einer Reduktion der Clostridium-difficile-Erkrankungsinzidenz um etwa 50 Prozent, teilweise auch mehr. Häufig wurden dabei krankenhaushygienische Maßnahmen begleitend eingeführt oder vorgeschaltet, wobei die alleinige Umsetzung basishygienischer Maßnahmen keinen nachhaltigen Erfolg zeigte. Bei gehäuftem Auftreten mehrfach resistenter Erreger und Ausbrüchen sollten umgehend Empfehlungen zu Diagnostik, Befundung, Behandlung sowie krankenhaushygienischem Management abgestimmt und lokal bekannt gemacht werden. Hier besteht in der Regel eine große Unsicherheit bezüglich optimaler Therapie. Unter Umständen müssen unkonventionelle Substanzen oder konventionelle Substanzen in unüblicher Dosis und Kombination verwendet werden. Es ist in dieser Situation unerlässlich, dass das ABS-Team in Abstimmung mit dem mikrobiologischen Labor Empfehlungen erarbeitet, um unter den gegebenen Umständen optimale Behandlungsergebnisse zu ermöglichen und nicht die weitere Verbreitung von multiresistenten Erregern durch inadäquaten Antibiotika-Einsatz zu fördern.
Als letzter Punkt dieser ergänzenden Strategieliste wird der Einsatz von Expertensystemen aufgeführt. Hier liegt ein Entwicklungspotenzial, das bislang nur punktuell genutzt wird. Es ist aber zu erwarten, dass mit der Einführung elektronischer Patientenakten auch das Thema dieser Systeme ein unverzichtbarer Bestandteil der Krankenversorgung sein wird [6].
Qualitätsindikatoren
Die Bereitschaft und der Wille, ein ABS-Programm in einem Krankenhaus zu etablieren, reicht alleine nicht aus, um ein solches Vorgehen auch erfolgreich zu gestalten. Es gelten die gleichen Regeln wie bei Einführung anderer Programme zur Verbesserung der Behandlungsqualität in der Krankenversorgung. Ohne regelmäßige Erfolgskontrolle sterben viele dieser positiven Ansätze einen schnellen Tod. Deshalb ist die Forderung nach Einbindung des ABS-Programms in das einrichtungsspezifische Qualitätsmanagementsystem in sich schlüssig und notwendiger Bestandteil bei seiner Umsetzung. Aufgrund der unterschiedlichen Strukturen und Organisation von Krankenhäusern müssen ABS-Maßnahmen lokal evaluiert und gegebenenfalls entsprechend angepasst werden. Neben den gesetzlichen Vorgaben zur Surveillance resistenter Erreger, des Antibiotikaverbrauches und ausgewählter Daten zum Infektionsmanagement aus der externen Qualitätssicherung müssen zusätzlich weitere Qualitätsindikatoren für das jeweilige Haus festgelegt und regelmäßig gemessen werden. Nur so kann systematisch überprüft und dokumentiert werden, inwieweit sich die Ziele des ABS-Programms erreichen lassen.
Um eine angemessene Wertigkeit sicherzustellen, unterliegt die Auswahl von Qualitätsindikatoren einem ähnlich rigorosen und evidenzbasierten Prozess, wie dies bei der Erstellung von Leitlinien gilt. So wurde von der Leitliniengruppe in Zusammenarbeit mit einem ABS-Netzwerk in einem mehrstufigen Prozess ein Katalog von Indikatoren erstellt, der als Grundlage für die externe und interne Qualitätssicherung dienen soll. Hierbei wurden sowohl die klinische, die ökologische (Einfluss auf die Resistenzentwicklung) als auch die ökonomische (Kosten, Kosteneffektivität) Relevanz sowie die Praktikabilität in mehreren Kategorien bewertet. Daraus ergab sich zunächst eine vorläufige Liste von 99 Struktur- und Prozessindikatoren. In mehreren weiteren Sitzungen wurden schließlich jeweils 21 Struktur- und Prozessindikatoren festgelegt (Tabelle 3 und 4). In jedem ABS-Programm sollten möglichst aus dieser Liste geeignete Qualitätsindikatoren zum Verordnungsverhalten (Prozessindikator) und zur Struktur (Strukturindikator) festgelegt und verwendet werden. Je mindestens drei Indikatoren der Strukturqualität und der Prozessqualität sollen regelmäßig bestimmt werden. Darüber hinaus gelten als kontinuierlich zu messende Ergebnisindikatoren die Entwicklung der Resistenzsituation und des Antiinfektivaverbrauchs.

Tabelle 3: Indikatorliste zur Strukturqualität eines ABS-Programms.

Tabelle 4: Indikatorliste zur Prozessqualität eines ABS-Programms.
1 TEE – Transösophageale Echokardiografie; 2 HACEK – H: Haemophilus aphrophilus und Haemophilus paraphrophilus, A: Aggregatibacter (Actinobacillus) actinomycetemcomitans, C: Cardiobacterium hominis, E: Eikenella corrodens, K: Kingella kingae
Fazit und Zusammenfassung
Diese S3-Leitlinie zum Antibiotic Stewardship unterscheidet sich von einer Vielzahl anderer klinischer Leitlinien vor allem darin, dass hier keine klaren Handlungsanweisungen oder klinischen Behandlungspfade vorgegeben werden, sondern von den Ärztinnen und Ärzten auf der Grundlage wissenschaftlich fundierter Erkenntnisse und Studien eine grundsätzliche Verhaltensänderung beim Umgang mit Antiinfektiva gefordert wird. Antibiotika wurden vor rund 70 Jahren für den breiten Einsatz in der Humanmedizin eingeführt und haben sicherlich entscheidend zu den Fortschritten in der modernen Medizin beigetragen. Antibiotika sind – neben den Chemotherapeutika (im Sinne von Onkologika) – die einzige Medikamentenklasse, deren heilende Wirkung durch die Abtötung von lebenden Zellen erreicht wird. Antibiotika wirken kausal und kurativ, und dies meist bei einer sehr kurzen Therapiedauer. Sie bewirken aber auch bei den betroffenen Mikroorganismen die Initiierung eines natürlichen Prozesses, der diese resistent gegen die betreffende Substanz macht. Einen ähnlichen Vorgang bei Krebszellen kann man auch bei der Anwendung einzelner Chemotherapeutika beobachten. Nur dass das Auftreten von Resistenzen bei Mikroorganismen nicht ein auf einen einzelnen Patienten beschränktes Ereignis bleibt, sondern sich mehr oder weniger schnell ausbreitet und so auch negative Auswirkungen auf die Allgemeinheit hat. Antibiotika sind die einzigen Arzneimittel, bei deren Anwendung – und zwar schon von der ersten Tablette oder Dosis an – zukünftige Patienten Schaden durch eine möglicherweise vorliegende Antibiotikaresistenz zugefügt wird. Dieses ethische Dilemma wird beschrieben als das Recht des einzelnen Patienten auf eine Antibiotikabehandlung vs. das Recht zukünftiger Patienten auf eine noch wirksame Therapie ist den meisten Verschreibern von Antibiotika nicht bewusst. Darin liegt sicherlich auch ein Grund, warum das Resistenzproblem lange Jahre ignoriert wurde, aber auch weil die Forschung uns über fast 40 Jahre hinweg ständig neue und immer breiter wirksame Antibiotika zur Verfügung gestellt hat. Seitdem wir aber sozusagen am Ende der Fahnenstange bei der Neuentwicklung von Antibiotika angekommen sind, rückt die drohende postantibiotische Ära immer mehr in den Blickpunkt des Interesses.
Zahlreiche Untersuchungen belegen, dass ca. 30 bis 50 Prozent aller Antibiotika im Krankenhaus (für den niedergelassenen Bereich dürfte das Gleiche gelten) nicht indiziert sind, falsch verabreicht oder zu lange gegeben werden. Neben der immer wieder zu beobachtenden Erwartungshaltung von Patienten hängt dies in erster Linie damit zusammen, dass das ärztliche Wissen über den richtigen Einsatz von Antibiotika stetig und industrieunabhängig auf den neuesten Stand gebracht werden muss. Genau hier setzt diese Leitlinie an: sie versucht klarzumachen, dass die sachgerechte und rationale antiinfektive Behandlung kein gottgegebenes ärztliches Wissen ist, sondern einer entsprechenden Fort- und Weiterbildung bedarf – und zwar durch industrieunabhängige Veranstaltungen. Antibiotikabehandlung erfordert Spezialwissen, wie dies bei anderen medizinischen Behandlungen selbstverständlich der Fall ist. Nur auf diese Weise kann sichergestellt werden, dass die Verordnung von Antiinfektiva zu besten klinischen Behandlungsergebnissen unter Beachtung der Minimierung von Toxizität für den Patienten sowie von Resistenzentwicklung und Kosten erreicht werden kann.

Das Literaturverzeichnis kann beim Verfasser angefordert oder im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Der Autor erklärt, dass er keine finanziellen oder persönlichen Beziehungen zu Dritten hat, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Professor Dr. Heinrich K. Geiss
Teilen:
Das könnte Sie auch interessieren: