S1-Leitlinie: Pädiatrische Multiple Sklerose
 Pädiatrische Multiple Sklerose
Pädiatrische Multiple Sklerose
pädiatrische Multiple Sklerose (MS), eine der wichtigsten erworbenen neurologischen Erkrankungen des Kindesalters, bedarf einer frühzeitigen Erkennung, Diagnosestellung und Behandlung. Aktuelle epidemiologische Untersuchungen [1] zeigen, dass drei bis fünf Prozent aller MS-Erkrankten Symptome bereits vor dem 17. Lebensjahr entwickeln. Das Auftreten vor dem zehnten Lebensjahr ist mit einer jährlichen Inzidenz von 0,09/100.000 sehr selten und steigt in der Adoleszenz auf 2,64/100.000 [1].
Prinzipiell scheint die MS im Kindes- und Jugendalter mit der Erwachsenenerkrankung vergleichbar zu sein, dennoch bestehen Besonderheiten in Bezug auf die klinische Symptomatik, den Verlauf sowie die Therapie. Pädiatrische MS-Patienten haben mehr Läsionen im MRT und eine höhere Schubrate als Erwachsene. Da die Rückbildung der Symptome nach einem Schub schneller und vollständiger ist, steigt der Behinderungsgrad initial langsamer an. Nach einer Untersuchung von Renoux et al. dauert es in der Regel 20 Jahre bis eine das Alltagsleben einschränkende Behinderung (Expanded Disability Status Scale – EDSS – von 4) [2] eintritt, aufgrund der frühen Manifestation sind die Patienten im Durchschnitt dann aber erst 34 Jahre alt [3].
Die Leitlinie fokussiert auf die wichtigsten Aspekte der Diagnostik und Therapie der pädiatrischen MS. Dabei hat sie den Schwerpunkt im Bereich der Therapieempfehlungen. Die Leitlinie für die pädiatrische MS orientiert sich an der Leitlinie zur MS im Erwachsenenalter (AWMF-Leitlinie Multiple Sklerose, Registrierungsnummer: 030-050), behandelt allerdings als Erweiterung der Leitlinie der Deutschen Gesellschaft für Neurologie konkrete Handlungsempfehlungen für das Akut-Management sowie für die immunmodulatorische Dauertherapie im Kindes- und Jugendalter.
Methodik der Leitlinienerstellung
Die Suchstrategie in den Jahren 2014/15 in PubMed und Cochrane bezog sich auf die Stichworte: multiple sclerosis, pediatric, childhood, diagnostic criteria, definition adolescent, treatment, therapy, immunmodulation. Die Literatursuche in PubMed (2000 bis 2015) wurde weiter durch das Altersspektrum (child 6-12 years; adolescents 13-18 years) limitiert. Für viele Aspekte der pädiatrischen MS liegen ausschließlich Aussagen und Empfehlungen relativ geringer Evidenzstärke wie Konsensusempfehlungen oder Expertenmeinungen vor. Es fehlen weitestgehend kontrollierte Studien.
Hinsichtlich der Stärke der Empfehlung werden gemäß dem Scottish Intercollegiate Guidelines Network drei Empfehlungsgrade unterschieden, die sich auch in den Formulierungen für die besprochenen Maßnahmen wiederfinden. Es werden folgende Modalitäten unterschieden (starke Empfehlung (A): „soll“; Empfehlung (B): „sollte“, Empfehlung offen (C): „kann“ (Tabelle 1) [4].

Tabelle 1: Stärke der Empfehlung nach dem Scottish Intercollegiate Guidelines Network (SIGN) [4].
Beteiligte Fachgesellschaften und Vertreter
» Gesellschaft für Neuropädiatrie (GNP, Professor Dr. Jutta Gärtner)
» Deutsche Gesellschaft für Neurologie (DGN, Professor Dr. Ralf Gold)
» Deutsche Gesellschaft für Kindern- und Jugendmedizin (DGKJ, Professor Dr. Regina Trollmann)
Die Vorstände aller beteiligten Fachgesellschaften haben der Leitlinie in der vorliegenden Form zugestimmt.
Verlaufsformen
Klinisch isoliertes Syndrom (clinically isolated syndrome – CIS): Als CIS wird ein erster klinischer Schub bezeichnet, bei dem in der zerebralen und/oder spinalen MRT Läsionen vorliegen, die Kriterien für eine zeitliche oder örtliche Dissemination jedoch nicht erfüllt sind, aber sowohl die klinische Symptomatik als auch das Läsionsmuster im MRT typisch für eine MS sind. In den folgenden fünf Jahren nach einem CIS wird je nach Studie bei 15 Prozent bis 46 Prozent eine MS diagnostiziert [5].
Am häufigsten ist der primär schubförmige Verlauf, der durch akute Schübe mit neurologischer Verschlechterung, einer Remission nach einem Schub und progressionsfreie Intervalle zwischen den Schüben gekennzeichnet ist. Diese Form findet sich in 95 bis 98 Prozent aller Fälle im Kindes- und Jugendalter (bei Erwachsenen in bis zu 80 Prozent der Erkrankten). Die mittlere Schubrate beträgt bei der pädiatrischen MS 1,9 im ersten Jahr nach Manifestation, 0,7 im zweiten Jahr und 0,4 im dritten Jahr [6].
Primär chronisch progredient verlaufende Erkrankungen stellen im pädiatrischen Kollektiv seltene Ausnahmen dar und sollten immer zum Anlass genommen werden, die Diagnose als solche zu überprüfen.
Klinische Symptomatik
Im Rahmen der Erstmanifestation treten sensorische Symptome (Taubheitsgefühle oder Kribbeln) sehr häufig auf. Daneben wird in 14 bis 35 Prozent der Fälle eine Optikusneuritis als initiales Symptom beschrieben. Auch häufig beobachtet man Hirnstammsymptome (Nystagmus, Gleichgewichtsstörungen mit Übelkeit und Erbrechen) [1, 7]. Als weitere unspezifische Beschwerden treten Kopfschmerzen, Schwindel, Konzentrationsschwäche und Müdigkeit auf.
Bei präpubertären Kindern präsentiert sich der erste Schub häufig polyfokal mit motorischen Störungen, Ataxie, Sphinkterstörungen aber auch kognitiven Problemen. Darüber hinaus kommt es bei Kindern nach dem ersten Schub oftmals nicht zu einer vollständigen Remission [8].
Diagnostik
Die Diagnose einer MS stützt sich auf die Anamnese (Hinweise für bereits früher stattgehabte neurologische Ereignisse mit Schubcharakter), die Objektivierung klinisch neurologischer Ausfälle, die eine zentralnervöse Störung anzeigen, sowie den klinischen oder paraklinischen Nachweis einer zeitlichen und örtlichen Dissemination bei Ausschluss anderer Ursachen.
Als ein Schub wird ein neurologisches Symptom bezeichnet, welches mindestens 24 Stunden angehalten hat, einen Abstand von mindestens 30 Tagen zum vorangegangenen Schub hat und nicht anderweitig erklärbar ist (zum Beispiel durch Fieber oder große Hitze). Die genaue Beachtung dieser Definition ist wichtig, da die Anzahl der Schübe innerhalb eines festgelegten Zeitraumes mitentscheidend für die Indikation einer verlaufsmodifizierenden Behandlung ist und auch bei der Beurteilung des Therapieeffektes Berücksichtigung findet.
Diagnostik bei Erstvorstellung
Die frühzeitige Diagnose ermöglicht einen prompten Therapiebeginn. Neben der Anamnese dienen klinisch-neurologische Untersuchungen sowie insbesondere die MRT-Darstellung der gesamten Neuroachse zur umgehenden Sicherung der Diagnose (Tabelle 2). Liquor- und serologische Analysen grenzen die MS gegen mögliche Differenzialdiagnosen ab. Evozierte Potenziale (insbesondere visuell und somatosensorisch) können klinisch stumme Läsionen aufdecken oder objektivieren.
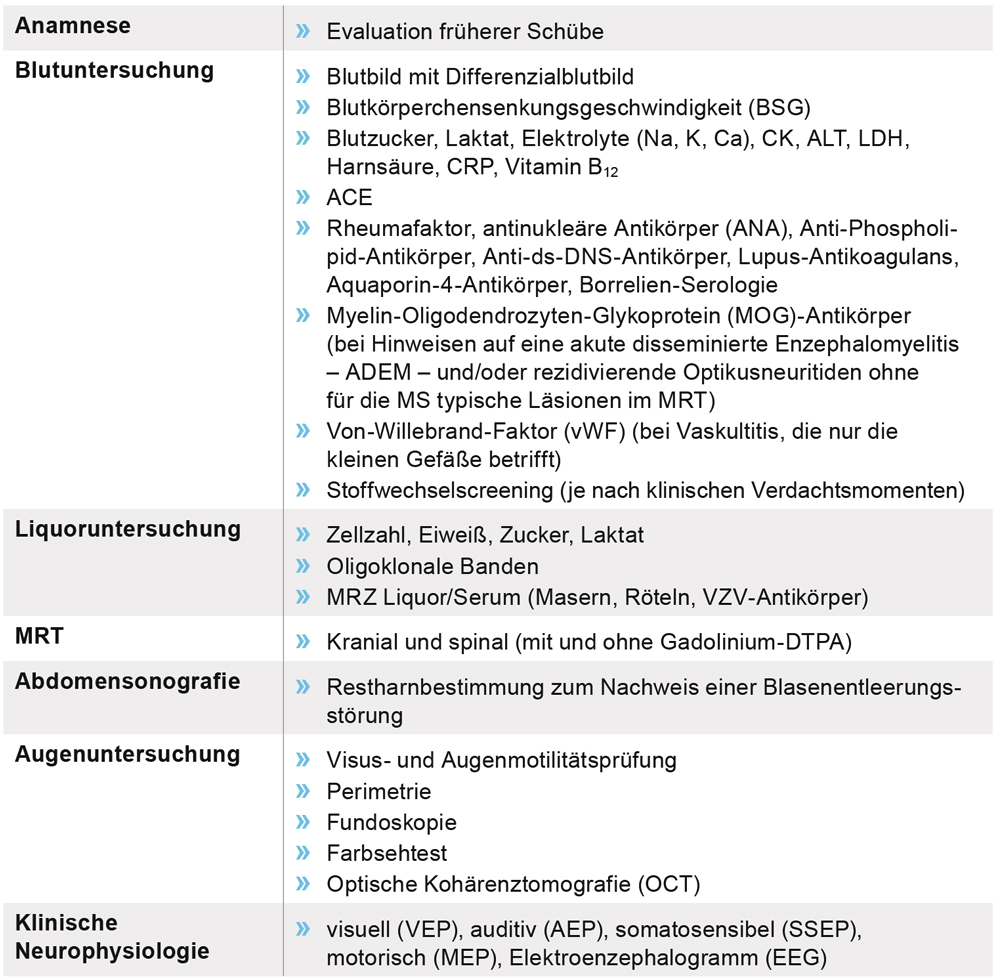
Tabelle 2: Empfohlene Diagnostik bei Verdacht auf MS
Die Diagnosestellung erfolgt auch im Kindesalter gemäß den McDonald-Kriterien (2010 revidierte Fassung der McDonald-Kriterien [9]). Da es keine einzelnen klinischen oder paraklinischen Befunde gibt, anhand derer sich eine MS ohne Zweifel diagnostizieren lässt, stellt die Tabelle 3 mögliche Befundkombinationen dar. Erst wenn sämtliche Diagnosekriterien für eine MS erfüllt sind und sich die Symptome nicht anderwärtig erklären lassen, kann die MS-Diagnose gestellt werden (Abbildung 1).

Tabelle 3: Diagnostische Kriterien für MS. 2010 Revision der McDonald-Kriterien [9]. * Dissemination bezeichnet das Auftreten mehrerer Läsionen, die entweder räumlich oder zeitlich getrennt auftreten.

Abbildung 1: Atypische Befunde, die eine erneute Überprüfung der Diagnose einleiten sollten.
Therapie
Es gibt derzeit keine Ergebnisse aus kontrollierten prospektiven klinischen Studien über die Behandlung der pädiatrischen MS. Die Therapie erfolgt daher weitgehend in Anlehnung an die MS im Erwachsenenalter, wobei bei Kindern und Jugendlichen verschiedene Besonderheiten zu beachten sind.
Therapie des akuten Schubes
Ein Schub sollte möglichst bald, das heißt innerhalb von zwei bis fünf Tagen nach Beginn der klinischen Symptomatik behandelt werden. Es werden intravenös einmal täglich 20 mg/kgKG Methylprednisolon (Maximaldosis 1 g/Tag) unter Magenschutz für drei bis fünf Tage (Steroid-Puls) gegeben. Sieben bis 14 Tage nach Beendigung des Steroidpulses sollte eine Re-Evaluation erfolgen. Bei nur geringer Besserung oder Zunahme der klinischen Symptomatik wird die Steroid-Puls-Therapie wiederholt. Sind die klinischen Symptome gravierend, zum Beispiel als gravierende unilaterale Hemiparese, bilaterale Parese oder Blindheit und bessern sich diese nicht deutlich durch die Steroid-Puls-Behandlungen, werden zeitnah fünf Zyklen einer Plasmapharese oder Immunadsorption empfohlen.
Immunmodulatorische Therapie
Ziel der immunmodulatorischen Therapie ist zum einen die Verringerung der Schubrate und Schubschwere, zum anderen das Hinauszögern oder Verhindern des Auftretens bleibender Behinderungen bzw. einer sekundär progredienten MS. Ein möglichst früher Beginn und eine konsequente Durchführung der Therapie sind anzustreben, da so die Prognose verbessert werden kann. Die Indikation zu einer immunmodulatorischen Therapie besteht daher, sobald die Diagnose MS gestellt wurde.
Verlaufsmodifizierende Therapie milde/moderate Verlaufsform
Bei Patienten mit leichten oder mittelschweren Verlaufsformen der MS wird zunächst eine Therapie mit einem der rekombinanten Interferon-beta-Präparate (IFN ß-1b Betaferon®/Bayer-Schering bioidentisch zu Extavia®/Novartis; IFN ß-1a Avonex®/BiogenIdec; Rebif®/Merck-Serono) oder Glatirameracetat (Copaxone®/Teva Pharma) eingeleitet. In Deutschland sind alle Präparate ab zwölf Jahren zugelassen, Rebif® hat die Zulassung ab zwei Jahren erhalten.
Auch Patienten, die jünger als zwölf Jahre sind, sollten zeitnah nach Diagnosestellung behandelt werden. Hierzu können alle aufgeführten immunmodulatorischen Präparate eingesetzt werden. Da die Erwachsenendosis zu schweren Nebenwirkungen führen kann, muss für jeden Patienten die individuell verträgliche Dosis gefunden werden. Die Therapie dieser Patienten sollte daher spezialisierten Zentren vorbehalten bleiben (Tabelle 4).

Tabelle 4: Gängige Medikation.
Für die Therapie mit Dimethylfumarat (Tecfidera®), pegyliertem Interferon ß-1a (Plegridy®), Teriflunomid (Aubagio®) und Alemtuzumab (Lemtrada®), die in Deutschland bei Erwachsenen mit MS auch für die Therapie der milden/moderaten Verlaufsform der MS zugelassen sind, gibt es bisher für die pädiatrische MS keine Erfahrungen.
Therapie bei (hoch-)aktiver Verlaufsform
Kriterien für eine (hoch-)aktive Verlaufsform
Eine (hoch-)aktive Verlaufsform muss angenommen werden, wenn unter einer verlaufsmodifizierenden Therapie im vorhergehenden Jahr mindestens ein Schub aufgetreten ist und mindestens neun T2-hyperintense Läsionen oder mindestens eine Gadolinium anreichernde Läsion im kraniellen MRT-Scan nachzuweisen sind.
Hinweisend auf eine hochaktive MS, bei der möglicherweise schon bei Diagnosestellung die Indikation zu einer Eskalationstherapie besteht, ist das Auftreten von zwei oder mehr Schüben mit Behinderungsprogression im Jahr zuvor und der Nachweis von ≥ 1 Gadolinium anreichernden Läsionen im kraniellen MRT oder eine signifikante Zunahme der T2-Läsionen im Vergleich zu einer kürzlich durchgeführten (sechs bis zwölf Monate alten) MRT-Aufnahme.
Die Therapie bei (hoch-)aktiver Verlaufsform wird bei Patienten eingesetzt, die kein ausreichendes Ansprechen auf die oben genannten Medikamente zeigen, sowie bei Patienten mit hochaktiver MS. Da alle für die Therapie bei (hoch-)aktiver Verlaufsform verfügbaren Medikamente in Deutschland unter 18 Jahren nicht zugelassen sind, handelt es sich immer um eine sogenannte Off-Label-Anwendung. Die Entscheidung zu einer solchen Therapie sollte in einem spezialisierten Zentrum bzw. in Kooperation mit diesem erfolgen.
Präparate für die (hoch-)aktive Verlaufsform
Derzeit werden in Deutschland Natalizumab (Tysabri®/Biogen Idec), Fingolimod (Gilenya®/Novartis) und Alemtuzumab (Lemtrada®/Genzyme) eingesetzt. Für das Kindes- und Jugendalter besteht derzeit die meiste Erfahrung mit Natalizumab; hierzu liegen Ergebnisse aus kleinen Fallserien vor [10, 11]. Die Therapie mit Natalizumab führt in der Regel zu einem weitgehenden Stillstand der Krankheitsaktivität. Patienten mit Natalizumab müssen engmaschig beobachtet werden, da unter der Therapie eine progressive multifokale Leukenzephalopathie (PML) auftreten kann. Für das Risiko an einer PML zu erkranken ist entscheidend, ob im Blut Antikörper gegen das JC-Virus (Humanes Polyomavirus) nachweisbar sind. Dies ist in Deutschland bei ca. 50 Prozent der Patienten mit pädiatrischer MS der Fall [12]. Bei diesen Patienten mit Nachweis von JCV-Antikörpern (JCV-positive Patienten) kann dennoch eine Therapie mit Natalizumab begonnen werden, sie sollte aber in der Regel nach zwei Jahren wieder beendet bzw. neu evaluiert werden, weil dann das Risiko an einer PML zu erkranken ansteigt. Im Einzelfall kann eine Fortsetzung der Therapie bei Patienten mit hochaktiver MS über diesen Zeitraum hinaus erwogen werden, bedarf dann aber einer besonderen Risikobeurteilung mit erneuter Aufklärung und schriftlichem Einverständnis. Für die zweite Substanz, Fingolimod, die zur Eskalationstherapie der pädiatrischen MS eingesetzt werden kann, gibt es bisher nur wenig Erfahrungen [13]. Diese deuten jedoch darauf hin, dass das Wirkungs- und Nebenwirkungsprofil bei pädiatrischer MS ähnlich dem bei adulter MS ist. Bei adulten Patienten hat Fingolimod sich auch für die Nachbehandlung von JCV-positiven Patienten nach Natalizumab als wirksam erwiesen. Für den Einsatz von Alemtuzumab liegen bisher keine Erfahrungen vor.
Für Informationen bezüglich der Nebenwirkungen und Kontraindikationen der immunmodulatorischen Medikamente sei auf die AWMF-Leitlinie „Diagnostik und Therapie der Multiplen Sklerose“ der Deutschen Gesellschaft für Neurologie verwiesen.
Aktuell befinden sich die Substanzen Teriflunomid, Dimethylfumarat und Fingolimod in klinischen Studien für Patienten unter 18 Jahren.
Allgemeine Betreuung
Die Betreuung dieser Patienten im Kindes- und Jugendalter bedarf besonderer Versorgungsstrukturen, die vor allem in spezialisierten interdisziplinären Zentren gewährleistet wird. Eine individuelle Betreuung der Patienten und ihrer Familien in der vulnerablen Phase der Adoleszenz wird durch ein interdisziplinäres Team aus Ärzten, Psychologen, Sozialpädagogen und Krankenschwestern gewährleistet. Beim Übergang in das Erwachsenenalter gehört zum Prozess der Transition ein individueller Kompetenzerwerb in Bezug auf die Erkrankung sowie die Sicherstellung einer bestmöglichen Kontinuität der Betreuung (Abbildung 2).
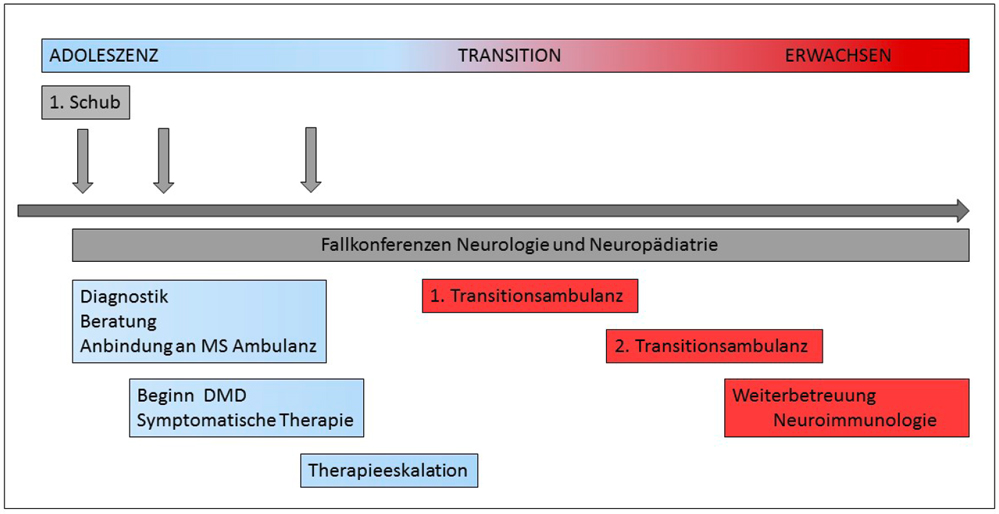
Abbildung 2: Herausforderung Übergang ins Erwachsenenalter. Transition als schrittweiser Übergang mit zunehmendem Kompetenzerwerb des jungen Patienten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-ärzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.


Professor Dr. Wolfgang Müller-Felber
Teilen:
Das könnte Sie auch interessieren:









