Pneumologie – highlighted
 Pneumologie – highlighted
Pneumologie – highlighted
Die drei hier vorgestellten Patienten mit akuten und chronischen Veränderungen aufgrund sehr unterschiedlicher Ätiologien (hier: infektiologisch, immunologisch-allergologisch, maligne) vermitteln einen Eindruck vom Spektrum der Pneumologie.
Insbesondere bei kritisch Kranken wird die komplexe Regulation der Ventilation – vom Atemzentrum bis zur Atemmuskulatur – deutlich. Die erste Fallvignette beschreibt eine der häufigen pneumologischen Notfallsituationen und erläutert anhand der pathophysiologischen Veränderungen aktuelle apparative Optionen zur Therapie von Ventilation und Gasaustausch.
Die Lunge steht mit jeder In- und Exspiration mit der Umwelt unmittelbar im Austausch. Der Anteil pneumologischer Erkrankungen durch inhalative Noxen oder Allergene im privaten oder beruflichen Umfeld ist erheblich. Gelingt die konsequente Karenz, verbessern sich Symptomatik, Prognose, und der Bedarf an pharmakologischer Therapie sinkt. Allerdings verdeutlicht die zweite Fallpräsentation, dass sowohl Identifikation des auslösenden Agens als auch die Überzeugung des Patienten zur konsequenten Karenz eine Herausforderung darstellen können.
In der pneumologischen Onkologie kann heute bei Patienten mit metastasiertem nicht-kleinzelligem Lungenkarzinom durch Kombination aus Chemo- und Immuntherapie ein längeres Überleben mit mehr Lebensqualität erzielt werden. Gleichzeitig stehen für einen Teil der Erkrankten orale, zielgerichtete Substanzen zur Verfügung. Die dritte Kasuistik demonstriert die diagnostische und therapeutische Vorgehensweise bei metastasiertem Lungentumor unter Einsatz aller oben genannter Modalitäten.
Allen hier vorgestellten Patienten ist gemeinsam, dass die Lungenerkrankung bzw. deren Therapie bei einer Infektion der Atemwege (zum Beispiel SARS-CoV-2) das Risiko für einen schwergradigen Verlauf erhöht [1].
Patient 1 – Notfall. Ex-Raucherin mit Dyspnoe und Somnolenz
Anamnese
Die 54-jährige Patientin stellt sich mit seit Tagen zunehmender Müdigkeit und deutlicher Verschlechterung einer bekannten Belastungsdyspnoe, begleitet von neu aufgetretenem Husten mit gelblichem Auswurf in der Notaufnahme vor. Eine COPD sei bekannt, die Patientin nutze ein Salbutamol Dosier-Aerosol bei Bedarf. Vor acht Monaten habe sie ihre „letzte Zigarette“ geraucht (zuvor kumulativ 70 pack years).
Verlauf
In der Notaufnahme präsentiert sich eine adipöse, beginnend somnolente Patientin mit verlängertem Exspirium und exspiratorischem Giemen über den basalen Lungenabschnitten beidseits. In der arteriellen Blutgasanalyse unter Raumluft findet sich eine deutliche Hypoxämie und Hyperkapnie mit Azidose (SpO2 57 Prozent, PaO2 29 mmHg, PaCO2 64 mmHg, pH 7,27). Somit liegt eine respiratorische Insuffizienz Typ II mit nicht kompensierter respiratorischer Azidose vor (Tabelle 1).
Unter sofortiger Sauerstoffgabe via Nasenbrille verbessert sich zwar die Oxygenierung (SpO2 75 Prozent) innerhalb von wenigen Minuten, allerdings verschlechtert sich der Grad der Hyperkapnie und die Patientin wird zunehmend somnolent.
In der Notaufnahme wird daher zeitnah eine nicht-invasive Beatmung (NIV) via Nasen-Mund-Maske eingeleitet. Im kurzfristigen Verlauf kommt es unter NIV (IPAP 14 mbar, EPAP 6 mbar, O2-Zufuhr 2 l/min) zur Abnahme der Hyperkapnie und zu einer geringen Besserung der Somnolenz. Es erfolgt die Verlegung auf die Intensivstation. Dort wird die leitliniengerechte Behandlung der infektassoziierten COPD-Exazerbation fortgesetzt, die unter anderem Antibiotika-, systemische Steroid- (Piperacillin/Tazobactam i.v., Prednisolon 40 mg p. o. über fünf Tage) sowie antiobstruktive Inhalationstherapie umfasst [2]. Am Abend des Folgetages ist die Patientin wach und verweigert die Fortführung der mittlerweile nur noch intermittierenden NIV. Unter Sauerstoffgabe kommt es innerhalb von zwölf Stunden zu einer deutlichen CO2-Retention. Erneut imponiert eine zunehmende Somnolenz. Arterielle Blutgasanalysen bestätigen einen PaCO2 zwischen 70 bis 90 mmHg. Bei intermittierendem Delir wird phasenweise eine nasale High-Flow-Therapie angewendet, da die Patientin unter der Mund-Nasen-Maske (sogenannte „Full Face Mask“; deckt Nase-Mund ab, lässt Stirn-Augen frei) Panik empfindet. Darunter kommt es zu einer Normalisierung der Oxygenierung, aber nur zu einer geringen Besserung der Hyperkapnie.
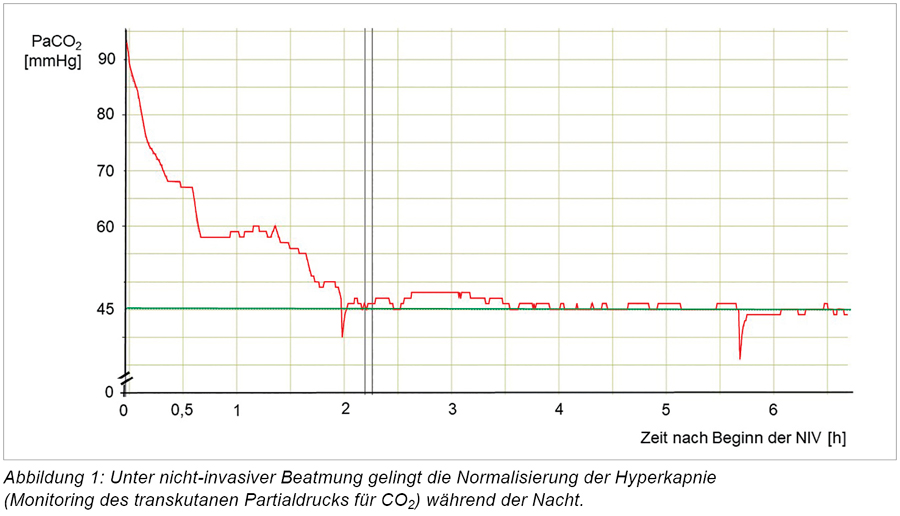
Erst nach wiederholter Aufklärung über die erhöhte Mortalität bei langfristiger Hyperkapnie infolge von Versagen der Atempumpe bei Patienten mit COPD können bei ihr Maske und NIV angepasst werden. Bei deutlich gebesserter Vigilanz, Eupnoe und rückläufiger Hyperkapnie in Blutgasanalysen unter nächtlicher NIV kann sie auf unsere spezialisierte Station für Patienten mit außerklinischer Beatmung übernommen werden. Dort wird der Inspirationsdruck im Bereich 20 bis 30 cm H2O während nächtlicher transkutaner Kapnometrie (PtcCO2-Messung) adaptiert (siehe Abbildung 1).
Die Patientin gibt keine Tagesmüdigkeit mehr an, wirkt deutlich wacher und verneint Dyspnoe. Die bisher unbehandelte COPD wird therapiert und die Patientin erhält eine Schulung in der Anwendung der Inhalationstherapie und der NIV sowie Beratung und Anbindung an eine Adipositas-Ambulanz zur Gewichtsreduktion. Eine stationäre pneumologische Rehabilitation wird beantragt.
Bei einer Kontrolluntersuchung nach acht Wochen und erfolgter Anschlussheilbehandlung zeigen sich eine regelmäßige und ausreichend lange Nutzung der NIV (100 Prozent der Tage, 6 h 20 min durchschnittlich).
Diskussion
Unser Fall zeigt die Risiken einer akuten Verschlechterung bei Patienten mit chronischer Überlastung der Atempumpe. Die häufigste Ursache ist, wie auch in diesem Fall, eine COPD. Andere Ursachen bzw. deren Kombination können zur chronischen Erschöpfung der Atemmuskulatur mit progredienter Hyperkapnie führen: unter anderem neuromuskuläre Erkrankungen, Zwerchfellparese, thorakal-restriktive Erkrankungen wie eine Kyphoskoliose oder das Obesitas-Hypoventilations-Syndrom [3].
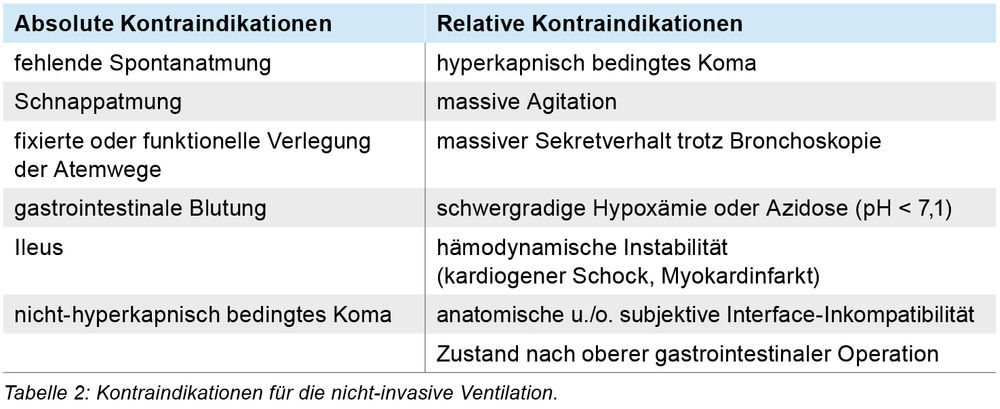
Durch eine akute Verschlechterung der Grunderkrankung zum Beispiel im Rahmen einer COPD-Exazerbation kommt es zu einer CO2-Retention, welche nicht mehr metabolisch kompensiert werden kann. Trotz erhöhtem HCO3- entwickelt sich eine deutliche respiratorische Azidose. Es folgt oftmals eine zunehmende Störung der Vigilanz bis zum Koma. Eine rasche Therapieeinleitung ist daher notwendig. Um die Komplikationen einer invasiven Beatmung (unter anderem beatmungsassoziierte Pneumonie, Notwendigkeit einer tiefen Sedierung, Risiko des prolongierten Weanings bei Lungenvorerkrankung) zu vermeiden, sollte mit einer NIV begonnen werden [4]. Hierbei sind Kontraindikationen zu beachten (Tabelle 2 nach [4]).
Ein möglichst frühzeitiger Beginn ist dabei wichtig. Vor allem Patienten mit einem pH von 7,30 bis 7,35 profitieren hinsichtlich niedrigerer Intubationsrate und gesenkter Mortalität. Bei einem pH < 7,3 ist der Erfolg einer NIV nicht eindeutig belegt. Bei vorhandener Spontanatmung und einem pH von 7,27 wurde im vorliegenden Fall unter kontinuierlichem Monitoring mit einer NIV mit einer Mund-Nasen-Maske begonnen. Entscheidend ist eine kurzfristige Re-Evaluation nach spätestens ein bis zwei Stunden. Ergibt sich keine signifikante Besserung der Hyperkapnie, Azidose und Hypoxämie sowie klinische Verbesserung (Dyspnoe, Atem-, Herzfrequenz, Vigilanz) sollte eine Intubation mit invasiver Beatmung erfolgen [4].
Da sich unsere Patientin klinisch nach den genannten Kriterien besserte, wurde die NIV fortgeführt. Die Patientin besserte sich von der Vigilanz, entwickelte aber ein Delir und verweigerte die NIV. Ein Versuch mittels High-Flow-Therapie wurde unternommen. Dabei wird über eine spezielle Nasenkanüle mit hohen Flussraten („High Flow Nasal Cannula“, HFNC) Sauerstoff appliziert. Somit kann die Oxygenierung verbessert werden. Durch die hohen Flussraten kommt es zusätzlich zu einer Auswaschung des oberen Totraumes und somit zu einer Reduktion des PaCO2 [5]. Bei unserer Patientin gelang die Entlastung der Atempumpe und Korrektur der Hyperkapnie durch HFNC nicht ausreichend. Die NIV ist dabei effektiver in der Entlastung der Atemarbeit [6]. In unserem Fall belastet neben der schweren COPD zusätzlich die Obesitas-Hypoventilation bei Adipositas Grad III (BMI von 40 kg/m2) die Atemmuskulatur langfristig.
Bei Vorliegen einer chronisch respiratorischen Insuffizienz ist bei ausgewählten Patienten (Tabelle 3) die Etablierung einer Langzeit-NIV indiziert [7]. Bei COPD-Patienten mit stabiler Hyperkapnie konnte die erhöhte Mortalität durch Einleitung einer Langzeit-NIV signifikant gesenkt werden [8].
Die Einleitung der außerklinischen NIV sollte in einem Zentrum für außerklinische Beatmung mit entsprechender Ausstattung, Erfahrung und Expertise erfolgen. Bei der individuellen Anpassung einer außerklinischen NIV haben sich die inspiratorische Druckunterstützung von 20 bis 30 mbar, ein exspiratorischer Druck von mindestens 6 mbar, die Einstellung einer (Back-up-) Atemfrequenz und die Nutzung unterschiedlicher Maskentypen (Nasenmasken, Mund-Nasen- oder Vollgesichtsmasken) bewährt.
Im Verlauf sollten mindestens ein- bis zweimal im Jahr Kontrollen durchgeführt werden [3]. Dabei sollte durch die NIV eine Normokapnie bzw. PaCO2-Reduktion um mehr als 20 Prozent erreicht werden, als Zeichen einer ausreichenden Entlastung der Atempumpe.
Wird eine Langzeit-NIV nach fachgerechter Einstellung und entsprechender Patientenschulung konsequent genutzt, sind die Ziele einer verbesserten Lebensqualität mit verminderter Tagesmüdigkeit, geringerer Atemnot und erhöhter Leistungsfähigkeit sowie die Verringerung von Exazerbationen und die Vermeidung einer Sauerstoff-Langzeittherapie realistisch erreichbar.
Patient 2 – Vermeidbare Erkrankung eines Tierfreundes
In unserer pneumologischen Klinik stellte sich ein 46-jähriger arabischer Patient aus Katar zur weiteren Abklärung von progredienter Belastungsdyspnoe (aktuell bereits nach einer Etage Treppensteigen) und unproduktivem Husten seit mehr als drei Jahren vor. Zudem berichtete er von einzelnen Tagen mit grippeähnlichen Beschwerden, allerdings ohne Fieber. Als Beamter geht er einer Bürotätigkeit nach, Nikotinkonsum bestand bis vor zehn Jahren (kumulativ ca. zehn pack years).
Ein CT-Thorax vor zwei Jahren habe im Heimatland beidseits noduläre Veränderungen gezeigt, die er aber nicht weiter abklären ließ.
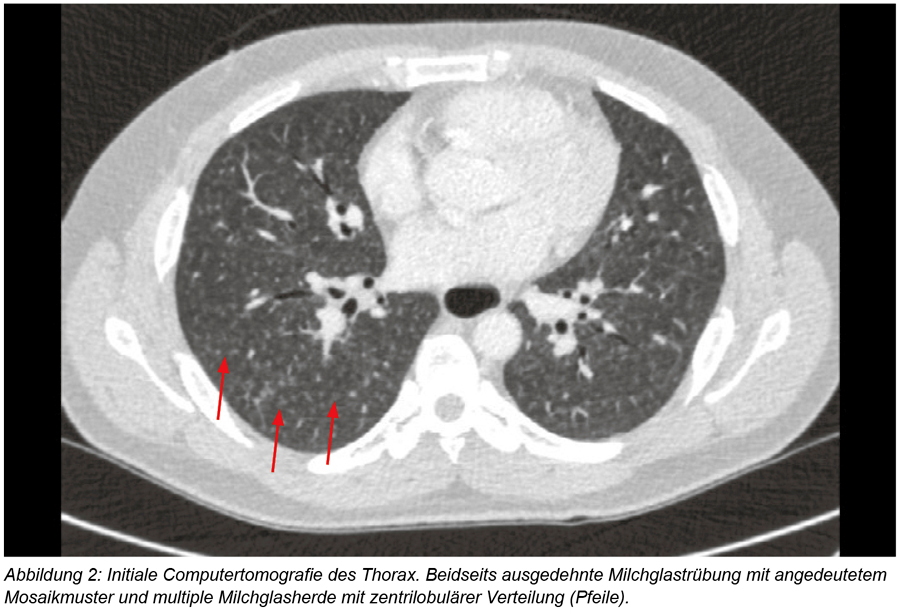
Das aktuelle CT-Thorax zeigte grenzwertig vergrößerte mediastinale Lymphknoten und die ausgedehnten Veränderungen im Lungenparenchym in Abbildung 2.
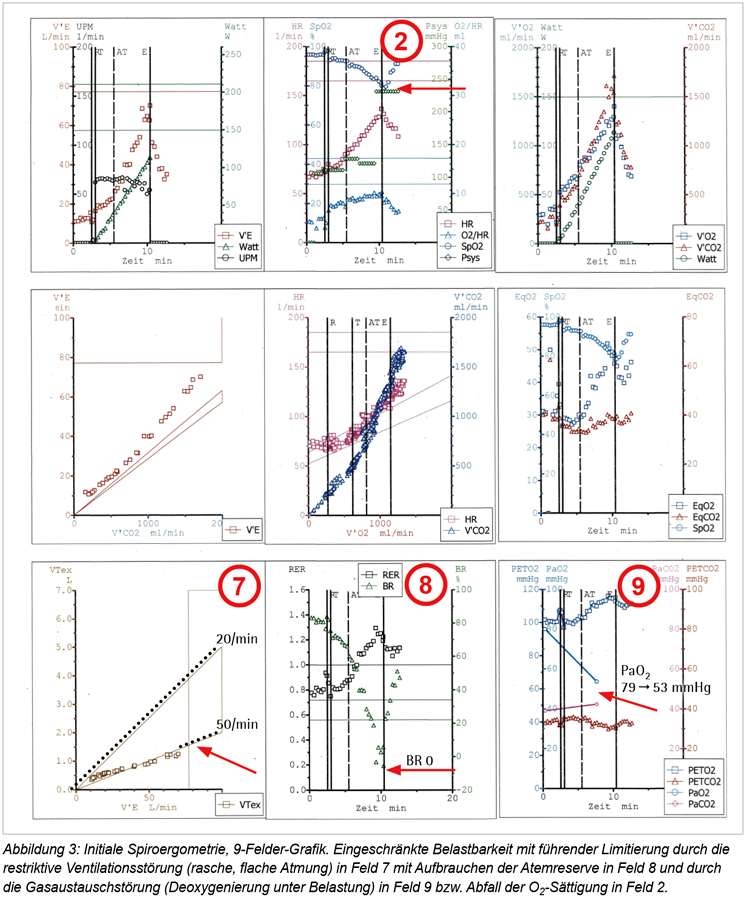
Ferner imponierte eine schwere Restriktion (Vitalkapazität 41 Prozent des Sollwertes) sowie eine mittelgradige Diffusionsstörung. Die Fahrradergometrie im Sitzen bestätigt eine deutliche Einschränkung der Sauerstoffaufnahme (peak VO2 55 Prozent Soll) bei vorwiegend pulmonal-ventilatorischer Limitation mit Tachypnoe ohne wesentliche Steigerung des Tidalvolumens sowie vollständig aufgebrauchter Atemreserve (BR) einerseits und Abfall des PaO2 von 79 mmHg in Ruhe auf 53 mmHg unter Belastung bzw. O2-Entsättigung (SpO2 97 Prozent auf 80 Prozent) andererseits. Trotz einzelner Hinweise auf eine kardio-zirkulatorische Limitierung, erkennbar an dem eingeschränkten Anstieg des O2-Pulses und geringfügig erhöhtem Verhältnis von Atemminutenvolumen zu CO2-Abgabe (VE/VCO2 slope), spielt diese nur eine untergeordnete Rolle (Abbildung 3).
Bei der Bronchoskopie erfolgte eine bronchoalveoläre Lavage, die sich als stark lymphozytär (67 Prozent – Norm: < 10 bis 15 Prozent) mit normalem Verhältnis der CD4/CD8-Lymphozytensubpopulationen herausstellte. Mittels endobronchialem Ultraschall wurden Lymphknoten-Feinnadelaspirationen vorgenommen, die keine Besonderheiten zeigten. In den transbronchialen Kryobiopsien aus dem linken Oberlappen imponierten nach histologischer Aufarbeitung neben einer vermehrten Lymphozyteninfiltration auch fibrotische Areale und auch mehrkernige Riesenzellen, allerdings ohne Granulombildung wie zum Beispiel bei Sarkoidose.
Erst auf wiederholte Nachfrage gibt der Patient an, in seiner Freizeit eine Renntaubenzucht, die er selbst mit Einstreu und Stroh versorgt, zu betreiben.
Die Verdachtsdiagnose einer exogen-allergischen Alveolitis (EAA) erhärtete sich durch den serologischen Nachweis von präzipitierenden Antikörpern (Typ IgG), im Speziellen gegen Hühner- und vor allem gegen Taubenfedern.
Für das Vorliegen einer EAA spricht der Nachweis folgender sechs Kriterien: Antigen-Exposition, expositions- und/oder zeitabhängige Symptome, Nachweis spezifischer IgG-Antikörper im Serum, Sklerosiphonie (sogenanntes Knisterrasseln), radiologische Zeichen einer EAA, PaO2 in Ruhe und/oder unter Belastung erniedrigt oder Diffusion eingeschränkt.
Im aktuellen Fall lagen fünf der sechs Kriterien vor. Lediglich die Symptomatik zeigte nicht die geforderte Expositions- bzw. Zeitabhängigkeit. Fehlt eines der vorgenannten Kriterien, so kann es durch nachfolgende Kriterien ersetzt werden: Lymphozytose in der BAL, mit EAA vereinbarer histopathologischer Befund der Lunge, positiver Karenztest, positive inhalative Expositions- oder Provokationstestung [9]. Da sowohl der histopathologische Befund mit EAA vereinbar war als auch eine Lymphozytose in der BAL vorlag, bestätigte sich abschließend die Diagnose einer exogen-allergischen Alveolitis. Aufgrund der prominenten Klinik wurde eine orale Steroidtherapie mit zunächst 0,5 mg/kg Körpergewicht in ausschleichender Dosierung begonnen. Der Patient gab seine Renntaubenzucht erst nach zwei weiteren akuten Rezidiven der EAA sehr ungern auf. Seither zeigen Kontrollen eine anhaltende klinische Besserung.
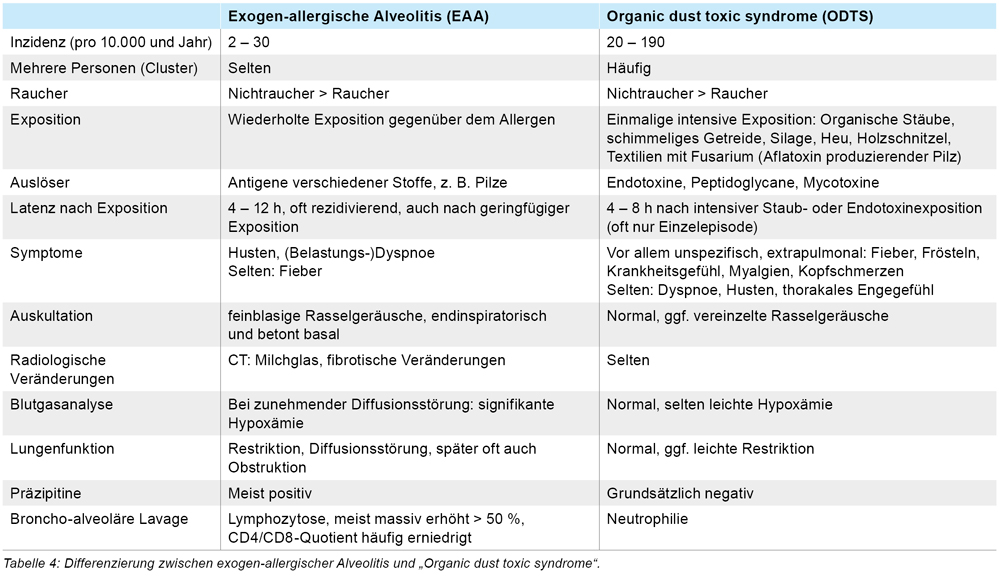
Eine wichtige Differenzialdiagnose zur EAA ist das „Organic dust toxic syndrome“ (ODTS). Das im Gegensatz zur EAA 30 bis 50 mal häufiger auftretende ODTS wurde erstmalig Mitte der 1970er-Jahre beschrieben [10]. Es handelt sich hierbei um eine nicht-immunologische Reaktion des Körpers auf bakterielle Endotoxine, die zum Beispiel beim Umgang mit Heu und Stroh freigesetzt und inhalativ aufgenommen werden (sogenanntes „Drescherfieber“). Mit einer Latenz von vier bis acht Stunden treten extra-pulmonale Symptome auf: Fieber, Atemnot, Abgeschlagenheit, Myalgien und Kopfschmerzen. Allerdings können Betroffene auch Husten und Dyspnoe zeigen, was die klinische Differenzialdiagnose zur EAA erschweren kann [9]. Ein ODTS kann bei mehreren gleichzeitig exponierten Personen auftreten, was wiederum bei der EAA eine Seltenheit darstellt. Die Symptome des ODTS verschwinden meist innerhalb von Stunden (selten Tagen) spontan. Die Differenzierung zwischen den beiden Entitäten fasst Tabelle 4 zusammen [9, 10].
Patient 3 – Metastasiertes Plattenepithelkarzinom der Lunge
Anamnese
Ein 61-jähriger Patient stellt sich mit Husten, Gewichtsabnahme und ossären Schmerzen im Beckenbereich vor. In der Computertomografie von Thorax/Abdomen/Becken zeigen sich eine im Längsdurchmesser 7 cm große Raumforderung im linken Lungenoberlappen, eine diffuse media-stinale Lymphadenopathie sowie disseminierte osteolytische Läsionen (die größten davon im linken Femur und in der Lendenwirbelsäule). Die Raucheranamnese ergibt lediglich zehn pack years.
Verlauf
In der bronchoskopisch gewonnenen Tumorprobe kann histologisch ein Plattenepithelkarzinom nachgewiesen werden. Das leitliniengerechte Staging ergibt das Stadium IV der Erkrankung [11]. In der interdisziplinären Tumorkonferenz entscheidet man sich, angesichts des guten Allgemeinzustandes und fehlender Komorbiditäten zur systemischen Chemotherapie mit Carboplatin/Nab-Paclitaxel (nanopartikelgebundene Form des Paclitaxels) kombiniert mit einer Immunotherapie mit Pembrolizumab (Carboplatin AUC6 Tag 1, Nab-Paclitaxel 100 mg/m2 Tag 1, 8, 15 und Pembrolizumab 200 mg absolut Tag 1, Wdh. Tag 21) [12].
Die schmerzhaften ossären Metastasen werden parallel analgetisch bestrahlt, der Patient erhält zusätzlich monatlich eine Infusion mit knochenstabilisierend wirkenden Bisphosphonaten (Zoledronsäure).
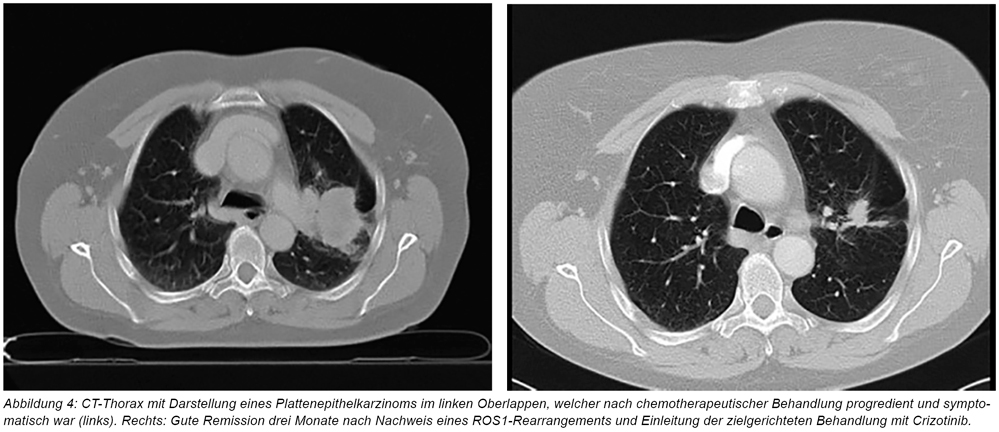
Nach initial gutem Ansprechen mit partieller Regredienz des Tumors im linken Oberlappen, kommt es nach sieben Monaten unter fortgeführter Erhaltungstherapie mit Pembrolizumab zum klinisch relevanten Progress thorakal und Wiederauftreten der initialen Symptomatik, insbesondere des Hustens mit erstmalig Hämoptysen. Da angesichts der Tumorgröße von 6 cm keine lokale Therapie (wie Bestrahlung) möglich ist, erfolgt eine Zweitlinien-Chemotherapie mit Gemcitabine, welche jedoch weder das Tumorwachstum noch die Symptome beeinflussen kann.
In Anbetracht des vergleichsweise geringen Nikotinkonsums wird in der Tumorkonferenz vorgeschlagen, trotz Vorliegens eines Plattenepithelkarzinoms die Tumorprobe des Patienten mittels NGS („next-generation-sequencing“) molekular zu untersuchen. Hier kann ein ROS1-Rearrangement nachgewiesen werden. Somit liegt eine Aktivierung der tumorwachstumsfördernden Rezeptortyrosinkinase ROS1 vor, welche die Option zur zielgerichteten Behandlung mittels des zugelassenen, oralen Multikinasehemmers Crizotinib eröffnet. Nach dreimonatiger, nebenwirkungsarmer Therapie (leichte Übelkeit und geringgradiger Durchfall), kommt es zur klinisch relevanten partiellen Remission des Tumors (siehe Abbildung 4), die pulmonale Symptomatik sistiert vollständig. Ein Jahr nach der Einleitung der Therapie mit Crizotinib besteht bei dem Patienten immer noch eine symptomlose, stabile Erkrankung.
Diskussion
Aufgrund der ausgedehnten Metastasierung bestand von Therapiebeginn an keine kurative Intention. Die initiale chemotherapeutische Behandlung hatte das Ziel, die große Tumorlast des Patienten im thorakalen Bereich zu reduzieren und damit eine Symptomkontrolle zu erreichen. Die Hinzunahme der Immuntherapie, welche seit 2018 einen Standard darstellt, trägt nicht nur zu besseren Ansprechraten bei, sondern ermöglicht einem Teil der Patienten (bis zehn Prozent) eine Stabilität der Tumorerkrankung über Monate bis Jahre hinweg zu erreichen [13].
Die initiale intensive Chemoimmuntherapie wird nach etwa zwölf Wochen überführt in eine für den Patienten angenehmere Erhaltungsphase, in der bis zum relevanten Fortschreiten des Tumors nur die Immuntherapie im dreiwöchigen Rhythmus verabreicht wird. Kommt es unter der immuntherapeutischen Erhaltung zum therapiebedürftigen Progress, sind die weiteren therapeutischen Optionen, insbesondere beim Plattenepithelkarzinom, sehr limitiert und nicht gut durch Evidenz belegt. In diesem Stadium des Behandlungsverlaufs sind bei den meisten Patienten die effektivsten systemisch wirksamen Medikamente bereits zum Einsatz gekommen.
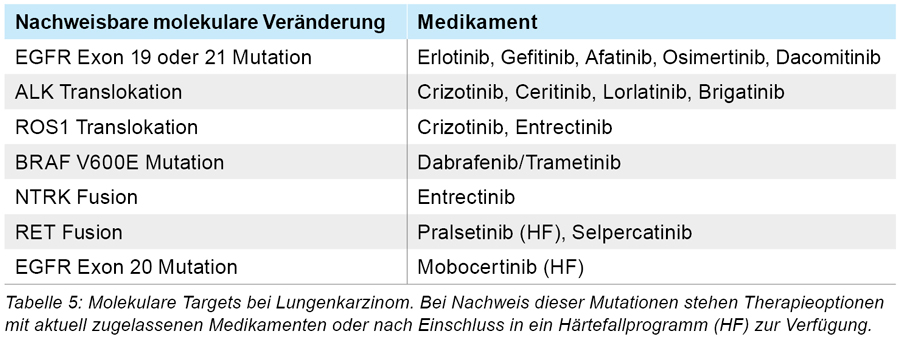
Eine „zielgerichtete Therapie“ ist die Domäne beim häufiger vorkommenden Adenokarzinom, bei dem die entsprechende molekulare Testung einen Standard bei jedem Patienten im metastasierten Stadium darstellt. Bei mindestens zehn Prozent der Patienten, insbesondere bei jüngeren Erkrankten, Nie-Rauchern, Frauen oder Patienten asiatischer Herkunft, gelingt der molekulare Nachweis solcher genetisch bedingten Angriffspunkte [14]. Bei diesen Patientengruppen findet man solche Treibermutationen oder Translokationen häufiger. Hier spielt die genetische Prädisposition (und nicht das Rauchen) in der Karzinogenese eine entscheidende Rolle. Im Gegensatz dazu werden die Plattenepithelkarzinome der Lunge seltener molekular getestet, weil die therapeutisch relevanten Mutationen nur sehr selten nachweisbar sind. In sporadischen Fällen, bei denen der Patient wenig (unter 15 pack years) oder nie geraucht hat, muss jedoch die Erhebung von therapierelevanten Mutationen (Tabelle 5) durchgeführt werden [15].
Auch in einem zertifizierten Lungenkrebszentrum mit hohem Patientenaufkommen gelingt es pro Jahr nur äußerst selten, Patienten mit Plattenepithelkarzinomen der Lunge und zugleich therapierelevanten aktivierenden Mutationen zu identifizieren. Kritisch muss man anmerken, dass die zielgerichteten Therapien zum Teil erhebliche Nebenwirkungen aufweisen können und deshalb von onkologischen Experten in Kooperation mit einem zertifizierten Lungenkrebszentrum durchgeführt werden sollten. Im hier dargestellten Fall, konnte durch den molekularen Ansatz eine langfristige Krankheitskontrolle erreicht werden – im Fall eines erneuten Progresses mit der zusätzlichen Option einer weiteren Off-Label-Behandlung mit dem Kinasehemmer Lorlatinib.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
Fall 1:
Eine dauerhaft gesteigerte Last der Atempumpe (zum Beispiel bei COPD oder Obesitas-Hypoventilations-Syndrom) kann akut zur Dekompensation der Atemmuskelschwäche mit Verschlechterung der Vigilanz führen (Hyperkapnie durch Hypoventilation!).
Die Akuttherapie der hyperkapnisch bedingten Vigilanzstörung sollte primär mittels einer nicht-invasiven Beatmung (NIV) erfolgen. Durch die NIV kann die akute respiratorische Störung meist effektiv und rasch verbessert werden.
Bei fortbestehender Hyperkapnie oder Risikofaktoren dafür ist eine dauerhafte häusliche NIV indiziert, welche mit fachgerechter Einstellung und Patientenschulung in einer spezialisierten Einrichtung eingeleitet werden sollte. Bei konsequenter Nutzung kann durch die NIV eine verbesserte Lebensqualität mit verminderter Tagesmüdigkeit, geringerer Atemnot und einer erhöhten Leistungsfähigkeit sowie einer verbesserten Prognose von Patienten mit COPD erreicht werden.
Fall 2:
Das häufiger auftretende „Organic dust toxic syndrome“ (ODTS) ist eine wichtige Differenzialdiagnose zur exogen allergischen Alveolitis (EAA). Die EAA tritt meist bei Nichtrauchern nach wiederholter Exposition gegenüber einem Allergen auf und imponiert häufig durch Husten, Dyspnoe und eine Diffusionsstörung.
Sowohl die akute als auch die chronische Form der EAA erfordern exakte Diagnostik (unter anderem hochauflösendes CT-Thorax, Immunzytologie der broncho-alveoläre Lavage, präzipitierende IgG-Antikörper im Serum).
Gelingt es das Allergen im häuslichen oder privaten Umfeld zu identifizieren und zu eliminieren, lässt sich der Einsatz einer immunsuppressiven Therapie deutlich reduzieren.
Fall 3:
Für Patienten mit metastasiertem Karzinom der Lunge stehen heute, neben der konventionellen Chemotherapie, weitere medikamentöse Modalitäten wie Immuntherapie oder zielgerichtete Therapie zur Verfügung. Bei der komplexen Therapiesteuerung und Beherrschung der Nebenwirkungen profitieren die Patientinnen und Patienten von einer guten Zusammenarbeit zwischen Hausärzten, ambulanten Onkologen und Pneumologen sowie den Spezialisten in zertifizierten Lungenkrebszentren.
Autoren

Dr. Anna Krandick 
Dr. Konrad Kokowski

Professor Dr. F. Joachim Meyer
Lungenzentrum München (Bogenhausen-Harlaching), München Klinik gGmbH,
Englschalkinger Straße 77, 81925 München, Tel. 089 9270-2281, E-Mail:
pneumologie.kb(at)muenchen-klink.de
Teilen:
Das könnte Sie auch interessieren: