Nach ausführlicher Diskussion über die verschiedenen Therapieoptionen wurde in ausführlicher Rückspra-che mit dem Patienten und Rücksprache im Interdisziplinären Tumorboard die Durchführung einer Therapie mit 177Lu-PSMA angeboten. Vier Wochen nach Durchführung des zweiten Zyklus der 177Lu-PSMA-Therapie mit jeweils ca. 7,4 GBq 177Lu-PSMA erfolgte eine PSMA-Liganden-PET/CT zur Beurteilung des Therapieansprechens. In der prätherapeutisch durchgeführten PSMA-Liganden-PET (siehe Abbildung 2 A) zeigte sich eine disseminierte Knochenmetastasierung im gesamten Stammskelett bis in die proximalen Extremitäten reichend. In der Verlaufsbildgebung nach dem zweiten Zyklus 177Lu-PSMA (Abbildung 2 C) zeigen sich die PSMA-exprimierenden Knochenmetastasen sowohl in der Ausdehnung als auch Intensität deutlich rückläufig im Sinne eines Therapieansprechens. In der dazugehörigen CT zeigte sich eine zunehmende Sklerose der Knochenmetastasen, was in Zusammenschau der Befunde ebenfalls als Therapieansprechen zu werten ist. Korrespondierend dazu zeigte sich auch labor-chemisch ein Abfall des PSA-Wertes auf 1,38 ng/ml zum Zeitpunkt des zweiten Zyklus 177Lu-PSMA-Therapie und ein weiterer Abfall auf 0,82 ng/ml zum Zeitpunkt der Verlaufsbildgebung mittels PSMA-Liganden-PET/CT vier Wochen später.
Nuklearmedizin – highlighted
 Nuklearmedizin
Nuklearmedizin
Die Nuklearmedizin diagnostiziert und behandelt Erkrankungen mit radioaktiven Stoffen. In der Diagnostik ist der Vorteil nuklearmedizinischer Verfahren die hohe Empfindlichkeit, mit der Biomoleküle im Körper des Patienten spezifisch nachgewiesen werden können. Dies ermöglicht die Darstellung der Expression von Rezeptoren oder der Funktion von Enzymen („Molekulare Bildgebung“). Andere bildgebende Verfahren sind aufgrund ihrer mehrere Größenordnungen niedrigeren Sensitivität dazu nicht in der Lage. Für die Bildgebung werden Isotope eingesetzt, bei deren Zerfall Gammastrahlung entsteht, die den Körper des Patienten durchdringt und mittels PET (Positronen-Emissions-Tomografie) und SPECT (Single Photon Emission Computed Tomography) nachgewiesen werden können.
In der Therapie werden dagegen Beta- und Alphastrahlen eingesetzt. Diese Strahlung wird im Gewebe nahezu vollständig absorbiert und kann deshalb eingesetzt werden, um Tumore selektiv zu bestrahlen. Diese Prinzipien der nuklearmedizinischen Diagnostik und Therapie sind seit vielen Jahren bekannt und werden unter anderem für die Behandlung von Schilddrüsenerkrankungen eingesetzt.
Aufgrund enormer Fortschritte in der Entwicklung neuer Radiopharmaka und verbesserter Kamerasysteme werden nuklearmedizinische Verfahren bei einer ganzen Reihe von Tumorerkrankungen zunehmend klinisch eingesetzt und nehmen bei einigen dieser Erkrankungen eine Schlüsselstellung in der Diagnostik und Therapie ein. Insbesondere das Prinzip der „Theranostik“ erweist sich dabei als erfolgreich. „Theranostik“ beschreibt das Vorgehen, eine Krankheit mit einem diagnostischen Radiopharmakon bildgebend darzustellen und den Patienten mit einem chemisch ähnlichen therapeutisch wirksamen Radiopharmakon zu therapieren, wenn sich eine ausreichende Anreicherung des Radiopharmakons im Tumorgewebe zeigt. Die erfolgreiche Bildgebung und Behandlung von neuroendokrinen Tumoren (NET) nach dem Theranostik-Prinzip hat den Weg auch für andere Tumorentitäten geebnet. So stellt die Kombination aus molekularer Bildgebung von metastasierten Prostatakarzinomen mit 68Ga- oder 18F-markierten, prostataspezifischen Membranantigen („prostate specific membrane antigen“ – PSMA) Inhibitoren in der PET und der molekularen Radiotherapie mit Lu-177-markierten Derivaten- (Radioliganden-Therapie) den nächsten Meilenstein der personalisierten Nuklearmedizin dar.
Die folgenden Fälle sollen das Spektrum der modernen theranostischen Anwendung in der Nuklearmedizin abbilden.
Erster Fall: Molekulare Bildgebung schlägt konventionelle Schnittbildgebung
Anamnese:
Ein heute 58-jähriger Patient wurde vor fünf Jahren wegen eines Prostatakarzinoms behandelt. Der Tumor konnte initial komplett reseziert werden (pT2c, pN0, R0, Gleason Score 6, PSA bei Diagnose (iPSA) 9 ng/ml). Nach der Operation war der PSA-Wert nicht mehr nachweisbar. Die klinische Nachsorge war bislang unauffällig, aber bei einer aktuellen Kontrolle war ein erhöhter PSA-Wert von 0,9 ng/ml aufgefallen. Der Patient ist weiterhin beschwerdefrei.
Diagnostik:
Zur Lokalisations- und Ausbreitungsdiagnostik wurde eine 68Ga-PSMA-11 PET/CT mit diagnostischem CT durchgeführt (siehe Abbildung 1). Die CT zeigte keinen pathologischen Befund, während die 68Ga-PSMA-PET hier eine intensive, fokale und somit metastasentypische PSMA-Expression zeigt (A und B, roter Pfeil). In der CT findet sich korrespondierend ein nicht vergrößerter Lymphknoten. Es gibt keine weiteren suspekten Herdbefunde.
Therapie und Verlauf:
Nach interdisziplinärer Befundbesprechung mit der Urologie, Radiologie und Nuklearmedizin wurde in Rücksprache mit dem Patienten bei insgesamt geringer und lokal begrenzter Tumorlast eine PSMA-Radioguided Surgery (PSMA-RGS) als individuelles Behandlungskonzept durchgeführt. Dabei wird dem Patienten präoperativ ein 99mTc-markierter PSMA-Ligand intravenös injiziert, welcher sich dann in dem betroffenen Lymphknoten anreichert und mittels einer Gammasonde aufgesucht werden kann (Abbildung 1 C).
In dem beschriebenen Fall wurde intraoperativ Gewebe an der entsprechenden Stelle reseziert und direkt am Operationstisch die erfolgreiche Entfernung durch eine Ex-vivo-Gammasondenmessung nachgewiesen (Abbildung 1 D). In der anschließenden histopathologischen Aufarbeitung bestätigte sich eine singuläre Lymphknotenmetastase (positiv in der HE-Färbung sowie in der PSMA Immunhistochemie). Postoperativ ist der PSA-Wert auf < 0,2 ng/ml abgefallen.
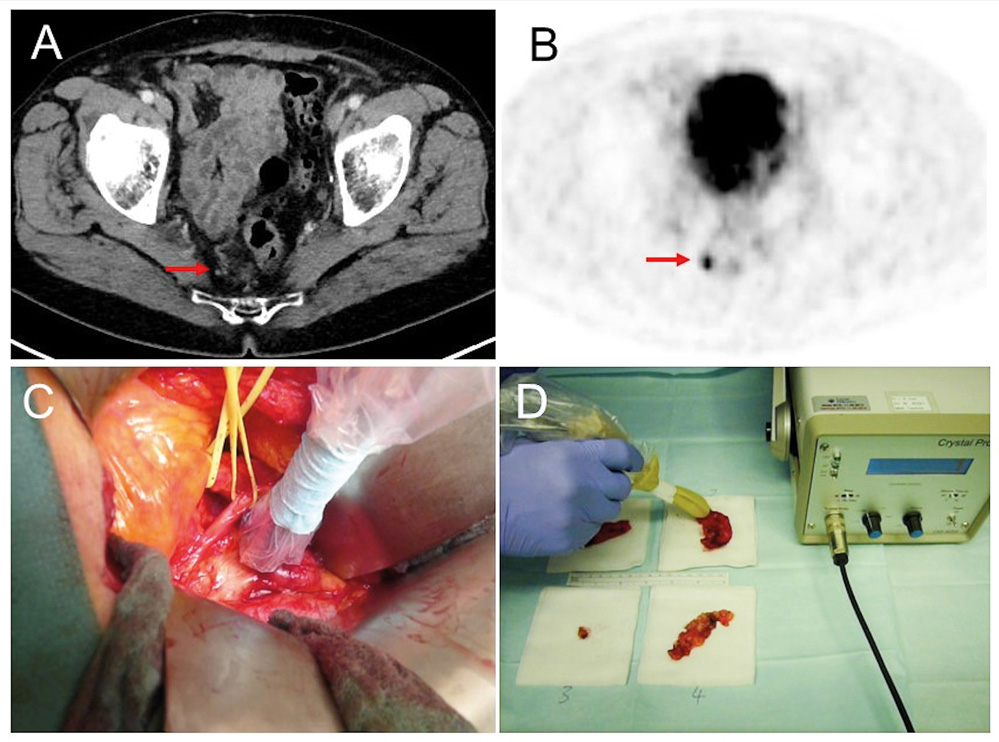
Abbildung 1: 68Ga-HBED-CC-PSMA PET/CT bei einem Patienten mit einem biochemischen Rezidiv und einer singulären Lymphknotenmetastase rechts präsakral und nachfolgender PSMA-Radioguided Surgery. (A) In der CT unauffälliger, wenige Millimeter großer pararektaler Lymphknoten (Pfeil). In der PSMA PET (B) intensive PSMA Expression des Lymphknotens. (C) Intraoperativer Situs mit Gammasonde zur Lokalisation des Lymphknotens. (D) Ex-vivo-Messung des resezierten Gewebes zur Kontrolle der Entfernung des in der PSMA PET/CT auffälligen Befundes.
Diskussion:
In den vergangenen Jahren wurden in der Nuklearmedizin zunehmend Liganden des PSMA in der Prostatadiagnostik verwendet. Das PSMA ist eine an die Zellmembran gebundene Peptidase, welches von fast allen (ca. 95 Prozent) Prostatakarzinomen deutlich überexprimiert wird. Die klinisch eingesetzten PSMA-Liganden sind kleine peptidähnliche Moleküle, die an die extrazelluläre, katalytische Domäne des PSMA binden, aber vom Enzym nicht gespalten werden können. Mittlerweile wurden bereits eine Vielzahl dieser PSMA-Liganden für die PET-Diagnostik entwickelt und evaluiert. Die meiste klinische Erfahrung liegt dabei mit 68Ga-PSMA-11 (radiochemischer Name: 68Ga-PSMA-HBED-CC) vor, welches ursprünglich am Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg entwickelt wurde [1].
Momentan ist die klinisch am meisten akzeptierte und validierte Domäne der PSMA-LigandenPET die Rezidivdiagnostik. Mehrere, hauptsächlich retrospektive Studien, die den Wert der PSMA-Liganden-PET/CT bei Patienten mit biochemischen Rezidiv evaluiert haben, zeigten eine signifikant höhere Tumordetektionsrate im Vergleich zur konventionellen Bildgebung mit Computertomografie, Magnetresonanztomografie und Knochenszintigrafie, aber auch im Vergleich zu den früher für die PET benutzten Cholinderivaten (11C bzw. 18F-Cholin) [2, 3]. Gerade bei Patienten mit einem biochemischen Rezidiv und niedrigen PSA-Werten ist eine genaue Lokalisationsdiagnostik wünschenswert, da hierdurch eine zielgerichtetere und möglicherweise kurative Therapie ermöglicht werden kann. Bei Patienten nach initialer Prostatektomie mit einem PSA-Wert von < 0,5 ng/ml beim Rezidiv lag die Detektionsrate in unterschiedlichen Studien bei 46 bis 58 Prozent [2]. In der konventionellen Bildgebung kann in diesem frühen Stadium nur in etwa zehn Prozent der Fälle das Rezidiv lokalisiert werden, wobei dabei fast ausschließlich Lokalrezidive nachgewiesen werden können. Wie in dem dargestellten Fall, ist das Rezidiv aber bei etwa 30 Prozent der Patienten nicht in der Prostataloge, sondern in Lymphknoten lokalisiert [4]. Auch Knochen- und andere Fernmetastasen lassen sich in der PSMA-Liganden-PET/CT bereits bei PSA-Werten von weniger als 0,5 ng/ml in etwa 15 Prozent der Fälle nachweisen [4]. Da sich somit aus der PSMA-Liganden-PET/CT unmittelbare Konsequenzen für die Behandlung ergeben (zum Beispiel Planung einer Strahlentherapie) wird in der aktualisierten S3-Leitlinie „Prostatakarzinom“ in Deutschland die PSMA-PET-Bildgebung als mögliche bildgebende Option beim Prostatakarzinomrezidiv seit Dezember 2016 berücksichtigt. Auch im Primärstaging von Hochrisikopatienten, auch in Kombination oder Zusammenschau mit der multiparametrischen MRT, stellt die PSMA-Liganden-PET eine vielversprechende Alternative dar [5].
Mit dem Erfolg der PSMA-Liganden-PET in der Rezidivdiagnostik und der Darstellung von sehr kleinen Metastasen ergeben sich auch neue therapeutische Optionen, welche die Prognose des Patienten möglicherweise verbessert. Dazu gehört die Methode der PSMA-RGS zur gezielten und erleichterten Detektion und Resektion von Lymphknotenmetastasen mit dieser experimentellen Methode
[6, 7, 8]. Erste Erfahrungen zeigen, dass die PSMA-RGS bei Patienten mit niedrigem PSA und nur einer Lymphknotenmetastase in der PET/CT die Notwendigkeit einer systemischen Behandlung um mehrere Jahre verzögern kann [9, 10]. Ob sich dadurch die Prognose der Patienten verbessert, wird in laufenden Studien untersucht.
Zweiter Fall: PSMA-Liganden-Theranostik beim metastasierten Prostatakarzinom
Anamnese:
78-jähriger Patient mit einem progredient ossär metastasierten, kastrationsresistenten Adenokarzinom der Prostata (Gleason-Score 9, iPSA 11,8 ng/ml). Nach der Erstdiagnose vor drei Jahren unterzog sich der Patient einer radikalen Prostatektomie mit pelviner Lymphadenektomie (Tumorstadium pT3b, pN1 (1/19), cMo, L1). Postoperativ lag der PSA-Nadir (tiefster Wert) bei 5,6 ng/ml. Im Verlauf kontinuierlicher PSA-Anstieg auf 8,2 ng/ml mit Nachweis von multiplen ossären Metastasen in der PSMA-Liganden-PET/CT und Initiierung einer hormonablativen Therapie mit GnRH-Analogon. Bei bildmorphologischem und laborchemischem Progress Durchführung von sechs Zyklen Chemotherapie mit Docetaxel. Hierunter zeigte sich ein weiterer Progress in der PSMA-Liganden-PET/CT. Unter erweiterter Hormontherapie mit Abiraterone/Prednison und GnRH-Analogon zeigte sich ein weiterer bildmorphologischer Progress und PSA-Anstieg auf 13,8 ng/ml.
Therapie und Verlauf:
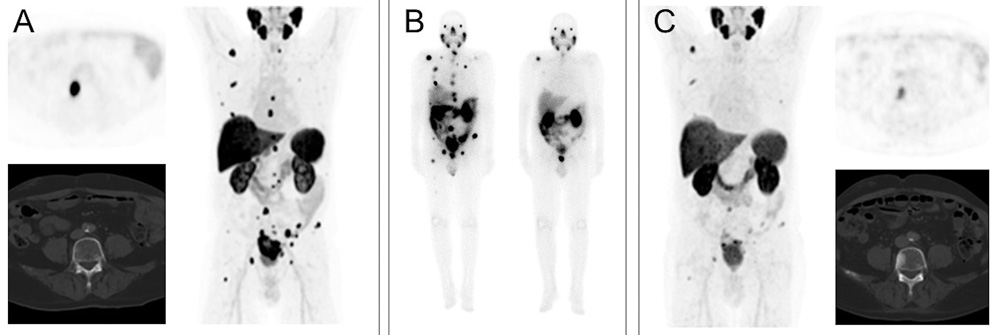
Abbildung 2: PSMA-Liganden-PET/CT vor (A) und nach zwei Zyklen 177Lu-PSMA-Therapie (C) zeigen ein gutes Therapieansprechen mit weitgehender Rückbildung der Knochenmetastasen in der PET und zunehmender Sklerosierung in der CT. Die korrespondierende Ganzkörperszintigrafie nach dem ersten bzw. zweiten Zyklus 177Lu-PSMA-Therapie (B) zeigt eine gute Speicherung der ossären Metastasen.
Diskussion:
Beim kastrationsresistenten und fortgeschritten metastasierten Prostatakarzinom liegt in der Regel eine sehr hohe PSMA-Expression vor. Diese wird zu Nutze gemacht, indem Liganden, die an PSMA binden, mit Betastrahlern, insbesondere 177Lu oder seltener auch dem Alphastrahler 225Ac, gekoppelt werden. Diese Radioliganden ermöglichen eine gezielte und nebenwirkungsarme Therapie des Prostatakarzinoms. Eine Zulassungsstudie für den PSMA-Radioliganden PSMA-617 wird wahrscheinlich 2020 abgeschlossen werden. Aufgrund der vorliegenden Daten einer Phase-II-Studie sowie weiterer retrospektiver klinischer Beobachtungen an mehreren 100 Patienten werden PSMA-Radioliganden aber bereits jetzt von vielen nuklearmedizinischen Kliniken zur Behandlung von Patienten mit fortgeschritten metastasiertem Prostatakarzinom nach Ausschöpfen aller anderen zugelassenen Therapien angeboten. Die PSMA-Radioliganden-Therapie ist auch bereits jetzt in der aktuellen S3-Leitlinie „Prostatakarzinom“ als mögliche Therapie im Rahmen einer Empfehlung in einer interdisziplinären Tumorkonferenz aufgeführt. Aktuell werden zur Radioliganden-Therapie die Liganden PSMA-617 sowie PSMA-I&T (imaging and therapy) verwendet [11, 12]. Üblicherweise werden zwei Zyklen mit jeweils 6 bis 8 GBq 177Lu-PSMA im Abstand von sechs Wochen durchgeführt und das Ansprechen mittels PSA-Wert und erneuter PSMA-Liganden-PET beurteilt [13]. Die Therapie darf in Deutschland nur stationär durchgeführt werden.
In einer Kohorte von massiv vorbehandelten Patienten zeigte sich in der größten retrospektiven Fallserie mit 145 Patienten und insgesamt 248 Zyklen 177Lu-PSMA-617 an zwölf deutschen nuklearmedizinischen Kliniken ein biochemisches Therapieansprechen, definiert als PSA-Abfall ≥ 50 Prozent, bei 45 Prozent der Patienten [14]. An der Technischen Universität München zeigte sich bei 100 Patienten nach insgesamt 319 Therapiezyklen mit 177Lu-PSMA-I&T bei 38 Prozent ein entsprechender PSA-Abfall [15].
Insgesamt zeichnet sich die 177Lu-PSMA-Therapie, zumindest im kurzfristigen Verlauf, durch eine sehr geringe Toxizität aus (< 10 Prozent Grad 3/4 Hämatotoxizität, keine höhergradigen anderen Toxizitäten). Hämatologische Nebenwirkungen zeigen sich bei disseminierter, ossärer Metastasierung und wiederholten Therapien. Die Therapie mit dem Alphastrahler 225Ac ist nicht in diesem Maße erprobt und zeigt mehr Nebenwirkungen, insbesondere leiden fast alle Patienten an einer Xerostomie (Mundtrockenheit) [16].
Dritter Fall: Diagnostik und Peptidradiorezeptortherapie von Neuroendokrinen Tumoren
Anamnese:
73-jähriger Patient mit einem Neuroendokrinen Tumor (NET) des Pankreaskopfes (Grad 1). Nach initialer Whipple-Operation mit Resektion des Primarius im Pankreaskopf zeigten sich in der Somatostatinrezeptor-PET/CT drei Jahre postoperativ erstmalig Leber- und Lymphknotenmetastasen. Nach Diskussion im interdisziplinären Tumorboard wurde die Indikation für eine Therapie mit 177Lu-DOTATATE gestellt.
Diagnostik und Therapie:
In der prätherapeutischen Somatostatinrezeptor-PET/CT finden sich multifokale Lebermetastasen sowie zusätzliche abdominelle Lymphknotenmetastasen (Abbildung 3 A). In der posttherapeutisch durchgeführten Ganzkörperszintigrafie ein Tag nach Applikation von 177Lu-DOTATATE bestätigt sich die Bindung der Substanz in den Metastasen (Abbildung 3 B). Nach Durchführung von vier Zyklen 177Lu-DOTATATE zeigte sich in der Verlaufskontrolle ein deutliches Therapieansprechen sowohl der Leber- als auch Lymphknotenmetastasen (Abbildung 3 C).
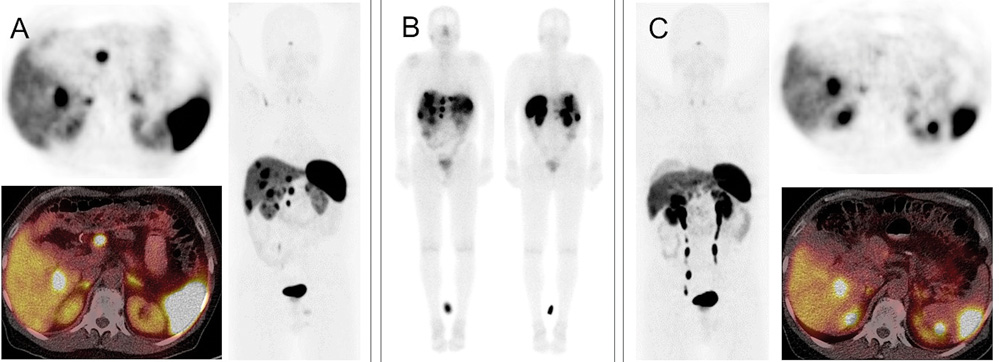
Abbildung 3: Baseline Somatostatinrezeptor PET/CT (A) und Verlaufsbildgebung nach vier Zyklen 177Lu-DOTATATE (C) zeigt ein gutes Therapieansprechen mit weitgehender Rückbildung der Leber- und Lymphknotenmetastasen. Die korrespondierende Ganzkörperszintigrafie (von vorne und von hinten) nach dem ersten Zyklus 177Lu-DOTATATE-Therapie (B) zeigt eine gute Speicherung der hepatischen und lymphogenen Filiae.
Diskussion:
Die Peptidradiorezeptortherapie (PRRT) ist ein nuklearmedizinisches Therapieverfahren zur Behandlung von NETs. Die PRRT wird vor allem bei niedriggradigen Tumorentitäten (Grad 1- und Grad 2-Tumore) angewendet. Eine wesentliche Voraussetzung ist eine ausreichende Radionuklidaufnahme in den Tumormanifestationen, welche mithilfe der PET-CT unter Verwendung eines Gallium-68 markierten Somatostatinanalogon (zum Beispiel 68Ga-DOTATOC) vor einer geplanten Therapie überprüft werden muss. Die PRRT kommt insbesondere bei Patienten mit metastasierten Tumoren zum Einsatz, bei denen sich ein Progress trotz primär eingesetzter Therapieverfahren (Operation, medikamentöse Therapie mit Somatostatinanaloga) zeigte. NET sind meist langsam wachsende, teils hormonproduzierende Tumore. Die Beschwerdesymptomatik der Patienten reicht dabei von Durchfällen bis zu anfallsartiger Gesichtsrötung („Flush“-Symptomatik), welche zum Großteil aus der Hormonproduktion der Tumorzellen resultiert.
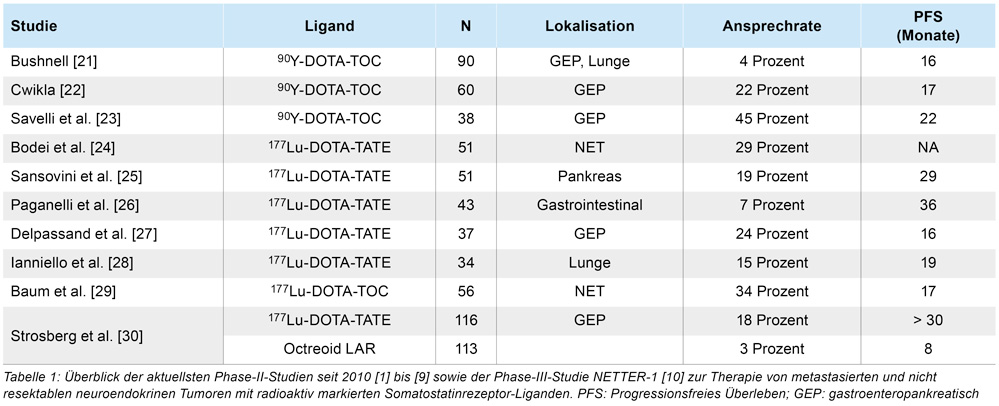
NETs überexprimieren häufig Somatostatin-Rezeptoren. Für die PRRT werden metabolisch stabile Somatostatinanaloga, wie DOTATOC und DOTATATE mit Lutetium-177 oder Yttrium-90 verbunden. Ziel der Therapie ist durch Verminderung des Tumorgewebes oder zumindest Wachstumsverzögerung der Tumorzellen eine verbesserte Lebensqualität für den Patienten zu erreichen, eine Heilung ist nicht möglich. Aufgrund der möglichen Nephro- und Hämatotoxizität ist eine ausreichende Nierenfunktion und Knochenmarkreserve unabdingbar. Die klinische Wirksamkeit der PRRT wurde in mehreren Patientenstudien bereits eingehend nachgewiesen (siehe Tabelle 1). Eine komplette Remission, partielle Remission und stabile Krankheit nach erfolgter Radionuklidbehandlung zusammenfasst, beträgt für 90Yttrium-DOTATOC bzw. für 177Lutetium-DOTATATE zwischen 70 und 80 Prozent [17, 18, 19]. Im Allgemeinen ist die Prognose von Patienten, die auf PRRT nach erstmaliger Behandlung gut ansprechen, auch im mittel- und langfristigen Verlauf günstig (mediane Zeit bis zur Progression ca. drei bis vier Jahre). Im Falle einer erneuten Progression nach initial gutem Therapieansprechen kann eine nochmalige Anwendung in Erwägung gezogen werden. Die PRRT mit 177Lu-DOTATATE (Handelsname: Lutathera®) ist mittlerweile nach erfolgreichem Abschluss der NETTER-1-Studie für Patienten mit fortgeschrittenen gastroenteropankreatischen NETs zugelassen und wird in den entsprechenden Leitlinien (zum Beispiels ENETS) empfohlen [20].
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Autoren

Privatdozent Dr. Thomas Horn 2

Professor Dr. Wolfgang Weber 1
1 Klinik und Poliklinik für Nuklearmedizin
2 Klinik für Urologie
Technische Universität München,
Klinikum rechts der Isar, Ismaninger Str. 22, 81675 München
Teilen:
Das könnte Sie auch interessieren:








