Neuropädiatrie – highlighted

Kinder sind keine kleinen Erwachsenen – dies gilt insbesondere auch für die Neuropädiatrie als eines der großen Schwerpunktfächer der Kinder- und Jugendmedizin. Das Wissen um die Besonderheiten des sich noch entwickelnden Gehirns und das sich daraus ergebende unterschiedliche Spektrum diagnostischer und therapeutischer Möglichkeiten hat sich in den vergangenen Jahren rasant entwickelt. Über das Next Generation Sequencing (NGS, Hochdurchsatzmethoden der Gensequenzierung) wurden die genetischen Ursachen einer Vielzahl neuropädiatrischer Krankheitsbilder aufgedeckt. Inzwischen sind vermehrt auch Therapien von zuvor unbehandelbaren Erkrankungen möglich, darunter in seltenen Fällen auch die Option einer Gentherapie. Eine schnelle und frühzeitige Diagnose ist dabei für den Therapieerfolg oft entscheidend.
Nachfolgend werden drei Kasuistiken von neuropädiatrischen Patienten geschildert, mit denen sowohl niedergelassene als auch in der Klinik tätige Ärzte konfrontiert werden können.
Kasuistik 1 – „Eine häufige Behandlungssituation“: Motorische und kognitive Entwicklungsstörung
Anamnese
Eine 9-jährige Patientin aus dem Iran wird von ihren Eltern mit einer schweren motorischen und kognitiven Entwicklungsstörung im Kinderzentrum München mit der Frage nach therapeutischen Optionen vorgestellt.
Nach einer unauffälligen Re-Sectio in der 38. Schwangerschaftswoche zeigte sie eine unauffällige Neonatalperiode und entwickelte sich bis zum Alter von vier Monaten normal. Zu diesem Alter konnte Sie den Kopf von der Unterlage abheben und vokalisierte. Im Alter von vier Monaten erholte sie sich nur schlecht nach einer fieberhaften Episode im Anschluss an eine Tetanus-Diphterie-Impfung und sei im Anschluss schwer muskulär hypoton gewesen. Seit diesem Zeitpunkt sei die Entwicklung verzögert verlaufen. Mit einem Jahr habe sie sich von Rücken- in die Bauchlage und zurückdrehen können. Zum Vorstellungszeitpunkt konnte das Mädchen robben, zeigte eine massiv eingeschränkte Kopfkontrolle und kein freies Sitzen sowie keinen Vierfüßerstand, griff aber mit dem Pinzettengriff gezielt nach Gegenständen. Die Patientin zeigte eine gemischte spastisch-dyskinetische Bewegungsstörung. Die Muskeleigenreflexe C5–8 waren mäßig, L2–S2 deutlich gesteigert, der Rossolimo-Reflex (Zehenbeugerreflex) positiv, der Muskeltonus mit Ashworth °1 zur oberen und °3 zur unteren Extremität erhöht (Ashworth-Skala: Maß für die Muskeltonuserhöhung). Das im Alter von einem Jahr im Heimatland durchgeführte Schädel-MRT sei unauffällig gewesen, ebenso wie eine genetische Untersuchung (genaue Angaben zur Art der Untersuchung konnten nicht gemacht werden).
Diagnostik, Therapie und Verlauf
Nach unauffälliger Primärdiagnostik (Schädel-MRT, Stoffwechseldiagnostik) wurde zum Ausschluss einer Segawa-Dystonie (Dopa-responsive Dystonie) ein L-Dopa-Therapieversuch durchgeführt, unter dem die Patientin eine deutliche Besserung zeigte. So konnte die Patientin nun frei sitzen und sich kurzzeitig selbstständig im Stehen halten. Sie wurde wacher und konnte sich nun artikulieren (Zwei-Wort-Sätze).
Parallel zur eingeführten L-Dopa-Therapie wurde eine Trio-Exom-Analyse (Exomanalyse mit Einbeziehung der Eltern, um genetische Varianten besser erkennen zu können → dadurch verbesserte Detektionsrate durch Identifizierung von de novo Varianten) an der Technischen Universität München durchgeführt. Diese ergab den Befund einer aromatischen L-Aminosäuren-Decarboxylase-Defizienz (homozygote Variant c.304G > A (GLY102SER)). Dieser Befund war nicht nur mit dem klinischen Befund einer gemischten spastisch-dystonen Bewegungsstörung in Einklang zu bringen, sondern auch mit dem partiellen Ansprechen auf L-Dopa. Die initial aufgrund der im Raum stehenden Segawa-Dystonie zurückhaltende L-Dopa-Dosierung konnte nun weiter gesteigert werden. Die Patientin zeigte vorübergehend Unruhe, welche sich schnell legte. Unter Aufdosierung bis auf 4 x 500 mg und 1 x 200 mg (8:00/10:00/13:00/16:00/19:00 Uhr) konnte eine weitere Verbesserung der Rumpfhaltung, Kopfkontrolle, Sprache (bis Drei-Wort-Sätze) und Aufmerksamkeit insgesamt erreicht werden. Nach wenigen Monaten in Deutschland zeigte sie bereits ein erstaunlich gutes Verständnis der deutschen Sprache.
Die aromatische L-Aminosäuren-Decarboxylase-Defizienz (AADCD; OMIM® #608643) ist eine extrem seltene, autosomal rezessiv vererbte Erkrankung des Serotonin-/Dopaminstoffwechsels mit den daraus resultierenden Symptomen von Hypokinesien, Dystonien, Ptosis, autonomer Dysfunktion und okulogyren Krisen. Die Symptome beginnen in der Regel im Säuglingsalter oder der frühen Kindheit und führen zu Beeinträchtigungen der Motorik und der Kognition mit einem variablen Schweregrad. Die Patienten zeigen ein variables Ansprechen auf L-DOPA, Pyridoxine (B6)/Pyridoxalphosphat, Dopaminagonisten und Monoamine-Oxidase-B-Inhibitoren [1]. Darüber hinaus konnte die Wirksamkeit einer, durch eine über einen viralen Vektor vermittelten und bilateral stereotaktisch, in die Basalganglien applizierte Gentherapie an zwanzig Patienten in der Literatur beschrieben werden. Kojima et al. [2] zeigte bei sechs Patienten im Alter von vier bis 19 Jahren nach Gentherapie sowohl eine Verbesserung der kognitiven als auch der motorischen Funktionen. Für die Gentherapie ist eine Zulassung bei der Europäischen Arzneimittel-Agentur (EMA) im Februar diesen Jahres beantragt worden. Im Einzelfall kann die „theoretische Option“ der Gentherapie, wie im vorliegenden Fall, schnell zum ethischen Dilemma werden: Auch wenn ein Ansprechen auf die Gentherapie nach der Verbesserung unter L-Dopa durchaus wahrscheinlich wäre, ist die Patientin mit neun Jahren bereits relativ alt. Die hohe Effektivität der Gentherapie im Säuglingsalter und in der frühen Kindheit lässt im Alter deutlich nach und wirft die Frage auf, bis zu welchem Alter und für welchen zu erwartenden therapeutischen Fortschritt die Therapien noch durch ein solidarisch finanziertes Gesundheitssystem finanziert werden kann.
Der vorliegende Fall demonstriert darüber hinaus, dass vor dem Hintergrund hoher Aufklärungsraten einer frühen genetischen Diagnostik eine hohe Priorität eingeräumt werden sollte. Hier hatte die Aufklärung der Ätiologie zwei Konsequenzen: zum einen konnte der Verdacht auf einen vermeintlichen Impfschaden ausgeräumt werden, welche die Eltern aufgrund des zeitlichen Zusammenhangs und der Dekompensation im Rahmen des Fiebers als ursächlich angenommen hatten. Darüber hinaus konnten konkrete therapeutische Optionen eingeleitet werden. Eine klinische Besserung nach Gabe von Levodopa wurde zwar bereits vor der Diagnose im Rahmen der Segawa-Syndrom-Abklärung festgestellt, die definitive Dosisfindung fiel jedoch nach Diagnosestellung leichter, ist doch beim Segawa-Syndrom bei höherer Dosierung mit Nebenwirkungen zu rechnen. Des Weiteren ergaben sich weitere medikamentöse Optionen (Pyridoxine (B6)/Pyridoxalphosphat, Dopamin-agonisten und Monoamine-Oxidase-B-Inhibitoren) sowie die Option der Gentherapie erst nach Diagnosestellung.
Kasuistik 2 – „Ein abwendbarer gefährlicher Verlauf“
Anamnese
Eine Patientin wird erstmals im Alter von drei Jahren und drei Monaten zur Abklärung einer globalen Entwicklungsverzögerung in der neuropädiatrischen Sprechstunde vorgestellt. Sie sitzt seit dem zehnten Lebensmonat (LM) und läuft frei seit dem 18. LM. Sie kann noch nicht schnell laufen oder alleine die Treppe auf- und abgehen. Das Sprachverständnis ist gut aber sie spricht nur in Einzelworten.
Sie wurde als zweites Kind nach unauffälliger Schwangerschaft geboren. Die Familienanamnese ist leer. Im 16. LM traten zwei kurze afebrile Krampfanfälle auf, die als Affektkrämpfe interpretiert wurden. EEG, EKG, Echokardiografie, Blutzuckertagesprofil und Routinelabor waren unauffällig.
Diagnostik, Therapie und Verlauf
Die klinische Untersuchung zeigt ein altersgemäßes Wachstum, Normozephalie und einen unauffälligen internistischen Status. Auffällig ist ein breitbasiger, etwas tollpatschiger Gang, sie spricht nur in einzelnen Worten, befolgt aber alle Anweisungen, sonst unauffällig.
Die initiale Diagnostik ist unauffällig für Stoffwechselanalytik (Aminosäuren im Plasma, organische Säuren im Urin, Oligosaccharide im Urin), Chromosomenanalytik und Mikrodele-tionsscreening.
Im weiteren Verlauf zeigt sie ein verlangsamtes, stetes Fortschreiten der sprachlichen und motorischen Entwicklung. Mit vier Jahren treten erneut zwei afebrile Anfälle im Abstand von zwei Wochen mit Augenverdrehen und Zittern auf. Auffällig ist eine Besserung nach Nahrungsaufnahme. Im EEG fällt zu diesem Zeitpunkt ein generalisiertes, irreguläres Sharp-Wave-Muster auf (siehe Abbildung 1 a). Das MRT zeigt eine leichte allgemeine kortikale und subkortikale Substanzminderung sowie eine leicht verzögerte Myelinisierung.
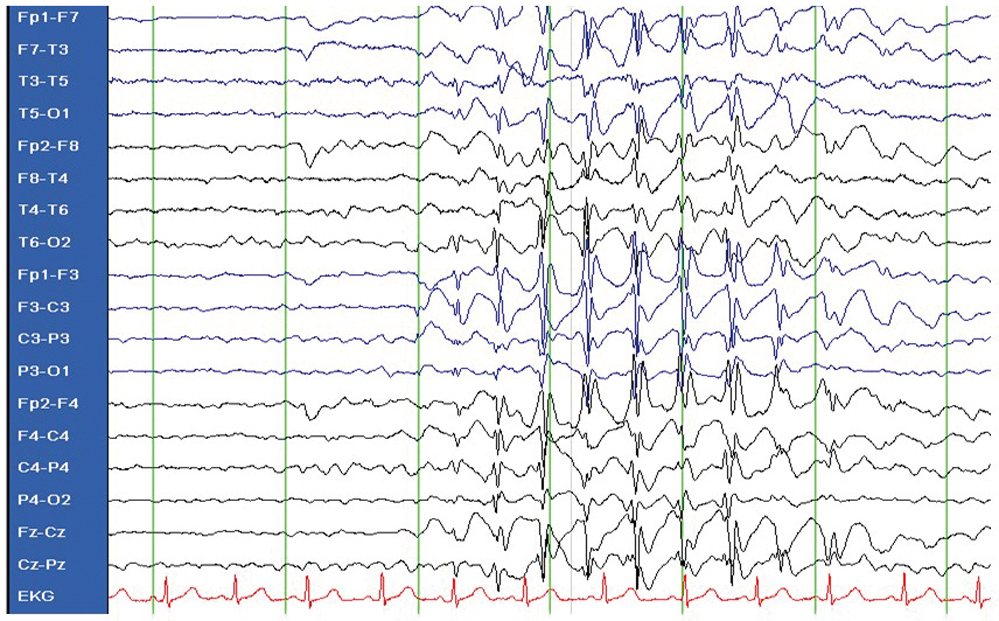
Abbildung 1 a: GLUT1-Defekt. EEG vor Therapie: generalisierte, frontal betonte Sharp Waves, klinisch Lidmyoklonien und Abwesenheit.
In den folgenden Wochen hat die Patientin mehrmals täglich Absencen; eine antikonvulsive Behandlung mit Ethosuximid (ESM) wird begonnen. Es zeigt sich zunächst eine leichte Abnahme der Anfallshäufigkeit dann aber eine Zunahme auf bis zu 20 Episoden/Tag trotz Ausdosierung von ESM. Erneut berichtet die Mutter von Besserung der Symptomatik nach Nahrungszufuhr. Dies führte letztendlich zur Verdachtsdiagnose einer metabolisch bedingten Epilepsie durch einen Glucose-Transporter-Defekt (GLUT1-Defekt). Die Diagnostik zeigt:
» Liquor: Glucose 30 mg/dl (Norm 60–85 mg/dl); Laktat 0,9 mmol/l (1,0–2,1 mmol/l); Eiweiß 20 mg/dl (15–40 mg/dl); keine erhöhte Zellzahl
» Plasma (zeitgleich): Glucose 93 mg/dl (74–120 mg/dl)
» Glucosequotient Liquor/Plasma 0,32 (0,65 +/- 0,1)
Damit wurde ein GLUT1-Defekt biochemisch bestätigt. Die molekulargenetische Analyse von SLC2A1(GLUT1-Gen) zeigte eine de novo Missense-Mutation(c.627G>C; Glu209Asp).
Die Therapie der Wahl beim GLUT1-Defekt ist die ketogene Diät. Bei der Patientin wurde eine 3 :1 Diät (3 Anteile Fett auf 1 Anteil Nicht-Fett) stationär eingeleitet. Darunter zeigten sich bereits während der ersten zehn Tage eine deutliche Besserung der Ataxie und klinisch ein Verschwinden der Absencen. Das EEG normalisierte sich nach ca. drei Wochen (siehe Abbildung 1 b). In dem Jahr nach Beginn der Behandlung hatte die Patientin keine Anfälle mehr. Sowohl im kognitiven wie im fein- und grobmotorischen Bereich hat sie deutliche Fortschritte gemacht und spricht in Drei-Wort-Sätzen.
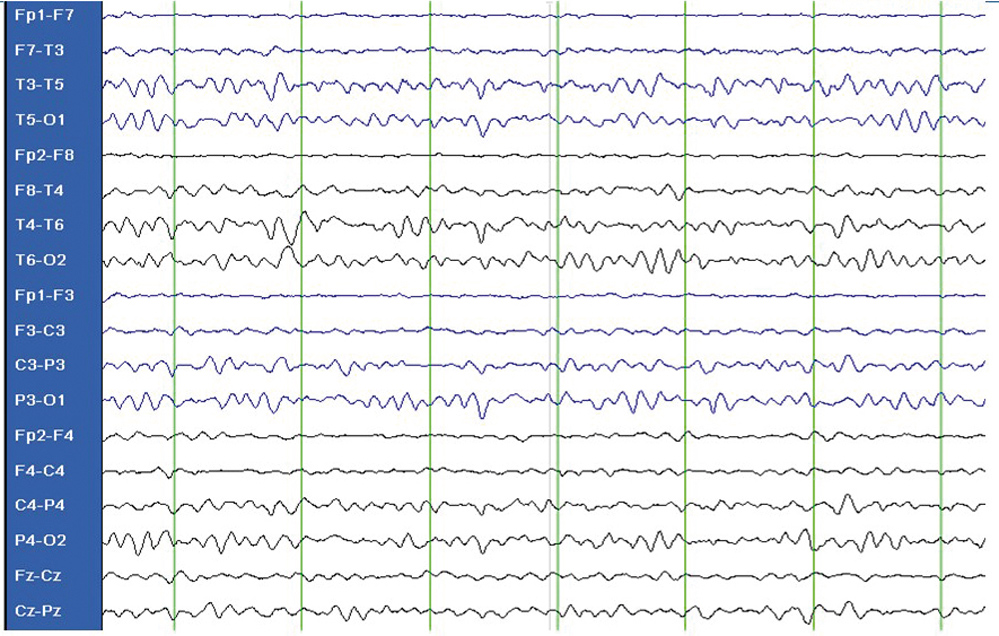
Abbildung 1 b: GLUT1-Defekt. EEG unter ketogener Diät: 7/sec-Grundrhythmus, keine epilepsietypischen Potenziale.
Krankheitsbild Glucose-Transporter-Defekt-Syndrom (GLUT1-DS)
Das GLUT1-DS ist bedingt durch einen gestörten Transport von Glucose, dem wichtigsten Energieträger für den zerebralen Stoffwechsel, ins Gehirn. Dieser Transport findet durch den Glucose-Transporter-Typ 1 statt. GLUT1 ist ein Membranprotein, das den einzigen Transportweg von Glucose über die Blut-Hirn-Schranke ermöglicht. Pathogene Mutationen im Gen des GLUT1 (SLC2A1) führen so zu einem unterschiedlich ausgeprägten Energiemangel im ZNS. Das Krankheitsbild wurde erstmals 1991 von DeVivo et al. [3] beschrieben.
Klinisch kann man eine klassische (> 80 Prozent der Patienten) und nichtklassische Verlaufsformen unterscheiden [4]. Die Prävalenz liegt bei ca. 1:80.000.
Die klassische Verlaufsform beginnt häufig schon im ersten Lebensjahr mit fokalen Krampfanfällen, die später generalisieren. Die Anfallsmuster sind variabel; frühinfantil werden Augenverdrehen, Apnoen und atone Anfälle beobachtet, später dann generalisiert tonisch-klonische Anfälle, Myoklonien und vor allem Absencen. Im EEG sind sehr häufig multifokale oder generalisierte Sharp Waves zu sehen. Die Anfälle sind meist schlecht durch Antikonvulsiva zu behandeln.
Bei der klassischen Form sind weitere Symptome regelmäßig vorhanden: sekundäre Mikrozephalie, globale Entwicklungsretardierung und Sprachentwicklungsstörungen, muskuläre Hypotonie, Ataxie und Bewegungsstörungen. Typischerweise wird die Symptomatik unter Nahrungszufuhr besser.
Die nichtklassischen Formen sind erst in den vergangenen Jahren als Teil des GLUT1-DS erkannt worden. Sie sind gekennzeichnet durch einen späteren Krankheitsbeginn (bis ins Erwachsenenalter) und nur zum Teil von einer Epilepsie begleitet. Häufig stehen Bewegungsstörungen wie Gangstörungen, Dystonie, Ataxie und Ähnliches im Vordergrund (zum Beispiel belastungsinduzierte paroxysmale Dyskinesie mit Epilepsie). Diese Formen sind klinisch schwieriger als GLUT1-DS zu erkennen (Tabelle 1).
Bei klinischem Verdacht erfolgt die Diagnose-sicherung durch die Bestimmung der Liquor-glucose im Verhältnis zur Plasmaglucose (nach vier Stunden Nüchternzeit). Ist die Liquorglucose unter 60 mg/dl bei normalem Blutzucker und das Verhältnis Liquor/Plasmaglucose unter 0,4, gilt die Diagnose als gesichert. Der Nachweis einer pathogenen Mutation im SLC2A1-Gen bestätigt ebenfalls die Diagnose.
Beim GLUT1-DS sind ausschließlich Mutationen im SLC2A1-Gen bekannt. In über 90 Prozent liegt eine heterozygote Mutation vor, die fast immer spontan entstanden ist. Autosomal rezessive Erbgänge sind beschrieben aber selten [5]. Eine Genotyp/Phänotyp-Korrelation ist bekannt [6]. Missense-Mutationen führen meist zu milden bis moderaten Krankheitsverläufen. Nonsense- Mutationen und Deletionen sowie rezessive Vererbung werden ausschließlich bei schweren Verläufen beobachtet.
Die Therapie der Wahl bei GLUT1-DS ist die ketogene Diät (KD). Ketonkörper sind ein alternativer Energieträger für das ZNS und werden durch den Monocarboxylat-Transporter (MCT1) über die Blut-Hirn-Schranke transportiert. Bei der KD wird durch einen sehr hohen Fettanteil in der Nahrung (75 bis 92 Prozent bezogen auf Kalorien) eine Ketose hergestellt und der Kohlenhydrat- und Proteinanteil auf ein Minimum beschränkt. Damit stehen dem ZNS ausreichend Energieträger zur Verfügung. Die KD sollte in einem spezialisierten Zentrum durchgeführt und geschult werden. Bei richtiger Anwendung wird sie gut toleriert und führt zu sehr guten Ergebnissen, wenn sie frühzeitig begonnen wird [7].
Antiepileptika sind in der Regel wenig oder gar nicht wirksam. Phenobarbital und Valproinsäure verschlechtern unter Umständen die Klinik, da sie GLUT1 hemmen.
Als neue Therapieoptionen werden aktuell synthetische Ketone (Triheptanoide) in klinischen Studien geprüft [8].
Diskussion
Unsere Patientin hatte einen relativ späten Beginn der Symptomatik mit zwei Episoden von sehr kurzen Anfällen. Zwischen den Episoden lag ein langer klinisch anfallsfreier Zeitraum, was die Verdachtsdiagnose verzögerte. Wichtig war der anamnestische Hinweis, dass sich die klinische Symptomatik durch Nahrungsaufnahme besserte. Dies kann gerade bei den nicht-klassischen Verläufen der entscheidende Hinweis sein.
Durch die Möglichkeit des Next Generation Sequencing erfolgt heute die Diagnostik bei unklaren Epilepsien frühzeitig genetisch durch Multigen-Panel, mit denen auch das SLC2A1-Gen untersucht wird. Dadurch werden atypische Formen früher diagnostiziert, bzw. hat sich das klinische Spektrum des GLUT1-DS deutlich erweitert. Auch bei den klassischen Formen wird zunehmend die Diagnose genetisch vor der biochemischen Diagnostik gestellt.
GLUT1-DS ist zwar eine seltene Erkrankung, kann aber durch die ketogene Diät sehr gut behandelt werden. Deswegen ist die frühe Diagnose wichtig für die Patienten. Der Weg dahin ist zum Teil dadurch erschwert, da die primäre Entwicklung bei Kindern mit Stoffwechselstörungen initial unauffällig sein kann und die Kinder erst im Verlauf später auffällig werden.
Kasuistik 3 – „Notfall“: Akute Hemiparese bei einem Jugendlichen – „Time is brain“
Anamnese
Bei einem 15-jährigen, bislang völlig gesunden Jungen war es zu einer akut einsetzenden Symptomatik mit hängendem Mundwinkel, Hemiparese links und verwaschener Sprache gekommen. Bei Eintreffen des Notarztes war der Junge bereits vigilanzgemindert. Es erfolgte der umgehende Transport in die Kinderklinik München-Schwabing.
Akute Diagnostik und Therapie
Bei Aufnahme in der Kinderklinik zeigte sich weiterhin eine hochauffällige neurologische Untersuchung (FAST-Test: Face, Arm, Speech positiv, Time). Aufgrund des jugendlichen Alters und der bestehenden Vigilanzminderung folgte die Entscheidung zur craniellen Computertomographie (CCT), die eine Stunde nach Symptombeginn durchgeführt wurde. Es zeigte sich bereits im nativen CCT der Hinweis auf einen thromboembolischen Verschluss durch ein hyperdenses Mediazeichen (Abbildung 2), daraufhin Entschluss zur interventionellen Thrombektomie. Bei der im Rahmen der Intervention durchgeführten Angiografie bestätigte sich der akute Verschluss der Arteria cerebri media rechts ab Segment M1 (Abbildung 3). Zwei Stunden nach Symptombeginn erfolgte eine mechanische Thrombektomie mittels Stentretriever sowie eine intraarterielle Lysetherapie in die M2-Äste mittels 30mg rt-PA.
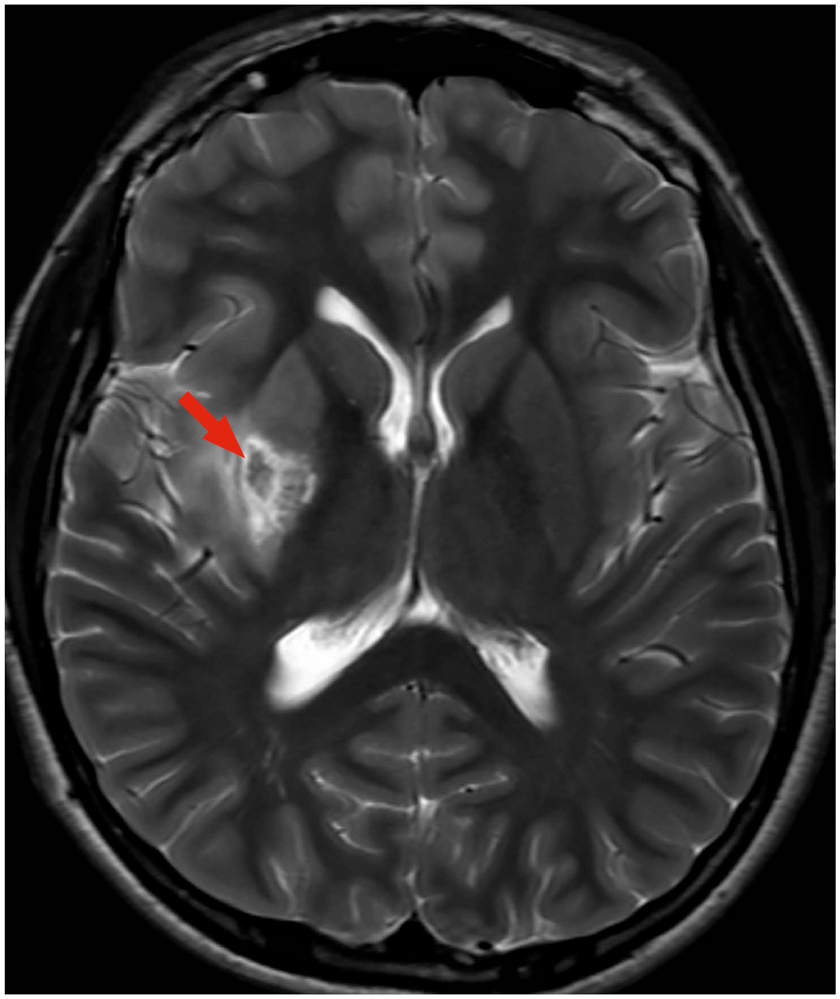
Abbildung 2: Koronare Rekonstruktion der nativen Computertomografie mit hyperdensem Mediazeichen (Pfeil).
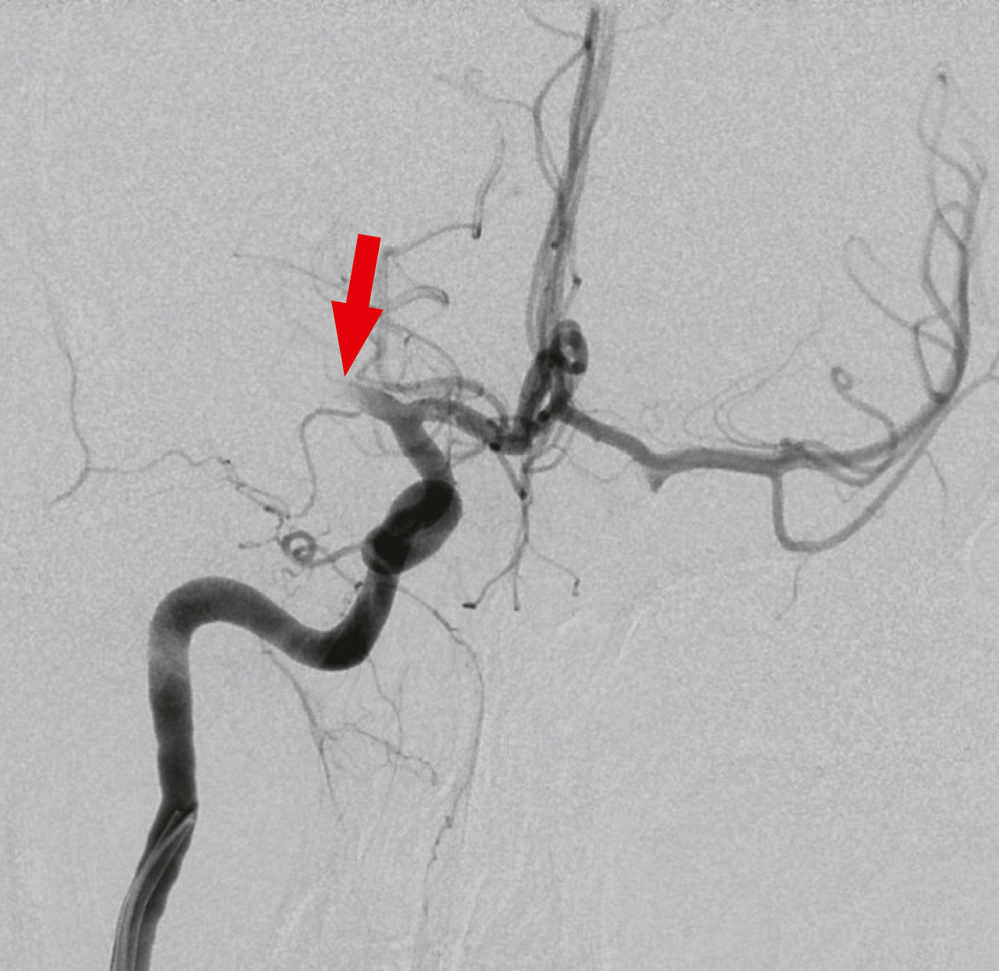
Abbildung 3: Zerebrale Angiografie, 60 Minuten nach dem CCT, mit dem Katheter in der A. carotis int. re. Es zeigt sich ein Verschluss (Pfeil) des proximalen Abschnittes der A. cerebri media (M1).
Verlauf
Nach der Intubationsnarkose zur Intervention konnte der Junge zügig extubiert werden. Die linksseitige Hemiparese war bereits nach der Extubation deutlich gebessert. Es folgte ein 14-tägiger Klinikaufenthalt. Bei Entlassung waren die neurologischen Ausfälle bis auf ein leichtes feinmotorisches Defizit der linken oberen Extremität komplett rückläufig, sodass eine Anschlussrehabilitation nicht indiziert war. In den bildgebenden Verlaufskontrollen mittels cMRT zeigte sich eine, gemessen an dem nachgewiesenen initial bestehendem Hauptstammverschluss, relativ kleine residuelle Infarktläsion im Bereich des rechten Linsenkerns (Abbildung 4). Im Rahmen der ätiologischen Abklärung wurde in der transösophagealen Echokardiografie ein persistierendes Foramen ovale (PFO) nachgewiesen, in der angiologischen Diagnostik gelang jedoch kein Thrombosenachweis. Die Labordiagnostik erbrachte keinen Hinweis auf folgende Differenzialdiagnosen des pädiatrischen Schlaganfalls: Infektionen, angeborene oder erworbene Vaskulopathie, Vaskulitis, hämatologische oder metabolische Erkrankungen. Im Thrombophilie-Screening fand sich ein erhöhtes Lipoprotein (a) als einziger prothrombotischer Risikofaktor.

Abbildung 4: T2-gewichtetes MRT, 15 Tage nach dem Schlaganfall mit relativ kleinem Infarkt im Bereich des rechten Linsenkerns.
Aufgrund des in der Akutbildgebung nachgewiesenen thromboembolischen Gefäßverschlusses wurde in Rücksprache mit der Pädiatrischen Hämostaseologie eine therapeutische Antikoagulation mit niedermolekularem Heparin (Enoxaparin, Dosiserhöhung bis zur angestrebten Verdopplung der partiellen Thromboplastinzeit PTT) begonnen und für vier Wochen fortgesetzt, im Anschluss daran Reduktion auf prophylaktische Dosis 1 x 40 mg subcutan pro Tag bis zum kathetergestützten Verschluss des PFO. Die zeitgleich begonnene Therapie mit ASS wurde über ein Jahr fortgesetzt.
„Stroke im Kindes- und Jugendalter“
Schlaganfälle im Kindes- und Jugendalter sind seltene Ereignisse mit ca. 1–8/100.000 Kindern/Jahr. Die neurologischen Symptome können variieren, desweiteren unterscheiden sich die zugrunde liegenden Ursachen erheblich von denen des erwachsenen Schlaganfallpatienten (siehe oben und Gerstl et al., 2017 [9]). Dies führt häufig zur verzögerten Diagnosestellung des pädiatrischen arteriell ischämischen Schlaganfalls (AIS, im Mittel > 24 h) und damit zu einem späteren Therapiebeginn, oft außerhalb des Lyse- oder Thrombektomie-Zeitfensters. Nur wenige (pädiatrische) Zentren verfügen über die Möglichkeit einer adäquaten Diagnostik und Behandlung von Kindern mit AIS rund um die Uhr.
Zur Etablierung einer nationalen Datenerhebung mit Entwicklung einheitlicher Therapierichtlinien wurde das Deutsche Netzwerk Pediatric Stroke im Jahr 2015 unter der Leitung von Dr. Lucia Gerstl und Universitätsprofessor Dr. Florian Heinen, LMU München, gegründet. Mittlerweile sind über 30 pädiatrische Akutkliniken und Rehabilitationskliniken bundesweit und Vertreter aus Österreich, Schweiz und den Niederlanden beteiligt. Aktuell besteht in Ermangelung randomisierter Studien kein internationaler Konsens bezüglich der Therapie des pädiatrischen AIS, sodass die Therapie oft als „individueller Heilversuch“ durchgeführt wird. Die untere Altersgrenze für Interventionen wie im geschilderten Fall hängt dabei stets von der Expertise und der Ausstattung der lokalen Neuroradiologie ab. Bei einer Vielzahl der zugrundeliegenden Differenzialdiagnosen ist jedoch auch in der Akutphase kein thromboembolischer Gefäßverschluss nachweisbar (Beispiel Vaskulopathie/Vaskulitis), sodass eine entsprechende Intervention ohnehin nicht in Betracht kommt. Der bildgebende „Goldstandard“ bei der Diagnostik des pädiatrischen AIS ist vor dem Hintergrund der im Vergleich zum Erwachsenenalter stark abweichenden Ätiologie und Differenzialdiagnostik die cMRT; dennoch zeigt unser Fallbericht, dass bei eindeutiger Klinik im Einzelfall bereits mit einem nativen CCT die Diagnose gestellt und wertvolle Zeit eingespart werden kann.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
Mit den hier vorgestellten Fällen lassen sich neue Entwicklungen in der Neuropädiatrie in mehrfacher Hinsicht veranschaulichen. Mit der ersten Kasuistik möchten wir darauf hinweisen, dass die ätiologische Aufklärung von Entwicklungsstörungen, aber auch einer wachsenden Zahl anderer neuropädiatrischer Erkrankungen durch das Next Generation Sequencing in einem bisher unbekannten Ausmaß gelingt. So liegt die Aufklärungsrate von Entwicklungsstörungen inzwischen bei 40 bis 60 Prozent (Übersicht bei Wright et al. 2018 [10]) und stellt das bisherige Vorgehen – Bildgebung, Stoffwechseluntersuchung, Genetik – zumindest in dieser Reihenfolge in Frage. Eine solche Diagnostik kann gegebenfalls nur bei frühzeitigem Einsatz sinnvolle medikamentöse Therapiemöglichkeiten eröffnen, sowie – bislang jedoch noch auf wenige Krankheitsbilder beschränkt – die Option der Gentherapie. Letztere hat in der Kinderneurologie für einzelne Erkrankungen bereits einen Durchbruch erreicht. So konnte zum Beispiel für die Spinale Muskelatrophie (SMA) bereits die Antisense-Oligonukleotid-Therapie mit dem Wirkstoff Nusinersen (und perspektivisch dem Gentherapeutikum Onasemnogene Abeparvovec) etabliert werden. Da die guten Therapieerfolge nur bei einer frühen, idealerweise prä-symptomatischen Therapie beobachtet werden, war die Etablierung eines Neugeborenen-Screenings naheliegend. Nicht zuletzt ist die Etablierung der Frühtherapie durch die Einführung des Neugeborenen-Screenings zunächst in Bayern und perspektivisch bundesweit unter der Federführung der Arbeitsgruppe um Universitätsprofessor Dr. Florian Heinen und Professor Dr. Wolfgang Müller-Felber aus dem iSPZ des Dr. von Haunerschen Kinderspitals in München in geradezu atemberaubender Geschwindigkeit gelungen.
Die zweite Kasuistik verdeutlicht den Stellenwert der frühzeitigen konventionellen Diagnostik mit der wegweisenden Liquor-Serum-Diagnostik im Falle einer behandelbaren metabolischen Erkrankung. Auch hier ist das frühe Erkennen entscheidend für den Erfolg der ketogenen Diät als eine kausal ansetzende Therapieoption.
In der dritten Kasuistik schließlich stellen wir einen neuropädiatrischen Notfall vor. Während es für den häufigsten kinderneurologischen Notfall, den akuten Krampfanfall (häufigste Manifestation im Alter von sechs Monaten bis sechs Jahren als Fieberkrampf), klar definierte Notfallalgorithmen gibt, ist die „Awareness“ für den pädiatrischen Schlaganfall immer noch nicht im notwendigen Maße außerhalb von Zentren mit hoher neuropädiatrischer Expertise vorhanden. Dies kann fatale Konsequenzen haben, denn gerade hier gilt in ganz besonderem Maße: „Time is brain“.
Autoren

Privatdozent Dr. Hendrik Jünger (1, 2)

Professor Dr. Andreas Saleh (3)

Professor Dr. Volker Mall (2, 5)

Professor Dr. Peter Freisinger (2, 6)

Professorin Dr. Juliane Winkelmann (7–10)
(1) Klinik für Kinderheilkunde, Jugendmedizin und Neonatologie, Klinikverbund Allgäu/Klinikum Kempten, Robert-Weixler-Straße 50, 87439 Kempten
(2) Medizinische Fakultät der Technischen Universität München, Ismaninger Str. 22, 81675 München
(3) München Klinik Schwabing, Klinik für Radiologie und Kinderradiologie, Kölner Platz 1, 80804 München
(4) Klinik und Poliklinik für Kinder- und Jugendmedizin, München Klinik Schwabing und Klinikum rechts der Isar der Technischen Universität München, Kölner Platz 1, 80804 München
(5) kbo-Kinderzentrum München, Heiglhofstraße 65, 81377 München
(6) Klinik für Kinder- und Jugendmedizin, Klinikum am Steinenberg/Ermstalklinik, Steinenbergstraße 31, 72764 Reutlingen
(7) Institut für Neurogenomik, Helmholtz Zentrum München
(8) Institut für Humangenetik, Technische Universität München
(9) Lehrstuhl für Neurogenetik, Technische Universität München
(10) Munich Cluster for Systems Neurology, SyNergy, München
Teilen:
Das könnte Sie auch interessieren:








