Neu in der Urologie
 Neu in der Urologie
Neu in der Urologie
Die Behandlung von urologischen Krebserkrankungen hat einen zentralen Stellenwert im Fach Urologie. In interdisziplinärer Zusammenarbeit betreuen Urologinnen und Urologen dabei alle Situationen des Krankheitsverlaufs, von der Vorsorge und Diagnostik über die operative und perioperative Therapie, bis hin zur palliativen Systemtherapie und Nachsorge. In der Uroonkologie haben in den vergangenen zehn Jahren gewaltige Veränderungen stattgefunden, die vor allem durch moderne Bildgebung und durch Verbesserungen der Systemtherapie hervorgerufen wurden. Hinsichtlich der Bildgebung sind das multiparametrische MRT der Prostata und die Hybridbildgebung mittels PSMA-PET/CT zu nennen, die aus dem Alltag nicht mehr wegzudenken sind. In der Systemtherapie wurden in zehn Jahren die Immuncheckpoint-Inhibition, PARP-Inhibitoren und Antikörper-Wirkstoff-Konjugate als völlig neue Ansatzpunkte fest in der therapeutischen Sequenz etabliert. Im Folgenden soll anhand von vier Patientenfällen dargestellt werden, welchen Stellenwert diese Neuerungen bereits jetzt in der routinemäßigen Patientenversorgung einnehmen und ein Ausblick auf zukünftige Entwicklungen gegeben werden.
1. MRT-basierte Früherkennung und Biopsie des Prostatakarzinoms
Im vergangenen Jahr stellte sich ein 67-jähriger Patient mit wiederholt erhöhten prostataspezifischen Antigen-Werten (PSA) von zuletzt gemessenen 5,7 ng/ml und in einer Kontrollmessung nach vier Wochen von 6,1 ng/ml (Normwert: 4 ng/ml) vor. In der Familienanamnese ist ein nicht letales Prostatakarzinom beim Vater des Patienten bekannt, in der Tastuntersuchung zeigt sich die Prostata unauffällig. In der daraufhin durchgeführten multiparametrischen MRT der Prostata zeigte sich eine PI-RADS IV-Läsion in der medialen peripheren Zone rechts, was gemäß der PI-RADS-Klassifikation des MRT der Prostata einem hohen Risiko für ein Karzinom entspricht. Der Patient wird zur perinealen Ultraschall-MRT-Fusionsbiopsie in die Klinik überwiesen. Nach Aufklärung und Ausschluss einer Gerinnungsstörung und eines subakuten Harnwegsinfektes wird eine perineale Fusionsbiopsie der Prostata, bestehend aus einer gezielten Biopsie der beschriebenen PI-RADS IV-Läsion und einer systematischen Biopsie der restlichen Prostata in Lokalanästhesie durchgeführt. Postinterventionell berichtet der Patient über eine leichte Makrohämaturie zu Beginn der Miktion für drei Tage und eine Hämatospermie, ist aber ansonsten völlig beschwerdefrei. Zwei Tage nach der Biopsie ergibt die pathologische Beurteilung den Nachweis eines azinären Adenokarzinoms der Prostata mit einem Gleason-Score von 7b, ISUP Grade Group 3 (siehe Tabelle 1). Damit liegt ein Prostatakarzinom mit intermediärem Risikoprofil vor und dem Patienten wird bei ansonsten ausgezeichnetem Allgemeinzustand eine aktive Tumortherapie mittels radikaler Prostatektomie mit Lymphadenektomie oder Strahlentherapie der Prostata empfohlen. Der Patient entscheidet sich für eine roboterassistierte, funktionserhaltende radikale Prostatektomie. Diese wird komplikationslos mit intraoperativer Schonung der Gefäßnervenbündel und des Harnröhrensphinkters bei negativem intraoperativem Schnellschnitt durchgeführt. Der postoperative Verlauf ist unauffällig und die histologische Begutachtung des entnommenen Operationspräparates bestätigt die Diagnose eines azinären Adenokarzinoms der Prostata mit folgender pathologischer Klassifikation: pT2c, pN0 (0/18), Pn1, R0, Gleason 4 + 3 = 7b. In der Verlaufskontrolle acht Wochen nach der durchgeführten Operation zeigt sich ein Abfall des PSA-Wertes unter die Nachweisgrenze, und der Patient berichtet eine sehr gute postoperative Belastbarkeit und Kontinenz. In den folgenden Kontrollen zeigt sich bisher weiterhin ein nicht nachweisbarer PSA-Wert.
Hintergrund
Das Prostatakarzinom ist die weltweit am zweithäufigsten diagnostizierte Tumorerkrankung des Mannes und in Deutschland die dritthäufigste Krebstodesursache bei Männern [1]. Bei 6 bis 15 Prozent der mit einem Prostatakarzinom neu diagnostizierten Männer liegt bereits eine metastasierte Erkrankung vor [2]. Diese kann einerseits die Lebenszeit begrenzen und andererseits die Lebensqualität durch tumorbedingte Symptome einschränken. Daher ist es von großem medizinischem Interesse, Prostatakarzinome in einem lokal begrenzten Stadium zu diagnostizieren, um eine Heilung betroffener Männer zu ermöglichen. Aus diesem Grund wird seit mehr als drei Jahrzehnten versucht, eine adäquate Früherkennung von Prostatakarzinomen zu etablieren. Als Teil einer Prostatakrebs-Früherkennung können zum aktuellen Zeitpunkt interessierten Männern eine rektale Tastuntersuchung der Prostata und nach Aufklärung über die Vor- und Nachteile die Bestimmung des PSA-Wertes angeboten werden [3]. Aufgrund der geringen Sensitivität und der ablehnenden Haltung vieler Patienten gegenüber der rektalen Tastuntersuchung wird diese nicht mehr als zentraler Bestandteil der Früherkennung angesehen [4]. Auch die alleinige Bestimmung des PSA-Wertes steht aufgrund der geringen Spezifität einer rein PSA-basierten Früherkennung seit langem in der Kritik. Dennoch haben die Daten der European Randomized Study of Screening for Prostate Cancer (ERPSC) und der GÖTEBORG-1-Studie bereits gezeigt, dass eine flächendeckende PSA-basierte Früherkennung zu einer Reduktion der Prostatakarzinomsterblichkeit führen kann [5, 6]. Allerdings ging dies in beiden Studien mit einer signifikanten Überdiagnose und Übertherapie von nicht signifikanten Karzinomen einher, das heißt von Prostatakarzinomen, die mit hoher Wahrscheinlichkeit keine Metastasen gebildet hätten. Die alleinige PSA-basierte Prostatakrebsfrüherkennung führt also dazu, dass eine relevante Patientenzahl ohne onkologischen Nutzen der psychischen Belastung einer Krebsdiagnose und den potenziell stark einschränkenden Folgen einer Prostatakrebsbehandlung (Inkontinenz, Impotenz) ausgesetzt wird. Aus diesem Grund gibt es in Deutschland bisher kein organisiertes flächendeckendes Prostatakrebs-Früherkennungsprogramm analog zur organisierten Brustkrebs-Früherkennung.
Ein verbessertes Programm zur Prostatakrebs-Früherkennung setzt die Reduktion der Überdiagnose von klinisch nicht signifikanten Karzinomen voraus. Diesbezüglich wurden und werden in laufenden großen internationalen Studien unter anderem eine risikoadaptierte sequenzielle bzw. verzögerte PSA-Bestimmung im Alter von 50 statt 45 Jahren [7], die Kombination des PSA-Wertes mit anderen im Blut messbaren genetischen Markern und Proteinen [8] und der Einsatz einer multiparametrischen MRT (mpMRT) der Prostata in der Prostatakrebs-Früherkennung getestet [8, 9].
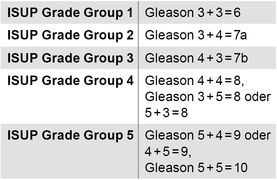
Tabelle 1: Grading des stanzbioptisch gesicherten Prostatakarzinoms nach dem Gleason-System (häufigstes und aggresivstes Wachstumsmuster addiert) und nach ISUP-Gruppen.
Dabei hat insbesondere der Einsatz der mpMRT der Prostata nach Nachweis eines erhöhten PSA-Wertes gezeigt, dass bei negativem MRT ein klinisch signifikantes Prostatakarzinom mit hoher Wahrscheinlichkeit ausgeschlossen werden kann und Männer in dieser Situation empfohlen wird, keine weitere invasive Abklärung mittels Biopsie durchzuführen. Auf diese Weise kann die Überdiagnose von nicht signifikanten Prostatakarzinomen, die sich in der Regel in einer MRT der Prostata nicht als auffällig darstellen, reduziert werden [9, 10, 11]. Bei Vorliegen einer positiven mpMRT können auffällige MRT-Läsionen gezielt biopsiert werden, um die Detektionsrate von signifikanten Karzinomen zu verbessern [11].
Die mpMRT der Prostata besteht aus einer T2-Sequenz, einer diffusionsgewichteten Sequenz (DWI) und einer perfusionsgewichteten T1-Sequenz (DCE). Insbesondere auf Basis der ersten beiden Sequenzen können Läsionen in der Prostata differenziert werden, die dann mit dem sogenannten „Prostate Imaging Reporting and Data System (PI-RADS)–Score“ hinsichtlich ihres Risikos für das Vorliegen eines signifikanten Karzinoms auf einer Skala von eins bis fünf bewertet werden können [12]. Dabei gilt in der Regel ein PI-RADS-Score ≥ 3 als auffällig, wobei insbesondere bei einem PI-RADS-Score von 4 und 5 mit hoher Wahrscheinlichkeit ein Prostatakarzinom vorliegt. Die perfusionsgewichtete T1-Sequenz ist von untergeordneter diagnostischer Bedeutung und kann bei schlechterer MRT-Qualität oder unklarem PI-RADS 3-Befund gegebenenfalls einen Karzinomverdacht erhärten (Abbildung 1). Derzeit wird die Durchführung eines solchen mpMRT bei allen Männern mit Verdacht auf ein lokal begrenztes Prostatakarzinom empfohlen und hat das klinische Management von Männern mit einem erhöhtem PSA in den vergangenen Jahren deutlich verbessert [3, 13]. Die hohe Zahl nötiger MRT-Untersuchungen der Prostata bringt wirtschaftliche und kapazitäre Probleme mit sich. Eine Lösung dieser Probleme scheint die zeitlich deutlich kürzere und kostengünstigere bi-parametrische MRT der Prostata als Alternative zur mpMRT zu sein. Dabei wird während der MRT kein Kontrastmittel verabreicht und auf die perfusionsgewichtete Sequenz verzichtet. Prospektive Daten zeigen, dass ein solches Verfahren der mpMRT in der Detektion von signifikanten Prostatakarzinomen nicht unterlegen ist, sodass sich die bi-parametrische Prostata-MRT in Zukunft zum neuen klinischen Standard entwickeln könnte [14].
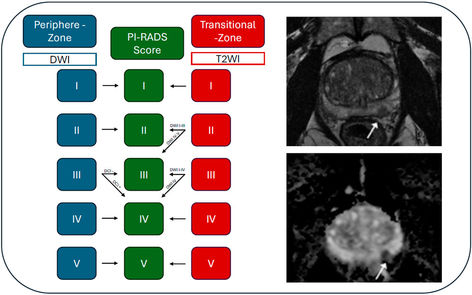
Abbildung 1: Algorithmus zur Beurteilung einer multiparametrischen MRT der Prostata nach PI-RADS V2.1. (links) und karzinomsuspekte PI-RADS IV-Läsion der peripheren Zone in der T2-gewichteten und diffusionsgewichteten Sequenz (rechts).
Abkürzungen: DWI = Diffusionsgewichtete Bildgebung; T2WI = T2-gewichtete Bildgebung; DCE = Dynamisch kontrastverstärkte Bildgebung
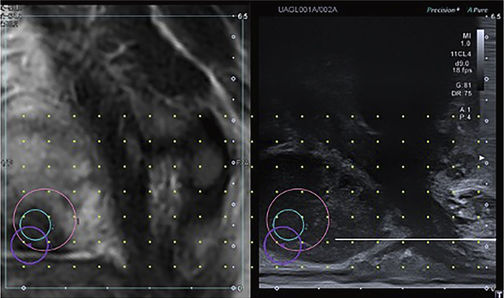
Abbildung 2: Synchronisierte „fusionierte“ MRT-Bilder (links) mit Live-Ultraschallbildgebung (rechts) in
sagittaler Darstellung zur perinealen Prostatabiopsie von einer suspekten MRT-Läsion (kreisförmig markiert).
Beim Nachweis verdächtiger MRT-Läsionen besteht der derzeitige diagnostische Standard in einer ultraschallgesteuerten gezielten Biopsie der verdächtigen MRT-Läsionen und einer systematischen Biopsie mit Entnahme von 10 bis 12 Biopsiezylindern aus der übrigen Prostata [13]. In mehreren Studien konnte gezeigt werden, dass die Kombination aus gezielter Biopsie verdächtiger MRT-Läsionen und systematischer Biopsie zu einer höheren Detektionsrate von klinisch signifikanten Prostatakarzinomen führt als die alleinige Anwendung einer der beiden Methoden [3, 11]. Durch die stetige Verbesserung der MRT-Diagnostik können aber häufig bereits bildgebend besonders verdächtige Prostataareale mit hoher diagnostischer Sensitivität identifiziert werden, sodass der Zusatznutzen der systematischen Biopsie bei erfahrenen Anwendern zunehmend in Frage gestellt wird und betroffenen Männern zunehmend nur noch eine gezielte Prostatabiopsie von MRT-verdächtigen Läsionen angeboten werden kann [15].
Prinzipiell wird bei der ultraschallgesteuerten Prostatabiopsie die Prostata mit einem Schallkopf transrektal dargestellt, wobei durch eine softwaregesteuerte Synchronisation die Live-Ultraschallbilder mit den MRT-Bildern übereinandergelagert werden können. Dies kann genutzt werden, um eine Biopsie von im MRT auffälligen Befunden zu ermöglichen, die im Schwarz-Weiß-Bild des Ultraschalls möglicherweise nicht erkennbar sind (Abbildung 2).
Die Führung der Biopsienadel kann dann entweder auch transrektal oder perineal über den Damm erfolgen. Beide Verfahren unterscheiden sich nicht signifikant in der Detektionsrate von signifikanten Prostatakarzinomen [16], und beide Biopsiemethoden können ambulant in Lokalanästhesie durchgeführt werden, wobei bei der perinealen Biopsie eine etwas ausgedehntere lokale Anästhesie der Haut und des prostatanahen Beckenbodens erforderlich ist. Aufgrund des etwas erhöhten Infektionsrisikos einer transrektalen Prostatabiopsie ist bei diesem Eingriff eine periinterventionelle Antibiotikaprophylaxe erforderlich. Internationale Leitlinien empfehlen daher zunehmend die Durchführung einer perinealen Prostatabiopsie [13, 16, 17].
Fazit
Die Entwicklung der vergangenen Jahre ermöglicht eine exaktere Identifizierung von Männern mit signifikanten lokalisierten Prostatakarzinomen und eine Reduktion der Überdiagnose von klinisch nicht signifikanten Tumoren. Darüber hinaus ermöglichen sie eine genauere und nebenwirkungsärmere bioptische Abklärung. Gegebenenfalls ermöglichen die noch ausstehenden Ergebnisse großer populationsbasierter Studien durch Integration einer PSA-Wert-Bestimmung mit einer Prostata-MRT und weiteren Risikomarkern die zeitnahe europaweite Etablierung eines flächendeckenden, organisierten Prostatakrebs-Screenings, mit dem die Inzidenz metastasierter Prostatakarzinome bei minimaler Überdiagnostik und klinisch nicht signifikanter Therapie von Tumoren reduziert werden kann.
2. PSMA-radioguided surgery beim lokal rezidivierten Prostatakarzinom
Ein 65-jähriger Patient stellt sich in unserer Klinik zur Zweitmeinung bei einem PSA-Rezidiv nach radikaler Prostatektomie vor. Initial war vor sechs Jahren eine roboterassistierte radikale Prostatektomie mit pelviner Lymphadenektomie durchgeführt worden. Die histopathologische Aufarbeitung ergab ein Adenokarzinom der Prostata, pT2c, pN0 (0/18), R0, Gleason 4 + 3 = 7b. Der initial gemessene PSA-Wert lag bei 11,5 ng/ml.
Bei der Nachsorgeuntersuchung vor zwei Jahren stieg der PSA-Wert erstmals von < 0,007 ng/ml auf 0,12 ng/ml an. Weitere Kontrollen bestätigten den langsamen PSA-Anstieg. Bei einem PSA-Wert von 0,35 ng/ml wurde eine PSMA-PET-Bildgebung durchgeführt. Hier zeigte sich der Verdacht auf eine Lymphknotenmetastase im Bereich des Stromgebiets der linken Arteria iliaca interna. Durch den behandelnden Urologen wurde eine Salvage-Strahlentherapie der Prostataloge und Lymphabflusswege mit begleitender Androgendeprivation diskutiert. Neben einer gut eingestellten arteriellen Hypertonie lagen keine relevanten Komorbiditäten bei dem Patienten vor.
Es wurde mit dem Patienten im Rahmen der Indikationssprechstunde die Möglichkeit einer radionuklidgesteuerten Salvage-Lymphadenektomie (PSMA-radioguided surgery) besprochen, für welche sich der Patient schließlich entschied. Am Vortag der Operation erhielt der Patient eine Infusion mit einem 99mTechnetium-markierten PSMA-Liganden. Am Folgetag konnte die Operation mit einer Gesamtdauer von 90 Minuten problemlos durchgeführt werden. Intraoperativ konnte der befallene Lymphknoten mit einer Gammasonde detektiert und entfernt werden. Der Patient wurde am vierten postoperativen Tag aus der stationären Behandlung entlassen. Der PSA-Wert fiel sechs Wochen nach erfolgter Operation erneut in den Nullbereich ab.
Hintergrund
Etwa ein Viertel der Patienten erleidet nach radikaler Prostatektomie ein biochemisches Rezidiv (PSA-Wert ≥ 0,2 ng/ml) [18]. Nationale und internationale Leitlinien empfehlen in diesem Fall eine Bildgebung mittels PSMA-PET/CT zur Planung einer individualisierten Therapie. Bei Patienten mit einem PSA-Wert von 0,2 ng/ml haben 45 Prozent der Patienten ein Korrelat im PSMA-PET-CT, dieser Anteil steigt bei zunehmendem PSA-Wert kontinuierlich an, sodass bei einem PSA-Wert ab 0,5 ng/ml 59 Prozent der Patienten ein Korrelat haben [19]. Diese seit etwa zehn Jahren verfügbare Bildgebung ist damit ungleich sensitiver als das konventionelle CT.
Im Fall eines Lymphknotenrezidivs stehen verschiedene Behandlungsmethoden zur Verfügung. Für lange Zeit galt eine systemische Androgendeprivationstherapie (ADT) als Standard. Erst kürzlich wurden die Ergebnisse der EMBARK-Studie publiziert, die nahelegen, dass sich eine frühe Intensivierung der antihormonellen Therapie, im Falle der EMBARK-Studie mit Enzalutamid, positiv auf das metastasenfreie Überleben auswirkt. Enzalutamid ist mittlerweile beim biochemischen Rezidiv nach Prostatektomie und Erfüllen gewisser Risikofaktoren zugelassen [20].
In den vergangenen Jahren wird zunehmend das Konzept einer metastasengerichteten Therapie (MDT) verfolgt [21, 22], deren Ziel in einer Verlängerung der rezidiv- und therapiefreien Zeit sowie dem Erlangen einer lokalen Tumorkontrolle besteht. Im Falle eines Lymphknotenrezidivs kann entweder eine gezielte Bestrahlung oder eine Salvage-Lymphadenektomie (SLND) durchgeführt werden. Da die Resektion kleinerer Läsionen im voroperierten Gebiet mitunter herausfordernd ist, wurde zur Erleichterung des operativen Vorgehens am Klinikum rechts der Isar im Jahr 2014 die PSMA-radioguided surgery (PSMA-RGS) entwickelt. Hierbei wird dem Patienten präoperativ ein radioaktiv markierter PSMA-Ligand injiziert, welcher intraoperativ mit einer Gammasonde detektiert werden kann. Mit dieser Methode konnte in einer großen Serie bei 94 Prozent der Patienten metastatisches Gewebe reseziert werden [23].
Eine entscheidende Frage im Arzt-Patienten-Gespräch vor der SLND ist, welchen onkologischen Benefit der Patient durch die Operation erhoffen darf.
In einer retrospektiven Studie von insgesamt 364 Patienten, die eine PSMA-RGS erhielten, konnte bei 165 Patienten (45 Prozent) eine komplette PSA-Remission (< 0,2 ng/dl) erreicht werden. Nach zwei Jahren lag der Anteil der Patienten ohne ein biochemisches Rezidiv bei 32 Prozent und der Anteil an Patienten ohne weitere Therapie bei 58 Prozent. Patienten mit einer höheren Anzahl an positiven Lymphknoten (HR: 1.23, 95 %-KI: 1,08 – 1,40) und Patienten mit retroperitonealen Lymphknoten (HR: 2.04, CI: 1.31–3.18) hatten ein höheres Risiko für ein biochemisches Rezidiv [23].
Weiterhin existieren vergleichende Daten zur konventionellen SLND. Steuber et al. untersuchten in einer Matched-pair Analyse 659 Männer mit einem Lymphknotenrezidiv nach kurativ intendierter Therapie. In dieser retrospektiven Betrachtung war die SLND dem Therapiestandard, welcher aus einer unmittelbaren oder verzögerten antihormonellen Therapie bestand, überlegen (Hazard ratio für das tumorspezifische Überleben 0,33, 95 %-KI 0,17 - 0,64) [24].
Die Arbeitsgruppe um Carlo Bravi und Kollegen publizierte kürzlich Zehn-Jahres-Daten zur SLND. In der Serie von 189 Patienten waren nach zehn Jahren Follow-up noch immer 11 Prozent der Patienten frei von einem biochemischen Rezidiv, was ein beachtlicher Anteil ist [25]. Es ist sehr wahrscheinlich, dass diese Zahl bei Verwendung eines PSMA-PET/CT als Grundlage der SLND, das in der zitierten Studie nicht zur Verfügung stand, noch höher ist.
Das Auftreten von Komplikationen im Rahmen der SLND hängt in erster Linie von der Indikationsstellung und in zweiter Linie von der operativen Expertise ab.
Die Wahrscheinlichkeit für transfusionspflichtige Blutungen ist sehr gering, sie liegt im eigenen Patientengut nach neun Jahren noch immer bei 0 Prozent. In der größten Serie zur PSMA-RGS wird von 6,6 Prozent Grad III/IV-Nebenwirkungen berichtet, numerisch kommt dabei am häufigsten eine Harnleiterproblematik vor [23]. Bei der Resektion von Rezidiven im Bereich der Samenblase kommt es gelegentlich zu einer postoperativen Entleerungsstörung der Harnblase. Dies ist mutmaßlich durch eine Veränderung der Innervation und der Durchblutung der Harnblase zu erklären und muss bei solchen Fällen im Aufklärungsgespräch erwähnt werden.
Da der onkologische Nutzen der SLND bei jedem individuellen Patienten nicht zu beziffern ist, muss nach dem Grundsatz „primum nil nocere“ die Vermeidung von chirurgischen Komplikationen das oberste Gebot sein.
Die radionuklidunterstützte Lymphadenektomie kann auch im Falle eines primär lymphogen metastasierten Prostatakarzinoms zeitgleich mit der Prostatektomie angewandt werden. Erste Daten aus einer retrospektiven Analyse von 35 Patienten legen nahe, dass vor allem Patienten mit weniger als zwei befallenen Lymphknoten von der Operation profitieren könnten [26].
Fazit
Die SLND ist eine häufig benutzte Form der metastasengerichteten Therapie, die auf der Basis eines PSMA-PET/CT durchgeführt werden sollte. Es wurde wiederholt gezeigt, dass Patienten mit einer singulären pelvinen Läsion und einem geringen PSA-Wert am meisten von der SLND profitieren. Die Durchführung der SLND als PSMA-RGS erhöht die Detektionsrate der SLND. In der größten publizierten Kohorte zur SLND wurde bei 60 Prozent der Patienten eine Reduktion des PSA-Wertes unter 0,2 ng/dl erreicht, nach zwei Jahren Follow-up liegt der Anteil der Patienten ohne biochemisches Rezidiv bei 32 Prozent. Komplikationen lassen sich durch eine gute Patientenselektion und chirurgische Expertise weitestgehend verhindern.
3. Systemtherapie des Urothelkarzinoms im Wandel
Fall 1: Perioperative Therapie des muskelinvasiven Urothelkarzinoms der Harnblase
Ein 62-jähriger Patient stellt sich bei seinem Hausarzt mit einer seit zwei Tagen bestehenden Makrohämaturie vor. Zur weiteren Abklärung wird beim niedergelassenen Urologen eine Zystoskopie durchgeführt. Hier zeigt sich ein etwa 4 cm großer breitbasiger Tumor. Daraufhin stellt sich der Patient in unserer Klinik zur transurethralen Resektion des Harnblasentumors (TUR-Blase) vor. Histologisch wird ein muskelinvasives Urothelkarzinom der Harnblase nachgewiesen. Zum weiteren Staging wird ein Kontrastmittel-CT von Thorax, Abdomen und Becken durchgeführt. Hier zeigen sich keine Fernmetastasen oder Pathologien des oberen Harntraktes. Allerdings findet sich der Verdacht auf drei pelvine Lymphknotenmetastasen von bis zu 3 cm Größe (Abbildung 4).
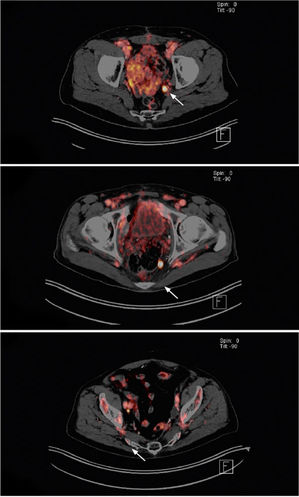
Abbildung 3: Drei Patienten mit idealen Befunden für eine SLND mittels PSMA-radioguided surgery. Bei einem PSA-Anstieg nach Prostatektomie zeigt sich als Korrelat in der PSMA-PET/CT jeweils eine isolierte Lymphknotenmetastase iliacal intern (oben), in der Fossa obturatoria (unten rechts) bzw. pararektal (unten links). Alle Patienten hatten ein PSA-Rezidiv nach radikaler Prostatektomie. Die Malignität der Veränderungen konnte in allen drei Fällen bestätigt werden.
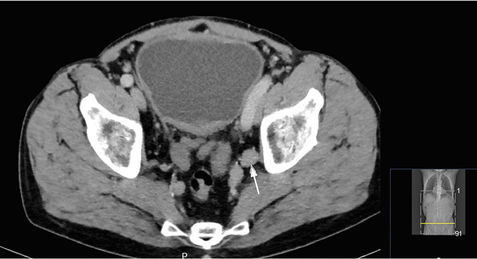
Abbildung 4: Staging-CT mit pelvinen Lymphknotenmetastasen
Bei dem Patienten liegt folglich ein muskelinvasives Urothelkarzinom der Harnblase mit dem Verdacht auf eine lokoregionäre Lymphknotenmetastasierung vor (pT2, cN2, cM0). Als multimodales Konzept haben wir dem Patienten eine induktive, cisplatinbasierte Kombinationschemotherapie und anschließend die Durchführung einer Zystektomie mit Anlage einer Ileum-Neoblase empfohlen. Wegen der Nephro-, Oto- und Neurotoxizität von Cisplatin gibt es definierte Kriterien, die eine Gabe von Cisplatin verbieten (ECOG ≥ 2, Kreatinin-Clearance < 60 ml/min, Hörverlust ≥ Grad 2, Neuropathie ≥ Grad 2, Herzinsuffizienz NYHA ≥ III) [27]. Bei weiterreichender Niereninsuffizienz bis zu einer GFR von 40 ml/min kann die Gabe von Cisplatin auf zwei Tage verteilt werden (Split-dose-Schema) [28], unter einer GFR von 40 ml/min ist eine Gabe von Cisplatin in der Regel nicht möglich.
Bei dem Patienten des Fallbeispiels bestanden keine relevanten Komorbiditäten und eine nicht eingeschränkte Nierenfunktion. Nach zwei Zyklen Chemotherapie mit Gemcitabin/Cisplatin führten wir ein Zwischen-Staging durch. Hier zeigten sich sowohl der Primarius als auch die Lymphknotenmetastasen regredient, nach vier Zyklen bildmorphologisch eine komplette Remission. Mit dem Patienten erfolgte vor der nun anstehenden Zystektomie ein erneutes Gespräch über die Harnableitung. Wegen des jungen Patientenalters und des guten Allgemeinzustandes entschied sich der Patient für die Anlage einer orthotopen Ileum-Neoblase als kontinente Form der Harnableitung. Beispiele für mögliche Alternativen sind die Anlage eines über den Nabel katheterisierbaren Pouches (zum Beispiel bei Harnröhrenbeteiligung durch das Tumorgeschehen) oder eine inkontinente Form der Harnableitung mittels Ileum-Conduit. Neben einer adäquaten Nierenfunktion erfordert die Ileum-Neoblase wegen der anfangs geringen Kapazität und der anfangs oft eingeschränkten nächtlichen Kontinenz eine gute Patientencompliance. Meist ist die Zeit bis zur kompletten Rehabilitation nach der Anlage eines Ileum-Conduit kürzer.
Die Operation als nervschonende radikale Zystektomie mit erweiterter pelviner Lymphadenektomie und Anlage einer Ileum-Neoblase wurde über eine unterhalb des Nabels endende mediane Unterbauchlaparotomie durchgeführt. Der postoperative Verlauf gestaltete sich komplikationslos. Der Patient verließ die Klinik nach 14 Tagen in die roborierende Anschlussheilbehandlung.
Die endgültige Histologie ergab ein Urothelkarzinom der Harnblase ypT0 ypN1mi (1 Mikrometastase in 32 Lymphknoten). Der eigentliche Tumor in der Blase war komplett regredient, allerdings zeigte sich eine Mikrometastasierung in einem Beckenlymphknoten. Der Nachweis von nur einer LK-Metastase ist zwar, auch in Anbetracht des bildgebenden Ansprechens, als Erfolg der Chemotherapie zu werten, stellt aber dennoch eine Hochrisiko-Situation dar.
Patienten in einer solchen Situation kann eine adjuvante Therapie mit dem PD-1-Antikörper Nivolumab gemäß den Daten der CheckMate-274-Studie (Nivolumab vs. Placebo) angeboten werden, wenn sie einen positiven PD-L1-Status (Tumor Proportion Score (TPS) ≥ 1 Prozent) aufweisen (PD-L1-pos. gefärbte Tumorzellen bezogen auf die Gesamtzahl der Turmozellen). Die Europäische Arzneimittel-Agentur (EMA)-Zulassung erfolgte bereits im Jahre 2022 aufgrund des Vorteils von Nivolumab im Vergleich zu Placebo bezogen auf das krankheitsfreie Überleben [29]. Auf dem diesjährigen European Association of Urology (EAU)-Kongress wurden aktualisierte Daten der CheckMate-274-Studie vorgestellt. Nach einer Nachbeobachtungsphase von drei Jahren konnte in der Intention-to-treat (ITT)-Population eine Verdopplung und in der Gruppe der PD-L1-positiven Patienten sogar eine Versechsfachung des krankheitsfreien Überlebens durch Nivolumab gezeigt werden. Erstmals wurden auch Interims-Daten zum Gesamtüberleben publiziert. Auch hier zeigt sich ein Vorteil von Nivolumab im Vergleich zu Placebo. In der ITT-Population wurde das numerische Gesamtüberleben von 50 auf ca. 70 Monate verlängert. In der PD-L1-positiven Gruppe wurde dieser Endpunkt noch nicht erreicht [30].
Bei dem Patienten wurde ein TPS von acht Prozent nachgewiesen und er erhielt eine adjuvante Therapie mit Nivolumab über ein Jahr. Diese adjuvante Immuntherapie bestand aus einer Infusion über 60 Minuten mit einer Fixdosis von 480 mg im 4-Wochen-Schema. Die onkologische Nachsorge blieb stets unauffällig. Nach anfänglicher Belastungsinkontinenz besteht nun tagsüber eine komplette Kontinenz, nachts ist ein einmaliges Aufstehen zur Vermeidung von Urinverlust nötig. Die erektile Funktion ist mit der Einnahme von PDE-5-Hemmern zufriedenstellend. Zur Vermeidung einer Übersäuerung des Urins nimmt der Patient täglich alkalisierend wirkendes Natriumbicarbonat ein. Da für die Neoblase das terminale Ileum verwendet wurde, ist nach drei Jahren laborchemisch die Bestimmung von Vitamin B12 erforderlich.
Fall 2: Moderne Erstlinientherapie des metastasierten Urothelkarzinoms (mUC)
Die initiale Vorstellung eines 56-jährigen Patienten erfolgte durch Überweisung seines niedergelassenen Urologen im Dezember 2023 mit dem Verdacht auf ein hepatisch metastasiertes Urothelkarzinom der Harnblase. Zwei Jahre zuvor war bei dem Patienten eine Zystektomie mit Anlage einer Ileum-Neoblase erfolgt, nun zeigte sich in der Nachsorge der Verdacht auf hepatische Filiae. Der Patient präsentierte sich in einem guten Allgemeinzustand ohne relevante Vorerkrankungen. Laborchemisch zeigten sich lediglich eine Anämie mit einem Hämoglobinwert von 11 g/dl sowie ein milder Anstieg der Transaminasen (ALT 75 U/l, AST 60 U/l, Bilirubin normwertig). Eine CT-gesteuerte Leberbiopsie konnte den Verdacht bestätigen.
Vor Entwicklung klassischer Chemotherapien betrug das mediane Gesamtüberleben von Patienten mit einem metastasierten Urothelkarzinom lediglich 3 bis 6 Monate [31].
Eine effektive Kombinationschemotherapie, bestehend aus Methotrexat, Vinblastin, Doxorubicin und Cisplatin (MVAC) wurde bereits Ende der 1990er-Jahre zugelassen. Hierdurch wurde die mediane Gesamtüberlebenszeit auf ca. 14 Monate verlängert [32]. Im Jahr 2000 konnte gezeigt werden, dass eine Chemotherapie mit Gemcitabin plus Cisplatin vergleichbare Daten für die Effektivität hat, dabei aber ein nebenwirkungsärmeres Regime darstellt als die klassische MVAC-Kombinationschemotherapie [33].
Somit galt die Chemotherapie mit Gemcitabin plus Cisplatin über zwei Jahrzehnte als Standard-Erstlinientherapie für Patienten mit einem mUC. Im Jahr 2021 wurde der PD-L1-Checkpoint-Inhibitor Avelumab als Erhaltungstherapie für Patienten zugelassen, die nach 4 bis 6 Zyklen einer platinhaltigen Chemotherapie in der Erstlinie mindestens einen stabilen Tumorstatus aufwiesen bzw. eine komplette oder partielle Remission gezeigt haben. Dadurch konnte das mediane Gesamtüberleben auf ca. 24 Monate verlängert werden [34].
Kurz vor der Vorstellung des Patienten in der uroonkologischen Sprechstunde unserer Klinik im Oktober 2023 zeigten Powles und Mitarbeiter im Rahmen des ESMO-Kongresses (Europäische Gesellschaft für Medizinische Onkologie) erstmals die positiven Ergebnisse der EV-302/KEYNOTE A39-Studie [35]. In diese Studie wurden therapienaive Patienten mit einem lokal fortgeschrittenen bzw. metastasierten Urothelkarzinom eingeschlossen. Verglichen wurde im Rahmen einer 1:1 Randomisierung eine Kombinationstherapie aus Enfortumab-Vedotin plus Pembrolizumab (EV + P) mit einer regulären Chemotherapie mit Gemcitabin plus Cisplatin oder Carboplatin (CG), teilweise in Verbindung mit einer im Studienverlauf eingeführten Erhaltungstherapie mit Avelumab.
Enfortumab-Vedotin (EV) ist ein sogenanntes Antikörper-Wirkstoff-Konjugat (engl. antibody-drug conjugate – ADC), welches aus drei Komponenten besteht (Abbildung 5):
- ein Antikörper, der gegen das Oberflächenprotein Nectin-4 gerichtet ist
- ein Zytostatikum, Monomethyl-Auristatin E (MMAE) (sog. „payload“)
- ein Linker, der Payload und Antikörper verbindet
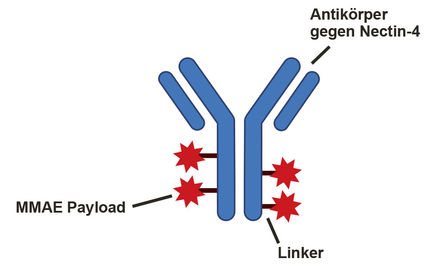
Abbildung 5: Aufbau des Antikörper-Wirkstoff-Konjugats Enfortumab-Vedotin
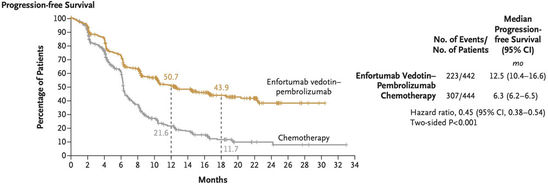
Abbildung 6: Verdopplung des medianen progressionsfreien Überlebens durch EV + P
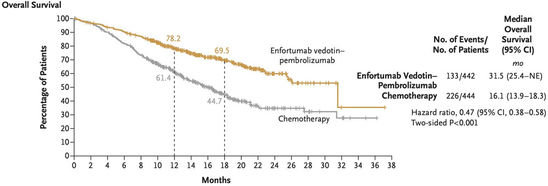
Abbildung 7: Verdopplung des medianen Gesamtüberlebens durch EV + P
Der Antikörper bindet an das Oberflächenprotein Nectin-4, welches auf Urothelkarzinomzellen exprimiert wird, und wird mittels Endozytose in die Zelle internalisiert. Der Linker wird im Zell-inneren durch Proteasen gespalten, sodass das Zytostatikum („payload“) MMAE freigesetzt wird. MMAE bindet an Mikrotubuli und unterbricht deren Polymerisation, was letztlich zur Apoptose der Tumorzelle führt. Enfortumab-Vedotin ist als Monotherapie aktuell bereits in der Drittlinie des metastasierten Urothelkarzinoms nach einer platinhaltigen Chemotherapie und einer Therapie mit einem PD-(L)-1-Immuncheckpoint-Inhibitor zugelassen [36].
In der EV-302/KEYNOTE A39-Studie zeigte sich durch die neuartige Kombinationstherapie eine Verdopplung sowohl des medianen progressionsfreien Überlebens (mPFS) von 6,3 Monaten (95 %-KI 6,2 – 6,5) auf 12,5 Monate (95 %-KI 10,4 – 16,6) mit einer HR von 0,45, als auch des medianen Gesamtüberlebens (mOS) von 16,1 Monaten (95 %-KI 13,9 – 18,3) auf 31,5 Monate (95 %-KI 25,4 – NE) (HR 0,47) (Abbildung 6 und 7). Der Überlebensvorteil durch die Therapie mit EV + P konnte in allen relevanten Subgruppen nachvollzogen werden und war unabhängig von der Lokalisation des Tumors im Harntrakt, der Cisplatinfähigkeit, einer viszeralen oder nur lymphogenen Metastasierung und dem PD-L1-Status vorhanden.
Nach individuellem Antrag auf Übernahme der Therapiekosten wurde im März 2024 die erste Staginguntersuchung durchgeführt. Hier zeigte sich ein gutes Therapieansprechen mit einer Größenregredienz sowohl des Primarius als auch der hepatischen Metastasen. Eine EMA-Zulassung für EV + P in der Erstlinie ist derzeit noch ausstehend und wird für Herbst 2024 erwartet.
Therapiebedingte Nebenwirkungen ≥ Grad 3 waren unter EV + P mit 55,9 Prozent vs. 69,9 Prozent zwar numerisch seltener als im Kontroll-arm mit Gemcitabin plus Cisplatin/Carboplatin, jedoch erfordert das differente Spektrum der Nebenwirkungen eine genauere Betrachtung. Die häufigste Nebenwirkung der neuartigen Kombinationstherapie war eine periphere sensorische Neuropathie, welche bei 50 Prozent der Patienten auftrat. 3,6 Prozent der Patienten hatten eine periphere sensorische Neuropathie ≥ Grad 3, was eine deutliche Einschränkung der Aktivitäten des täglichen Lebens bedeutet. Im Gegensatz zur platinhaltigen Chemotherapie kann aber durch eine Dosisreduktion oder ein Pausieren von EV die periphere Neuropathie verbessert werden oder sich sogar vollständig zurückbilden. Weitere Nebenwirkungen waren Pruritus, makulopapulöser Hautausschlag, Fatigue, Alopezie, Hyperglykämie, Diarrhö, Appetitverminderung, Übelkeit, Anämie, Pneumonitis, Neutropenie und Thrombozytopenie. Die Veränderungen des Blutbildes traten allerdings bedeutend seltener auf als bei der klassischen Chemotherapie mit Gemcitabin plus Cisplatin/Carboplatin.
Fazit
Die neuesten Ergebnisse der CheckMate-274-Studie zeigen einen Vorteil von Nivolumab in der Adjuvanz nach radikaler Zystektomie bei einem Hochrisiko-Harnblasentumor bezogen auf das krankheitsfreie Überleben und das Gesamtüberleben.
Durch die Ergebnisse der EV-302/KEYNOTE A39-Studie wird mit der Kombination Enfortumab-Vedotin plus Pembrolizumab erstmals eine platinfreie Therapie in der Erstlinienbehandlung des metastasierten Urothelkarzimoms einen neuen Standard darstellen.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom
Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autorinnen und Autoren:

Professor Dr. Thomas Horn

Dr. Matthias Jahnen

Dr. Philipp Korn

Dr. Kira Schüller

Professorin Dr. Margitta Retz

Professor Dr. Jürgen E. Gschwend
Klinik und Poliklinik für Urologie,
Universitätsklinikum rechts der Isar,
School of Medicine and Health,
Technische Universität München,
Ismaninger Str. 22, 81675 München
Teilen:
Das könnte Sie auch interessieren:






