Neu in der Rheumatologie
 Rheumatologie
Rheumatologie
Die Rheumatologie hat in den vergangenen Jahren nicht nur einen rasanten Zuwachs an therapeutischen Möglichkeiten erfahren, sondern es hat sich auch die Sicht- und Herangehensweise an verschiedene Krankheitsbilder grundlegend gewandelt. Dies schließt die frühe Diagnosestellung und die frühe Etablierung einer effektiven Therapie, die sich an definierten Therapiezielen („treat to target“) ausrichtet, ein. Weiterhin wird zunehmend den Komorbiditäten, vor allem dem kardiovaskulären Risiko, Beachtung geschenkt, einerseits im Rahmen der Erkrankungen selber, andererseits aber auch durch die Anwendung von Glukokortikoiden, deren Reduktion zentral im Fokus steht. Zunehmend an Bedeutung gewinnt auch der Gedanke, unter welchen Bedingungen Therapien reduziert oder ganz beendet werden können. Nicht zuletzt aufgrund der Möglichkeiten der genetischen Diagnostik hat sich das Wissen um die Pathophysiologie rheumatologischer Erkrankungen deutlich erweitert, was sich in der Definition neuer Entitäten widerspiegelt.
Fall 1: Rheumatoide Arthritis
Ein 52-jähriger Architekt wird in die rheumatologische Sprechstunde überwiesen mit seit ca. sechs Monaten wiederkehrenden dumpfen Schmerzen im Bereich der Handgelenke, der Fingergrundgelenke und der Fingermittelgelenke. Mit jeder Episode sind mehr Gelenke betroffen, die Schmerzen nehmen immer mehr zu, es besteht vor allem morgens bis in den späten Vormittag eine Steifigkeit der Gelenke, die ihn zunehmend an der PC-Arbeit hindert. Seit kurzem bestehen auch Schmerzen des Fußballens des linken Fußes beim Auftreten und Abrollen. Von der hausärztlichen Kollegin wurden aufgrund des suggestiven Krankheitsbildes bereits Rheumafaktor (IgM) und Antikörper gegen cyclische citrullinierte Proteine (ACPA = CCP-AK) bestimmt, die sich mit 235 U/ml (Normbereich < 10 U/ml) und 309 U/ml (Normwert < 17 U/ml) jeweils deutlich erhöht zeigen, das CRP mit 2,1 mg/dl ebenfalls erhöht. In der Früharthritis-Sprechstunde präsentieren sich die als schmerzhaft beschriebenen Gelenke in der Palpation geschwollen, die Beweglichkeit in den Handgelenken ist schmerzhaft eingeschränkt. An den Zehengrundgelenken ist ein Querdruckschmerz provozierbar. Sonografisch liegt eine ausgeprägte Carpalarthritis und Arthritis mehrerer Zehengrundgelenke vor (Abbildung 1). Der DAS28 (siehe Glossar) entspricht mit 5,4 einer hohen Krankheitsaktivität. Es wird die Diagnose einer seropositiven rheumatoiden Arthritis gestellt. Der Patient möchte über die Diagnose und das therapeutische Vorgehen aufgeklärt werden. Der Einnahme von Glukokortikoiden steht er skeptisch gegenüber, da seine Mutter an einer Polymyalgia erkrankt war und unter Therapie mit Glukokortikoiden mehrere Nebenwirkungen in Form eines steroidinduzierten Diabetes und einer Osteoporose mit Wirbelkörpereinbrüchen erlitt. Darüber hinaus ist der Patient an einem unter antihypertensiver Zweifachtherapie gut eingestellten Hypertonus und einem mit oralen Antidiabetika eingestellten Typ-2-Diabetes erkrankt. Ein Myokardinfarkt oder ein Apoplex sind nicht bekannt.
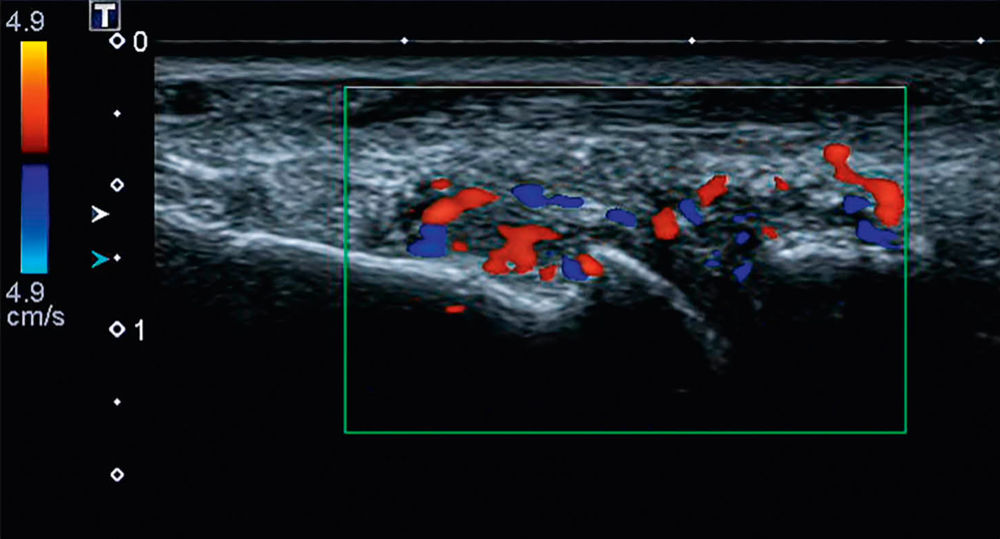
Abbildung 1: Sonografische Darstellung einer aktiven Synovitis MTP2 (Metatarsophalangealgelenk 2) bei rheumatoider Arthritis mit Synoviaproliferation und intensiver Mehrbelegung in der Farbdarstellung als Ausdruck entzündlicher Aktivität.
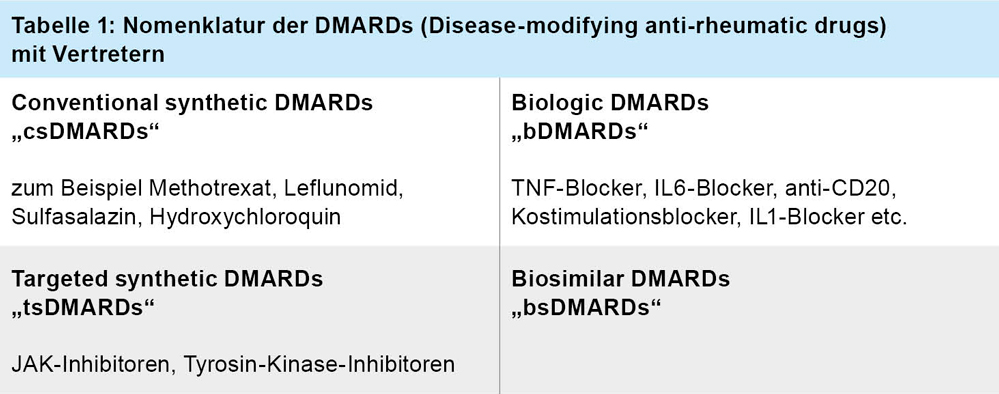
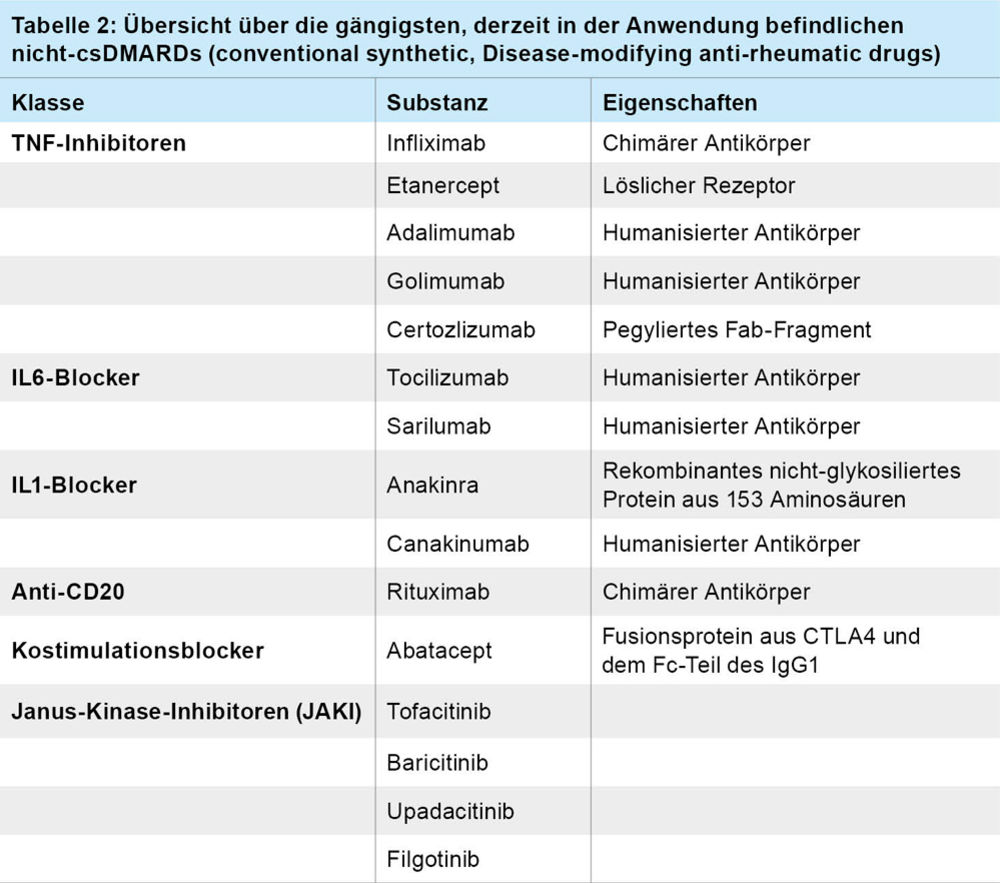
Diskussion
Die rheumatoide Arthritis gehört mit einer Prävalenz von ca. einem Prozent neben der Spondylarthritis und Psoriasisarthritis mit einer Prävalenz von jeweils ca. 0,4 Prozent und ca. 0,3 Prozent zu den häufigsten rheumatologischen Erkrankungen in Deutschland. Aufgrund neuer Therapien und neuer Therapiekonzepte werden Krankheitsbilder mit schweren Deformitäten immer seltener gesehen. Dies beinhaltet den frühen Beginn einer Therapie mit „disease modifying antirheumatic drugs“ („DMARDs“), früher „Basistherapeutika“, die aufgrund der zunehmenden Zahl an Substanzgruppen in einer neuen Nomenklatur zusammengefasst wurden (Tabelle 1 und 2) . Die Therapie sollte optimalerweise innerhalb von drei Monaten nach Diagnosestellung begonnen werden, die Diagnosestellung optimalerweise innerhalb von sechs Wochen nach Symptombeginn von rheumatologischer Seite erfolgen. Die Diagnose erfolgt durch klinische Untersuchung, Gelenksonografie und Laboruntersuchungen, in Ausnahmefällen sind weitere Verfahren wie zum Beispiel eine Kernspintomografie erforderlich. Während der Rheumafaktor insbesondere bei niedrigen Titern eine niedrige Sensitivität und Spezifität besitzt, kommt den ACPA, insbesondere bei hohen Titern, eine wichtige diagnostische, aber auch prognostische Bedeutung zu, wobei neue Testsysteme eine Sensitivität und Spezifität von ca. 97 Prozent besitzen. Methotrexat bleibt in der Therapie der rheumatoiden Arthritis aufgrund seiner insgesamt sehr guten Wirksamkeit und Verträglichkeit trotz vieler Neuerungen auch in den 2022 aktualisierten Leitlinien der EULAR das Medikament der ersten Wahl. Noch stärker in den Vordergrund gerückt ist die konsequente Reduktion des kontinuierlichen Einsatzes von Glukokortikoiden. Untersuchungen der letzten Jahre haben eindrucksvoll das deutlich erhöhte Risiko für Infekte und kardiovaskuläre Morbidität auch in den früher fälschlicherweise nur als gering schädigend eingestuften Niedrigdosis-Bereichen belegt. Der Einsatz von Glukokortikoiden ist insbesondere zu Beginn der Therapie meist nicht zu umgehen, sollte aber gemäß der 2022 aktualisierten EULAR-Leitlinie in möglichst geringer Dosis angewendet werden und so rasch wie möglich, möglichst nach drei Monaten, beendet werden. Eine jüngere Arbeit aus dem deutschen Rabbit-Register konnte zeigen, dass für eine wirksame Therapie in der Initialphase der Therapie eine Tagesdosis von 10 mg Prednisolon eine vergleichbare Wirksamkeit zu einer Tagesdosis von 60 mg Prednisolon besitzt. Therapieziel ist die Remission (siehe Tabelle 3). Bei Nichterreichen soll eine rasche Therapieeskalation erfolgen, wobei die Kombination von bDMARD oder tsDMARD mit Methotrexat empfohlen wird. Mit den europäischen Erstzulassungen von Tofacitinib und Baricitinib 2017, von Upadacitinib 2019 und Filgotinib 2020, ist die Gruppe der per os applizierten Janus-Kinase-Inhibitoren („JAKI“) in der Rheumatologie ein wichtiger Bestandteil der Therapie in den Indikationen rheumatoide Arthritis, Psoriasis-Arthritis, Spondylarthritis und juvenile rheumatoide Arthritis geworden. Aufgrund der Ergebnisse der 2022 publizierten „Oral-Surveillance“ post marketing Sicherheitsstudie, in der Tofacitinib bei Patienten mit rheumatoider Arthritis über 50 Jahre und mindestens einem kardiovaskulärem Risikofaktor untersucht und in der einer gegenüber TNF-Blockern erhöhte Rate insbesondere an kardiovaskulären Ereignissen (MACE) und Malignomen beschrieben wurde, wurde von der EMA eine Warnung ausgesprochen, die sich trotz fehlendem Einschluss der übrigen JAKI auch auf diese Substanzen bezieht. Ein erhöhtes Risiko für unerwünschte Ereignisse lag vor allem für Patienten im Alter von mindestens 65 Jahren und Raucheranamnese vor, das Risiko für MACE war bei Patienten ohne manifeste atherosklerotische Erkrankung nicht erhöht. Erwähnenswert ist, dass die Ergebnisse in mehreren jüngeren Arbeiten nicht nachvollzogen werden konnten. In den aktuellen Leitlinien der EULAR zur Therapie der rheumatoiden Arthritis wird daher der Einsatz von JAKI nur unter Risikoabwägung empfohlen. Checklisten zur Risikoeinschätzung stehen beispielsweise auf der Homepage der Deutschen Gesellschaft für Rheumatologie (DGRh) zur Verfügung.
In Bezug auf eine Therapiedeeskalation spricht die Evidenz der letzten Jahre dafür, dass bei der überwiegenden Anzahl von Patienten nach vollständigem Absetzen der Therapie eine erneute Krankheitsaktivität zu erwarten ist. Es wird daher bei Kombinationstherapie zunächst die Reduktion auf ein DMARD (csDMARD oder bDMARD oder tsDMARD) empfohlen und, falls möglich, eine Dosisreduktion und/oder eine Verlängerung des Applikationsintervalls, aber keine vollständige Therapiebeendigung. Voraussetzung für eine Therapiedeeskalation ist eine anhaltende Remission („sustained remission“) ohne Glukokortikoide.
Ein weiteres, aktuell in den Vordergrund rückendes Thema ist die pulmonale Beteiligung bei rheumatologischen Erkrankungen, insbesondere die Entwicklung einer interstitiellen Lungenerkrankung („ILD“), nicht nur bei Kollagenosen (siehe Fallbeispiel 2), sondern auch bei der rheumatoiden Arthritis („rA-ILD“). Wichtig ist, dass die effektive Behandlung der Grunderkrankung durch eine immunmodulierende Therapie (DMARD) bereits in der Lage ist, die Progression einer ILD zu verlangsamen. Da Unklarheit besteht, ob TNF-Inhibitoren mit die Progression einer ILD begünstigen, wird vom Einsatz von TNF-Inhibitoren bei mit rA-ILD abgeraten. Sofern trotz ausreichender Kontrolle der entzündlichen Aktivität der rheumatischen Erkrankung ein progressiver Verlauf einer ILD vorliegt („progredient pulmonale Fibrose“, „PPF“) besteht die Indikation für eine antifibrotische Therapie, gegebenenfalls in Kombination mit der immunmodulierenden Therapie. Neuere Daten zum Einsatz von Methotrexat haben gezeigt, dass im Gegensatz zur Auffassung in der Vergangenheit Methotrexat für die Entstehung von Lungenfibrose nicht verantwortlich ist, sondern dass hier von einer Assoziation auszugehen ist. Der Einsatz von Methotrexat bei Patienten mit rA-ILD ist möglich und scheint sich sogar positiv auf den Verlauf der rA-ILD auszuwirken.
In Bezug auf die Entwicklung von Malignomen ist aufgrund der aktuellen Datenlage davon auszugehen, dass die aktive rheumatologische Erkrankung ein Haupttrigger für die Entstehung von Malignomen ist, und dass eine immunmodulierende Therapie bei Malignomen in Remission ohne Verzögerung aufgenommen werden sollte und kann. Eine Einschränkung ergibt sich für den Kostimulationsblocker Abatacept, für den in mehreren Arbeiten bei Patienten mit rheumatoider Arthritis ohne vorangegangenes Malignom eine häufigere Inzidenz von Malignomen beobachtet werden konnte und für JAKI auf dem Boden der oben diskutierten Daten der Oral-Surveillance-Studie.
Fall 2: Lupus und ANCA-assoziierte Vaskulitis (AAV)
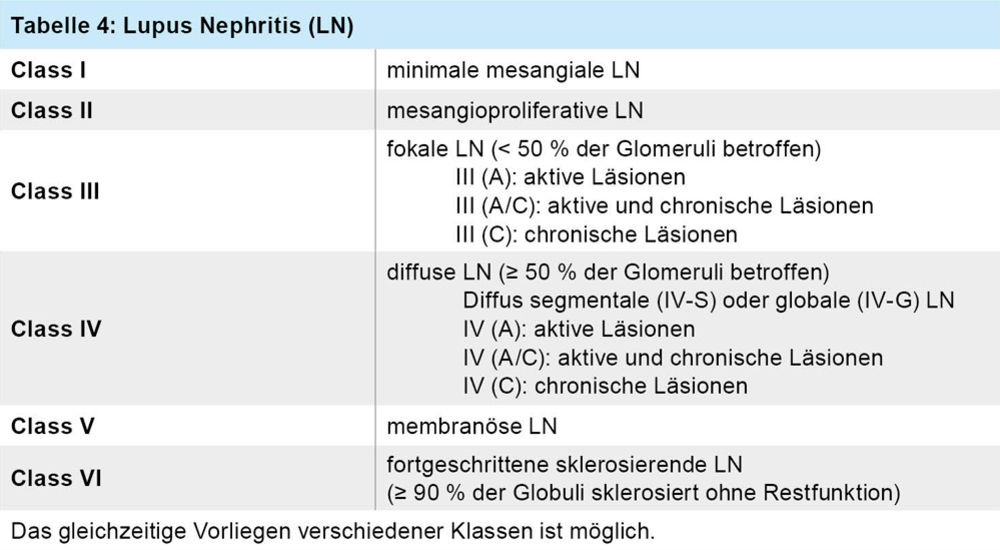
Eine 24-jährige Patientin mit der Vordiagnose eines Systemischen Lupus Erythematodes (SLE) mit Fatigue und Beteiligung von Haut und Gelenken unter gut kontrollierter Krankheitsaktivität unter Hydroxychloroquin und mit sekundärem Antiphospholipid-Syndrom mit Zustand nach tiefer Beinvenenthrombose und Dauerantikoagulation mit direkten oralen Antikoagulantien (DOAK) wird mit starken Cephalgien in die Notaufnahme eingewiesen. In der MRT nativ zeigt sich eine Thrombose des Sinus sagittalis. Die Antikoagulation mit DOAK wird beendet, die Antikoagulation wird überlappend mit niedermolekularen Heparinen (NMH) und im Anschluss mit einem Vitamin-K-Antagonist weitergeführt. Im Kontroll-MRT nach sechs Monaten zeigt sich eine vollständige Rückbildung des Thrombus. Vier Monate später fällt in der Routinekontrolle eine bis dahin nicht bekannte, leichtgradige Proteinurie von 234 mg in 24 Stunden mit überwiegender Albuminurie und im Urin-Sediment eine minimale Hämaturie mit fünf Erythrozyten pro Gesichtsfeld, allerdings mit zwei Akanthozyten, auf. Das Kreatinin liegt mit 0,9 mg/dl im Normbereich, die errechnete GFR mit 124 ml/min/1,73 m2 im alterserwarteten Bereich. Aufgrund des Befundes wird die Indikation zur Nierenbiopsie gestellt, in der sich in 40 Prozent der untersuchten Glomeruli eine extrakapillär proliferierende Glomerulonephritis und in der Immunhistochemie ein „Full-house-pattern“ mit Ablagerungen von IgG, IgM, IgA, C3 und C1q zeigt. Bei Diagnose einer Klasse III-Glomerulonephritis (Tabelle 4) bei SLE wurde eine Therapie mit Mycophenolat Mofetil einschleichend mit einer Ziel-Tagesdosis von 3 g und mit Prednisolon 1 mg pro kg Körpergewicht in absteigender Dosis begonnen. Weiterhin wurde eine Therapie mit Belimumab s. c. begonnen. Die Einnahme von Hydroxychloroquin und die Antikoagulation werden weitergeführt. Durch zahlreiche ausführliche Gespräche kann erreicht werden, dass die Patientin die Therapie einnimmt, bzw. appliziert.
Diskussion
Seit der Zulassung des BLyS-Antagonisten Belimumab 2011 als Add-on-Therapie zur Standardtherapie des Systemischen Lupus vergingen über zehn Jahre bis zu weiteren Zulassungen in dieser Indikation. 2017 wurde durch Änderung der Arzneimittelrichtlinie durch den Gemeinsamen Bundesausschuss dem Einsatz von Mycophenolat-Mofetil (MMF) in der Induktions- und Erhaltungstherapie der Lupus-Nephritis zugestimmt, obwohl aufgrund von Verfehlen der von der U. S. Food and Drug Administration geforderten Überlegenheit in Vergleich zu Cyclophosphamid, und im Weiteren aufgrund des auslaufenden Patentschutzes, keine Zulassung erreicht wurde. 2021 erhielt Belimumab auf der Grundlage der 2020 publizierten BLYSS-LN-Studie die zusätzliche Zulassung zur Behandlung der aktiven Lupus-Nephritis bei erwachsenen Patienten, zusätzlich zur Standardtherapie. 2022 wurde der Interferon 1-Rezeptor Antagonist Anifrolumab (Saphnelo®) als Add-on-Therapie zur Behandlung von erwachsenen Patienten mit moderatem bis schwerem aktiven Autoantikörper-positivem Systemischem Lupus, die bereits eine Standardtherapie erhalten, zugelassen. Ebenfalls 2022 wurde dem Calcineurin-Inhibitor Voclosporin (Lupkynis®) auf dem Boden der AURORA-1-Studie durch die EMA die Zulassung für die Behandlung von Patienten mit aktiver Lupus-Nephritis der Klassen III, IV oder V einschließlich gemischter Klassen erteilt, allerdings ausschließlich in Kombination mit Mycophenolat-Mofetil. Die Besonderheit von Voclosporin besteht in einer Modifikation der Struktur, durch die eine zuverlässigere Pharmakokinetik erreicht wird, sodass im Gegensatz zu den Calcineurin-Inhibitoren Ciclosporin und Tacrolimus ein Monitoring nicht erforderlich ist.
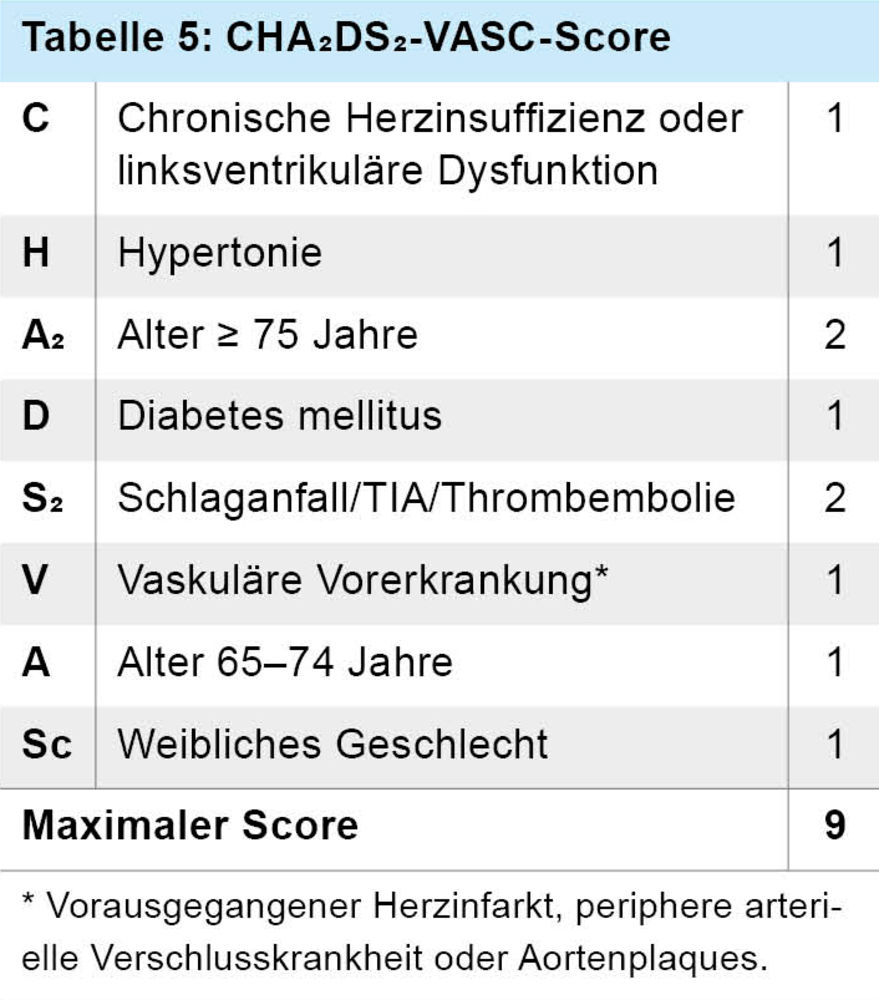
Eine Bewertung der neu zugelassenen Substanzen in Leitlinien steht aus. Insgesamt bleibt jedoch bei den meisten Patienten die Notwendigkeit einer Kombination mehrerer Substanzen erhalten. Das Therapieziel des Systemischen Lupus ist, ähnlich wie bei der rheumatoiden Arthritis die Remission oder die geringstmögliche Krankheitsaktivität, die mit der geringstmöglichen Dosis an Glukokortikoiden erzielt werden kann, weiterhin die Verhinderung von Krankheitsschüben. Dem ehrgeizigen Therapieziel stehen das beschriebene Armamentarium an zugelassenen Substanzen und weitere immunmodulierende Substanzen, wie zum Beispiel Azatioprin oder Methotrexat, gegenüber. Die Reduktion oder gar der Verzicht auf Glukokortikoide gewinnt aufgrund des Kollektivs, das zu einem großen Teil aus jungen Frauen besteht, immer mehr an Bedeutung. Häufig wird gerade aufgrund des jungen, überwiegend weiblichen Kollektivs das erhöhte kardiovaskuläre Risiko nur unzureichend beachtet. Erschwerend kommt hinzu, dass in den gängigen Scores zur Abschätzung des kardiovaskulären Risikos, beispielsweise dem CHA2DS2-VASc-Score (siehe Tabelle 5), das spezifische kardiovaskuläre Risiko von Patienten mit rheumatologischen Erkrankungen, wie dem SLE oder Vaskulitiden, nicht abgebildet wird. Die Einnahme von Hydroxychloroquin ist mit einer Verminderung des kardiovaskulären Risikos, aber auch einer Verminderung der Rate an Infekten und an thromboembolischen Ereignissen bei SLE-Patienten verbunden, sodass Hydroxychloroquin für alle SLE-Patienten empfohlen wird. An bisher experimentellen Therapien, die sich aktuell in der klinischen Erprobung befinden, sind unter anderem der anti-CD20-Antikörper Obinutuzumab und der aus der Hämatologie entlehnte anti-CD38-Antikörper Daratumumab zu nennen. Bahnbrechend war die weltweit erstmalige erfolgreiche Anwendung der CAR-T-Zell-Therapie bei einer Patientin mit schwerstem, therapierefraktärem SLE mit einer seither medikamentenfreien Remission durch das Deutsche Zentrum für Immuntherapie der Universitätsklinik Erlangen. Mittlerweile wurden durch das Zentrum 14 Patienten nicht nur mit SLE, sondern auch mit Systemsklerose und Dermatomyositis erfolgreich mit einem sehr günstigen Nebenwirkungsprofil therapiert (DGRh 2023), sodass die CAR-T-Zell-Therapie bei Autoimmunerkrankungen bei selektierten Patienten in der Zukunft eine Therapieoption darstellen könnte.
Die Gesamtheit der Evidenz der vergangenen Jahre spricht weiterhin gegen eine ausreichende Wirksamkeit der Direkten Oralen Antikoagulantien (DOAK) bei Antiphosphlipid-Syndrom (APS), sodass insbesondere bei APS-Patienten mit hohem Risiko für thromboembolische Ereignisse eine alternative Antikoagulation (Vitamin-K-Antagonisten, niedermolekulare Heparine) erfolgen sollte.
Eine weitere bahnbrechende Entdeckung der vergangenen Jahre ist die Beschreibung der Rolle des Komplement-Systems in der Pathogenese der ANCA-assoziierten Vaskulitis (AAV) und der irreführend als „pauciimmun“ bezeichneten Glomerulonephritis bei AAV. Durch die Blockade des Rezeptors für den aktivierten Komplementfaktor 5 (C5a) durch den 2022 zugelassenen Wirkstoff Avacopan (Tavneos®) wird die Interaktion des Rezeptors mit dem C5a, das unter anderem als Anaphylatoxin und Chemoattraktant für Neutrophile wirkt, blockiert. Avacopan ist zugelassen für die Behandlung der schweren aktiven Granulomatose mit Polyangiitis (GPA) oder mikroskopische Polyangiitis (MPA) in Kombination mit einer Rituximab- oder Cyclophosphamid-basierten Induktionstherapie. Durch die Therapie mit Avacopan ist eine deutliche Reduktion der kumulativen Glukokortikoiddosis im Rahmen der Behandlung möglich.
Fall 3: Neue Krankheitsbilder – Vexas-Syndrom und IgG4 assoziierte Erkrankung
Ein 72 Jahre alter Patient mit der Vordiagnose einer seronegativen rheumatoiden Arthritis wird stationär eingewiesen. Die initiale Therapie mit Methotrexat wurde nach sechs Monaten beendet, da trotz Dosissteigerung keine vollständige Beschwerdefreiheit erreicht werden konnte. Außerdem traten unter gesteigerter Dosis erhöhte Transaminasen auf das sechsfache des oberen Normbereiches und eine makrozytäre Anämie mit einer Hämoglobin-Konzentration von 9,4 g/dl auf. Auch unter der in der Folge begonnenen Therapie mit einem TNF-Inhibitor zeigt sich die Arthritis weiterhin aktiv, es treten wiederholt subfebrile Temperaturen auf, das CRP liegt unter Prednisolon 10 mg/d bei 4,3 mg/dl (Norm bis 0,5 mg/dl). Aufgrund der Anämie werden die Werte des Eisenhaushaltes bestimmt, wobei sich ein deutlich überhöhtes Ferritin von 1.580 µg/l (Norm 13 bis 150 µg/l) zeigt. Aufgrund der klinischen Symptomatik und der makrozytären Anämie mit einem MCV von 106 fl wird eine Knochenmarkbiopsie durchgeführt, in der sich ein hyperzelluläres Knochenmark ohne Hinweis auf eine Leukämie oder ein Lymphom zeigt. Jedoch werden auffällige Vakuolisierungen von Proerythroblasten und Promyelozyten beschrieben. Nach Ausschluss anderer Ursachen für diesen Befund wird der Verdacht auf ein VEXAS-Syndrom gestellt und eine genetische Untersuchung durchgeführt, die den Befund bestätigt. Die Therapie wird auf einen Interleukin-1-Antagonisten umgestellt, worunter es zunächst zu einer deutlichen Verbesserung des Zustandes des Patienten kommt.
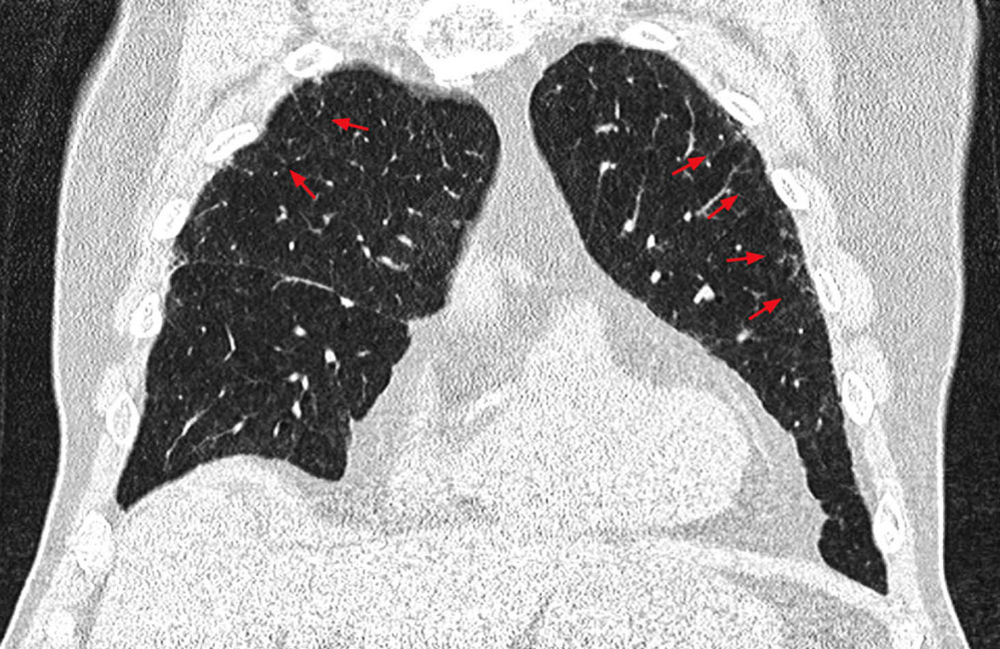
Abbildung 2: Beginnende rA-ILD bei 79-jährigem Patienten mit seropositiver rheumatoider Arthritis unter Therapie mit Methotrexat und Abatacept.
Diskussion
Die zunehmenden Möglichkeiten der genetischen Diagnostik in Verbindung mit Grundlagen- und klinischer Forschung führen zunehmend zu einem neuen Verständnis von rheumatologischen Erkrankungen. Krankheitsbilder, die in der Vergangenheit aufgrund klinischer Ähnlichkeiten unter Sammelbegriffen zusammengefasst wurden, können präziser definiert und voneinander abgegrenzt werden, es kommt zur Definition neuer Entitäten. Ein Beispiel für die Entdeckung und Definition einer bis dahin nicht erkannten Erkrankung auf dem Boden genetischer Analysen ist das 2020 erstbeschriebene VEXAS-Syndrom. Wie aus dem Akrynom hervorgeht (Vakuolen, E1-Enzym, X-linked, autoinflammatorisch, somatisch), wird das VEXAS-Syndrom zu den autoinflammatorischen Erkrankungen gezählt, die ohne Vermittlung eines Antigens zu Inflammation führen können, beispielsweise über Aktivierung des Inflammasoms mit Interleukin-1-Aktivierung und andere Mechanismen. Im Fall des VEXAS-Syndroms liegt eine erworbene somatische Mutation des UBA1-Gens mit verminderter Ubiquitinierung von Proteinen und hierdurch vermittelter Aktivierung von Signalwegen des angeborenen Immunsystems vor. Es unterscheidet sich von anderen autoinflammatorischen Erkrankungen durch das hohe mediane Manifestationsalter von 64 Jahren und der fast ausschließlichen Beteiligung von Männern. Andere prominente Vertreter autoinflammatorischer Erkrankungen sind das Familiäre Mittelmeerfieber, der Morbus Still oder die Cryopyrin-assoziierten periodischen Fiebersyndrome, wobei sich letztere vor allem im Kindesalter manifestieren. Es handelt sich um Multisystemerkrankungen mit ausgeprägter entzündlicher Konstellation und häufiger Beteiligung von Gelenken, Haut und dem blutbildenden System, weswegen es häufig zu Verwechslungen mit anderen rheumatologischen Erkrankungen kommen kann. Die autoinflammatorischen Erkrankungen benötigen häufig andere Therapieformen wie die klassischen Autoimmunerkrankungen. Bei Nichtansprechen immunmodulierender Therapien oder unklaren entzündlichen Krankheitsbildern sollte daher auch im Erwachsenenalter immer an autoinflammatorische oder genetisch determinierte Erkrankungen gedacht werden und eine gründliche klinische Aufarbeitung und bei begründetem Verdacht auch eine genetische Diagnostik erfolgen.
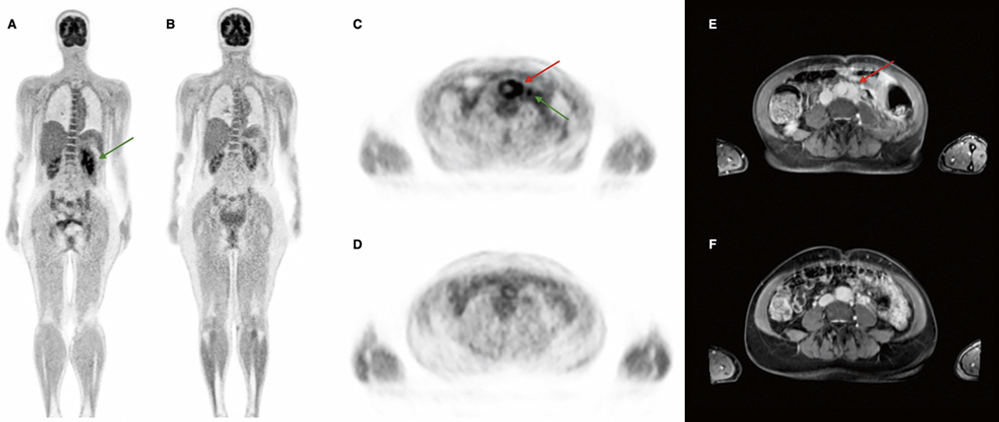
Abbildung 3: PET-MRT bei retroperitonealer Fibrose mit IgG4-assoziierter Erkrankung. In der sagittalen Darstellung Tracer-Mehrbelegung um die infrarenale Aorta unter Einbezug des linken Ureters (C), in der koronaren Darstellung Mehrbelegung der linken Niere bei Harnstau.In der sagittalen Darstellung in der MRT korrespondierend eine Gewebsvermehrung um die infrarenale Aorta unter Einbezug des linken Ureters.
Ein Beispiel für die Definition einer neu etablierten Krankheitsentität, in der mehrere bisher pathogenetisch unklare Erkrankungen mit ähnlichen klinischen und histologischen Charakteristika zusammengefasst werden konnten, ist die IgG4-assoziierte Erkrankung. Es handelt sich um eine polyklonale Aktivierung von IgG4-positiven Plasmazellen mit Tropismus für verschiedene Gewebe, die zu einer Entzündung mit Ausbildung einer charakteristischen Fibrose führt. Unter anderem kann sich eine retroperitoneale Fibrose (M. Ormond) im Rahmen einer IgG4-assoziierten Erkrankung manifestieren, es können aber zahlreiche andere Organe betroffen sein, sodass die IgG4-assoziierte Erkrankung eine wichtige Differenzialdiagnose zu den übrigen rheumatologischen Systemerkrankungen darstellt.
Der Autor erklärt, dass er keine finanziellen oder persönlichen Beziehungen zu Dritten hat, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Glossar
AAV: ANCA-assoziierte Vaskulitis
BAFF: B-cell activating factor (Synonym zu BLyS)
BICLA: British Isles Lupus Assessment Group (BILAG) – based Composite Lupus Assessment
BLyS: B-Lymphocate Stimulator (Synonym zu BAFF)
CAR: chimeric antigen receptor
DAS28: Disease Activity Score – Instrument zur Bestimmung der Aktivität der rheumatoiden Arthritis mit Untersuchung von 28 Gelenken und Beurteilung hinsichtlich Druckschmerzhaftigkeit und Schwellung, Entzündungsparameter (CRP oder BSG), Einschätzung der Krankheitsaktivität durch den Patienten auf einer visuell-analogen Skala.
DGRh: Deutsche Gesellschaft für Rheumatologie
DOAK: Direkte orale Antikoagulantien
EMA: European Medical Agency, Europäische Arzneimittel-Agentur
EULAR: European League against Rheumatism, neuer European Alliance of Associations for Rheumatology
GPA: Granulomatose mit Polyangiitis
IL: Interleukin
ILD: Interstitielle Lungenerkrankung
JAKI: Janus-Kinase-Inhibitor
LN: Lupus Nephritis
MACE: Major adverse cardiovascular events
MMF: Mycophenolat Mofetil
MPA: Mikroskopische Polyangiitis
NMH: Niedermolekulare Heparine
PPF: Progredient Progressive Fibrose (der Lunge)
PMR: Polymyalgia rheumatica
SLE: Systemischer Lupus Erythematodes
TNF: Tumor-Nekrose-Faktor alpha
UFH: Unfraktionierte Heparine
Autor
Privatdozent Dr. Klaus Thürmel
Nephrologe/Rheumatologe
Chefarzt Nephrologie und Rheumatologie, Augustinum Klinik München, Wolkerweg 16, 81375 München
Teilen:
Das könnte Sie auch interessieren: