Neu in der Neurochirurgie
 Neu in der Neurochirurgie
Neu in der Neurochirurgie
Dem rasanten technologischen Wandel und dem Fortschritt von Forschung und Entwicklung, sind die steten Verbesserungen der neuroonkologischen Versorgung, innerhalb der vergangenen Jahre zu verdanken. Als ein bedeutender Teil des neurochirurgischen Fachbereichs werden im Folgenden drei Kasuistiken beispielhaft für Neuerungen in der neuroonkologischen Therapie diskutiert. Anhand dieser soll die Relevanz der interdisziplinären Behandlung als eine Säule der gegenwärtigen medizinischen Versorgung herausgestellt werden. Hierzu gehört die Versorgung in multidisziplinären, neuroonkologischen oder entsprechend der Fragestellung auch in Schädelbasis-Zentren sowie jeweils die Fallbesprechung in einem Board vor Einleitung einer Therapie.
Fall 1
Bei einer 32-jährigen Primipara, hatte ein Ultraschall des Fötus den Verdacht auf einen Gehirntumor erbracht. Ein pränatales MRT des Kindes, hatte daraufhin den Nachweis eines großen intra- und extrakraniell wachsenden Schädelbasis-Tumors mit Ausdehnung durch das Keilbein und den Gaumen bis in den Oropharynx ergeben. In der 36 + 5 Schwangerschaftswoche erfolgte die primäre Sectio eines Jungen mit einem Geburtsgewicht von 2.300 g. Im Rahmen eines „Ex-utero-intrapartum-treatment“ (EXIT) Prozedere erfolgte umgehend peripartal (noch während der Entbindung und noch an der Nabelschnur) die orale Intubation des Säuglings sowie im Anschluss die perorale Entlastung von flüssigen Tumoranteilen mit nasaler Umintubation, bevor die operative Versorgung des oralen Tumoranteils durch Exzision erfolgen konnte. Die postpartale MRT zeigte den großen Schädelbasistumor mit Verdrängung der Umgebungsstrukturen intrakraniell (Nn. Optici, Chiasma und Neurohypophyse) und noch verbliebenem oropharyngealen Tumoranteil.
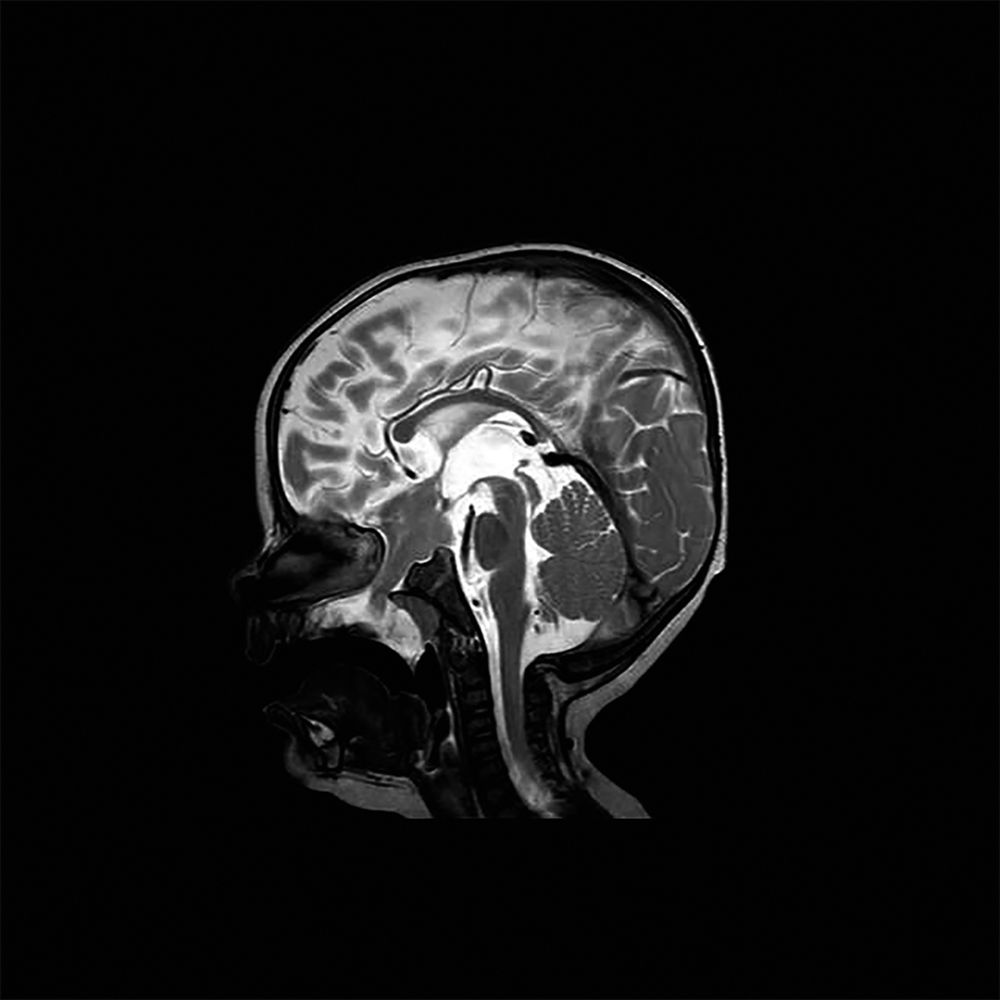
Abbildung 1: Postpartales MRT in saggital T2-Wichtung. Nachweis eines großen Schädelbasis-Tumors mit Ausdehnung durch das Keilbein und den Gaumen bis in den Oropharynx.
Die neuropathologische Untersuchung bestätigte ein reifes Teratom, sogenannter Epignathus. Nach sukzessivem, apparativem Weaning und regelrechter Entwicklung konnte das Kind mit Trinkplatte zum funktionellen Verschluss des Gaumens nach Hause entlassen werden. Intermittierend war bei noch bestandener Pharyngomalazie eine NIV-CPAP (Non invasive Ventilation-Positive Airway Pressure) Beatmung und eine additive enterale Ernährung per Magensonde nötig. Zudem erfolgte bei zentralem Hypocortisolismus eine Substitution. Der junge Patient entwickelte im Verlauf wiederholt Meningitiden, weswegen im Alter von neun Monaten zunächst der enorale Tumoranteil reseziert und die Gaumenspalte mund-kiefer-gesichtschirurgisch verschlossen wurde. Vier Wochen später konnte dann über eine transnasale Endoskopie der intrakranielle Tumoranteil reseziert werden.
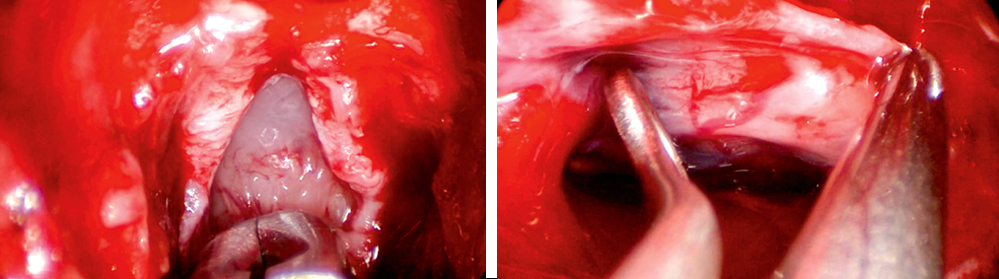
Intraoperative, endoskopisch transsphenoidale Darstellung: Abbildung 2 (links) eröffnete Dura mata mit darunter zum Vorschein tretendem Tumor durch Zug mit der Fasszange. Abbildung 3 (rechts) Blick in die Sella turcica mit der rechten Arteria carotis (links im Bildrand) und einer Kürette zwischen Arterie und Tumorgewebe.
Der operative Korridor über die Schädel-Basis, transplanum-/transtuberculum sphenoidale, wurde intraoperativ mittels Fascia lata abgedeckt und es wurde eine lumbale Liquordrainage zur Sicherstellung der Wundheilung angelegt. Nach Gonzalez-Crussi werden reife Teratome (G0) von unreifen Teratomen (G1 bis G3) unterschieden. Je weniger differenziert (bzw. reif) ein Teratom ist, desto höher ist die Graduierung und umso ungünstiger ist die Prognose der Erkrankung [1]. Bei dem hier beschriebenen Epignathus handelt es sich um einen Grad-0-Tumor ohne erhöhtes Risiko für einen Tumorprogress, weswegen ein postoperativ verbliebener kleiner Tumorrest von 6 mm belassen und verlaufskontrolliert wurde.
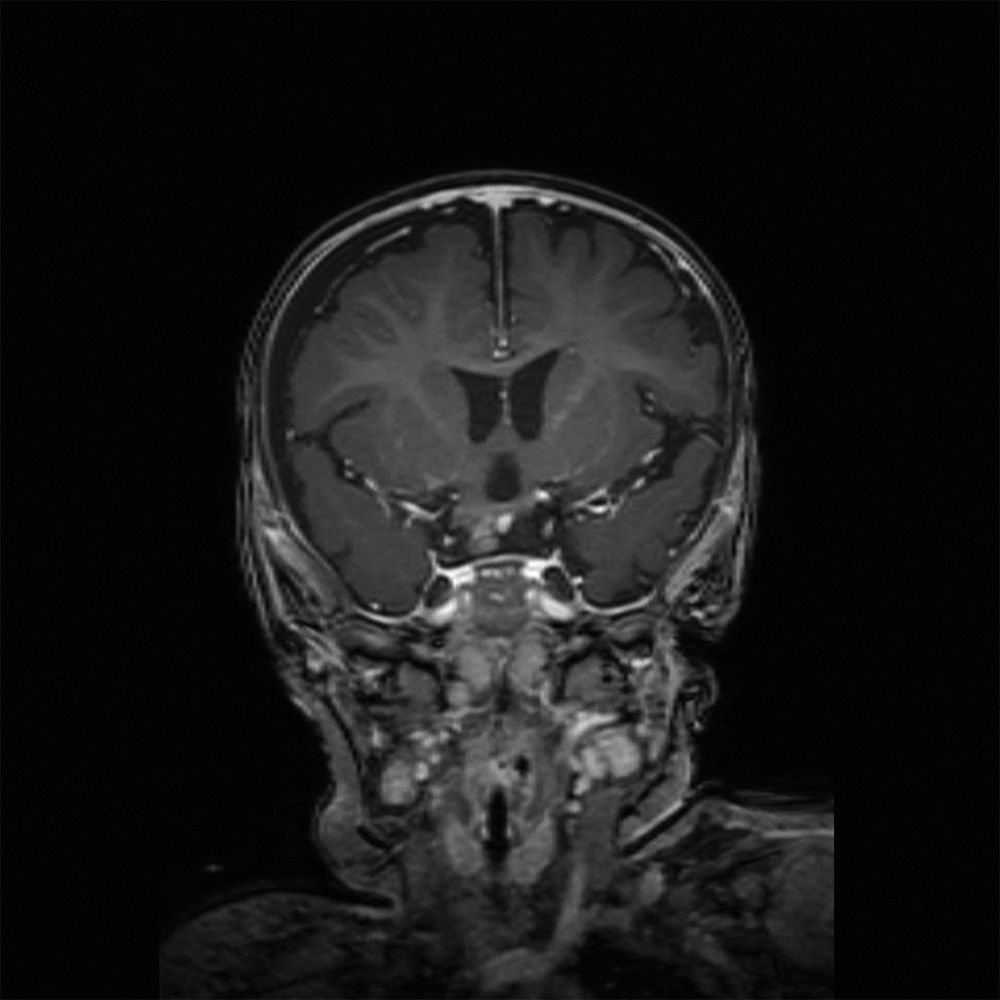 Abbildung 4: Postoperatives MRT in coronarer T1-Wichtung mit Kontrastmittel, Darstellung des geringen Resttumors rechts unterhalb des Chiasmas.
Abbildung 4: Postoperatives MRT in coronarer T1-Wichtung mit Kontrastmittel, Darstellung des geringen Resttumors rechts unterhalb des Chiasmas.
Fortan entwickelte sich das Kind erfreulicherweise regelhaft, es zeigten sich keine Auffälligkeiten bis es im Alter von 21 Monaten erneut zu einer Meningitis kam. Die erneute MRT des Schädels konnte die Formierung eines liqourgefüllten Blindsacks im Bereich der vormals angelegten Schädel-Basis-Rekonstruktion mit Vorwölben in den Nasopharynx zeigen, sodass eine endoskopische Revisionsoperation mit erneuter Abdeckung über eine Fettplombe erfolgte. Seither kam es zu keinen erneuten Liquorinfekten mehr, der Resttumor zeigt sich größenstabil und auch die Hypophysenfunktion sowie das Sehvermögen ergaben zuletzt stabile Befunde.
Diskussion
Tumore der Schädelbasis stellen aufgrund ihrer häufig tiefen Lage am knöchernen Schädel und deren engen räumlichen Beziehung zu wesentlichen nervalen-, vaskulären-, neuroendokrinen- und ZNS-Strukturen eine besondere chirurgische Herausforderung dar. Durch die bereits Anfang des vergangenen Jahrhunderts entstandene Möglichkeit, Operationen unter Mikroskopie durchzuführen, konnte der Erfolg der neurochirurgischen Versorgung stets vorangetrieben werden. Operationsmikroskope ermöglichen mittlerweile eine ausgezeichnete Tiefenschärfe bei gleichzeitiger Visualisierung verschiedenster anatomischer und funktioneller Bilddatensätze. Eine wesentliche Limitation der Mikrochirurgie ist jedoch die Betrachtung von tief gelegenen Strukturen in unterschiedlichen Winkeln, insbesondere wenn dies über einen engen operativen Korridor erfolgt. Das Streben der modernen Chirurgie nach minimalinvasiven Behandlungen zur bestmöglichen Gewebsschonung hat innerhalb der letzten Dekaden die zunehmende Verwendung endoskopischer Techniken gefördert. Neben dem Vorteil der Verwendung von natürlichen Körperöffnungen (entgegen der Alternative einer Schädeltrepanation) ergeben sich Vorteile wie die direkte und verbesserte Visualisierung von Pathologien in der Tiefe und in unterschiedlichen Blickwinkeln sowie einem geringeren „Flurschaden“. Insbesondere bei Tumoren der mittleren Schädelbasis, also im Bereich der sella turcica, sowie supra- und parasellär daran angrenzend konnten in der adulten Population regelmäßig vollständige Tumorresektionen der meist gutartigen Läsionen ohne Schädigung des Nachbargewebes gezeigt werden. Aufgrund der niedrigen Prävalenz von kindlichen Schädelbasistumoren, vorrangig jedoch aufgrund der besonderen anatomischen Verhältnisse bei Kindern, wurden erst in den vergangenen Jahren Daten über die endoskopische Resektion von Schädelbasistumoren in der pädiatrischen Population veröffentlicht. Galten doch bislang der enge operative Korridor durch zum Beispiel kleine Nasenlöcher, die fehlende Pneumatisation der Nasennebenhöhlen, oder die Herausforderungen bei Rekonstruktion der Schädelbasis zur Vermeidung einer Liquorfistel als operative Limitation [2, 3, 4].
Zentraler Schädelbasistumor
Der hier vorgestellte Fall zeigt anhand einer seltenen Tumorentität die häufigen Herausforderungen bei der Behandlung von Tumoren der zentralen Schädelbasis, die sowohl bei Erwachsenen, aber auch bei Kindern auftreten können. Häufige Tumore der zentralen Schädelbasis im Erwachsenenalter, welche zudem einer endoskopischen Resektion sehr gut zugänglich sind, betreffen in erster Linie die Hypophysenadenome. Weitere Tumore der Sella- und Suprasellärregion, welche heutzutage regelhaft transnasal endoskopisch reseziert werden können, sind unter anderem Meningeome, Kraniopharyngeome und Chordome [5, 6]. Kindliche Tumoren der Schädelbasis zeigen altersabhängig unterschiedliche Inzidenzen. Neben den oben genannten Entitäten treten bei pädiatrischen Patienten zudem, wie in der beschriebenen Kasuistik dargestellt, vermehrt Keimzelltumore auf [6, 7]. Aufgrund der Lage im Bereich der zentralen Schädelbasis besteht durch oben genannte Tumore vor allem das Risiko einer Schädigung des optischen Systems durch Druck auf einen oder beide Sehnerven, das Chiasma (mit dem typischen Bild der bitemporalen Hemianospsie) oder selten den Tractus opticus. Darüber hinaus können Augenbewegungsstörungen, Taubheiten oder sogar Schmerzen im Gesicht durch das Einwachsen oder die Kompression von Tumorgewebe auf die Hirnnerven im Sinus cavernosus entstehen. Eine relevante Stenosierung der vaskulären Strukturen stellt zwar eine Ausnahme dar, kann bei Meningeomen jedoch zu einer Einengung der Arteria carotis im Sinus cavernosus oder bei einer suprasellären Tumorausdehnung zur Okklusion der abgehenden Gefäße des Circulus Willisii oder dessen selbst führen. Während bei der suprasellären Tumorausdehnung auch das Risiko für Schäden der angrenzenden ZNS-Strukturen, wie des Hypothalamus, vorliegt, führt das Wachstum innerhalb der Sella zu endokrinen Störungen durch Schädigung des Hypophysenstiels, der Adeno- und Neurohypophyse. Der Vorteil der transsphenoidalen, endoskopischen Operation ist die Darstellung der Tumore und deren Nachbarstrukturen von der Schädelbasis und somit von unten. Häufig gelingt durch den direkten Blick auf den Tumor zunächst eine Reduktion dieses mit Entlastung der oben genannten fragilen Schädelbasis-Strukturen und hierdurch eine schonendere und sicherere Resektion. Wie im beschriebenen Fall dargestellt, bedarf die Schädelbasisabdeckung und Duraplastik bei Eröffnung der Liquorräume einer besonderen Sorgfalt, da die Keimlast der Nasennebenhöhlen in Kombination mit der Schwerkraft ein erhöhtes Risiko für eine Liquorinfektion darstellt. Dennoch besteht in den Händen erfahrener Schädelbasischirurgen durch eine mehrschichtige Abdeckung des operativen Zugangs in Kombination mit der Anlage einer lumbalen Liquordrainage ein nur geringes Risiko für eine persistierende Liquorfistel [3].
Fall 2
Eine 53-jährige, bislang vollkommen gesunde, sportlich aktive Patientin stellte sich aufgrund einer anhaltenden Schwindelsymptomatik in einer externen Klinik vor. Die auswertige Schädel MRT hatte in den flüssigkeitsgewichteten Sequenzen (T2: MRT-Sequenz, bei der sich Wasser und Fett signalreich darstellen; FLAIR: Spezielle MRT-Sequenz welche durch Unterdrückung des Signals freier Flüssigkeit, gewebsgebundene Flüssigkeit kontrastreich abhebt) eine Läsion links frontal mit einem Durchmesser von 3 cm ohne Kontrastmittelaufnahme gezeigt. Die Patientin (Rechtshänderin) stellte sich daraufhin in unserer Klinik zur weiteren Beratung vor. Wir sahen eine gesunde, neurologisch unauffällige und beschwerdefreie Patientin ohne Hinweis auf stattgehabte, epileptische Anfälle oder Hinweis auf Sprach-/Sprechstörungen. Die Patientin war wach, orientiert, hatte keine Hirnnervendefizite und keine Fokalneurologie. Zur genaueren diagnostischen Eingrenzung der Läsion erfolgte eine 18F-Fluor-Ethyl-Tyrosin (FET)-Positronen-Emissionstomographie (PET) Untersuchung des Schädels. Typisch für einen niedrigmalignen astrozytären Tumor zeigte sich eine Tracer-Mehrbelegung in der MRT-suspekten Region links frontal. Entsprechend dem Tumorboardbeschluss, erfolgte zur operativen Planung eine Untersuchung zur Kartierung der kortikalen Sprachfunktion über eine navigierte transkranielle Magnetstimulation. Anhand der Resultate dieser (funktionelle Sprachareale waren dorsal und caudal an den Tumorrand angrenzend) wurde entschieden, die Operation samt Tumorresektion im Wachzustand zur kontinuierlichen Überwachung der Sprachfunktion bei der Patientin durchzuführen. 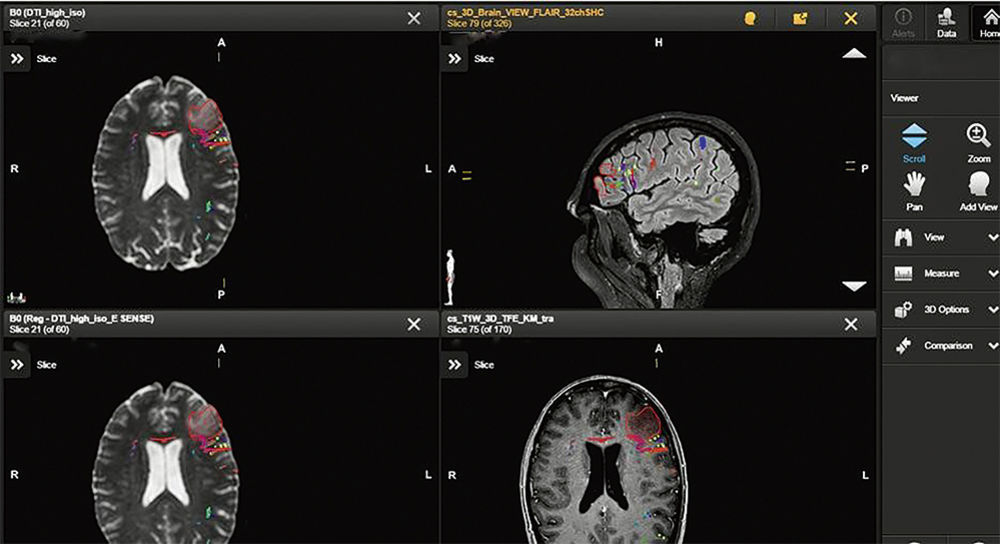
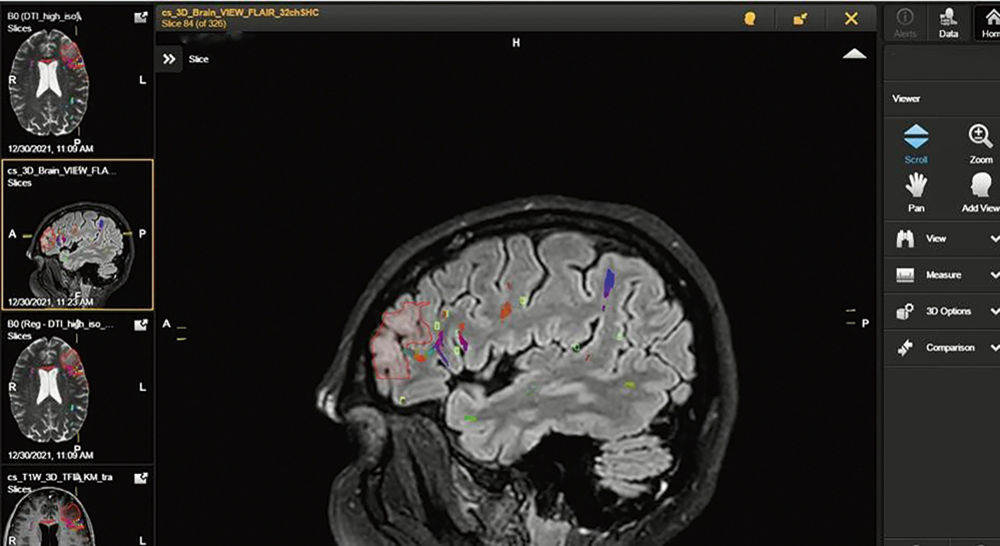 Abbildung 5 und 6: Darstellung der zusammengeführten Bilddatensätze zur intraoperativen Visualisierung und Navigation. Das Tumorareal aus den kombinierten Bilddaten von MRT und FET-PET rot umrandet. Funktionelle Daten aus der transkraniellen Magnetstimulation zeigen in grüner Umrandung Sprachareale dorsal an den Tumor angrenzend. Faserbahnen (DTI) sind zudem Bunt dargestellt.
Abbildung 5 und 6: Darstellung der zusammengeführten Bilddatensätze zur intraoperativen Visualisierung und Navigation. Das Tumorareal aus den kombinierten Bilddaten von MRT und FET-PET rot umrandet. Funktionelle Daten aus der transkraniellen Magnetstimulation zeigen in grüner Umrandung Sprachareale dorsal an den Tumor angrenzend. Faserbahnen (DTI) sind zudem Bunt dargestellt.
Unter Wachbedingungen und einem intraoperativen, neurophysiologischen Monitoring samt Sprachmapping, konnte eine Komplettresektion des Tumors erreicht werden, ohne ein neurologisches Defizit bei der Patientin hervorzurufen. Die neuropathologische Gewebsdiagnose ergab ein Oligodendrogliom, IDH mutiert, 1p/19q kodeletiert (hierbei handelt es sich um spezifische Marker einer molekularpathologischen Untersuchung, welche für die Subtypisierung der Gliome wichtige Hinweise geben, sowie therapeutische und prognostische Bedeutung haben) weswegen die Patientin einer Radiochemotherapie (Hochpräzisionsstrahlentherapie und sechs Zyklen Procarbazin, Chlorethyl-Cyclohexyl-Nitroso-Urea [CCNU] und Vincristin) zugeführt wurde. Die Patientin hat sich vollständig erholt und ist aktuell tumorfrei.
Diskussion
Bei Wachoperationen wird im Wesentlichen zwischen der Asleep-Awake-Asleep und der Asleep-Awake-Awake geführten Narkose unterschieden, wobei alternativ auch eine leichte kontinuierliche Sedierung erwogen werden kann. Nachteil der letztgenannten Methode ist die meist reduzierte Kooperation der Patienten, weswegen diese aus neurochirurgischer Sicht als ungünstig beurteilt wird. Bei allen Formen der Narkoseführung wird eine örtliche Betäubung der sensiblen Hautäste (gegebenenfalls mit oder ohne Lokalanästhesie des Hautschnittes) über eine Leitungsanästhesie (sogenannter Skalp-Block) der großen Occipital-, Temporal- und Supraorbital-Nerven mit einem langwirksamen Lokalanästhetikum (Ropivacain) durchgeführt. Für den Fall einer Narkoseeinleitung erfolgt die Initiierung mit einem extrem kurzwirksamen Opioid (Remifentanil) und einem kurzwirksamen Hypnotikum (Propofol) mit anschließender Platzierung einer Larynxmaske. Zudem erfolgt zur Anfalls-Prophylaxe die Applikation eines Antikonvulsivums (Phenytoin). Nachdem der operative Zugang beim analgosedierten Patienten erfolgt ist, wird dieser langsam aus der Narkose erweckt und die Beatmungsmaske entfernt. Sofern der Patient ausreichend wach ist und dies gut toleriert, erfolgt die Kartierung der Sprachfunktion auf der Gehirnoberfläche. Hierzu erfolgte die kontinuierliche Beurteilung der Sprachfunktion durch eine festgelegte Testbatterie, wobei diese von einer einfachen Benennleistung bis zu neuropsychologischen Tests reichen kann. Während der funktionellen Testung erfolgt die Kortexstimulation mit einem (schmerzlosen) Niedrigstrom-Impuls, welcher im Falle der Affektion eines Sprachareals zum Beispiel zu einem Spracharrest führt. Anhand der für die Sprach-/Sprechleistung relevanten Kortexbereiche kann nun der Gewebszugang und die Tumorresektion erfolgen. Auch die Resektion erfolgt unter kontinuierlicher Fortführung der funktionellen Testung. Während die Narkose nach Abschluss der Resektion wieder vertieft werden kann „Asleep-Awake-Asleep“, besteht auch die Möglichkeit des vollständigen operativen Verschlusses unter Wachbedingungen „Asleep-Awake-Awake“.
Operative Gliomtherapie
Die Behandlung von Gliomen, also hirneigenen Tumoren, ist ebenso wie die anderer Tumorerkrankungen einer fortwährenden Entwicklung unterlegen. So ist die Verlängerung des gesamt- und progressionsfreien Überlebens auf eine Verbesserung der onkologischen Behandlung im Sinne einer, an die Tumor-Subtypen adaptierten Radio- und Chemotherapie zurückzuführen. Als integraler Bestandteil der Neuroonkologie haben zudem Neuerungen in der chirurgischen Behandlung wesentlich zur Verbesserung des Therapieerfolges und der Lebensqualität beigetragen. Das Ziel der vollständigen Entfernung des mittels MRT dargestellten Tumoranteils bei gleichzeitiger Schonung der eloquenten Gehirnbereiche kann hierbei immer öfter erreicht werden. Hierbei stellt die Überwachung neurologischer Funktionen während der chirurgischen Tumorresektion einen wesentlichen Faktor der Gliom-Therapie dar und ist seit Jahrzenten etabliert. Tumore nahe sogenannter eloquenter Gehirnareale wie der Bewegungszentren werden zur Sicherstellung der funktionellen Integrität, unter Überwachung mittels eines intraoperativen neurophysiologischem Monitorings, reseziert. Hierbei erfolgt die direkte Stimulation des Motorkortexes sowie der Pyramidenbahn oder die intraoperative Ableitung von motorisch evozierten Potenzialen zur Überwachung der Muskelfunktion beim narkotisierten Patienten [8]. Seit vielen Jahren werden auch Tumorresektionen unter Wachbedingungen durchgeführt. Zum sicheren Erhalt, der Sprachfunktion können auf diese Weise für die Sprachbildung und das Sprachverständnis relevante Kortexareale identifiziert und im Rahmen der Tumorresektion geschont werden [9 bis 12]. Die Indikationen für Wachoperationen wurden ursprünglich aufgrund sehr hoher medizintechnischer Voraussetzungen, des hohen personellen und logistischen Aufwandes, einer mutmaßlich sehr hohen Belastung für den Patienten bei zudem (noch) nicht nachgewiesenem Nutzen nur sehr zurückhaltend bei einzelnen ausgewählten Patienten gestellt. Seit einigen Jahren zeigt sich jedoch die zunehmende Relativierung der Vorbehalte und eine Ausweitung dieses Verfahrens über viele neurochirurgische Zentren hinaus. Durch die Verbesserung der Narkoseführung und die ausreichende Vorbereitung der Patienten auf die Abläufe während der Operation sind viele Hirntumorpatienten offen für solch ein Therapieverfahren und zeigen während der Wachphasen der Operationen eine überwiegend sehr hohe Compliance. Zudem stellen unterschiedliche Begleiterkrankungen keine Kontraindikation mehr da und ermöglichen heutzutage auch diesen Patienten die bestmögliche operative Behandlung der Tumorerkrankung. Mittlerweile konnten Untersuchungen nicht nur einen Vorteil für das erreichte Resektionsausmaß bei vollem Funktionserhalt zeigen, sondern zudem einen Vorteil im progressionsfreien- und Gesamt-Überleben bei Patienten, welche unter Wachbedingungen operiert wurden, gegenüber Patienten die in Vollnarkose behandelt wurden [11, 13, 14]. Aus diesem Grund besteht für die Verwendung intraoperativer, neurophysiologischer Monitoring verfahren bei der Resektion von Gliomen in eloquenten Gehirnarealen Leitlinienempfehlung [15, 16].
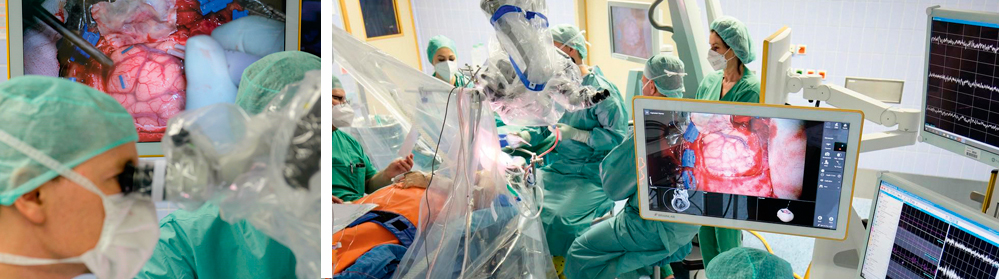 Abbildung 7 und 8: Darstellung des intraoperativen Aufbaus einer Wachoperation zur Resektion eines Glioms im Sprachareal. Abbildung 7 (links) zeigt die Kortexstimulation mit einem Niedrigstrom-Impuls (bipolare Stimulationssonde). Abbildung 8 (rechts) zeigt die funktionelle Testung des wachen Patienten über das Bennen von Strichzeichnungen (linker Bildrand), sowie zeitgleich die kontinuierliche Ableitung des neurophysiologischen Monitorings (rechter Bildrand).
Abbildung 7 und 8: Darstellung des intraoperativen Aufbaus einer Wachoperation zur Resektion eines Glioms im Sprachareal. Abbildung 7 (links) zeigt die Kortexstimulation mit einem Niedrigstrom-Impuls (bipolare Stimulationssonde). Abbildung 8 (rechts) zeigt die funktionelle Testung des wachen Patienten über das Bennen von Strichzeichnungen (linker Bildrand), sowie zeitgleich die kontinuierliche Ableitung des neurophysiologischen Monitorings (rechter Bildrand).
Fall 3
Ein 55-jähriger Patient stellte sich mit einer Halbseitenlähmung über die Notaufnahme vor. Hier berichtet er von einer Knieoperation eine Woche zuvor. Seit der Operation habe er das rechte Bein nur schlecht bewegen können, aktuell war dem Patienten zusätzlich eine Schwäche im Arm aufgefallen. Zum Zeitpunkt der Vorstellung bestand eine Plegie des rechten Beines und eine mittelgradige Schwäche des rechten Armes. Als Komorbiditäten bestand ein Hypertonus, ein medikamentös behandelter Typ-II-Diabetes, eine Hypercholesterinämie, sowie eine Rivaroxaban Dauermedikation bei zweimalig stattgehabten Lungenarterienembolien auf Grundlage einer tiefen Venenthrombose. Nach stationärer Aufnahme des Patienten erfolgte unter anderem eine kranielle MRT-Bildgebung welche eine große, girlandenförmige, kontrastmittelaufnehmende Läsion links frontoparietal im Bereich der Zentralregion zeigte. Bei hochgradigem Verdacht auf ein Glioblastom erfolgte nach Beschluss des neuroonkologischen Tumorboards die operative Resektion mittels 5-Aminolävulinsäure (5-ALA) Fluoreszenz-Darstellung (5-ALA ist eine Aminosäure, die als Metabolit des menschlichen Hämstoffwechsel entsteht. Als Medikament appliziert, reichert sich das Umbauprodukt Protoporphyrin IX verstärkt in Tumorzellen an. Durch die fluoreszierende Eigenschaft unter spezifischem Blaulicht, können Tumorgrenzen während einer Operation so deutlicher kontrastiert werden) und unter neurophysiologischem Monitoring in mikrochirurgischer Technik. Die postoperative MRT bestätigte die komplette Resektion des kontrastmittelaufnehmenden Tumoranteils. Die vorbestehende Hemiparese zeigte sich zunächst unverändert. Postoperativ erschwerend wurde, nach perioperativer Pausierung der Antikoagulation, eine zentrale Lungenarterienembolie rechts diagnostiziert. Die neuropathologische Gewebsdiagnostik bestätigte die Verdachtsdiagnose eines Glioblastoms, IDH-Wildtyp, WHO Grad IV, MGMT-Promotorstatus unmethyliert. Entsprechend der erneuten Tumorboard-Empfehlung erfolgte die stationäre, adjuvante Radio-Chemotherapie nach Stupp-Schema (Das Stupp-Schema beinhaltet eine fraktionierte Tumor-Bestrahlung über einen Zeitraum von sechs Wochen bei simultaner Einnahme eines alkylierenden Zytostatikums [Temozolomid]. Im Anschluss erfolgen weiter sechs Behandlungszyklen einer Temozolomid-Monotherapie an fünf von 28 Tagen). Zudem wurde eine Therapie mit alternierenden elektrischen Feldern (Novo Tumor Treating Field) empfohlen, welche der Patient jedoch ablehnte. Im Rahmen einer Verlaufs-MRT hatte sich der Zufallsbefund einer zerebralen Sinusvenenthrombose im linken Sinus transversus, ohne Hinweis auf ein Tumorrezidiv, dargestellt. Bei erneuter nicht richtungsweisender hämatologischer Diagnostik wurde die vorhandene Rivaroxaban-Medikation fortgeführt. Neun Monate nach der Operation erfolgte die Vorstellung des Patienten aufgrund des Verdachtes auf einen epileptischen Anfall, bei dem der Patient rhythmische, motorische Entäußerungen des rechten Armes für etwa fünf Minuten bemerkt hatte. Ohne Nachweis epilepsietypischer Potenziale in der EEG erfolgt die Einleitung einer antikonvulsiven Therapie. Der Patient war mittlerweile Selbstversorger und bis auf eine leichtgradige Unsicherheit im Bein rechts, zeigte sich die vorbestehende Hemiparese vollständig rückläufig. Eine erneute MRT zeigte die Sinusvenenthrombose im kurzfristigen Verlauf leicht rückläufig, bei jedoch nun Nachweis eines lokalen, kontrastmittelaufnehmenden Tumorrezidivs links zentral. In der nochmaligen Tumorboard-Besprechung des Falls erging die Empfehlung zur erneuten Tumorresektion mit Entsendung des Gewebes zur erweiterten molekularen Diagnostik mittels Next-Generation-Sequencing sowie bei Bestätigung des Rezidivtumors der Beginn einer Re-Bestrahlung und Temozolomid-Behandlung. Es erfolgte die erneute Tumorresektion mittels 5-ALA Fluoreszenz-Darstellung unter kontinuierlichem intraoperativen Monitoring mittels 3D-Exoskop-Darstellung.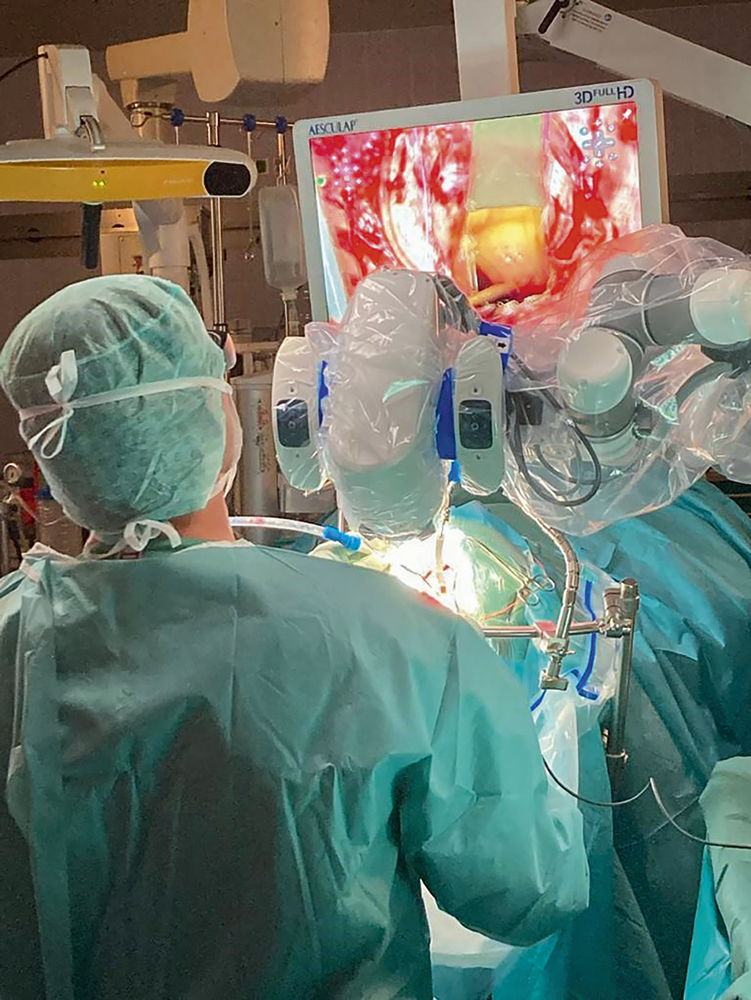
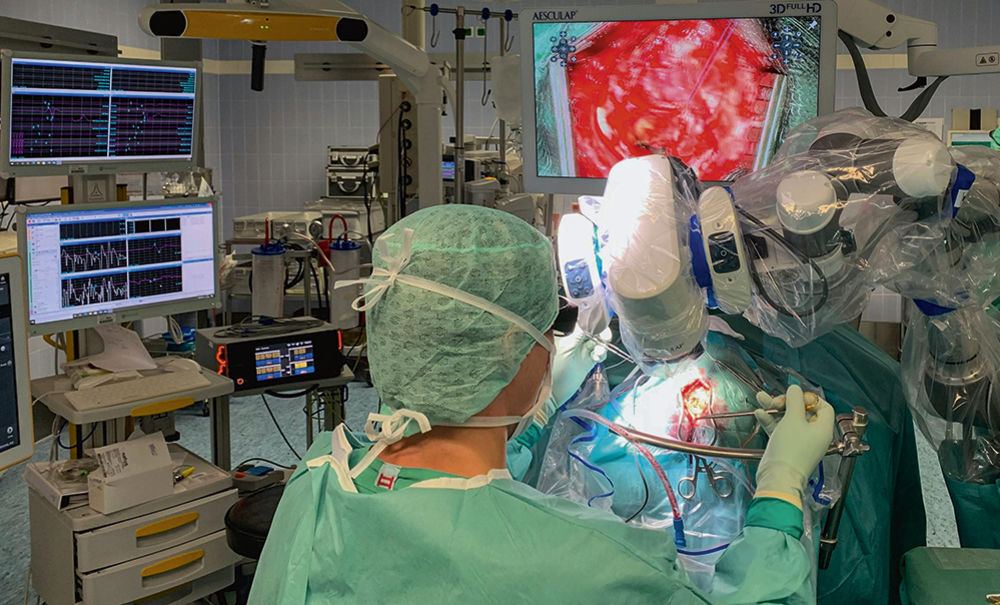 Abbildung 9 und 10: Darstellung des intraoperativen Aufbaus bei einer exoskopisch geführten Resektion eines Rezidivglioblastoms unter neurophysiologischem Monitoring und mittels Fluoreszenzdarstellung (5-ALA).
Abbildung 9 und 10: Darstellung des intraoperativen Aufbaus bei einer exoskopisch geführten Resektion eines Rezidivglioblastoms unter neurophysiologischem Monitoring und mittels Fluoreszenzdarstellung (5-ALA).
Intraoperativ kam es zu einem Abfall der motorisch evozierten Potenziale zum rechten Bein. Die postoperative Kontrolle mittels MRT konnte erneut die komplette Resektion des kontrastmittelaufnehmenden Tumoranteils darstellen. Analog zur intraoperativen Neurophysiologie zeigte sich erneut eine mittelgradige Hemiparese rechtsseitig bei dem Patienten. In der Histo- und Molekularpathologischen Untersuchung bestätigte sich das Rezidiv des vordiagnostizierten Glioblastoms, weswegen erneut die adjuvante Radiochemotherapie stationär erfolgte.
Diskussion
Der hier vorgestellte Fall zeigt die gegenwärtigen Abläufe der neurochirurgischen und neuro-onkologischen Behandlung bei dem Verdacht auf einen hirneigenen Tumor. Nach vorliegenden Bildbefunden erfolgt die Fallbesprechung in einem neuroonkologischen Board, im oben genannten Fall mit der resultierenden Empfehlung zur operativen Resektion. Wie im zuvor beschriebenen Fall 2 besteht auch bei dem zuletzt dargestellten Patienten ein Tumorwachstum in einem (so genannten) eloquenten Hirnareal. Aufgrund der Lokalisation im subkortikalen Beinareal erfolgte die Tumorresektion hier in Vollnarkose, unter einem intraoperativen neurophysiologischen Monitoring (Somatosensorisch evozierte Potenziale [SSEP], Motorisch evozierte Potenziale [MEP], Phasenumkehr, direkte kortikale und subkortikale Stimulation) zur Überwachung der motorischen Funktion. Etabliert bei der chirurgischen Behandlung ist zudem die patho-anatomische Resektionsführung unter Verwendung einer Neuronavigation, welche wiederum präoperativ gewonnene funktionelle Daten, zum Beispiel der transkraniellen Magnetstimulation und/oder der funktionellen Magnetresonanztomographie mit anatomischen Bilddaten aus der MRT wie zum Beispiel dem Verlauf der subcortikalen Faserbahnen (DTI), den Tumor Hot-Spots der PET und anderen kombiniert und intraoperativ visualisiert [17, 18]. Eine darüber hinaus sehr wesentliche Methode zur Kennzeichnung von vitalem Tumorgewebe ist die Fluoreszenzdarstellung mit dem Farbstoff 5-Aminolävulinsäure (5-ALA) [19]. Die Kombination dieser verfügbaren Daten oder auch einzelne selektierte Informationen können zur größtmöglichen Therapiesicherheit während der Operation auf das OP-Mikroskop, oder wie bei der Revisionsoperation des oben genannten Patienten dargestellt, auf ein OP-Exoskop übertragen werden. Bei Darstellung des OP-Feldes mit einem Exoskop erfolgt die Aufnahme mit, entgegen der endoskopischen Technik, einer außen und neben dem Patienten platzierten Kamera und Übertragung auf einen Bildschirm. Neben den hierin inkludierten technischen Neuerungen der 3D-Darstellung, HD- oder 4K-Auflösung, einer verbesserten Beleuchtung und Tiefenschärfe ist vor allem die verbesserte Ergonomie und damit der erhöhte Komfort des Chirurgen durch eine verbesserte Haltung bzw. Sitzposition hervorzuheben [20, 21]. Damit scheint eine geringere Ermüdbarkeit insbesondere bei langen und komplexen neurochirurgischen Operationen möglich.
High-grade Gliomrezidive
Wie eingangs der Fallvorstellungen bereits angesprochen, haben fortwährende Anpassungen, insbesondere bei der nicht-chirurgischen onkologischen Therapie, zu einer Verbesserung der Lebenserwartung bei Patienten mit high-grade Gliomen geführt. Mit dem höchsten Anteil unter den malignen ZNS-Tumoren einerseits und der höchsten Inzidenz unter den Gliomen anderseits, sind neuroonkologische Zentren immer wieder auch mit der Frage einer Therapie bei einer Rezidivsituation eines Glioblastoms konfrontiert. Die aktuelle Datenlage lässt hierzu keine Standard-Therapieempfehlung zu. Bei jedoch mutmaßlich zu erzielender Komplettresektion und gleichzeitigem Erhalt der Lebensqualität ohne Risiko eines permanenten neurologischen Defizites, stellt die erneute Operation mit Strahlentherapie und/oder Systemtherapie eine Option dar. Im vorliegenden Fall ist diese Option im interdisziplinären Konsens für den Patienten gewählt worden. Zusätzlich zu den bei der Erstoperation bestimmten, molekularen Markern, erfolgte bei der erneuten Gewebeentnahme eine erweiterte molekulare Diagnostik (Next-Generation-Sequencing [NGS]) mit der Option einer Behandlungsempfehlung aus einem molekularen Tumorboard.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
» Endoskopische Verfahren erlauben eine definitive, sichere und schonende Resektion von Schädel-Basis-Tumoren, sowohl in der erwachsenen als auch in der pädiatrischen Population.
» Die chirurgische Versorgung von Gliomen sollte in eloquenten Gehirnregionen unter multimodalem Monitoring, je nach Lokalisation auch als Wachoperation durchgeführt, erfolgen. Durch die vollständige Resektion des MR-grafisch dargestellten Tumors, kann so ein Vorteil im Progressionsfreien- und Gesamtüberleben erreicht werden.
» Auch bei erneutem Tumorwachstum nach Primärtherapie eines Glioblastoms, sollte die erneute operative Resektion gefolgt von einer Radiochemotherapie in Betracht gezogen werden, sofern dies ohne Einbußen der Lebensqualität für den Patienten erfolgen kann.
» Zur Leitlinien-Kongruenz sollte die neuroonkologische Behandlung stets nach interdisziplinärer Besprechung in einem Tumorboard festgelegt werden.
Autoren
Neurochirurgische Klinik, München Klinik Bogenhausen, Englschalkinger Str. 77, 81925 München, E-Mail: michael.meier@muenchen-klinik.de
Teilen:
Das könnte Sie auch interessieren:








