Neu in der Nephrologie
 Nephrologie
Nephrologie
Ursprünglich als neuartiges Antidiabetikum eingeführt, zeigen die SGLT2-Inhibitoren auch bei nicht-diabetischen chronischen Nierenpatienten ihren therapeutischen Vorteil (SGLT-2 [sodium-glucose linked transporter 2] ist ein sekundär aktives Carrier-Protein, das in der Niere im proximalen Tubulus aus dem Primärharn Glucose und Natrium resorbiert. Der durch die Natrium-Kalium-ATPase aufgebaute Natriumgradient stellt hierbei die treibende Kraft für die Glucoseresorption dar, Abbildung 1). Neue diagnostische Erkenntnisse in der Erfassung originärer Nierenerkrankungen verbessern nicht nur die diagnostische Präzision, sondern können auch als Leitfaden für eine optimierte, patientenzentrierte Therapieführung angewendet werden. Die Innovationen in der nephrologischen Bildgebung erhöhen die Präzision der diagnostischen Aussage und ergänzen das Portfolio der Schnittbilddiagnostik.
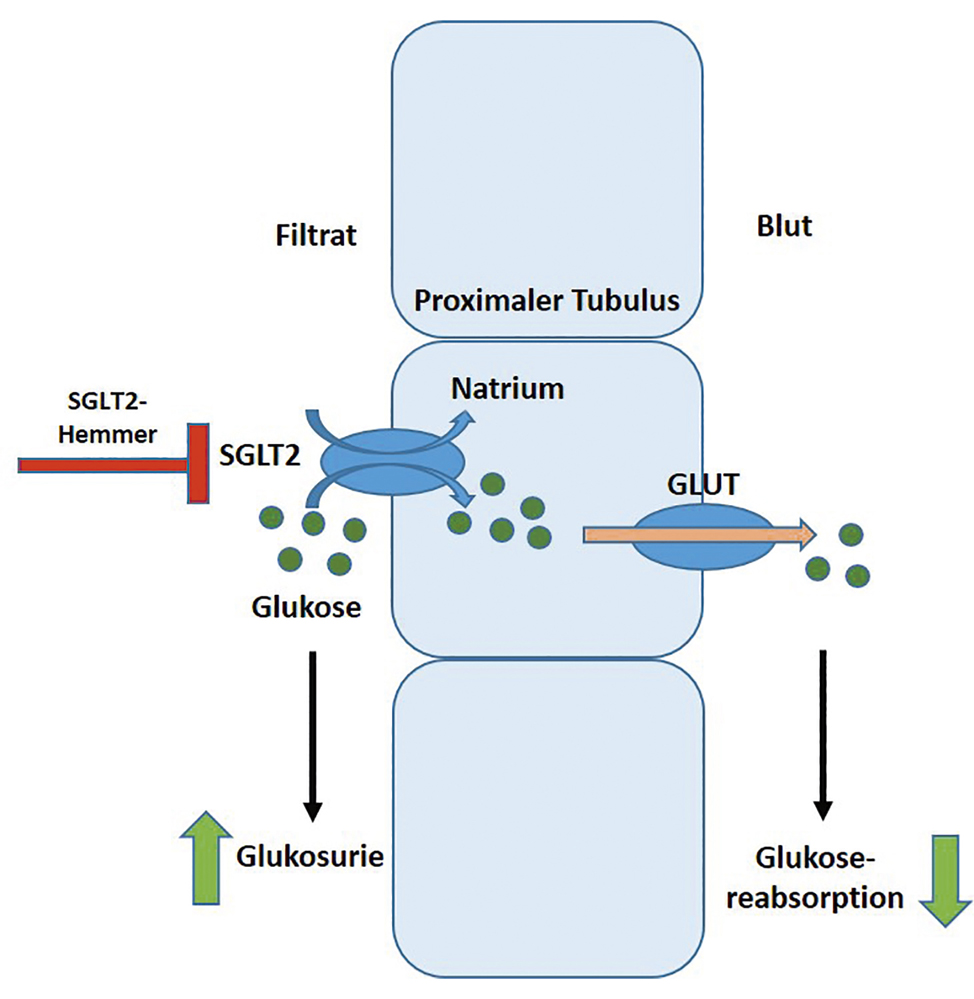
Abbildung 1: SGLT2-Hemmer sind für die selektive Hemmung des Natrium-Glukose-Cotransporters 2 (SGLT2) an der Niere verantwortlich. Die Reabsorption der Glukose aus dem Urin in den Blutkreislauf findet im Bereich des proximalen Tubulus statt. Durch die intensivierte Glukosurie unter SGLT2-Therapie werden bis zu 80 g Glukose/Tag mit dem Urin ausgeschieden (Grafik modifiziert nach PharmaWiki).
Fall 1
Vorgestellt wird ein 25-jähriger Mann mit ungestörter Nierenleistung (Serumkreatinin 0,96 mg/dl, eGFR CKD-EPI 109 ml/min) bei dem sich ambulant wiederholt erhöhte Blutdruckwerte (gemittelt 143/81 mmHg) nachweisen ließen. In der Abklärung sekundärer Ursachen der Hypertonie lassen sich keine endokrinologischen Auffälligkeiten nachweisen, die Sonografie der Nieren zeigt normdimensionierte, regelrecht vaskularisierte Nieren, insbesondere ohne Nachweis einer Nierenarterienstenose. In der nephrologischen Umgebungsdiagnostik lässt sich eine Mikrohämaturie sowie eine evidente Albuminurie (1,2 g/g Krea, Proteinurie 1,3 g/g Krea) ausmachen, wobei sich im mikroskopischen Urinsediment typisch verformte Erythrozyten (= Akanthozyten) im Sinne einer sogenannten glomerulären Hämaturie, ohne Nachweis von Erythrozytenzylindern, zeigten. Die erweiterte nephrologische Spezialdiagnostik zur Abklärung einer Glomerulonephritis (GN) inklusive ANA-Titer, ENA-Screening, c-/p-ANCA verbleibt unauffällig. Die zur Ursachenabklärung durchgeführte Nierenbiopsie zeigt als wesentlichen Befund glomerulär eine mesangiale Zell- und Matrixvermehrung ohne segmentale Glomerulosklerose oder intra-, extrakapilläre Proliferate. In Zusammenschau mit der komplementären Immunhistochemie sowie Elektronenmikroskopie ergab sich der Befund einer mesangioproliferativen IgA-Glomerulonephritis.
Diskussion
Die IgA-Nephropathie (IgAN – Ablagerung von IgA-Immunkomplexen in den Glomeruli) ist die häufigste primäre GN [1], insbesondere in Ostasien sowie bei Kaukasiern, die definitiv nur mittels Nierenbiopsie diagnostiziert werden kann. Der Erkrankungsgipfel liegt in der zweiten bis dritten Lebensdekade, wobei Männer doppelt so häufig betroffen sind wie Frauen [2, 3]. Klinische Manifestationen reichen von einer asymptomatischen Mikrohämaturie bis zur rapid progressiven GN (= RPGN), wobei insbesondere eine intermittierende Makrohämaturie, oft in zeitlicher Assoziation zu einem Infekt der oberen Atemwege, als typisches Präsentationsmerkmal gilt. Weniger als zehn Prozent der Patientinnen und Patienten werden mit einem schweren nephrotischen Syndrom oder einer rasch fortschreitenden GN vorstellig.
Als wesentliche Risikofaktoren für das Fortschreiten einer IgAN gelten eine persistierende große Proteinurie > 1 g/Tag, eine erniedrigte eGFR (estimated glomerular filtration rate), eine ungenügend kontrollierte arterielle Hypertonie (Ziel-RR < 130/80 mmHg), eine persistierende (Mikro-)Hämaturie sowie bestimmte histopathologische Veränderungen [4 bis 8]. Gelingt es nicht, diese Risikofaktoren adäquat einzustellen, so liegt das Risiko für eine terminale dialysepflichtige Niereninsuffizienz bei etwa 15 Prozent nach zehn Jahren bzw. 20 bis 30 Prozent nach 20 Jahren. Das patientenindividuelle Risiko – definiert als 50-prozentiger Rückgang der eGFR binnen fünf Jahren – kann heutzutage mittels International IgA Nephropathy Prediction Tool (https://ukkidney.org/resource/international-iga-nephropathy-prediction-tool) abgeschätzt werden [9].
Nach Diagnosestellung sollte bei allen Patienten eine optimale supportive Therapie, die sich aus einer konsequenten Blutdruckeinstellung unter Einbeziehung einer RAAS-Blockade (basierend auf ACE-Hemmer oder Sartan) und verschiedenen Maßnahmen der Lebensstilmodifikation (Nikotinverzicht, Salzreduktion etc.) zusammensetzt, umgesetzt werden. Als interessanter neuer Therapieansatz erlangte die Substanzklasse der SGLT2-Inhibitoren zuletzt große Aufmerksamkeit. Nachdem unter anderem in Metaanalysen [10] zunächst die Vorteile für diabetische Patienten hinsichtlich kardiovaskulärer wie renaler Ereignisse aufgezeigt wurden (38-prozentige Risikoreduktion für renale Ereignisse bei Patienten mit vorbekannter Chronic Kidney Disease [CKD]und begleitender Albuminurie > 300 mg/g) zeigten weiterführende Analysen zuletzt auch den Benefit bezüglich renaler Ereignisse an nicht-diabetischen Patienten. So konnte im Rahmen einer Subanalyse der DAPA-CKD-Studie [11] an 270 IgAN-Patienten ein Vorteil gegenüber dem Placebo gezeigt werden [12]. Eingeschlossen waren Patienten mit einer eGFR zwischen 25 bis 75 ml/min und einer Albuminurie zwischen 200 bis 5.000 mg/g Krea, die auf eine stabile Dosis einer RAAS-Blockade eingestellt waren. Von den eingeschlossenen Patienten lag in 94 Prozent der Fälle eine bioptisch bestätigte IgAN vor. In der SGLT2-Inhibitorengruppe konnte im Vergleich mit Placebo eine signifikante Risikoreduktion für den primären Endpunkt (HR 0,28 [95 Prozent CI, 0,11 bis 0,72]), aber auch den renalen Endpunkt (HR, 0,23 [95 Prozent CI, 0,09 bis 0,63]) ermittelt werden. Diese Ergebnisse ließen sich auch bei einer evidenten Albuminurie > 1.000 mg/g Krea (HR 0,27, [95 Prozent, CI 0,09 bis 0,82]) nachvollziehen. Die Nebenwirkungsprofile beider Studienarme unterschieden sich dabei nicht, was zur Zulassung von Dapagliflozin für die Therapie der chronischen Niereninsuffizienz bei diabetischen und nicht-diabetischen Patienten geführt hat.
Sollte sich nach drei bis sechs Monaten optimierter, supportiver Therapie in einer abermaligen Risikostratifizierung eine Persistenz der Proteinurie (≥ 1 g/Tag) oder ein rascher Nierenfunktionsverlust abbilden, sollte eine immunmodulatorische Therapie, zum Beispiel mit unterschiedlichen Steroidprotokollen, eventuell auch als spezielle Budesonidformulierung (Target-Release-Formulierung-Budesonid) [13] erwogen werden. Die Indikationsstellung für den Einsatz von Immunsuppressiva sollte stets geleitet sein durch entsprechende klinische (zum Beispiel Persistenz einer Proteinurie, rasche Nierenfunktionsverschlechterung) sowie histopathologische Veränderungen (wie zum Beispiel intra-/extrakapilläre Proliferation), eine dezidierte Abwägung des patientenindividuellen Nutzen-Risikoprofils und der Expertise spezialisierter nephrologischer Schwerpunktkliniken im Einsatz derartiger Medikamente.
In dem oben genannten Fall wurde daher unter anderem eine kombinierte Therapie mit ACE-Hemmer Ramipril (5 mg 1-0-1) und SGLT-2-Inhibitor Dapagliflozin (10 mg 1-0-0) eingeleitet, worunter sich bei optimierter Blutdruckeinstellung eine regrediente Albuminurie/Proteinurie zeigte.
Fall 2
Ein 46-jähriger Patient wurde zur Abklärung bei Erstmanifestation eines nephrotischen Syndroms (periphere Ödeme, Proteinurie 11,5 g/24 h, Hypalbuminämie mit 25 g/l, Hypercholesteriämie mit 430 mg/dl) überwiesen. Im Urin fand sich eine geringe eumorphe Erythrozyturie (50/µl), das Serumkreatinin war mit 1,6 mg/dl erhöht (eGFR 51 ml/min/1,73 m²). Überdies bestand kein Hinweis auf Paraproteinämie, Komplementfaktoren und rheumatologische Umfelddiagnostik waren unauffällig, allerdings fanden sich erhöhte Titer für PLA2R-AK im Serum (1:320, Normbereich < 1:10). Konsekutiv erfolgte eine diagnostische Nierenbiopsie, welche die Verdachtsdiagnose einer primären, PLA2R-positiven membranösen Nephropathie ohne relevanten chronischen glomerulären oder tubulo-interstitiellen Schaden bestätigte. Da das Progressionsrisiko anhand eGFR, Proteinurie und PLA2R-AK-Nachweis als hoch einzustufen war, erfolgte die Gabe von 2 g Rituximab i. v. (jeweils 1 g im Abstand von 14 Tagen), was nach sechs Monaten bei zwar niedrigeren, aber noch nachweisbaren (1:100) PLA2R-AK-Titern und einer Proteinurie von 4,7 g/24 h wiederholt wurde. Weitere drei Monate später waren die PLA2R-AK im Serum nicht mehr nachweisbar, die Proteinurie auf 1,7 g/24 h rückläufig, das Serumalbumin normalisiert und die Nierenfunktion stabil (Kreatinin 1,5 mg/dl, eGFR 52 ml/min/1,73 m²).

Abbildung 2: Ätiologie der membranösen Nephropathie.
Abkürzungen: PLA2R (Phospholipase A2 Rezeptor); THSD7A (Thrombospondin type-1 domain-containing 7A); NELL-1 (Neural epidermal growth factor-like 1 protein); Sema3B (Semaphorin 3B); SLE (Systemischer Lupus erythematodes); EXT1/EXT2 (Exostosin 1/2); HBV (Hepatitis-B-Virus); HCV (Hepatitis-C-Virus); NSAR (nicht-steroidale Antirheumatika); NHL (Non-Hodgkin-Lymphom); NEP (neutrale Endopeptidase).
Diskussion
Die membranöse Nephropathie (MN) ist eine der häufigsten Ursachen des nephrotischen Syndroms im Erwachsenenalter, sie wird in Nierenbiopsien bei diesem Patientenkollektiv in bis zu 30 Prozent der Fälle diagnostiziert. Pathophysiologisches Korrelat ist die subepitheliale Ablagerung von Immunkomplexen aus Immunglobulinen und Komplementbestandteilen in den Glomeruli, was zur Verdickung der glomerulären Basalmembran und konsekutivem Podozytenschaden führt und sich klinisch mit großer Proteinurie bis hin zum Vollbild des nephrotischen Syndroms manifestiert. Die Genese kann dabei primär, sekundär oder sogar alloimmun sein (Abbildung 2) [14]. Über 70 Prozent entfallen auf eine primäre Genese, für deren Verständnis die Identifizierung des podozytären Phospholipase-A2-Rezeptors (PLA2R) als Ziel-Autoantigen im Jahr 2009 [15] wegweisend war. Im Folgenden wurden weitere podozytäre Strukturen bzw. Bestandteile der glomerulären Basalmembran als Ziele von Auto-Antikörpern charakterisiert (THSD7A [16], Ext1/Ext2 [17], Nell-1 [18], Sema3B [19]), wobei diese einen relativ geringen Anteil ausmachen und teilweise auch mit autoimmunen oder malignen Prozessen assoziiert sind (Abbildung 2). PLA2R-AK stellen mit ca. 80 Prozent an der primären Form (Abbildung 2) [15] auch die häufigste Ursache der MN insgesamt dar, können histologisch und serologisch nachgewiesen werden, was die Herangehensweise bezüglich Diagnostik, Monitoring und Therapie der Erkrankung in den letzten Jahren entscheidend änderte. In Abhängigkeit von eGFR, Ausmaß der Proteinurie und Nachweis von PLA2R-AK erfolgt eine Risikostratifizierung (Abbildung 3), anhand welcher entsprechende Therapiemaßnahmen von sogennantem „watchful waiting“ bis hin zum unmittelbaren Einsatz einer stark immunsuppressiven Therapie empfohlen werden - additiv zur generellen Empfehlung von Blutdruckkontrolle einschließlich RAAS-Inhibition und lipidsenkender Therapie. Neu in diesem Zusammenhang ist der Stellenwert des CD20-Antikörpers Rituximab als B-Zell-depletierende Substanz: Bei moderatem bis hohem Risiko stellt Rituximab nun die immunsuppressive First-Line-Therapie dar, was sich in den erst 2021 überarbeiteten KDIGO (Kidney Disease Improving Global Outcome [20]) Empfehlungen entsprechend abbildet. Es konnte eine Überlegenheit bezüglich kompletter bzw. partieller Remission sowohl gegenüber Calcineurin-Inhibitoren (60 vs. 20 Prozent nach 24 Monaten) [21] als auch einer maximal konservativen, anti-proteinurischen Therapie (65 vs. 34 Prozent nach 18 Monaten) [22] gezeigt werden. Ein direkter Vergleich zwischen Rituximab (RTX) und Cyclophosphamid (CP) zeigte in einem Kollektiv mit intensiviertem Risiko in einer randomisiert kontrollierten Studie [23] ein ähnliches Ansprechen für beide Gruppen bezüglich kompletter und partieller Remission (81 Prozent RTX vs. 85 Prozent CP) nach 24 Monaten, wobei der Einsatz von Cyclophosphamid schneller zu Remissionen führte. Ein entscheidender Vorteil von Rituximab gegenüber Cyclophosphamid ist die geringere Toxizität. Der serologische PLA2R-AK-Nachweis ist in mehrfacher Hinsicht hilfreich: Er dient zum einen als Verlaufsparameter, da die serologische Remission der klinischen in der Regel vorausgeht [20, 22] und kann – falls bei anhaltend großer Proteinurie steigend – die Notwendigkeit einer Umstellung/Eskalation der Therapie anzeigen. Zum anderen wird diskutiert, bei niedrigem bis moderatem Progressionsrisiko und serologischer PLA2R-AK-Positivität auf eine diagnostische Nierenpunktion zunächst zu verzichten, solange eine beobachtende Strategie verfolgt wird [20]. Vor Beginn einer immunsuppressiven Therapie ist eine Nierenpunktion zur Diagnosesicherung, aber auch Quantifizierung eines chronischen Schadens und Ausschluss additiver Ursachen in jedem Fall zu empfehlen.
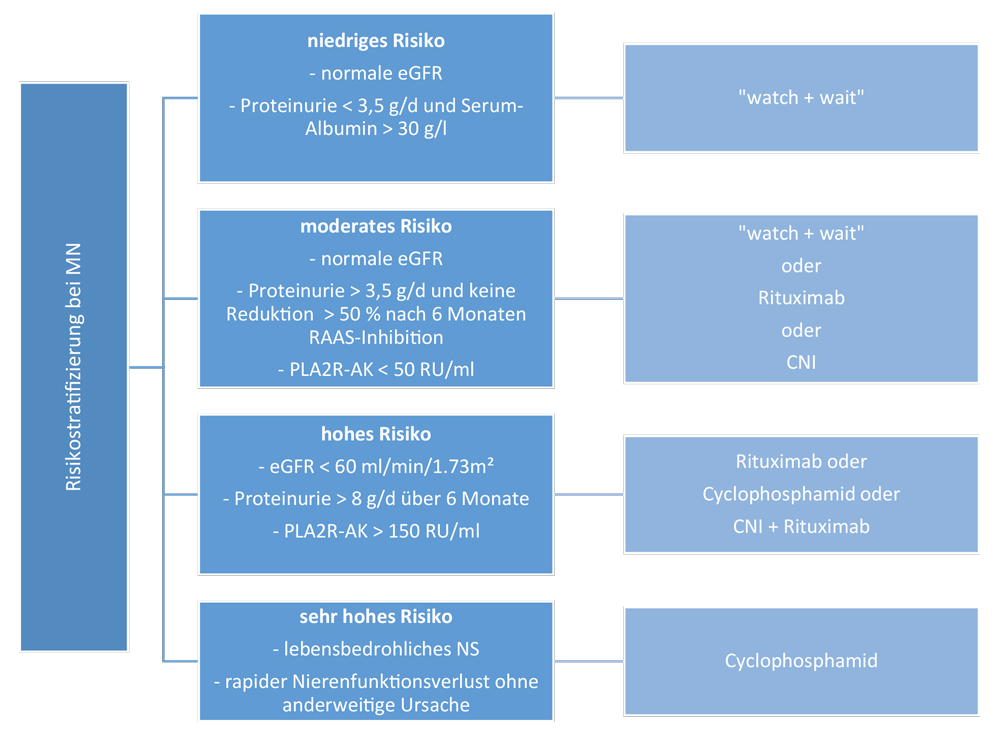
Abbildung 3: Risiko-basierte Therapie der primären membranösen Nephropathie.
Modifiziert gemäß den globalen „Kidney Disease – Improving Global Outcomes“ (KDIGO) Empfehlungen 2021 [20]. Abkürzungen: MN (membranöse Nephropathie); eGFR (estimated glomerular filtration rate); RAAS (Renin-Angiotensin-Aldosteron-System); PLA2R-AK (Phospholipase A2 Rezeptor-Antikörper);
NS (Nephrotisches Syndrom); CNI (Calcineurininhibitor).
Bei unserem Patienten konnte durch Rituximab eine serologische Voll- und klinische Teilremission erzielt werden, wobei ein weiterer Rückgang der Proteinurie zu erwarten ist. Angesichts des jungen Alters konnte so bislang auf eine Therapie mit potenziell kanzerogenen und teratogenen Nebenwirkungen verzichtet werden.
Fall 3
Ein 30-jähriger Patient stellte sich mit rechtsseitigen Flankenschmerzen vor. Die Schmerzen waren plötzlich aufgetreten und zeigten sich progredient. Es bestanden keine Vorerkrankungen, kein Trauma. Die Laborwerte zeigten eine moderate Kreatinin-Erhöhung (Kreatinin 1,37 mg/dl – eGFR [CKD-EPI] 68 ml/min/1,73 m²) bei hoch normalen LDH- und CK-Werten (LDH 246 U/l, CK 59 U/l). Die Urin-Analyse war bis auf eine leichte Erythrozyturie blande. Unter der initialen Annahme einer Nierenkolik bei Nephrolithiasis erfolgte zuerst die Sonografie der Nieren, bei der sich kein Konkrement darstellen ließ. Allerdings zeigte sich am Oberpol der rechten Niere ein dezent echoreiches Nierenparenchym mit einem schmalen Flüssigkeitssaum. Im Farbdoppler fand sich ein korrespondierender Ausfall der Vaskularisation. Um den Verdacht zu erhärten, wurde umgehend in der Notaufnahme eine Kontrastmittelsonografie (CEUS) ergänzt. Hier zeigte sich bei insgesamt verzögerter Kontrastmittelanflutung im Oberpol der rechten Niere ein keilförmiger Perfusionsausfall von ca. 3 cm (Abbildung 4). Die zuführende Arterie zeigte eine teils spiralförmige Taillierung mit deutlich erhöhten Blutflussgeschwindigkeiten (> 300 cm/s), hinweisend auf eine Nierenarteriendissektion. Die linke Niere war ohne Befund. Nach CT-grafischer Befundbestätigung konnte angiografisch unter Einbringung eines Stents durch die Kollegen der interventionellen Radiologie am Universitätsklinikum Regensburg die rechte Nierenarterie rekanalisiert werden. Ein Fortschreiten der Dissektion mit konsekutivem Funktionsverlust konnte verhindert werden (Abbildung 5).
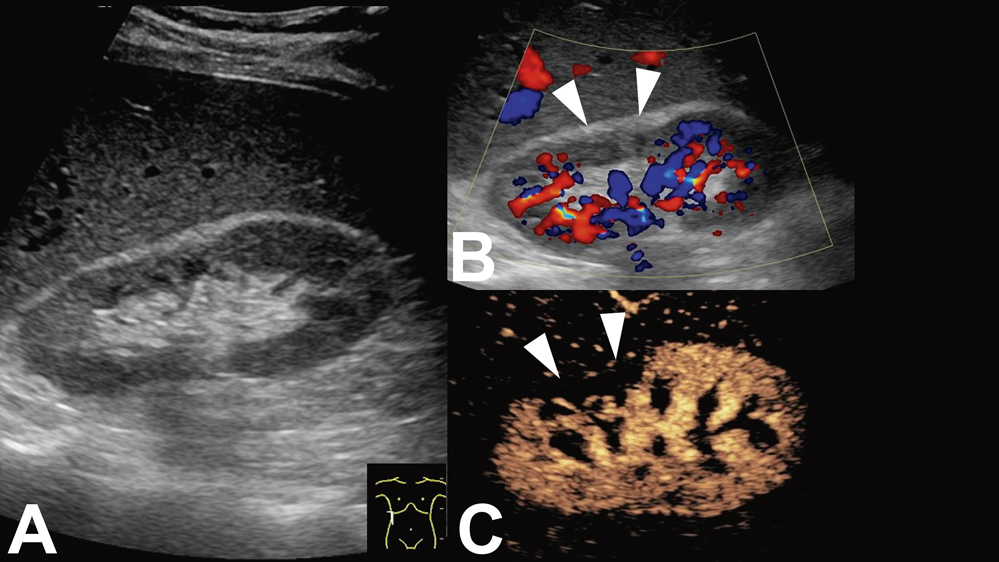
Abbildung 4: Duplexsonografie und Kontrastmittelsonografie der rechten Niere.
A: In der B-Bild-Sonografie lässt sich eine weitestgehend unauffällige rechte Niere darstellen. Es ergibt sich kein Hinweis für ein Konkrement oder einen Harnstau, die die Beschwerden des Patienten erklären können. B: In der Farbduplexsonografie zeigt sich ein keilförmiges Areal ohne Vaskularisation, hinweisend auf einen Niereninfarkt (Pfeilspitzen), welcher sich in der B-Bild-Sonografie allein nicht darstellen lässt. C: Nach Gabe von nicht-nephrotoxischem Ultraschallkontrastmittel zeigt sich korrespondierend ein keilförmiger Niereninfarkt (Pfeilspitzen).
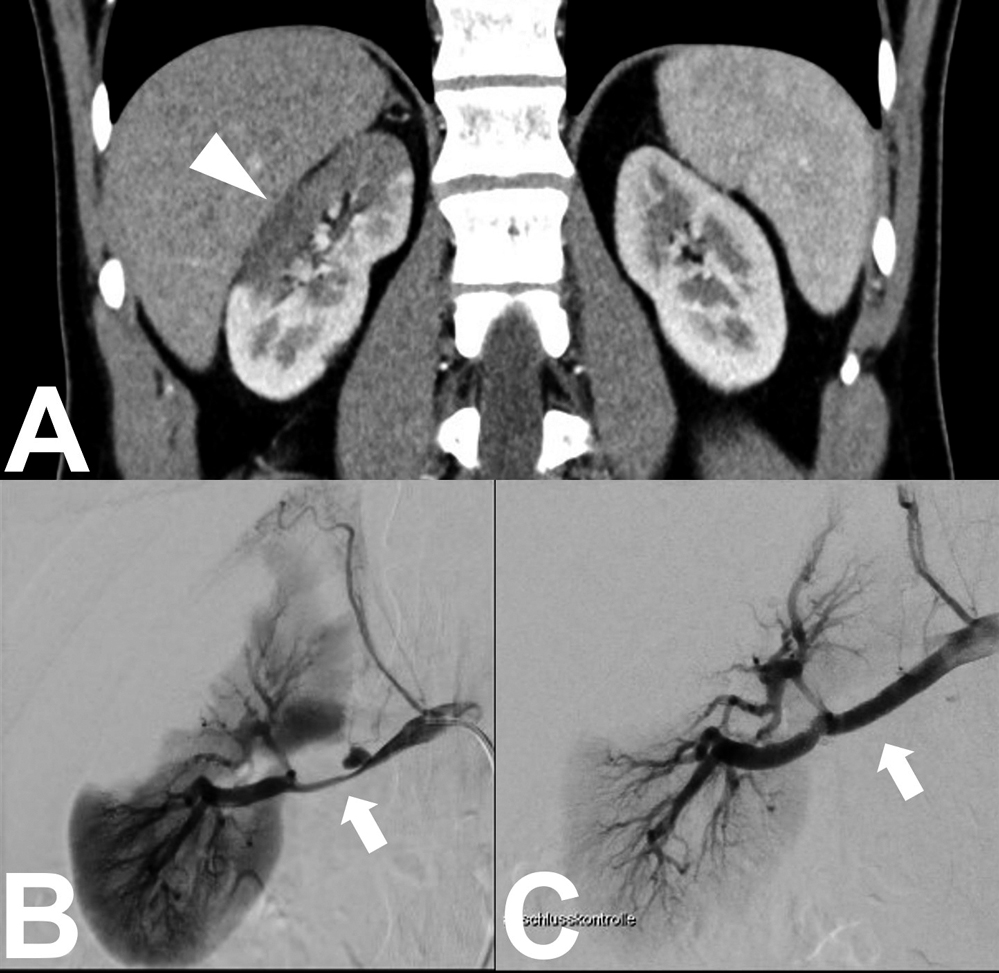
Abbildung 5: Kontrastmittel-Computertomografie und Angiografie beider Nieren.
A: Kontrastmittel-CT mit Bestätigung des Niereninfarkts am Oberpol der rechten Niere (Pfeilspitze) korrespondierend zur zuvor durchgeführten Kontrastmittelsonografie. Ein Konkrement als Ursache für die Flankenschmerzen ließ sich nicht darstellen. B: Angiografie der rechten Niere mit Darstellung einer ausgedehnten Nierenarteriendissektion und Kaliberschwankung in der Nierenarterie (Pfeil). C: Die Abschlussangiografie nach Stentimplantation zeigt die wiedereröffnete rechte Nierenarterie.
Bei unserem Patienten konnte in der Verlaufskontrolle nach einem Jahr eine stabile, uneingeschränkte Nierenfunktion festgestellt werden (Kreatinin 0,96 mg/dl, eGFR [CKD-EPI] 104 ml/min/1,73 m²). Sonografisch zeigte sich eine verbleibende Narbe im ehemaligen Infarktareal bei uneingeschränkter Vaskularisation der restlichen Niere und offenem Nierenarterienstent, im Farbdoppler-Ultraschall.
Akute Durchblutungsstörungen sind (auch bei jungen Patienten) eine wichtige Differenzialdiagnose bei unklaren Flankenschmerzen und stellen einen nephrologischen Notfall dar. Die Symptomatik ist ähnlich der einer Nephrolithiasis und besteht häufig aus Flankenschmerzen (50 Prozent) oder unklaren Abdomenschmerzen (53 Prozent). Teilweise wird dies von einer ausgeprägten vegetativen Symptomatik (Übelkeit 16,4 Prozent, Erbrechen 13 Prozent) begleitet [24]. Bilaterale Beschwerden werden von 16,4 Prozent der Patienten angegeben [25]. Auffällig ist häufig eine begleitende Blutdruckerhöhung [26, 27]. Laborchemisch kann sich eine Erhöhung der Zellzerfallsparameter (LDH, Lactat) zeigen, dies kann aber unmittelbar initial oder aber bei subakuten Verläufen fehlen. Einschränkungen der Nierenfunktion oder der Urinanalyse sind variabel.
Die Ursachen für akute Perfusionsstörungen der Nieren sind in 55,7 Prozent der Fälle systemische Embolien, zum Beispiel bei Vorhofflimmern oder Endokarditis. Gefäßprobleme treten in 7,5 Prozent der Fälle auf und sind zumeist Folge eines Traumas, können aber auch bei Vaskulitis, fibromuskulärer Dysplasie oder auch spontan auftreten. Spontane Nierenarteriendissektionen sind allgemein selten, prädisponiert sind allerdings Patienten mit Kollagenstörungen (zum Beispiel Marfan-Syndrom) [25].
Der Erhalt der Nierenfunktion kann nur durch das schnelle Wiedereröffnen des verschlossenen Blutgefäßes sichergestellt werden, wobei interventionelle oder gefäßchirurgische Methoden zur Verfügung stehen [28, 29]. Zeitverzögerungen sind mit einer schlechteren renalen Prognose assoziiert.
Der Fall zeigt eindrucksvoll, inwieweit die schnelle Diagnosefindung den Behandlungsplan entscheidend beeinflussen kann. Der Sonografie fällt eine entscheidende Rolle zu. Neben der B-Bild-Sonografie ist hierbei die Duplexsonografie zur vollständigen Sonografie der Nieren unabdingbar [30].
In spezialisierten Zentren können vermutete Durchblutungsstörungen der Nieren ohne Zeitverlust unmittelbar durch CEUS abgeklärt werden. Die Frage nach Perfusionsstörungen ist mit ca. 31 Prozent der Fälle neben der Abklärung suspekter Nierenzysten, -tumoren und -infektionen eine häufige Fragestellung an CEUS [31]. Da das verwendete Ultraschallkontrastmittel (Schwefelhexafluorid) nicht nephrotoxisch ist, kann es auch bei eingeschränkter Nierenfunktion eingesetzt werden. Auch wenn der Einsatz bei der Untersuchung der Nieren einen sogenannten Off-Label-Use darstellt, wird er bei der Abklärung von akuten Durchblutungsstörungen durch die internationalen Leitlinien empfohlen [32].
Entscheidend ist, dass ein häufig zur Steinsuche durchgeführtes CT der Nieren in der Regel nativ (das heißt ohne Kontrastmittel) erfolgt und dadurch Perfusionsstörungen nicht direkt ausgeschlossen werden. Bei nicht erklärten Beschwerden muss in diesen Fällen die Durchblutung der Nieren aktiv überprüft werden. Bei unklaren Fällen ist eine kontrastmittelgestützte Untersuchung indiziert und je nach lokaler Expertise kann die Kontrastmittelsonografie den Einsatz von nephrotoxischem Kontrastmittel im CT entbehrlich machen.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
» Die IgA-Nephropathie, die sich durch Urinauffälligkeiten (wie zum Beispiel Hämaturie, Albuminurie) und Veränderungen der Nierenfunktion abbildet, ist eine häufige Glomerulonephritis, die bioptisch abgeklärt werden sollte.
» Mit den SGLT2-Inhibitoren stehen neue Medikamente – auch für IgAN-Patienten ohne Diabetes – zur Verfügung.
» Die primäre Genese der MN konnte in den vergangenen Jahren mit diversen Auto-Antikörpern assoziiert werden, wobei Antikörper gegen podozytäre Phospholipase A2-Rezeptoren die häufigste Ursache der (primären) MN darstellen.
» Der serologische Nachweis von PLA2R-AK kann der Diagnostik, Prognoseabschätzung und Therapiekontrolle bei primärer MN dienen.
» Abhängig vom patientenindividuellen Risiko löst Rituximab den Einsatz von Calcineurin-Inhibitoren und Cyclophosphamid als „First-Line-Therapie“ ab.
» Akute Perfusionsstörungen der Niere sind eine relevante Differenzialdiagnose bei unklaren Flankenschmerzen.
» Der Sonografie der Nieren kommt bei der Differenzialdiagnose nephrologischer Krankheitsbilder eine entscheidende Bedeutung zu. Neben der B-Bild-Sonografie liefert die farbkodierte Duplexsonografie erste Hinweise für Störungen der Vaskularisation.
» Der Einsatz von nicht nephrotoxischem Ultraschallkontrastmittel ergänzt die Möglichkeiten der Sonografie und erlaubt Darstellungen der Mikrozirkulation der Niere. Typische Fragestellungen sind die Abklärung von suspekten Nierenzysten, Nierentumoren, Perfusionsstörungen und infektiösen Nierenerkrankungen.
Autoren

Privatdozent Dr. Franz Josef Putz
Abteilung für Nephrologie, Universitätsklinikum Regensburg
Korrespondenzadresse: Professor Dr. Tobias Bergler, Abteilung für Nephrologie, Universitätsklinikum Regensburg, Franz-Josef-Strauß-Allee 11, 93053 Regensburg, E-Mail: tobias.bergler(at)ukr.de
Teilen:
Das könnte Sie auch interessieren:









