Neu in der Kardiologie
 Neu in der Kardiologie
Neu in der Kardiologie
In den vergangenen fünf Jahren hat sich die Kardiologie nicht nur weiter technisiert, sondern auch neu geerdet. Während evidenzbasierte interventionelle Behandlungsstrategien der koronaren Herzerkrankung wirksamer, differenzierter und individualisierter werden, gewinnen zugleich bislang wenig beachtete Patientengruppen an Aufmerksamkeit – etwa Patientinnen und Patienten mit Angina pectoris ohne signifikante Koronarstenosen(ANOCA) oder myokardialer Ischämie ohne Obstruktion (INOCA).
In der Rhythmologie treten neue Ablationsverfahren an, sich mit konventionellen Methoden zu messen. Die eindeutigste Datenlage zum positiven Einfluss ablativer Behandlungen von Herzrhythmusstörungen auf das Patienten-Outcome seit Jahren unterstreicht die wichtige und richtige interventionelle Ausrichtung der kardiologischen Rhythmologie im Jahr 2025. Gleichzeitig wurde die Herzinsuffizienztherapie neu gedacht. Neue medikamentöse Ansätze verbessern nicht nur die Lebensqualität, sondern auch die Lebenserwartung herzinsuffizienter Patienten signifikant. Auch die Therapie von Patienten mit Herzinsuffizienz und erhaltener Pumpfunktion kann dank neuester vielversprechender Daten angepasst werden.
Dieser Beitrag gibt einen Überblick über aktuelle Entwicklungen in der Kardiologie die im Praxis- und Klinikalltag von Haus- und Fachärztinnen/-ärzten zunehmend eine Rolle spielen.
Fall 1: Koronardiagnostik bei gestörter Mikrozirkulation
Eine 58-jährige Patientin stellt sich in der Notaufnahme vor. Sie berichtet über Angina pectoris-Beschwerden, die seit mehreren Monaten bestünden und nun zuletzt gestern in Ruhe abends im Bett aufgetreten seien. Es bestehen keine relevanten Nebenerkrankungen, jedoch ein kardiovaskuläres Risikoprofil mit Nikotinabusus und Hypercholesterinämie. Bei negativem Troponin-Wert erfolgt die weiterführende, nichtinvasive Ischämiediagnostik bei instabiler Angina pectoris. Bei pathologischer Ergometrie (Angina pectoris und ST-Strecken-Veränderungen ab 75 Watt) wird die Indikation zur invasiven Koronardiagnostik gestellt.
Hier zeigt sich keine einschränkende atherosklerotische Stenose der großen und mittleren epikardialen Koronararterien. Befundtext: „Ausschluss einer relevanten koronaren Herzerkrankung“.
Symptomatik – aber unauffälliger Koronardarstellung – und jetzt?
Ältere pathophysiologische Konzepte des chronischen Koronarsyndroms betrachteten eine fixierte, fokale, den Fluss einschränkende atherosklerotische Stenose einer großen oder mittleren Koronararterie als Conditio sine qua non für induzierbare Myokardischämie und daraus resultierend myokardiale Ischämie und Angina pectoris.
Jedoch ist nicht unbekannt, dass Störungen, die sowohl makro- als auch mikrovaskuläre Kompartimente des Koronarbaums umfassen, zu einer transienten Myokardischämie führen können. Auf makrovaskulärer Ebene können neben atherosklerotisch bedingten Stenosen auch diffuse atherosklerotische Läsionen ohne erkennbare Lumenverengung zu einer Ischämie unter Belastung führen. Auch strukturelle Anomalien wie intramuskuläre Verläufe der Koronararterien oder Vasospasmen können für eine Ischämie verantwortlich sein.
ANOCA, INOCA und CMD
Auf mikrovaskulärer Ebene wird die koronare mikrovaskuläre Dysfunktion (CMD) zunehmend als eine wichtige Entität anerkannt, die Teile des Spektrums des chronischen Koronarsyndroms (CCS) charakterisiert. So können funktionelle und strukturelle Störungen der Mikrozirkulation bei Patienten mit nicht-obstruktiver Erkrankung der großen oder mittleren Koronararterien Angina pectoris verursachen (Angina pectoris mit nicht-obstruktiven Koronararterien [ANOCA]) und Ischämie (Ischämie mit nicht-obstruktiven Koronararterien [INOKA]). Krankheitsbilder, die bei weitem keinen Bagatellbefund darstellen, sondern neben einer erheblichen Einschränkung der Lebensqualität auch mit einer erhöhten Morbidität assoziiert sind. „Die Gefäße sind sauber, alles ist in Ordnung.“ Diese Annahme ist heute insbesondere bei Patienten mit typischen Beschwerden oder positivem Ischämienachweis bei weitem überholt, und der diagnostische Nachholbedarf ist gigantisch. Die Europäische Gesellschaft für Kardiologie (ESC) spricht von bis zu 30 bis 50 Prozent der Patienten sowie bis zu 70 Prozent der Patientinnen mit Verdacht auf KHK und unauffälliger Angiografie, die eine funktionelle Auffälligkeit, mikrovaskuläre Dysfunktion oder einen Koronarspasmus aufweisen. Ein Viertel dieser Patienten weist einen positiven Ischämienachweis auf [1]. Die Diagnosestellung indes bleibt selten, die Rehospitalisationsraten der Patienten mit persistierender Angina hoch und der Anteil unnötig wiederholter Koronarangiografien erheblich.
Die Risikofaktoren, die für die Entwicklung einer epikardialen „klassischen“ KHK prädisponieren, fördern auch eine endotheliale Dysfunktion und abnorme Vasomotion im gesamten Koronarbaum, einschließlich der Arteriolen, die den koronaren Fluss und Widerstand regulieren. Somit sind Mischbilder der einzelnen Komponenten des CCS keine Seltenheit und erschweren die Diagnosestellung.
Diagnostik im Wandel
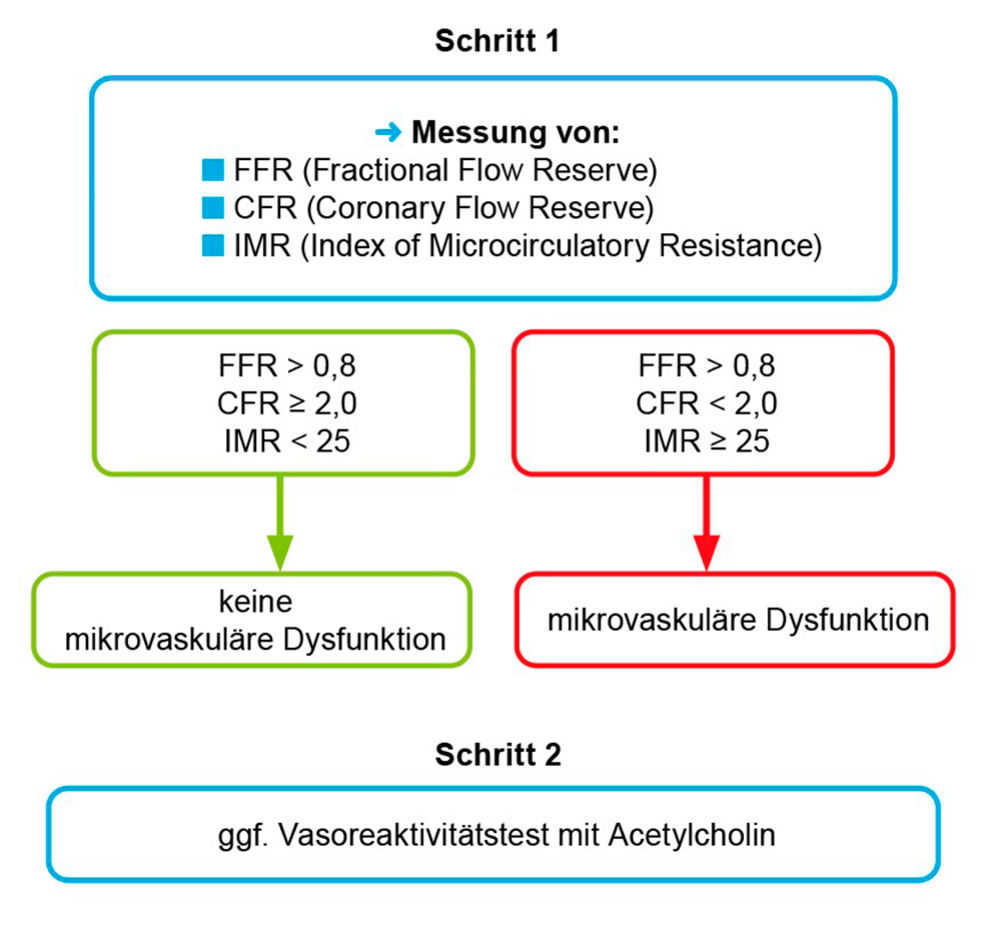
Im Rahmen einer Koronarangiografie bieten Koronarfunktionstests mit Acetylcholin (ACH) und Adenosin bei Patienten mit Verdacht auf CCS und nicht-obstruktiven Koronararterien die Möglichkeit einer flussdrahtbasierten weiterführenden Diagnostik. Hierbei werden die koronare Flussreserve (CFR), die funktionelle Flussreserve (FFR) und der mikrovaskuläre Widerstand (IMR) in Ruhe sowie unter Hyperämie (während Adenosin-Provokation) gemessen [2]. Eine intrakoronare ACH-Provokation zum Nachweis von Koronarspasmen kann je nach Bedarf angeschlossen werden. Dies ermöglicht die Differenzierung in, und Diagnosestellung von:
1. endothelialer Dysfunktion,
2. beeinträchtigter Vasodilatation (niedrige koronare Flussreserve und/oder hoher mikrovaskulärer Widerstand),
3. vasospastischer Angina.
Die weiterführende Diagnostik mittels invasiver funktioneller Messung wird von der europäischen Gesellschaft für Kardiologie bei Patienten mit Verdacht auf ANOCA/INOCA und persistierenden Beschwerden trotz medikamentöser Therapie mit einer starken Klasse IB-Empfehlung befürwortet [1].
Therapieansätze symptomorientiert – aber nicht belanglos
Aktuelle therapeutische Konzepte der CMD sind nicht kausal sondern zielen auf eine medikamentöse Linderung der Symptome und Verbesserung der Lebensqualität ab. So ergeben sich nach erfolgter funktioneller Diagnostik folgende grundsätzliche Therapieoptionen:
1. ACE-Hemmer zur Symptomkontrolle bei endothelialer Dysfunktion,
2. Statine, Beta-Blocker und anti-anginöse Therapie bei mikrovaskulärer Dysfunktion,
3. Kalziumantagonisten und Nitrate bei Vasospasmen.
Zurück zum Fall: In der invasiven funktionellen Koronardiagnostik der Patientin gelingt der Nachweis einer gestörten Mikrozirkulation (Abbildungen 1 und 2).
Messung der koronaren Flussreserve (CFR), der funktionellen Flussreserve (FFR) und des mikrovaskulären Widerstands (IMR) in Ruhe sowie unter Hyperämie (Adenosin-Provokation) während der Herzkatheteruntersuchung mittels Flussdraht. Der FFR-Wert dient als Marker für eine flussrelevante Obstruktion der großen Koronargefäße. Pathologische Werte im Rahmen der Thermodilution für CFR und IMR weisen auf eine endotheliale Dysfunktion bzw. beeinträchtigte Vasodilatation hin. Bei Verdacht auf erhöhte Vasoreaktivität kann zum Abschluss der Untersuchung ein Acetylcholintest durchgeführt werden. Hier wird mittels intrakoronarer ACH-Injektion ein Koronarspasmus bei vulnerablen Patienten provoziert.
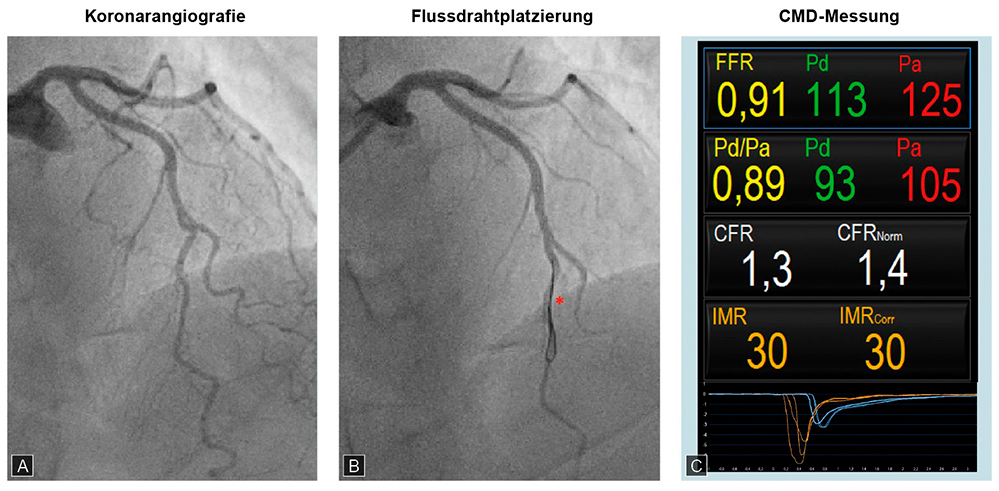
Abbildung 2: INOCA mit Nachweis einer mikrovaskulären Dysfunktion
A: Ausschluss einer relevanten Stenose aller großen und mittleren epikardialen Koronargefäße.
B: CMD-Messung mittels Flussdraht platziert in LAD (left anterior descendet), Messung in Ruhe sowie unter Hyperämie durch Adenosin-Provokation. *FFR Draht
C: Unauffällige FFR-Messung, pathologische CFR- und IMR-Messung.
Fall 1 wurde freundlicherweise von Professor Dr. Thorsten Kessler, Deutsches Herzzentrum München, Klinik für Herz- und Kreislauferkrankungen (Kardiologie), zur Verfügung gestellt.
Bei Nachweis einer mikrovaskulären Dysfunktion mit erhöhtem IMR erfolgt die Therapie mittels Beta-Blocker. Vor dem Hintergrund der nun gestellten somatischen Diagnose treffen wir sechs Wochen später eine Patientin mit erheblich gebesserter Lebensqualität an. In der wiederholten Ergometrie gelingt eine beschwerdefreie Belastung bis 110 Watt.
Fall 2: Therapie von Vorhofflimmern
Eine 66-jährige Patientin stellt sich mit progredienter Belastungsdyspnoe in der Notaufnahme vor, berichtet über Palpitationen seit einigen Monaten, im EKG bei Aufnahme zeigt sich eine Tachyarrhythmie um 130/min. bei tachykard übergeleitetem Vorhofflimmern, echokardiografisch ist der linke Ventrikel grenzwertig groß bei reduzierter systolischer Funktion (LVEF 40 Prozent), der linke Vorhof ist mäßig dilatiert, außer einer Mitralklappeninsuffizienz I° zeigen sich keine relevanten Vitien.
Auf dem Kongress der ESC wurde 2024 eine aktualisierte Leitlinie zur Diagnostik, Therapie und Prävention von Vorhofflimmern vorgestellt. Eine wesentliche Änderung ist die Einführung eines multidisziplinären Konzeptes als AF-CARE-Behandlungspfad [3].
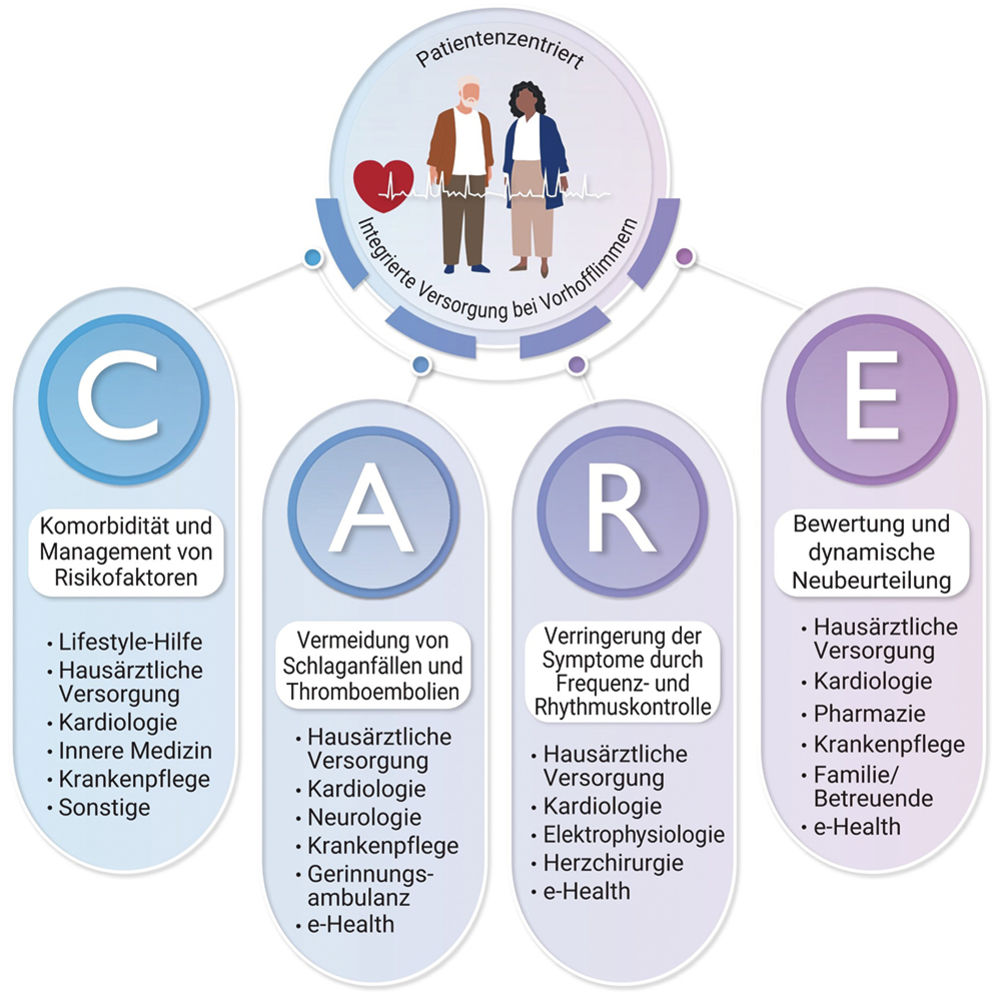
AF-CARE-Behandlungspfad, modifiziert nach ESC-Guidelines 2024 [3].
C: Comorbidity and risk factor management; A: Avoid stroke and thromboembolism; R: Reduce symptoms by rate and rhythm control; E: Evaluation and dynamic reassessment
Eine weitere Neuerung betrifft die Indikationsstellung zur oralen Antikoagulation. Bei der Risikoabschätzung für eine Thromboembolie wurde zuletzt das Patientengeschlecht zunehmend relativiert und geht in den neuen CHA2DS2-VA-Score nicht mehr ein.
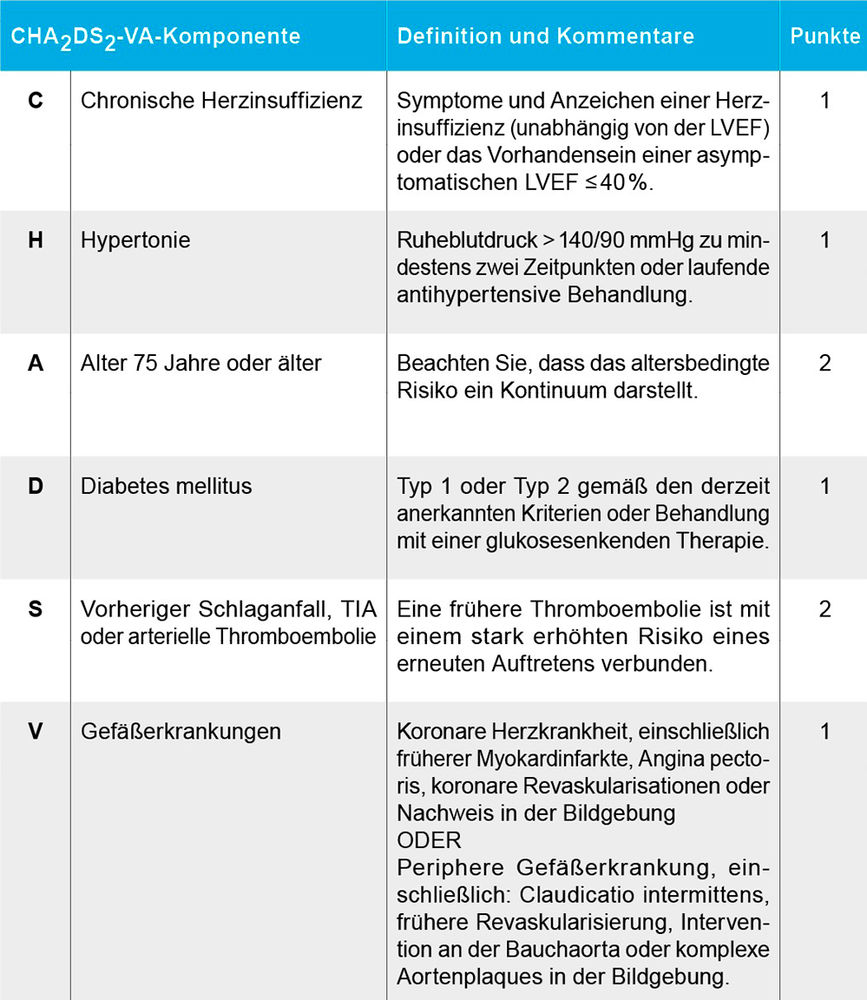
Risikoscore für Thromboembolien bei Vorhofflimmern (A: 1 Punkt im Alter von 65 bis 74 Jahren) [3].
Eine Indikation zur oralen Antikoagulation besteht mit einer Klasse-I-Empfehlung bei mehr als einem Punkt, sowie einer Klasse-IIa-Empfehlung bei einem Punkt [3].
In spezifischen klinischen Situationen, insbesondere bei hohem Thromboembolierisiko und Kontraindikationen gegen eine dauerhafte orale Antikoagulation, ist eine effektive prophylaktische Therapie durch einen interventionellen oder chirurgischen Verschluss des linken Vorhofohrs möglich.
Die Empfehlungen sind wie bei der Antikoagulation in den „2024 ESC Guidelines for the management of atrial fibrillation“ formuliert.
Stellenwert der Katheterablation
Die Katheterablation stellt mittlerweile eine entscheidende Säule der Behandlung von Vorhofflimmern dar. Die Leitlinienempfehlung zur Ablation bei Vorhofflimmern war noch nie so stark und so gut belegt wie heute. Bei paroxysmalem Vorhofflimmern besteht für die Ablation Klasse-I-Empfehlung als Erstlinientherapie [3]. Bei persistierendem Vorhofflimmern ist die Studienlage weniger einheitlich und gerade im kontinuierlichen Übergang von paroxysmalem zu persistierendem Vorhofflimmern in der Bewertung schwierig. Als Erstlinientherapie besteht bei persistierendem Vorhofflimmern eine Klasse-IIb-Empfehlung, jedoch nach gescheiterter Rhythmuskontrolle mit medikamentöser antiarrhythmischer Therapie eine Klasse-I-Indikation zur Katheterablation. Viele Patienten mit formal persistierendem Vorhofflimmern können in Abhängigkeit von der Art des atrialen Substrates ähnlich gut profitieren wie Patienten mit paroxysmalem Vorhofflimmern.
Bei Patienten mit Vorhofflimmern und Herzinsuffizienz mit reduzierter Ejektionsfraktion ≤ 40 Prozent (HFrEF) besteht insbesondere bei Verdacht auf eine zugrundeliegende Tachymyopathie eine Klasse-I-Indikation für eine Katheterablation, um die linksventrikuläre Dysfunktion und Symptome zu bessern. Um erneute Hospitalisierungen durch Herzinsuffizienz zu vermeiden und das Überleben zu verlängern, besteht aus prognostischer Sicht eine Klasse-IIa-Indikation zur Katheterablation [3].
Bislang standen mit der Radiofrequenz- und Kryoablation thermische Verfahren für die Katheterablation von Vorhofflimmern zur Verfügung. Trotz hoher Effektivität sind schwerwiegende Komplikationen, insbesondere die Schädigung des N. phrenicus und des Ösophagus sehr selten.
Neue Energieform, neue Ablationstechnologie
Mit der „pulsed-field ablation“ (PFA) steht mittlerweile eine neue, nichtthermische Energieform zur Ablation durch sogenannte irreversible Elektroporation zur Verfügung [4]. Präklinische Studien haben gezeigt, dass durch ein sehr starkes elektrisches Feld effektive, myokardspezifische Schädigungen und transmurale Läsionen ohne thermische Kollateralschäden generiert werden können. In den bisherigen klinischen Untersuchungen zeigt sich eine hohe Effektivität, Reproduzierbarkeit und Sicherheit bei der Pulmonalvenenisolation im Vergleich zu den bisher verwendeten Ablationsverfahren.
Gegenwärtig stehen bereits verschiedene Katheterkonfigurationen und PFA-Systeme zur Verfügung, die bei sehr guter prozeduraler Sicherheit die Etablierung dauerhafter Läsionen ermöglichen.
Zurück zum Fall: Die Patientin wird stationär rekompensiert, dabei eine medikamentöse Herzinsuffizienztherapie und orale Antikoagulation etabliert. Nach Ausschluss einer koronaren Herzerkrankung mittels Koronarangiografie erfolgt eine primär erfolgreiche elektrische Kardioversion und bei leicht gebesserter LV-EF zur intensivierten Rhythmuskontrolle eine erfolgreiche Pulmonalvenenisolation.
Fall 3: Herzinsuffizienz Neue Therapie – neue Haltung
Eine 74-jährige Patientin stellt sich mit zunehmender Belastungsdyspnoe und Knöchelödemen vor. Die Patientin ist bekannt, leidet seit Jahren an arterieller Hypertonie, Diabetes mellitus Typ 2 und chronischer Niereninsuffizienz Stadium III. In der Echokardiografie zeigt sich eine nun neu eingeschränkte linksventrikuläre Ejektionsfraktion (LVEF) von 30 Prozent, NT-proBNP ist erhöht.
Die Diagnose lautet HFrEF (Heart Failure with reduced Ejection Fraction).
Die Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) bleibt ein zentrales Thema der Inneren Medizin – mit hoher Prävalenz, komplexer Therapie und hohem Leidensdruck.
Neue Nomenklatur
Die heutige Nomenklatur der Herzinsuffizienz basiert auf der LVEF und unterscheidet vier Hauptformen [5]:
Bei der HFrEF (Heart Failure with reduced Ejection Fraction) liegt eine LVEF < 40 Prozent vor. Es handelt sich um eine systolische Herzinsuffizienz mit gut belegter Evidenz für prognoseverbessernde Therapien.
Die HFimpEF (improved EF) beschreibt Patienten mit vormals reduzierter LVEF, die sich unter Therapie > 40 Prozent gebessert hat. Die medikamentöse Behandlung sollte/muss in den meisten Fällen insbesondere bei fehlender reversibler Ursache fortgeführt werden.
Die HFmrEF (mildly reduced EF) mit einer LVEF von 41 bis 49 Prozent bezieht sich nur vordergründig auf eine rein systolische Dysfunktion. Auch hier profitieren viele Patienten von der HFrEF-Therapie.
Bei der HFpEF (preserved EF) mit einer LVEF ≥ 50 Prozent steht die diastolische Funktionsstörung im Vordergrund. Die Diagnostik erfordert zusätzlich strukturelle oder funktionelle Hinweise (zum Beispiel erhöhte NT-proBNP-Werte). Auch eine gezielte Anamnese ist entscheidend. Häufig betroffen sind ältere Patienten mit Komorbiditäten.
Diese Einteilung erleichtert die gezielte Diagnostik und individualisierte Therapie der Herzinsuffizienz.
Neue Therapie
Jeder Patient mit neu diagnostizierter Herzinsuffizienz sollte eine fachärztliche Basisdiagnostik, sowie – je nach Bedarf – eine weiterführende Diagnostik in einer spezifischen Ambulanz oder Klinik erhalten, da die Genese der Herzinsuffizienz heterogen und auch multifaktoriell sein kann. Die Ursache der Herzinsuffizienz und deren spezifische Therapie stellt ein weites Feld dar: Rekanalisation bei ischämischer Kardiomyopathie, Frequenz- und Rhythmus-Kontrolle bei Tachymyopathie, Behandlung von Klappendefekten und Device Therapie zur Prävention des plötzlichen Herztodes und/oder kardialen Resynchronisation und vieles mehr.
Die medikamentöse Therapie hingegen, die früher als Spezialwissen galt, ist heute Alltagswissen, breit in nahezu allen Fällen von Patienten mit Herzinsuffizienz einsetzbar, evidenzbasiert und klar strukturiert und ruht seit den ESC-Leitlinien von 2023 auf vier Säulen den sogenannten „fantastic four“:
ACE-Hemmer/ARNI, Betablocker, Mineralokortikoid-Rezeptor-Antagonisten (MRA) und SGLT2-Inhibitoren [5].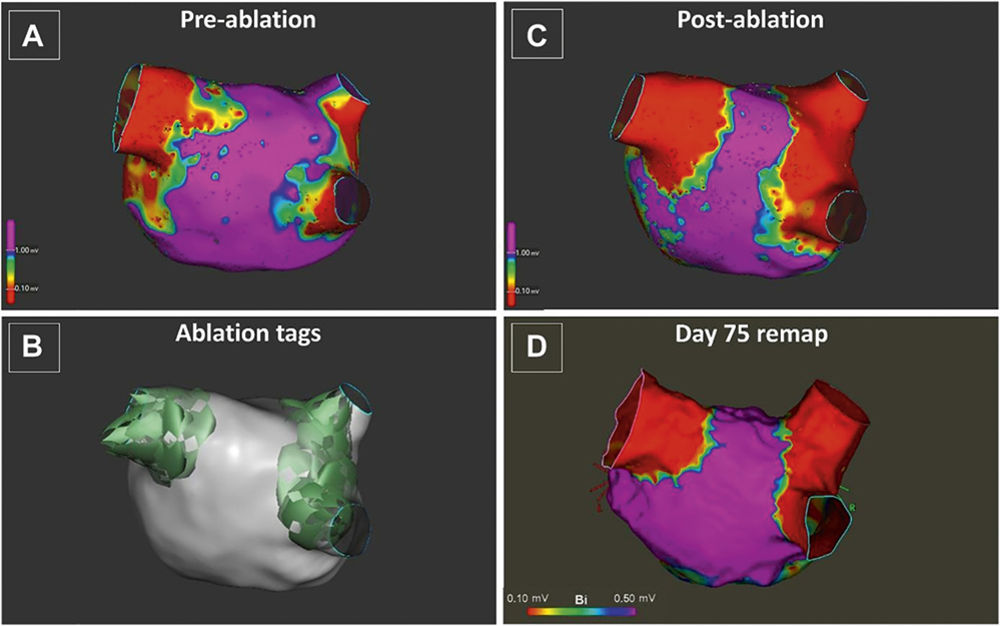
Akute und Langzeitergebnisse nach Pulmonalvenenisolation mittels pulsed-field ablation (Sicht auf linken Vorhof von
posterior-anterior, rot stellt die Pulmonalvenen als elektrisch isoliert, violett gesundes Vorhofmyokard dar) [13].
Besonders letztere leiteten eine grundlegende Novellierung der medikamentösen Herzinsuffizienztherapie ein: Ursprünglich in der Diabetologie entwickelt, haben SGLT2-Hemmer ihren festen Platz in der Therapie der HFrEF – unabhängig vom Diabetesstatus. Studien wie DAPA-HF und EMPEROR-Reduced zeigen eine Reduktion kardiovaskulärer Mortalität und Hospitalisierungen um etwa 25 Prozent. Die Wirkung tritt früh ein, ist konsistent über Altersgruppen und Begleiterkrankungen hinweg [6, 7].
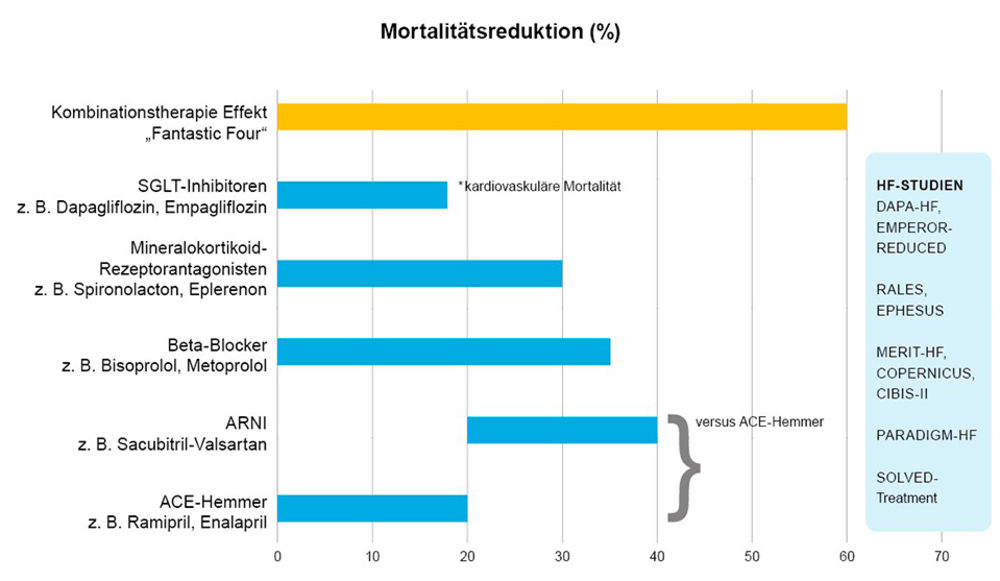
Abbildung 5: Mortalitätsreduktion durch medikamentöse Herzinsuffizienztherapie.
Neue Strategie
Nicht mehr verzögertes Aufdosieren, sondern ein frühzeitiges paralleles Einsetzen aller vier Substanzklassen wird empfohlen. Damit wird aus einer sequenziellen eine möglichst simultane Therapie.
Auch der Einsatz von ARNIs (Angiotensin-Rezeptor-Neprilysin-Inhibitor zum Beispiel Sacubitril/Valsartan) hat sich als Erstlinientherapie etabliert – insbesondere bei symptomatischen Patienten mit stabiler Kreislaufsituation ergibt sich eine deutliche Mortalitätsreduktion von ca. 20 Prozent im Vergleich zur ACE-Hemmer-Therapie [8]. Es gilt jedoch Blutdruck- und Nierenwerte streng im Blick zu halten und gegebenenfalls Dosisanpassungen vorzunehmen. Dies, wohl wissend, dass Mortalitätsvorteile in den randomisierten Studien stets unter Ausdosierung des jeweiligen Medikaments erzielt wurden.
Herzinsuffizienz mit erhaltener Pumpfunktion
Mit der Einführung der Zwischenkategorie HFmrEF (Heart Failure with mildly reduced EF) und neueren Daten zur HFpEF (erhaltener EF) verschwimmen die Grenzen zwischen den Entitäten der Herzinsuffizienz. Der Nutzen von SGLT2-Hemmern zeigt sich auch hier – etwa in EMPEROR-Preserved und DELIVER, großen randomisierten Studien zur HFpEF [9, 10]. Gleichzeitig versprechen positive Daten aus Subgruppenanalysen zu Finerenon, ein nicht-steroidaler Mineralokortikoidrezeptor-Antagonist und GLP-1-Rezeptoragonisten (zum Beispiel Semaglutid) letztere bei Patienten mit hohem BMI bei Patienten mit HFpEF vielversprechende Daten [11, 12]. Dies ist insbesondere im lange stagnierenden Bereich der HFpEF erfreulich, in dem es in den vergangenen Jahren bei stetig steigenden Inzidenzen wenig Hoffnung auf eine wirksame medikamentöse Therapie gab.
Zurück zur Kasuistik: Die Patientin wird stationär aufgenommen. Nach eintägiger Rekompensation mittels i.v.-Schleifendiuretikum erfolgt das Einleiten einer Herzinsuffizienztherapie mittels ARNI, SGLT-2-Inhibitor und Betablocker. Bei sich leicht verschlechternder GFR wird zunächst auf die MRA-Therapie verzichtet. Nach Ausschluss einer stenosierenden KHK sowie Klappenvitien und relevanter Rhythmusstörungen wird die Patientin entlassen. Nach sechs Wochen medikamentöser Herzinsuffizienztherapie zeigt sich bei deutlicher klinischer Besserung auch eine verbesserte systolische LV-Funktion im Sinne einer HFimpEF sowie ein deutlich gebesserter BNP-Wert. Die Medikation wird unverändert fortgesetzt eine Indikation zur primärprophylaktischen ICD-Implantation besteht nicht mehr.
Kasten: Das Wichtigste in Kürze

Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autoren

Professor Dr. Sebastian Kufner 1
1
Chefarzt der Klinik für Kardiologie
und internistische Intensivmedizin
Helios Klinikum München West,
Steinerweg 5, 81241 München
Teilen:
Das könnte Sie auch interessieren:







