Neu in der Kardiologie – Rhythmologie
 Kardiologie
Kardiologie
Die kardiale Elektrophysiologie bzw. Rhythmologie hat sich über die vergangenen zwei Jahrzehnte zu einem überaus wichtigen Bereich der Kardiologie entwickelt, der durch eine rasante Fortentwicklung der wissenschaftlichen Erkenntnisse aber auch spezialisierter Technologien immer neue Behandlungsmöglichkeiten für Patientinnen und Patienten mit Herz-Rhythmusstörungen erschließen konnte. Viele wissenschaftliche Untersuchungen und technologische Weiterentwicklungen bei invasiven Behandlungsmethoden (Katheter-Ablationen, implantierbare Geräte), sorgten für die Entwicklung und Verbesserung evidenzbasierter Behandlungsstrategien. Aufgrund der immensen Anzahl der betroffenen Patienten wollen wir im folgenden Artikel gerade auch auf Fortschritte bei der Behandlung von Vorhofflimmern, der „rhythmologischen Volkskrankheit Nr. 1“, eingehen: Immerhin leiden ca. zwei Prozent der Gesamtbevölkerung an Vorhofflimmern, allein in Deutschland ca. 1,8 Millionen Menschen. Dabei steigt die Prävalenz mit dem Alter an, bei den über 70-jährigen sind knapp zehn Prozent der Bevölkerung betroffen. Neue Behandlungsstrategien ermöglichen es, die bei Vorhofflimmern erheblich gesteigerte kardiale Morbidität und Mortalität zu senken, gerade auch wenn Vorhofflimmern eine Herzinsuffizienz induziert oder aggraviert. Im Folgenden berichten wir über Fortschritte in der kardialen Bildgebung, die mittlerweile neben der anatomischen Information auch pathophysiologisch bedeutsame, funktionelle Vorgänge, und noch dazu in 3D, darstellen kann. Und zuletzt zeigen wir auf, wie sich die Risiko-Evaluierung und die Behandlungsmöglichkeiten bei lebensbedrohlichen ventrikulären Arrhythmien (ventrikuläre Tachykardien, plötzlicher Herztod) verbessert haben.
Fall 1
Ein 71-jähriger Patient präsentiert sich mit seit ca. drei Monaten zunehmender Dyspnoe und Leistungseinschränkung. In der Anamnese findet sich eine bekannte koronare Herzkrankheit (KHK) mit invasivem Ausschluss interventionsbedürftiger Stenosen vor drei Jahren bei damals echokardiografischem Normalbefund sowie in einem Langzeit-EKG einmalig dokumentiertem 6-minütigem (asymptomatischem) paroxysmalem Vorhofflimmern.
Im Aufnahme-EKG zeigt sich Vorhofflimmern mit eher tachykarder Überleitung (94 S/min.). Es liegt eine pulmonale Stauung mit beginnenden Knöchelödemen vor und im UKG zeigt sich eine neu aufgetretene global mittelgradig eingeschränkte Pumpfunktion (Ejektionsfraktion [EF] 47 Prozent – siehe Tabelle 1) mit dilatierten Vorhöfen bei einer funktionellen Mitralinsuffizienz I-II°. Laborchemisch fallen ein stauungsbedingter Anstieg der Transaminasen sowie ein erhöhtes NT-proBNP von 1.800 pg/ml auf. Bei neu aufgetretener Herzinsuffizienz auf dem Boden von nun persistierendem, eher tachykard übergeleitetem Vorhofflimmern erfolgt die sofortige Initiation einer oralen Antikoagulation mit einem NOAK bei einem individuell berechneten CHADSvasc score von 3 (Alter > 65 Jahre, neu aufgetretene Herzinsuffizienz und vaskuläre Erkrankung; Tabelle 2). Ferner erfolgt die Initiation einer Betablockade, Diuretika-Gabe und einer angepassten Herzinsuffizienz-Medikation mit niedrig dosiertem Angiotensin-Rezeptor-Neprilysin-Inhibitor Sacubitril/Valsartan und dem Mineralokortikoid-Rezeptor-Antagonisten Spironolacton.
Parallel zur Rekompensation werden mit dem Patienten die Möglichkeiten der Rhythmuskontrolle besprochen: Bei vorbekanntem paroxysmalem Vorhofflimmern wird aufgrund des deutlich besseren Langzeitergebnisses eine Katheterablation des Vorhofflimmerns mittels elektrischer Isolation der Pulmonalvenen (PVI) empfohlen. Präprozedural erfolgt ein Ausschluss intrakardialer Thromben mittels Niedrig-Dosis CT, wobei gleichzeitig ein Progress der KHK im simultan durchgeführten Koronar-CT ausgeschlossen wird. Nach komplikationsloser Katheterablation mittels 3D-Mapping und Radiofrequenz-(RF)-Ablation in High-Power-Short-Duration (HPSD)-Technik (Abbildung 1) kann der Patient nach Abschluss der Rekompensation im stabilen Sinusrhythmus mit verbessertem echokardiografischem Befund nach Hause entlassen werden. In der kurzfristigen Nachsorge nach einem und drei Monaten in der Rhythmusambulanz und beim niedergelassenen Kardiologen zeigt sich eine normalisierte linksventrikuläre Ejektionsfraktion (LV-EF) sowie eine Normalisierung der kardialen Diameter und der MI auf ≤ I°. Medikamentös erfolgt bis auf weiteres eine Fortführung der oralen Antikoagulation, die Herzinsuffizienz-Medikation kann sukzessive ausgeschlichen werden, wobei eine milde Beta-Blockade belassen wird.
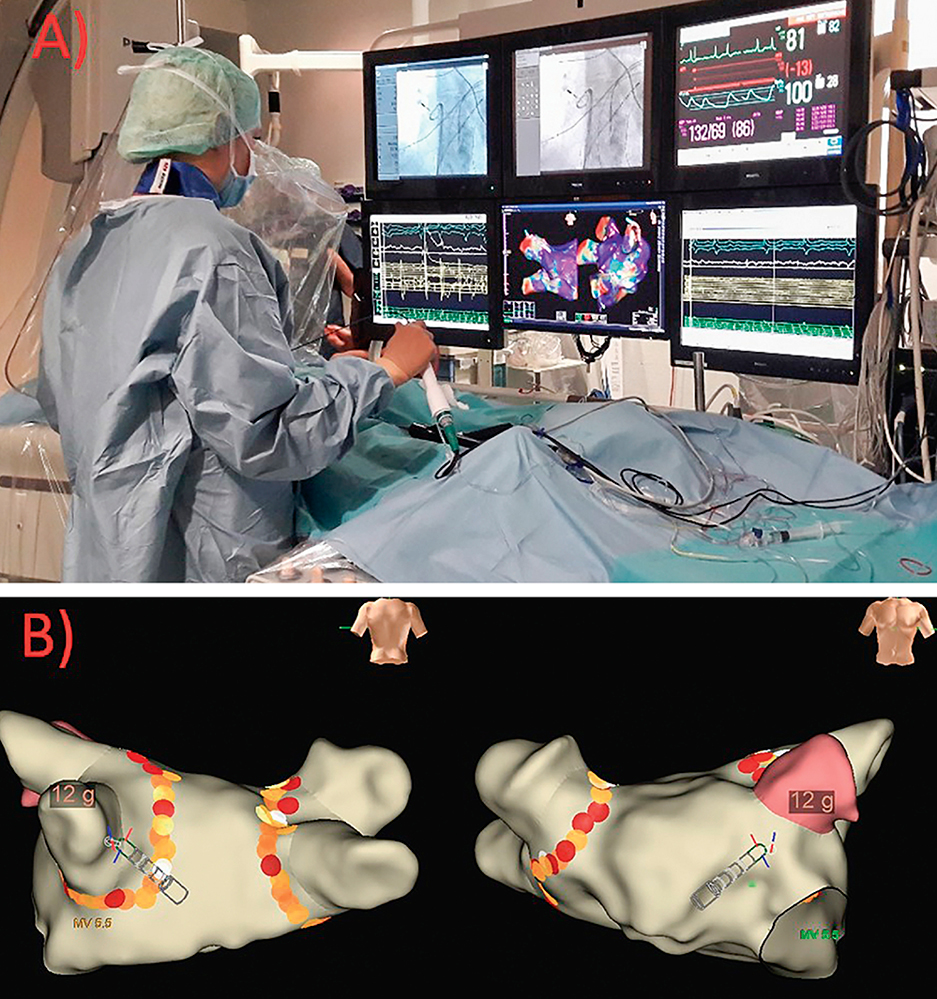
Abbildung 1: A) Blick in das elektrophysiologische Katheterlabor. Auf den Monitoren sind Röntgenbild, Hämodynamik, EKG-Messplatz und 3D-Mapping-System während einer PVI zu sehen.
B) zeigt eine posteriore Ansicht (links) und eine anteriore Ansicht (rechts) auf die 3D-Rekonstruktion eines linken Vorhofs im Rahmen einer PVI. Die gelb-orange-roten Punkte repräsentieren die Ablationslinien um die linken und rechten Pulmonalvenen. Die Farbgebung der einzelnen Linienpunkte (gelb bis rot) repräsentiert die gemessene Kontaktkraft des Ablationskatheters an das Vorhofgewebe während der Ablationen.
Diskussion
Beim Vorhofflimmern, der „rhythmologischen Volkskrankheit Nr. 1“, hat sich in den vergangenen Jahren ein Paradigmenwechsel ergeben, da immer mehr erkannt wurde, wie sehr Vorhofflimmern einen signifikanten, negativen Effekt auf die kardiovaskuläre Morbidität und Mortalität hat. Am deutlichsten wurde dies in der EAST-AF-net-Studie nachgewiesen: Hier wurde bei 2.789 Patienten mit neu aufgetretenem Vorhofflimmern und kardiovaskulärem Risikoprofil eine Rhythmuskontrolle mit dem Ziel, den Sinusrhythmus zu erhalten, mit einer reinen Frequenzkontrolle bzgl. des kombinierten Endpunktes aus kardiovaskulärem Tod, Stroke, Hospitalisierung wegen Herzinsuffizienzverschlechterung oder akutem Koronar-Syndrom (ACS) randomisiert verglichen. Es zeigte sich, dass die frühe Rhythmuskontrolle (mittels medikamentöser Therapie und gegebenenfalls Kardioversion oder Ablation) der Frequenzkontrolle signifikant überlegen ist. Bemerkenswert ist, dass dieser Effekt auch bei bzgl. des Vorhofflimmerns asymptomatischen Patienten nachweisbar war.
Bezüglich der „besten“ Rhythmuskontrolle hat sich in den vergangenen drei Jahren bei paroxysmalem Vorhofflimmern gleich in mehreren randomisierten Studien eine signifikante Überlegenheit der „first line“ Katheterablation gegenüber einer erstmaligen antiarrhythmischen Medikation gezeigt bzgl. der Freiheit von Vorhofflimmern, mit Erfolgsraten der Ablation zwischen 70 bis 80 Prozent nach einer Ablation bei gleichzeitig sehr niedriger prozedur-assoziierter Komplikationsrate (<5 Prozent). Dies beruht wesentlich auf deutlich verbesserten Technologien, die bei der Pulmonalvenenisolation (PVI) verwendet werden: Einerseits mit dem oben beschriebenen „High-Power-Short Duration“-RF-Verfahren mit erheblich verkürzten Prozedurzeiten von ca. 70 bis 90 Minuten und einer verbesserten Effektivität von ca. 70 bis 80 Prozent Vorhofflimmer-Freiheit nach einer Prozedur. Andererseits durch Weiterentwicklung der sogenannten Single-shot-Devices wie zum Beispiel dem Cryo-Ballon-Verfahren und zuletzt durch die moderne Pulsed Field Ablation (PFA), mit der eine komplette elektrische Isolation aller Pulmonalvenen oft schon in weniger als 60 Minuten gelingt.
Ebenfalls in den Fokus rückte die unheilvolle Allianz von Vorhofflimmern und Herzinsuffizienz, bei der einerseits ein deutlich erhöhtes Risiko für Vorhofflimmern vorliegt, wobei andererseits aber auch das Vorhofflimmern alleine schon zu einer Herzinsuffizienz führen kann (Abbildung 2). Für Patienten mit der Kombination aus Vorhofflimmern und erheblich eingeschränkter systolischer Pumpfunktion (EF < 35 Prozent) konnte dabei in der Castle AF-Studie [2] eine Halbierung der Mortalität durch eine Rhythmuskontrolle mittels Katheterablation von Vorhofflimmern nachgewiesen werden. In der CABANA-Studie [3] mit ca. 2.200 Patienten (randomisierter Vergleich der Katheterablation vs. einer Rhythmus- oder Frequenzkontrolle) ergab sich in der Subanalyse der ganz überwiegend an einer diastolischen Herzinsuffizienz leidenden Patienten (HFpEF; heart failure with preserved ejection fraction) ebenfalls ein signifikant verbessertes Outcome bzgl. des primären Endpunktes aus Tod, Stroke, Major-Blutung und Herzstillstand durch die Ablation.
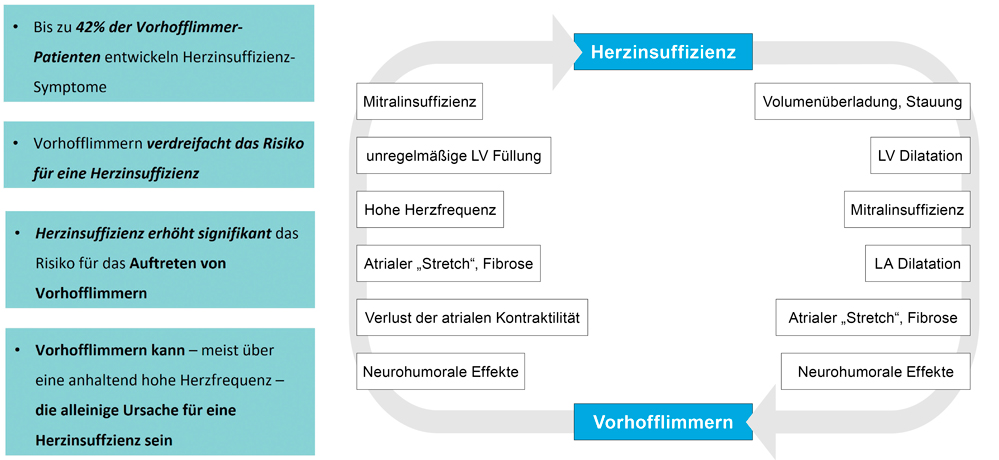
Abbildung 2: Schema der Pathomechanismen von sich gegenseitig aggravierender Herzinsuffizienz und Vorhofflimmern.
Daneben sind beim Vorhofflimmer-Management aber auch nicht-invasive Therapiestrategien in den Fokus gerückt: Fortschritte im Bereich der oralen Antikoagulation mit den sogenannten
neue orale Antikoagulantien (NOAKs), ein „aggressives“ Management der wichtigsten Vorhofflimmer-Risikofaktoren Adipositas/Inaktivität, Bluthochdruck und Diabetes Mellitus und eine verbesserte medikamentöse Therapie einer evtl. begleitenden Herzinsuffizienz mit Angiotensin-Rezeptor-Neprilysin-Inhibitor Sacubitril/Valsartan, Mineralokortikoid-Rezeptor-Antagonisten und SGLT2-Rezeptor-Antagonisten haben die Prognose dieser Patienten weiter verbessert.
Fall 2
Ein 63-jähriger Landwirt wird von seiner Ehefrau in die Notaufnahme der Klinik gebracht. Seit mehreren Stunden leidet er unter neu aufgetretener Dyspnoe mit thorakalem Engegefühl und war mehrfach synkopiert. Bekannt ist eine ischämische Kardiomyopathie mit hochgradig eingeschränkter LV-Funktion von 25 Prozent bei koronarer Dreigefäßerkrankung. Vor 15 Jahren erlitt er einen Myokardinfarkt der Hinterwand mit Intervention der RCA. Seitdem bestehen eine medikamentöse Thrombozytenaggregationshemmung mit Aspirin sowie eine Statin- und eine Herzinsuffizienz-Therapie. Vor fünf Jahren erfolgte zudem die primärprophylaktische Implantation eines VVI-ICD-Systems. Im umgehend aufgezeichneten 12-Kanal-EKG präsentierte sich eine monomorphe ventrikuläre Tachykardie (VT) mit einer Herzfrequenz von 160/min. Die periphere O2-Sättigung betrug 94 Prozent, der Blutdruck lag bei 85/61 mmHg, der Patient war zum Zeitpunkt der Aufnahme wach und ansprechbar. Es erfolgten dann eine Blutentnahme zur Kontrolle der Laborwerte sowie eine Abfrage des ICD-Systems, wobei sich eine einprogrammierte Therapiezone des Systems oberhalb von 180/min zeigte. Ein Versuch die VT mit Hilfe eines Programmiergerätes manuell über den ICD überzustimulieren gelang leider nicht, sodass im nächsten Schritt eine erfolgreiche externe Kardioversion mit 200 Joule erfolgte. Eine von radialem Zugang durchgeführte Koronarangiografie ergab einen stabilen Befund der bekannten koronaren Dreigefäßerkrankung ohne Interventionsbedarf. Die zwischenzeitlich verfügbaren Laborwerte des Patienten ergaben keinen relevanten pathologischen Befund, insbesondere die Schilddrüsen- und Elektrolytwerte waren normwertig. Unter Monitor-Überwachung auf der Intermediate Care Station kam es nach wenigen Stunden zu einem erneuten Auftreten der ventrikulären Tachykardie und der damit einhergehenden klinisch stark belastenden Symptomatik. Anhand der 12-Kanal-Morphologie der VT konnte deren Ursprung in der bestehenden Hinterwand-Narbe des linken Ventrikels verortet werden. In der daraufhin durchgeführten Katheterablation konnte der VT-Mechanismus durch hochauflösendes 3D-Mapping präzise im Bereich der Hinterwandnarbe nachvollzogen und gleichzeitig erfolgreich abladiert werden (Abbildung 3). Während der anschließenden weiteren stationären Überwachung bestand durchwegs stabiler Sinusrhythmus, es kam zu keinem erneuten Auftreten ventrikulärer Herzrhythmusstörungen, die Frequenz-Zonen der ICD-Therapie wurden in einer erneuten Aggregatkontrolle optimiert. Nach zwei Tagen konnte der Patient in stabilem Zustand in die Häuslichkeit entlassen werden. Eine Verlaufskontrolle nach sechs Monaten bestätigte die Rezidivfreiheit von VT.
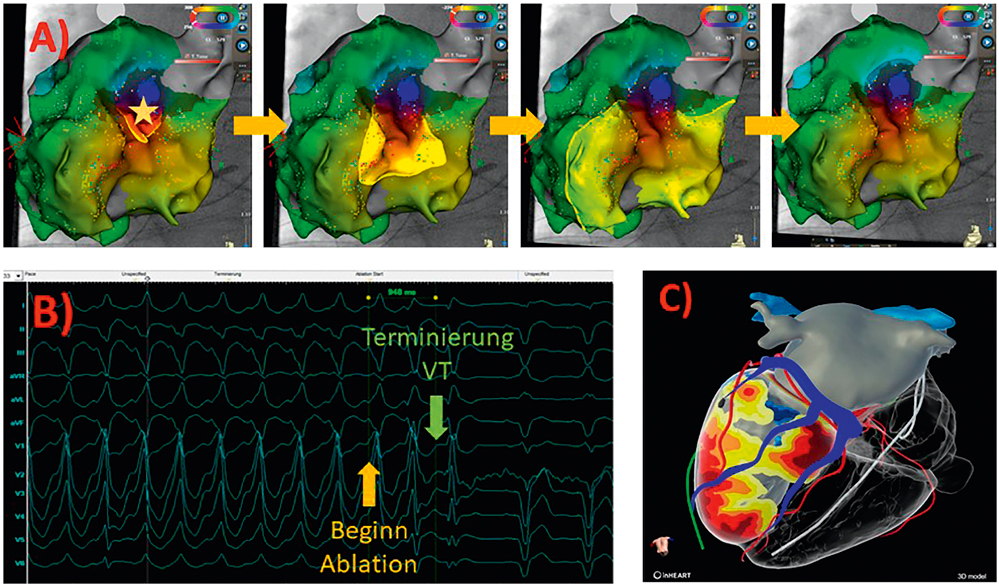
Abbildung 3: A) zeigt posteriore Ansichten der linksventrikulären Patientenanatomie. Durch 3D-Mapping konnte ein intrakardiales Abbild der VT erstellt werden, die der VT zugrundeliegende kreisende Aktivierung ist anhand des Farbverlaufs und der durch die helle Fläche dargestellten elektrischen Aktivierung visuell nachvollziehbar. Der gelbe Stern markiert den sogenannten „Isthmus“ als kritische Engstelle des VT-Mechanismus. Durch Ablation dieses Isthmus (B) kann eine sofortige Terminierung der laufenden VT erzielt werden. C) stellt eine 3D-Rekonstruktion funktioneller CT-Bildgebung dar. Die rot-orange-gelben Areale zeigen eine von basal bis apikal und lateral reichende Hinterwandnarbe nach Myokardinfarkt an. Linksatriale und linksventrikuläre Anatomie sind grau, das rechte System ist transparent mit liegender ICD-Sonde dargestellt. Venöse Koronargefäße sind blau, arterielle sind rot visualisiert.
Diskussion
Das Auftreten von ventrikulärer Tachykardie (VT) stellt einen oft lebensbedrohlichen klinischen Zustand dar und bedarf einer sofortigen internistisch-kardiologischen Diagnostik und Therapie. Im Gegensatz zur physiologischen elektrischen Aktivierung der Ventrikel führt die VT nur zu einer insuffizienten ventrikulären Kontraktion und somit zu einem deutlich verminderten Herzzeitvolumen und hämodynamischer Kompromittierung des Patienten. Während ventrikuläre Tachykardien selten idiopathisch beim Herzgesunden oder sekundär im Rahmen von zum Beispiel Elektrolytentgleisungen auftreten, sind sie klinisch meistens durch strukturelle Schädigung des ventrikulären Myokards bei ischämischer oder dilatativer Kardiomyopathie (zum Beispiel Narbe nach Myokardinfarkt) bedingt. Die strukturelle Schädigung des Myokards bewirkt eine Verzögerung der elektrischen Signalweiterleitung, sodass es zum Auftreten sogenannter Reentry-Tachykardien kommen kann - einer kreisenden elektrischen Aktivierung im Ventrikel, im Oberflächen-EKG als Bild einer VT erkennbar. Handelt es sich um eine stabil kreisende elektrische Aktivierung, zum Beispiel durch eine nach einem Myokardinfarkt der Hinterwand aufgetretene, anatomisch fixierte Myokardnarbe, zeigt sich im EKG das Bild einer monomorphen VT. Eine polymorphe VT bildet sich bei instabilen oder wechselnden Aktivierungsmustern aus. Die polymorphe VT zeigt dabei ein noch größeres Risiko in Kammerflattern oder -flimmern zu degenerieren. Durch den Einsatz von (neuartigen) ICD-Systemen (siehe Patientenfall Nummer 3) können VT zwar terminiert und dadurch die kardiale Mortalität dieser Population reduziert werden, jedoch führen ICD nicht zu einer Reduktion der weiteren VT-Inzidenz und die an sich lebensrettenden ICD-Therapien bedeuten für die betroffenen Patienten eine ernstzunehmende Verschlechterung ihrer Lebensqualität.
Die aktuellen Leitlinien der Deutschen Gesellschaft für Kardiologie und European Society of Cardiology (ESC) [4] stellen nun den großen Nutzen einer Katheterablation von VTs in den Fokus. Die Katheterablation ermöglicht eine ursächliche Therapie ventrikulärer Tachykardien, indem sie die Regionen narbenbedingter myokardialer Leitungsverzögerung derart modifiziert, dass ursprünglich durch die Narbe bedingte VTs nicht mehr ausgelöst werden können. Dieses Verfahren stellt für von VT betroffene Patienten eine effektive Therapieoption dar und die Leitlinien sehen eine Evidenz-Klasse-I-Indikation zur Katheterablation für Patienten mit rezidivierenden VT trotz medikamentöser antiarrhythmischer Therapie sowie für Patienten, die von in kurzer Zeit wiederholt auftretenden VT („elektrischer Sturm“) betroffen sind, vor. Basierend auf den Ergebnissen der SMASH-VT [5] und VTACH-Studien [6], kann die Ablation ischämischer VT bereits nach einem ersten VT-Ereignis als Primärtherapie empfohlen werden. Die kürzlich publizierte randomisierte PARTITA-Studie [7] zeigt darüber hinaus, dass die VT-Ablation bei Patienten mit ischämischer Kardiomyopathie auch eine hochsignifikante prognostische Relevanz hinsichtlich Mortalität und Herzinsuffizienz besitzt.
Während einer VT-Katheterablation wird in einem ersten prozeduralen Schritt eine hochaufgelöste „Landkarte“ (3D-Mapping) des betroffenen Ventrikels durch meist von einem femoralem Zugang aus eingebrachte Katheter angefertigt. Dabei erhält der Untersucher anatomische und elektrische Information über strukturelle myokardiale Narben (zum Beispiel die Position und Charakteristik der relevanten Infarktnarbe) und kann den der ventrikulären Tachykardie zugrundeliegenden Mechanismus genau nachvollziehen (Abbildung 3A). Im zweiten prozeduralen Schritt abladiert er auf diesen Informationen aufbauend diejenigen Bereiche des ventrikulären Myokards, welche für die Aufrechterhaltung der Tachykardie relevant sind (Abbildung 3B). Mit diesem Verfahren kann bei ischämischen VTs eine 1-Jahres-Erfolgsrate von 80 bis 90 Prozent erzielt werden. Neue nicht-invasive Methoden ermöglichen zudem die Visualisierung und 3D-Darstellung myokardialer Narben und VT-Mechanismen durch funktionelle MRT- oder CT-Bildgebung (Abbildung 3C). Diese 3D-Darstellungen können direkt in das 3D-Mapping während Katheterablationen integriert werden und bieten dem Untersucher dadurch zusätzliche Orientierung und Einblicke in Anatomie und relevante VT-Mechanismen.
Fall 3
In der Herzinsuffizienz-Ambulanz stellt sich ein 67-jähriger Patient mit ischämischer Kardiomyopathie und einer erheblich reduzierten LV-EF von 31 Prozent vor. Er leidet trotz einer optimalen Herzinsuffizienz-Medikation weiterhin unter einer Dyspnoe NYHA III. Bei einem zusätzlich bestehendem Linksschenkelblock mit einer QRS-Dauer von 173 ms wird im Herzinsuffizienz-(Heart Failure; HF) Team die Entscheidung zu einer Versorgung mit einem ICD System mit kardialer Resynchronisation (cardiac resynchronization, CRT-ICD) mit Anlage einer endovenösen (links-ventrikulären) Sonde im Coronarvenensinus (CS) gefällt. Im Rahmen des Eingriffs zeigt sich leider in den Seit-Ästen des CS nur eine einzige Ziel-Vene bezüglich der optimalen Resynchronisation von linkem und rechtem Ventrikel geeignet, dort zeigt sich zunächst auch eine zufriedenstellende Reizschwelle. Die Lage der LV-Sonde in diesem CS-Seit-Ast ist jedoch instabil. Deshalb fällt intra-operativ die Entscheidung zum Versuch einer Stimulation des spezifischen Reizleitungssystems, um doch noch eine für die Behandlung der Herzinsuffizienz so wichtige synchrone rechts- und linksventrikuläre Kontraktion zu erreichen. Dafür erfolgt die Anlage einer Stimulationselektrode im Bereich des linken Schenkels mittels einer spezifischen, neu-entwickelten Sonde, die von rechtsventrikulär aus transseptal bis in den Bereich des linken Schenkels eingeschraubt wird. Nun kann durch diese „physiologische“ gleichzeitige Stimulation beider Schenkel ein deutlich schlankerer QRS-Komplex von 110 ms ohne typische linksschenkelblock-förmige Deformation erreicht werden (Abbildung 4). Bereits vor Verlassen des Krankenhauses kann in der trans-thorakalen Echokardiografie ein deutlich verbessertes Kontraktionsverhalten der Ventrikel mit Anhebung der LV-EF auf ca. 40 Prozent nachgewiesen werden, mit einer Verbesserung der NYHA-Klasse auf II im mittelfristigen Verlauf.
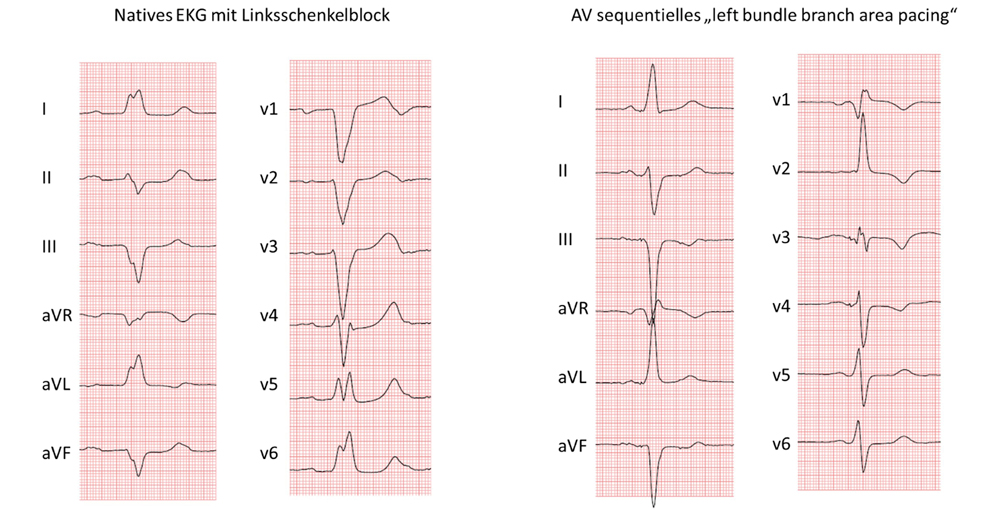
Abbildung 4: In der linken Bildhälfte das native EKG im Sinusrhythmus mit intrinsischer Überleitung und mit breitem Linksschenkelblock, QRS Breite ca. 170ms mit typischer doppelgipflig positivem QRS in I und QS-Konfiguration in V1-V3. In der rechten Bildhälfte atrial getriggerte ventrikuläre Stimulation mit deutlich schlankerem QRS (ca. 120ms) und deutlich veränderter R-Progression in den Brustwänden mit RSB-förmiger Deformation in V1 und (Stimulationsbedingten) Repolarisation-Störungen in V1-V4. Das Ziel einer erheblich schnelleren und synchroneren Depolarisation beider Ventrikel mit entsprechend dynamischeren und damit verbesserter Kontraktilität konnte hier voll erreicht werden.
Diskussion
Im Bereich der implantierbaren kardialen Devices sind Herzschrittmacher (HSM) und Defibrillatoren (ICD) sowie Systemen zur kardialen Resynchronisation (CRT) etablierte Therapien zur Behandlung von bradykarden bzw. tachykarden Herzzrhythmusstörungen sowie der Linksherzinsuffizienz. Es handelt sich bei allen Gerätearten um sehr sichere und ausgereifte Medizinprodukte, die jährlich tausenden Patienten in Deutschland das Leben retten oder die Lebensqualität verbessern.
Wie im vorliegenden Fall gezeigt, konzentrieren sich die Forschung und klinische Anwendung in der Device-Therapie zunehmend auf eine möglichst physiologische Stimulation des Reizleitungssystems. Die direkte Stimulation des His-Bündels oder des linken Tawara-Schenkels werden aktuell als optimale Stimulationsorte diskutiert. Eine Stimulation des Reizleitungssystems verspricht eine physiologischere und synchronere Erregung der Ventrikel als eine konventionelle rechtsventrikuläre Stimulation, da diese zur asynchronen Kontraktion des linken Ventrikels führt und eine bestehende Linksherzinsuffizienz verschlechtern oder sogar verursachen kann. Große Beobachtungsstudien zeigen eine signifikante (30 bis 50 Prozent) Risikoreduktion für die Mortalität oder Hospitalisierung bei Herzinsuffizienz bei His-Bündel- oder Linksschenkelstimulation gegenüber der konventionellen RV-Stimulation.
Die direkte Stimulation des Reizleitungssystems beim sogenannten „conduction system pacing“ könnte auch eine Alternative oder sogar Verbesserung zur etablierten CRT-Therapie bei Linksherzinsuffizienz darstellen, die zur Resynchronisation eine biventrikuläre Stimulation über eine klassische rechtsventrikuläre und eine linksventrikuläre Sonde im Coronarsinus verwendet. Allerdings sollte es hierfür noch eine technologische Weiterentwicklung des conduction system pacings geben, um die anspruchsvolle Sondenimplantation zur Stimulation des Reizleitungssystems zu erleichtern.
Betrachtet man die möglichen Komplikationen der modernen Geräte-Therapie, so sind diese ganz überwiegend direkt „Sonden-assoziiert“: akut mit dem Einbringen und der Platzierung der transvenösen Elektroden (zum Beispiel Pneumothorax, Sondendislokation) oder langfristig mit einem notwendigen Wechsel bzw. Entfernung der Elektroden (zum Beispiel bei Sondenbruch, Isolationsdefekt oder Infektion). Viele Innovationen im Bereich der Device-Therapie zielen daher darauf ab, die Risiken von Sonden-assoziierten Komplikationen zu reduzieren.
Beim „leadless pacer“ oder sondenlosen HSM wird ein kapselförmiger Herzschrittmacher über die V. femoralis kathetergestützt eingebracht und direkt im rechten Ventrikel unter Verzicht auf eine Elektrode implantiert (Abbildung 5). Aktuell ist zwar nur ein Modell marktverfügbar, doch zukünftig sind von mehreren Herstellern sondenlose HSM zu erwarten. Durch Miniaturisierung ist dieser kapselartige HSM nur ca. 2,6 cm lang, wiegt 1,75 g und verspricht eine Laufzeit von 8 bis 13 Jahren. Die erste Geräte-Generation war als Einkammer-HSM lediglich für eine kleine Zielgruppe geeignet, das heißt für Patienten mit bradykardem Vorhofflimmern. Der Implantationserfolg ist mit 99 Prozent hoch und die Funktion sehr stabil. Eine anfänglich erhöhte Rate an Perikardergüssen und Tamponaden bei Implantation hat sich mit septaler Zielregion und Erfahrung deutlich reduziert und ist jetzt vergleichbar zur traditionellen HSM Implantation. Eine Überlegenheit konnte der sondenlose HSM bzgl. Reinterventionsrate und chronischen Komplikationen zeigen. Die zweite Geräte-Generation kann über einen Bewegungssensor die mechanische Vorhofaktivität wahrnehmen und somit eine zeitliche Abstimmung zwischen Vorhof (A) und Ventrikel (V) ermöglichen. Diese „AV-synchrone“ Arbeitsweise macht den sondenlosen HSM auch für Patienten mit relevanten AV-Blockierungen attraktiv. Schließlich ist auch bereits ein echtes Zweikammer-System mit kommunizierenden, sondenlosen HSM im Vorhof und Ventrikel bereits in der Studienphase, sodass wahrscheinlich auch zukünftig alle HSM Indikationen über die sondenlosen HSM abgebildet werden können. Bereits heute ist der sondenlose HSM nach den ESC-Guidelines eine Klasse IIa Empfehlung, wenn kein Venenzugang zu den oberen Extremitäten vorhanden ist oder wenn das Risiko einer Infektion der Gerätetasche besonders hoch ist, zum Beispiel nach früheren Infektionen und bei hämodialysepflichtigen Patienten.
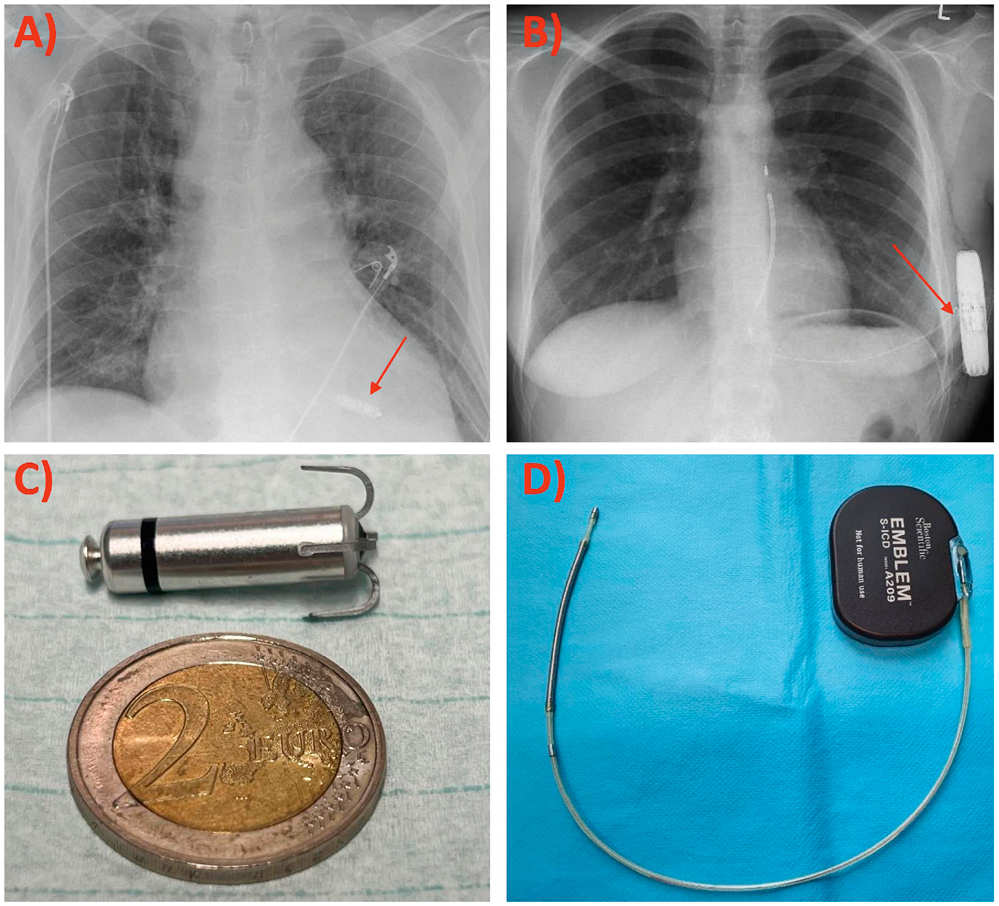
Abbildung 5: A) Röntgen-Thorax nach Implantation eines sondenlosen HSM. Der miniaturisierte Schrittmacher projiziert sich im Bild auf den rechten Ventrikel (roter Pfeil). B) Röntgen-Thorax nach Implantation eines subkutanen ICD (S-ICD). Das Aggregat liegt außerhalb des Brustkorbs (roter Pfeil), die Sonde verläuft parallel zum Brustbein, ebenfalls unter der Haut. C) Sondenloser HSM (in Relation zu einer 2-Euro-Münze). D) Modell des Subkutanen ICD (S-ICD) Aggregat mit angeschlossener Sonde.
Das Bestreben, auch bei den implantierbaren Defibrillatoren/Cardiovertern auf eine transvenöse Schocksonde zu verzichten, führte 2009 zur Einführung eines rein subkutanen Defibrillators (Abbildung 4). Die Defibrillationssonde liegt subkutan, parallel zum Sternum und zieht entlang des Rippenbogens zum mid-axillären Aggregat unterhalb des M. latissimus dorsi. Der subkutane implantierbare Kardioverter-Defibrillator (S-ICD) ist nahezu doppelt so groß und schwer (130 g) wie ein konventioneller ICD aufgrund der größeren Batterie, die eine Defibrillationsenergie von 80J aufbringen muss. Hierdurch wird eine Defibrillationseffektivität von 98 Prozent erreicht. Ein geringerer Anspruch an Biegsamkeit führt zu einem dickeren, robusten Sondendesign ohne Anfälligkeit für Elektrodenbrüche. Andere mit transvenösen Elektroden in Verbindung stehende Komplikationen wie Pneumothorax, Perforation, Tamponade, hämatogene Infektion und risikoreiche Sondenextraktionen sind beim S-ICD minimiert oder vollständig beseitigt. Aus dem fehlenden Kontakt zum Herzen resultiert jedoch auch die größte Limitation des S-ICD, eine fehlende Stimulationsmöglichkeit des Herzens. Folglich ist der S-ICD keine Option für Patienten mit Stimulationsbedarf bei Bradykardie oder für Patienten mit ventrikulären Tachykardien, die von einer schmerzfreien Überstimulation profitieren. Ansonsten sollte der S-ICD gemäß ESC-Empfehlung (Klasse IIa) als Alternative zum transvenösen ICD berücksichtigt werden.
Ausblick
Ab nächstem Jahr steht mit einem extravaskulären ICD eine potenzielle Alternative zur Verfügung. Dieses Gerät versucht die Vorteile des subkutanen und des herkömmlichen ICD-Systems, das heißt Verzicht auf eine transvenöse Sonde bei gleichzeitiger Möglichkeit zur antibradykarden sowie antitachykarden Stimulation, zu vereinen. Hierzu wird die Schockelektrode retrosternal bis nahe ans Herz implantiert. Erste Ergebnisse bzgl. Defibrillationseffektivität und Sicherheit sind überzeugend, erste Daten bzgl. der Tolerierbarkeit der Stimulation, des Überstimulationserfolgs sowie der Rate an inadäquaten Schocks bleiben noch hinter den Erwartungen zurück.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
Bei Vorhofflimmern wird aufgrund der erhöhten kardiovaskulären Morbidität/Mortalität eine frühe, aggressive Behandlung im Sinne einer Rhythmuskontrolle mit dem Erhalt/Wiederherstellung des Sinusrhythmus propagiert. Hier hat sich die Katheter-Ablation als erfolgreiche und sichere Methode etabliert. Mit den sogenannten neue orale Antikoagulantien (NOAKs) und einer erweiterten Herzinsuffizienz-Medikation konnte die Prognose weiter verbessert werden.
Bei ventrikulären Arrhythmien haben Fortschritte in der Bildgebung (Cardio-MRT, funktionelles Cardio-CT) zu einem verbesserten Verständnis der Pathophysiologie geführt. Vor allem die Fortschritte im invasiven „3D-Mapping“ führten zu deutlich verbesserten Erfolgsaussichten der Katheterablation und damit zur Ausweitung der Ablations-Indikation bei ventrikulären Tachykardien.
Im Bereich der implantierbaren kardialen Geräte zielen Innovationen wie der sondenlose Schrittmacher, der subkutane, extravasale implantierbare Kardioverter-Defibrillator (ICD) sowie die gezielte Stimulation des Reizleitungssystems darauf ab, die Risiken von Sonden-assoziierten Komplikationen zu reduzieren und die Stimulationstherapie immer mehr der physiologischen Erregungsausbreitung anzugleichen.
Autoren

PD Dr. Felix Bourier, Oberarzt,
Abteilung für Elektrophysiologie

Prof. Dr. Isabel Deisenhofer,
Leiterin der Abteilung für Elektrophysiologie

PD Dr. Carsten Lennerz, Oberarzt,
Abteilung für Elektrophysiologie
Deutsches Herzzentrum München,
Klinik an der Technischen Universität
München (TUM),
Lazarettstr. 36, 80636 München
Korrespondenz an: Deisenhofer@dhm.mhn.de
Teilen:
Das könnte Sie auch interessieren: