Neu in der Hals-, Nasen- und Ohrenheilkunde
 Hals-, Nasen- und Ohrenheilkunde
Hals-, Nasen- und Ohrenheilkunde
In den vergangenen Jahren haben pharmakologische und medizintechnische Entwicklungen die Behandlung gleich mehrerer Erkrankungen des Hals-, Nasen- und Ohrenbereiches beeinflusst. Die Immuntherapie mittels Checkpoint-Inhibitoren ist inzwischen ein fester Bestandteil der Therapiekonzepte von Kopf-Hals-Tumoren und hat einen deutlichen Einfluss auf das Überleben von Patientinnen und Patienten mit fortgeschrittenen Karzinomen im Kopf-Hals-Bereich. In der Therapie der obstruktiven Schlafapnoe steht Patienten mit der Stimulationstherapie des Nervus hypoglossus eine völlig neue Therapieform zur Verfügung. Die Einführung von Antikörpertherapien in das Behandlungskonzept einer chronischen Rhinosinusitis konnte vielen Patienten wiederkehrende operative Eingriffe ersparen.
Fall 1
Die 65-jährige Patientin stellte sich in unserer Poliklinik zur Abklärung einer Raumforderung im Bereich des rechten Zungenrandes vor. Zusätzlich beklagte die Patientin eine Odyno- und Dysphagie, die Fragen nach Heiserkeit oder Atemnot wurden verneint. Relevante Nebenerkrankungen waren eine arterielle Hypertonie, Diabetes mellitus und ein Alkohol- und Nikotinabusus. In der klinischen Untersuchung ergab sich der Verdacht auf ein synchrones Zungenrand- und supraglottisches Larynxkarzinom, der dann durch eine Probeentnahme im Rahmen einer Panendoskopie bestätigt wurde. Die Patientin lehnte die empfohlene operative Sanierung ab und erhielt eine definitive Radiochemotherapie.
Knapp drei Jahre später stellte sich die Patientin mit einem Rezidiv des Zungenrandkarzinoms sowie neu aufgetretenen cervikalen und retropharyngealen Lymphknotenmetastasen vor. Mangels operativer Möglichkeiten wurde eine erneute Radiochemotherapie durchgeführt.
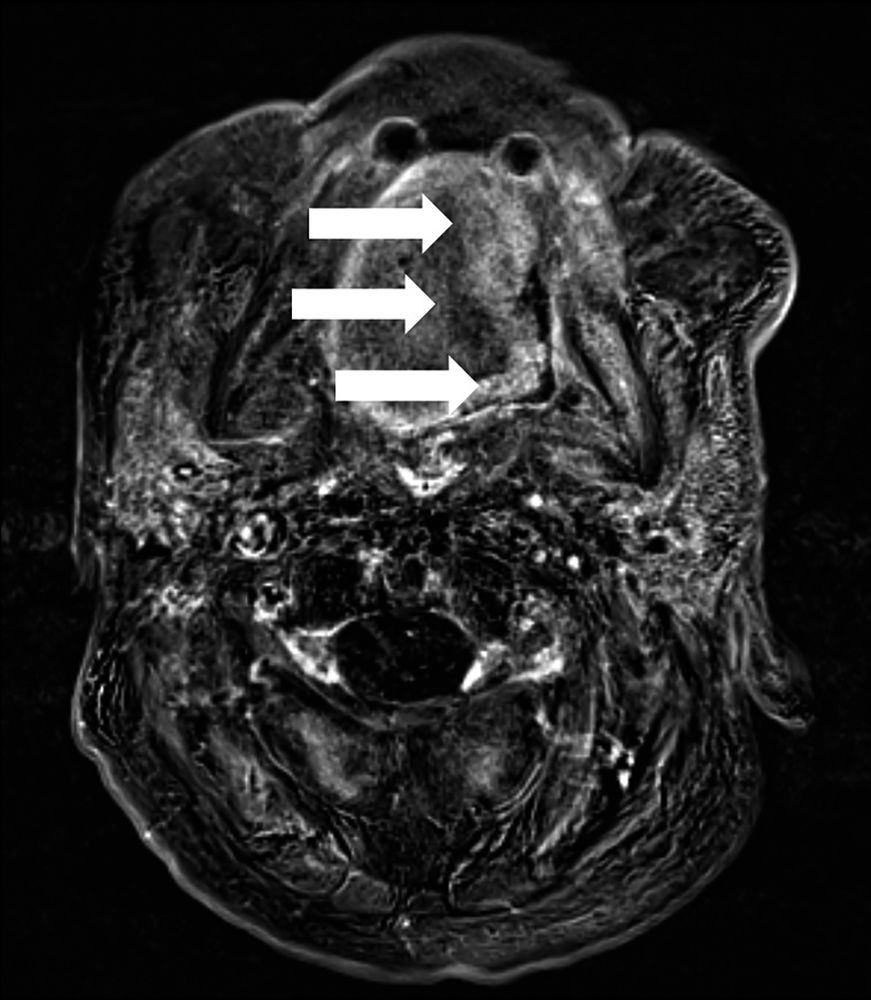
Abbildung 1: In der Kernspintomografie des Halses zeigt sich Tumorgewebe im Bereich der lateralen Zunge und des Zungengrundes linksseitig (Pfeile) mit Verdacht auf Übergreifen auf den lateralen Oropharynx, nicht abgebildet sind die größenprogredienten Lymphknoten.
Weniger als sechs Monate nach Beendigung dieser Therapie stellte sich die Patientin mit einem erneuten Rezidiv von Primärtumor und Lymphknotenmetastasen vor. Nach Bestimmung des PD-L1-Status sowie des Tumor-Proportion- (TPS) und Combined-Positive-Score (CPS) wurde eine Monotherapie mit Pembrolizumab empfohlen (siehe Infokasten, Seite 481). Die Patientin befindet sich nun seit sechs Monaten unter dieser Immuntherapie und in der durchgeführten Staging-Untersuchung zeigt sich ein größenkonstantes Tumorrezidiv ohne weiteres Wachstum und kein Nachweis von malignitätssuspekten Lymphknoten.
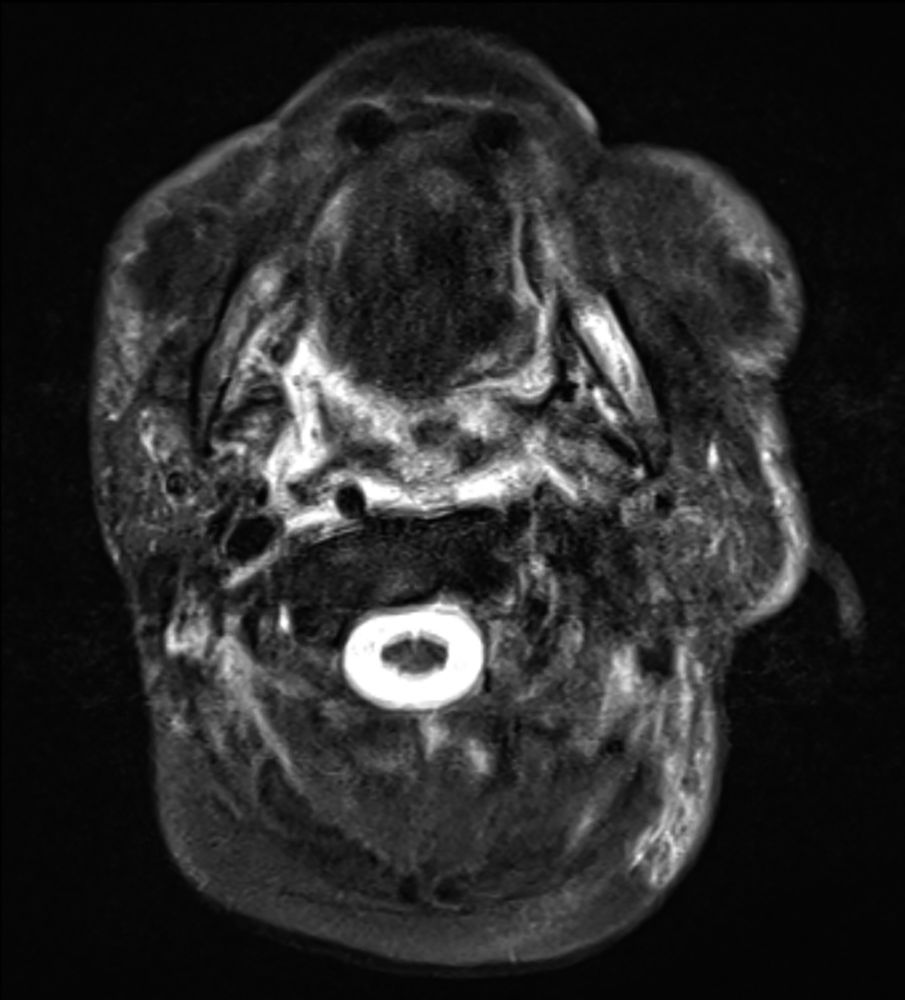
Abbildung 2: In der Verlaufs-Kernspintomografie zeigt sich eine weitgehend größenkonstante Raumforderung bzw. Signalalteration des linksseitigen Zungenrandes und Zungengrundes, suspekte Lymphknoten sind nicht mehr nachweisbar.
Tabelle/Kasten
TPS und CPS
Für den Einsatz von Checkpoint-Inhibitoren sind derzeit zwei Scores von Bedeutung:
» Tumor-Proportion-Score (TPS): Prozentsatz lebensfähiger Tumorzellen, die eine teilweise oder vollständige PD-L1-Membranfärbung zeigen. Ab einem TPS ≥ 50 Prozent wird eine Probe als PD-L1-positiv bewertet.
» Combined-Positive-Score (CPS): Anzahl der PD-L1-positiven Zellen (Tumorzellen, Lymphozyten, Makrophagen) geteilt durch die Gesamtzahl lebensfähiger Tumorzellen multipliziert mit 100.
Diskussion
In den vergangenen fünf Jahren zeigte sich eine große Dynamik bei der Zulassung von sogenannten Checkpoint-Inhibitoren für Indikationen bei Kopf-Hals-Tumoren – inzwischen stellt die Immuntherapie mit Immuno-Checkpoint-Inhibitoren neben der Chirurgie, der Strahlen- und der Chemotherapie eine starke vierte Säule des multimodalen Behandlungsspektrums von Kopf-Hals-Tumoren dar [1, 2]. Bei Checkpoint-Inhibitoren handelt es sich um Antikörper, die Signalen des Tumors, die Immunantwort zu bremsen, entgegenwirken. Hierbei werden die sogenannten „checkpoints“ mittels Antikörper angesteuert, Rezeptoren, die auf T-Zellen aber auch natürlichen Killerzellen vorkommen und deren Aktivierung steuern. Von besonderer Bedeutung ist hier aktuell der PD-1-Rezeptor (programmed cell death), der ein negativer Regulator der T-Zell-Aktivität ist und an der Kontrolle der T-Zell-Immunreaktion beteiligt ist. Durch eine Blockade der Interaktion zwischen PD-1-Rezeptor und Ligand (PD-L1) können PD-1-Inhibitoren die T-Zell-Reaktion gegen den Tumor verstärken. Im Kopf-Hals-Bereich sind aktuell die folgenden Antikörper zugelassen:
• Nivolumab (Anti-PD-1): Zugelassen für die Monotherapie des rezidivierten oder metastasierten Plattenepithelkarzinoms des Kopf-Hals-Bereichs bei Erwachsenen mit einer Progression während oder nach einer platinbasierten Therapie (wichtige Studien: CheckMate-141) [3].
• Pembrolizumab (Anti-PD-1): Zugelassen für die Monotherapie des rezidivierten oder metastasierten Plattenepithelkarzinoms des Kopf-Hals-Bereichs bei PD-L1-exprimierenden Tumoren (TPS ≥ 50 Prozent) mit einer Progression während oder nach einer platinbasierten Therapie und für die Monotherapie oder als Kombination mit Platin- und 5-Fluorouracil-Chemotherapie zur Erstlinientherapie des metastasierten oder nicht-resezierbaren rezidivierten Plattenepithelkarzinoms bei PD-L1-exprimierenden Tumoren (CPS ≥ 1) (wichtige Studien: KEYNOTE-040, KEYNOTE-048) [4, 5].
Beide Antikörper erhöhen in den besprochenen Patientenkollektiven signifikant das Gesamtüberleben im Vergleich zur bisherigen Standardtherapie. Durch den Einsatz von Nivolumab wurde im Vergleich zu einer Monotherapie mit Methotrexat, Docetaxel oder Cetuximab bei Patienten mit einem rezidivierten oder metastasierten Plattenepithelkarzinom des Kopf-Hals-Bereiches nach vorheriger platinbasierter Therapie ein medianes Gesamtüberleben von 7,7 Monaten im Vergleich zu 5,1 Monaten erreicht. Die Überlebensrate betrug nach zwölf Monaten 34 Prozent im Vergleich zu 19,7 Prozent, nach 18 Monaten 21,5 Prozent im Vergleich zu 8,3 Prozent. In der KEYNOTE-040-Studie wurde in einem ähnlichen Patientenkollektiv Pembrolizumab mit einer Chemotherapie mit Taxan, Methotrexat oder Cetuximab verglichen. Hier zeigte sich ein Gesamtüberleben nach zwölf Monaten von 36,8 Prozent (Pembrolizumab) und 22,7 Prozent (Chemotherapie).
Tabelle/Kasten
Weitere Antikörper, die im Kopf-Hals-Bereich eine Rolle spielen, sind Avelumab (Anti-PD-L1, zugelassen bei metastasierten Merkel-Zell-Karzinomen mit Fortschreiten nach mindestens einer Chemotherapie) und Cemiplimab (Anti-PD-1, zugelassen bei metastasierten oder lokal fortgeschrittenen kutanen Plattenepithelkarzinomen ohne Möglichkeit einer kurativen Operation oder Strahlentherapie).
Es muss erwähnt werden, dass sich die Checkpoint-Inhibitoren hinsichtlich ihres Ansprechens stark von sofort wirkenden Chemotherapeutika unterscheiden – ein klinischer Effekt ist hier in der Regel erst nach mehr als zwei Monaten zu verzeichnen. Die Toxizität von Checkpoint-Inhibitoren ist hingegen vergleichsweise niedrig, kann aber alle Organsysteme betreffen und auch noch sehr spät nach Therapiebeginn auftreten. Hier ist es wichtig, einen entsprechenden Zusammenhang zu erkennen [1, 6]. Am häufigsten betroffen sind Haut (Exanthem), Darm (Kolitis), endokrine Organe (Thyreoiditis, Hypophysitis), Leber (Hepatitis) und Lunge (Pneumonitis). Die Therapie der Nebenwirkungen orientiert sich am betroffenen Organ und dem jeweiligen Schweregrad [2].
Fall 2
Ein 54-jähriger Patient (männlich, Body-Mass-Index: 32 kg/m2) litt seit vielen Jahren unter einem unerholsamen Schlaf, fühlte sich am Morgen nicht fit und hatte über Tage vor allem am Nachmittag Probleme, sich wach zu halten. Seine Frau berichtete, dass er nachts massiv schnarche. Über den Hausarzt wurde eine ambulante Polygraphie (Apnoe-Hypopnoe-Index (AHI – Anzahl der Atemaussetzer und Flusslimitationen pro Stunde): 35/h) veranlasst, die den Verdacht auf eine obstruktive Schlafapnoe (OSA) ergab. Daraufhin wurde der Patient in unser Schlaflabor überwiesen. Aufgrund der subjektiv schlecht geschlafenen Nacht während der Schlafmessung zu Hause, wurde eine weitere Messnacht im Schlaflabor durchgeführt (AHI: 40/h). Diese bestätigte erneut die initiale Verdachtsdiagnose einer OSA. Die daraufhin direkt eingeleitete Therapie mittels einer kontinuierlichen Überdruckbeatmung (CPAP = continuous positive airway pressure therapy) wurde von Seiten des Patienten nach einigen Wochen Therapieversuch nicht toleriert. Beklemmungsgefühle unter der Maske, Probleme, gegen den Druck auszuatmen (obwohl sehr niedriger Druck von 5 mbar eingestellt wurde) und einfach nicht damit einschlafen zu können, verhinderten, dass der Patient mit dieser Therapie zurechtkam. Weitere Therapiealternativen sind neben der Unterkieferprotrusionsschiene (UKPS), die jedoch nach S3-Leitlinie nur bis zu einem AHI von 30/h empfohlen wird, die Stimulationstherapie des Nervus hypoglossus.
Diese wurde von dem Patienten präferiert und nach erfolgreicher Implantation und Titration gab der Patient bereits einige Wochen später an, wieder richtig erholt zu schlafen. Auch das nächtliche Schnarchen sei nun verschwunden. Eine erneute ambulante Kontrolle mittels Polygraphie ergab einen AHI von 3,6/h.
Diskussion
Die OSA hat eine Prävalenz von bis zu 22 Prozent und geht mit Verschlüssen (sogenannte Obstruktionen) im Pharynx einher [7]. Durch die damit verbundene Reduktion des Atemflusses kommt es zu rezidivierenden Hypoxämien, welche in der Nacht von sogenannten Weckreaktionen (Arousals) beendet werden. Auf der einen Seite wird dadurch der Tief- und REM-Schlafanteil gemindert, auf der andere Seite sind diese Hypoxämien mit einem erhöhten Risiko für kardiovaskuläre Ereignisse verbunden. Bei übergewichtigen Patientinnen/Patienten ist eine Reduktion des Körpergewichtes immer sinnvoll und anzustreben. Dieses sollte als Basistherapie mit den Betroffenen besprochen werden.
Als Standardtherapie kommt hier die CPAP zum Zuge. Jedoch wird diese nicht von jedem Patienten toleriert, sodass speziell bei der mittel- und schwergradigen OSA Therapiealternativen notwendig sind. In den vergangenen Jahren hat sich hierbei die Neurostimulation der oberen Atemwege in der klinischen Routine etabliert. Dabei wird zwischen der atemsynchronen selektiven Stimulation und der bilateralen selektiven Stimulation des Nervus hypoglossus unterschieden. Vor allem letztere hat in den vergangenen zwei Jahren immer weiter an Bedeutung gewonnen [8]. Dabei handelt es sich um ein Implantat, welches submental oberhalb des Zungenbeins mit einem Hautschnitt eingebracht wird. Zwei seitliche Paddle-Elektroden stimulieren selektiv die Nervenfasern des Hypoglossus, welche für die Vorverlagerung der Zunge verantwortlich sind.

Abbildung 3: Implantat zur bilateralen, selektiven Stimulation des Nervus hypoglossus (Genio-System, Firma Nyxoah, Mt. St. Gilbert, Belgien).
Als weiterer Unterschied zu dem althergebrachten unilateralen System wird bei bilateraler Stimulation kein Pulsgenerator und keine Batterie implantiert. Beide Komponenten werden über einen externen Aktivierungschip (AC) mit Hilfe eines Pflasters submental angebracht. Damit kann die Energieübertragung kontaktlos über Induktion erfolgen. Vorteil des Verfahrens ist, dass das System zur bilateralen selektiven Hypoglossusnervstimulation bis 3 Tesla komplett MRT-fähig ist.
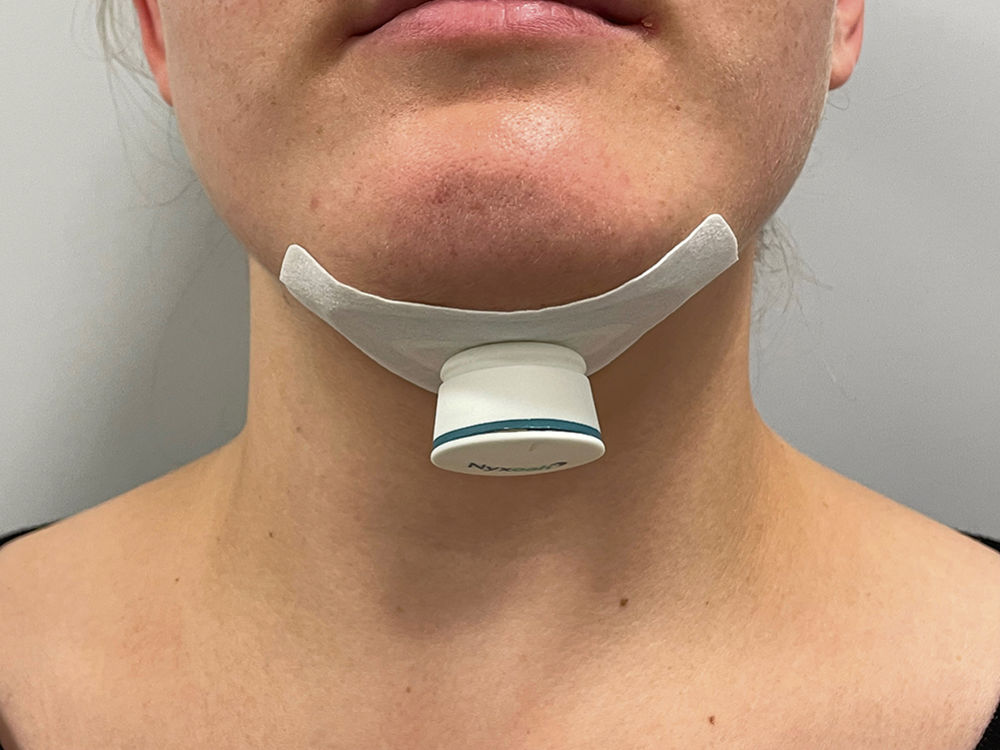
Abbildung 4: Anbringung des externen Aktivierungschips über ein submental aufgeklebtes Pflaster.
Die Neurostimulation der oberen Atemwege hat sich als hocheffektive Therapieform für OSA-Patienten, die mit der CPAP-Maske nicht zurechtkommen, in den vergangenen Jahren etabliert [9]. Dabei hat vor allem die bilaterale Stimulation des Nervus hypoglossus das Therapiespektrum deutlich erweitert. Die hohe Akzeptanz bei den Patienten sowie die guten klinischen Ergebnisse zeigen, dass hier auch in Zukunft weitere Stimulationsarten und -ziele das Indikationsspektrum der Neurostimulation der oberen Atemwege erweitern werden [10].
Fall 3
In unserer rhinologischen Sprechstunde stellte sich ein 45-jähriger Patient mit einer chronischen Rhinosinusitis (CRS) mit Nasenpolypen beidseits vor, er berichtete über zweimalige Nasennebenhöhlenoperationen alio loco, zuletzt vor zehn Jahren. Hauptbeschwerden waren eine subtotale Nasenatmungsbehinderung und totale Anosmie. Nach der letzten Operation hatte er trotz konsequenter Anwendung topisch-nasaler Steroide (Mometasonfuroat Nasenspray, 400 µg täglich) nach wenigen Monaten nicht mehr riechen können. Er hatte in den vergangenen Jahren zweimal jährlich systemische Kortisonkuren erhalten, die jedoch nur graduelle Besserung erreicht hatten. Für eine erneute endoskopische Pansinusoperation war der Patient wegen fehlender Nachhaltigkeit nicht mehr aufgeschlossen. Respiratorische Allergien oder ein behandlungsbedürftiges Asthma bronchiale lagen nicht vor. Endonasal zeigte sich ein nasaler Polypenscore von 7 (von maximal 8). Das Gesamt-IgE lag bei 63 kU/l, mit 530 Eosinophilen/µl (Norm < 450/l – allerdings liegt eine moderate Erhöhung bereits ab 150/l vor).
Der Patient wurde seit März 2022 mit Dupilumab 300 mg subkutan alle 14 Tage als Add-on-Therapie zur Gabe der topisch-nasalen Steroide In-label behandelt. Innerhalb von weniger als 14 Tagen konnte er wieder seinen Kaffee riechen und schmecken sowie wieder einen angebrannten Toast wahrnehmen. Er berichtete begeistert von positiven Effekten auf Lebensqualität, Geschmack, Partnerschaft, Schlaf und verfolgt die Therapie konsequent weiter.
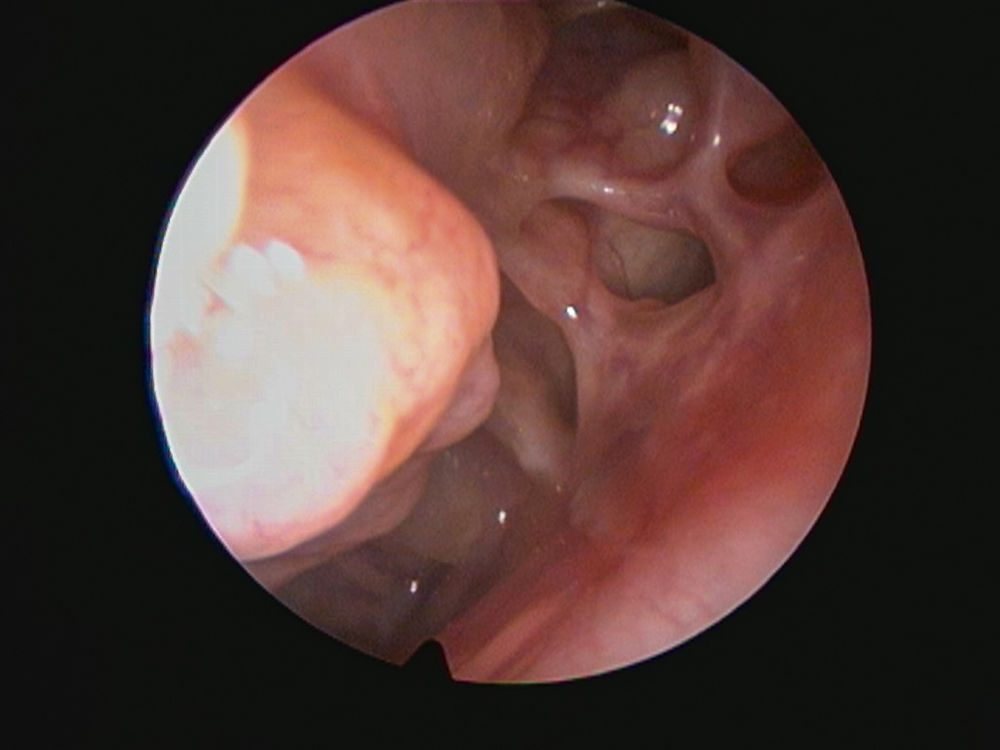
Abbildung 5: Endoskopisches Bild des Siebbeins ohne Nasenpolypen nach erfolgreicher Therapie mit
Dupilumab 300 mg s.c. 14-tägig als Add-on-Therapie zu topisch-nasalen Steroiden.
Diskussion
Die CRS ist eine der häufigsten chronischen Erkrankungen der westlichen Welt und betrifft ca. 10 Prozent der europäischen Bevölkerung [11, 12]. Die europäische Guideline European Position Paper on Rhinosinusitis and Nasal Polyps (EPOS) definiert einen Zeitraum von mindestens zwölf Wochen mit Symptomen einer chronischen Nasenatmungsbehinderung und posterioren Rhinorrhoe (postnasal drip). Fakultative Symptome sind Druck über den Nasennebenhöhlen, meistens frontal, maxillär oder an der Nasenwurzel und Riechstörungen bis zur Anosmie. Hierdurch wird die Lebensqualität der Betroffenen teils erheblich eingeschränkt. Die Erkrankung betrifft in diesen Fällen nicht nur einen elementaren Teil der Sensorik, sondern wirkt sich teils erheblich auf Emotion, Freizeiterleben, Produktivität und Schlaf aus. Die CRS ist assoziiert mit Asthma, respiratorischen Allergien und einer Intoleranz gegen Analgetika vom Typ der nicht-steroidalen Antiphlogistika (N-ERD: NSAR-exacerbated respiratory disease) [13]. In seltenen Fällen ist diese eosinophile CRS mit einer eGPA (eosinophile Granulomatose mit Polyangitis, vormalig Churg-Strauss-Vaskulitis) vergesellschaftet. Vielen dieser systemisch erkrankten Patienten konnte bisher nur unzureichend geholfen werden. Aber auch therapierefraktären Betroffenen ohne diese Komorbiditäten konnte bisher in bis zu 40 Prozent der Fälle trotz fachlich einwandfreier endonasaler Nasennebenhöhlenoperation nicht nachhaltig geholfen werden.
Es werden klinisch grob zwei Entitäten unterschieden: CRS mit Nasenpolypen (CRSwNP) und CRS ohne Nasenpolypen (CRSsNP). Dabei ergibt sich das Problem, dass die klinische Klassifikation nur unzureichend mit der Prognose und dem Therapieansprechen korreliert und diese Klassifikation zudem nicht erlaubt, die beste Therapieform auszuwählen. Daher wurde mit der aktuellen EPOS-Klassifikation eine klinisch einfache und für die weitere Behandlung zweckmäßige Einteilung in Untergruppen vorgenommen, die die Pathophysiologie zumindest teilweise berücksichtigen (neue EPOS-Klassifikation).
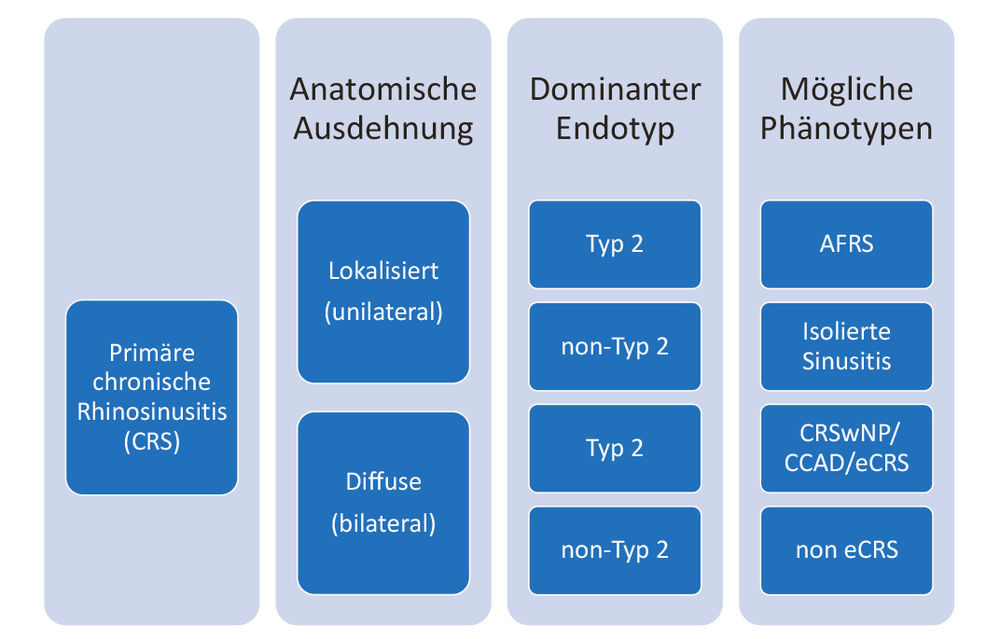
Abbildung 6: Deutsche Adaptation der EPOS-Klassifikation der primären chronischen Rhinosinusitis (aus: European Position Paper on Rhinosinusitis and Nasal Polyposis 2020, Fokkens W. et al., Rhinology, Volume 58, Supplement 29, Feb. 2020, Fig. 1.2.1); CRS: Chronische Rhinosinusitis. Type 2 bezieht sich auf eine Th2-Entzündung, häufig generisch einer allergischen Entzündung ähnelnde Pathophysiologie unter Einbeziehung proinflammatorischer Zytokine wie IL-4, IL-5 und IL-13 sowie einer typischen Gewebeeosinophilie. Non-type 2 ist daher die pragmatische Zusammenfassung aller nicht dieser Pathophysiologie ähnelnden Befunde. Eine „non-type 2 isolated sinusitis“ ist zum Beispiel eine chronische Sinusitis maxillars (als primäre), eine sekundäre wäre zum Beispiel eine dentogene Sinusitis maxillaris. AFRS: Allergic Fungal Rhinosinusitis. CRSwNP: chronische Rhinosinusitis mit Nasenpolypen. eCRS: eosinophile CRS. CCAD: central-compartment atopic disease, zum Beispiel bei chronisch-persistierender allergischer Rhinitis mit zentralem Befall der Ethmoide.
Für die adäquate Diagnostik ist eine HNO-fachärztliche Beurteilung mit Endoskopie der Nase unerlässlich. Die funktionelle Diagnostik beinhaltet eine Rhinomanometrie und Riechprüfung, zusätzlich können klinische Fragebögen wie zum Beispiel der Sino-Nasal Outcome Test-22 (SNOT22) hilfreiche Instrumente sein, um die Symptomlast und Einschränkung der krankheitsassoziierten Lebensqualität zu erfassen. Des Weiteren ist eine Schnittbildgebung, zum Beispiel durch eine Computertomografie oder digitale Volumentomografie (DVT), erforderlich. Ergänzend sollten Indikatoren für eine eosinophile oder IgE-assoziierte (sogenannte Typ-2 Entzündung) untersucht werden: also Blut- und Gewebeeosinophilie, IgE im Serum, Allergiediagnostik und gegebenenfalls Lungenfunktionsdiagnostik [14]. Die Therapie der chronischen Rhinosinusitis richtet sich nach der Art des Subtyps und beinhaltet die konservativ-medikamentöse und operative Therapie. Einer der Grundpfeiler der konservativen Therapie der CRS mit und ohne Nasenpolypen ist die Gabe topisch-nasaler Steroide, zum Beispiel Mometasonfuroat und Analoga. Die funktionell-endoskopische Nasennebenhöhlenoperation (Functional Endoscopic Sinus Surgery – FESS) ist eine sichere und etablierte Therapie, wenn die Krankheitssymptome einer CRS nach initialer konservativer Therapie nicht ausreichend kontrolliert werden können. Bei sekundär-chronifizierenden Sinusitiden mit eindeutigem pathologisch-anatomischem Korrelat oder bei einseitigen Befunden ist die FESS als kausale Therapie und zur Klärung der Histologie die Therapie der Wahl. Die bisherige deutsche S2K-Linie wird nach eingehender Revision voraussichtlich in Kürze publiziert.
Für die chronische Rhinosinusitis mit Nasenpolypen wurden seit 2019 bisher drei therapeutische Antikörper zur Behandlung zugelassen, die unter anderem auch im Asthma bronchiale, der atopischen Dermatitis oder anderen Typ-2 Erkrankungen erfolgreich eingesetzt werden. Der vollhumane Antikörper Dupilumab richtet sich spezifisch gegen die IL-4-alpha Rezeptoruntereinheit und inhibiert damit die Aktivität der proinflammatorischen Typ-2 Zytokine IL-4 und IL-13 [15]. Der bereits seit vielen Jahren zugelassene anti-IgE Antikörper Omalizumab [16], welcher an verschiedenen Stellen mit dem Typ-2 Signalweg interferiert, sowie der gegen IL-5 und somit die pathophysiologisch bedeutsamen eosinophilen Granulozyten gerichtete therapeutische Antikörper Mepolizumab wurden 2020 bzw. 2021 für die Behandlung der CRSwNP zugelassen [17, 18]. Alle drei Antikörper bestanden in pivotalen Studien und haben ein sehr gutes Sicherheitsprofil, sodass auch eine Selbstapplikation möglich ist.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Adam M. Chaker gibt folgende Interessenkonflikte an: Forschungsunterstützung, Drittmittel, Vortragshonorare und Beratungshonorare (zum Beispiel Advisory Boards), alle via Klinikum rechts der Isar/TUM, von ALK Abello, Allergopharma, Bencard/Allergen Therapeutics, GSK, Novartis, Leti, Roche, Zeller AG, Sanofi Genzyme, Regeneron, AstaZeneca, Immunotek, Stallergenes, EIT Health, BMBF.
Clemens Heiser gibt folgende Interessenkonflikte an: Honorare für Beratertätigkeiten, Erstattung von Teilnahmegebühren für Kongresse, Reise- und Übernachtungskosten, Gelder für von ihm initiierte Forschungsvorhaben sowie Gelder für die Durchführung von klinischen Studien, bei denen ein Bezug zum Thema besteht von: Inspire Medical, Löwenstein Medical, Neuwirth Medical, Nyxoah, Signifier Medical Technologies und XM Consult.
Die weiteren Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
» Die Immuntherapie mit Checkpoint-Inhibitoren stellt neben der Chirurgie, der Strahlen- und der Chemotherapie eine starke vierte Säule im Behandlungsspektrum von Kopf-Hals-Karzinomen dar.
» Checkpoint-Inhibitoren stehen inzwischen für verschiedene Tumorentitäten im Kopf-Hals-Bereich zur Verfügung.
» Der Einsatz von Checkpoint-Inhibitoren beeinflusst das Gesamtüberleben von Patienten mit fortgeschrittenen Kopf-Hals-Karzinomen.
» Beim Einsatz von Checkpoint-Inhibitoren muss das im Vergleich zu klassischen Chemotherapeutika unterschiedliche Therapieansprechen und Nebenwirkungsprofil beachtet werden.
» Ziel zahlreicher laufender Studien ist die Verlagerung des Einsatzes von Checkpoint-Inhibitoren weiter in Richtung der Primärtherapie von Kopf-Hals-Karzinomen.
» Mit der Stimulationstherapie des Nervus hypoglossus konnte sich ein völlig neuer Therapieansatz in der Behandlung der obstruktiven Schlafapnoe etablieren.
» Die Therapie mittels Neurostimulation entwickelt sich stetig weiter, sodass das Indikationsspektrum erweitert und die Invasivität reduziert werden kann.
» Der Einsatz von therapeutischen Antikörpern bei chronischer Rhinosinusitis mit Nasenpolypen ist eine der erfolgreichsten Innovationen in der HNO-Heilkunde der vergangenen Jahre und kann bei schweren Fällen mit rekurrenter Rhinosinusitis frustrane operative Eingriffe ersparen und verbessert die Lebensqualität in Bezug auf Nasenatmung, Riechen und Schlaf.
Autoren

Privatdozent Dr. Benedikt Hofauer 1

Privatdozent Dr. Adam M. Chaker 1, 2

Professorin Dr. Barbara Wollenberg 1

Professor Dr. Clemens Heiser 1
1 Klinik und Poliklinik für Hals-, Nasen- und Ohrenheilkunde, Klinikum rechts der Isar der Technischen Universität München
2 Zentrum für Allergie und Umwelt, Klinikum rechts der Isar der Technischen Universität München und des Helmholtz Zentrums München
Korrespondierender Autor:
Privatdozent Dr. Benedikt Hofauer,
Klinik und Poliklinik für Hals-, Nasen- und Ohrenheilkunde, Klinikum rechts der Isar der Technischen Universität München, Ismaninger Str. 22, 81675 München,
E-Mail: benedikt.hofauer(at)mri.tum.de
Teilen:
Das könnte Sie auch interessieren:






