Neu in der Hämatologie und Onkologie
 Hämatologie
Hämatologie
Molekulare Diagnostik und Immuntherapie in der Behandlung von Tumorerkrankungen
In der modernen Onkologie gehören molekulare Diagnostik und Immuntherapie derzeit zu den Bereichen mit der größten Dynamik. Die Verfügbarkeit sowie auch der breite Einsatz der erweiterten molekularen Diagnostik des Tumorgewebes sind die Grundvoraussetzungen für den Einsatz jener innovativen und molekular zielgerichteten Therapieansätze, die allen Tumorpatienten zugänglich gemacht werden sollten. Auch für die Immuntherapie gilt, dass eine Wirksamkeit nur in biologisch genau definierten Tumorentitäten und Subgruppen erwartet werden kann.
Case Report 1
Metastasiertes Kolonkarzinom mit Mikrosatelliteninstabilität (MSI)
Bei einer 41 Jahre alten Patientin wurde die Diagnose eines hepatisch metastasierten Kolonkarzinoms gestellt. Endoskopisch fand sich ein zirkulär wachsender Tumor im Bereich des Colon ascendens. Die CT-Untersuchung des Abdomens zeigte eine fortgeschrittene bilobäre Metastasierung der Leber. Die pathohistologische Untersuchung einer Biopsie des Primärtumors bestätigte die Diagnose eines gering differenzierten Adenokarzinoms (G3).
Angesichts der Ausdehnung der synchronen Metastasierung kam ein primär operatives Vorgehen nicht in Betracht. Vor Einleitung der geplanten systemischen Therapie wurde leitliniengerecht eine molekulare Analytik durchgeführt (S3-Leitlinie [1]). Diese zeigte einen Wildtyp in den RAS- und BRAF-Genen sowie eine hochgradige Mikrosatelliteninstabilität (MSI-high) bei immunhistochemischem Ausfall der Gene MLH1 und PMS2.
Der Befund der Mikrosatelliteninstabilität ermöglichte die primäre Behandlung mit dem Checkpoint-Inhibitor Pembrolizumab. Bereits nach einer Behandlungsdauer von zwei Monaten wurde im Bereich der Lebermetastasierung ein gutes Ansprechen (partielle Remission) konstatiert. Fünf Monate nach Therapiebeginn entschied man sich bei weiterhin deutlich rückläufigen Tumormanifestationen zu einer Hemikolektomie rechts. Diese ergab ein postoperatives Tumorstadium ypT1, ypN0, R0. In der gleichzeitig durchgeführten Hemihepatektomie rechts wurde kein Tumor mehr nachgewiesen (pathologisch komplette Remission). Unter postoperativer Fortführung der Immuntherapie mit dem Checkpoint-Inhibitor befindet sich die Patientin in langfristig anhaltender kompletter Remission dieser initial weit fortgeschrittenen metastasierten Erkrankung.
Diskussion
In der immuntherapeutischen Behandlung des metastasierten kolorektalen Karzinoms (mKRK) kommt der Mikrosatelliteninstabilität (MSI) bzw. der defekten DNA Mismatchreparatur (dMMR) eine zentrale Bedeutung zu. Sie allein gilt als akzeptierter Prädiktor der Effektivität, während die bei anderen Tumoren relevante Oberflächenprotein PD-L1-Expression keine prädiktive Bedeutung hat.
Die Häufigkeit der MSI ist in den lokal begrenzten Tumorstadien vergleichsweise hoch (UICC-Stadium II 22 Prozent, UICC-Stadium III 12 Prozent). Aufgrund der geringen Metastasierungsrate ist die MSI hier mit einer sehr günstigen Prognose verbunden [2]. Bei metastasierter Erkrankung (UICC-Stadium IV) ist die MSI dagegen nicht nur deutlich seltener (drei bis fünf Prozent), sie ist dann auch mit einer eher ungünstigeren Prognose assoziiert. Entsprechend lag auch im vorliegenden Fall bereits bei Primärdiagnose eine weit fortgeschrittene Metastasierung vor.
Die Untersuchung auf eine defekte Mismatch-Reparatur (dMMR) bzw. eine MSI wird vorrangig bei Verdacht auf ein hereditäres, nicht-polypöses kolorektales Karzinom (HNPCC) (jüngere
Patienten, familiäre Belastung etc.) empfohlen. Laut S3-Leitlinie soll eine dMMR/MSI-Testung (aus Biopsien/Tumorgewebe) darüber hinaus bei Vorliegen schlecht differenzierter Adenokarzinome, einschließlich der muzinösen Adenokarzinome oder undifferenzierte Kolonkarzinome, erfolgen. Aufgrund ihrer Sensitivität und Spezifität sowie auch aufgrund der geringeren Kosten steht zunächst die immunhistochemische dMMR-Diagnostik im Vordergrund. Damit kann gezielt überprüft werden, welche der DNA-Reparaturenzyme/-enzymkomplexe (MLH1, MSH2, MSH6, PMS2) nicht mehr exprimiert werden. In unklaren Fällen kann aber auch eine molekulare Analyse (Polymerase-Kettenreaktion [PCR], Next-Generation-Sequencing [NGS]) zur MSI-Diagnostik eingesetzt werden.
Der vorliegende Fall zeigt, dass die MSI-Testung gerade bei jüngeren Patienten, aber auch bei Patienten mit Tumoren im rechtsseitigen Colon oder anderen Risikofaktoren, noch vor Einleitung der systemischen Therapie vorliegen sollte. Die randomisierte KEYNOTE-177-Studie verglich den Checkpoint-Inhibitor Pembrolizumab mit einer Chemotherapie und zeigte in der Erstlinienbehandlung des mKRK eine deutliche Überlegenheit in Hinblick auf die relevanten Effektivitätsparameter Gesamtüberleben, progressionsfreies Überleben und Ansprechrate [3]. Basierend auf diesen Resultaten liegt derzeit eine Zulassung für den Einsatz des PD-1-Inhibitors Pembrolizumab in der Erstlinientherapie vor. Die Indikationsstellung fußt dabei allein auf dem Nachweis der MSI.
Bei chemotherapeutisch vorbehandelten mKRK-Patienten mit MSI-h/dMMR wurde die Studie „CheckMate-142“ durchgeführt [4, 5]. Diese nicht randomisierte Kohortenstudie belegte die therapeutische Effektivität des PD-1-Inhibitors Nivolumab allein und in Kombination mit dem CTL-A4-Inhibitor Ipilimumab. Angesichts der deutlich höheren Effektivität der Kombinationstherapie wurde beim vorbehandelten mKRK die Behandlung mit Nivolumab plus Ipilimumab zugelassen.
Der vorliegende Fallbericht ist deshalb von besonderem Interesse, weil hier allein mit einer Immuntherapie (PD-1-Inhibition) eine komplette pathologische Remission (pCR) der hepatischen Metastasierung erreicht wurde. Darüber hinaus konnte auch der Primärtumor weitestgehend reduziert werden (ypT1, ypN0), sodass bei initial eigentlich infauster Prognose ohne den Einsatz einer Chemotherapie jetzt ein tumorfreies Langzeitüberleben möglich scheint. Der Fallbericht weist insbesondere auf den hohen Nutzen der prätherapeutisch durchgeführten molekularpathologischen Untersuchung des Tumormaterials hin. Zusätzlich zu der empfohlenen Primärdiagnostik von KRAS, NRAS, BRAF und MSI kommen in rascher Folge weitere genetische Veränderungen hinzu, die aktuell aber nur in Studien oder im Rahmen eines „Off-Label-Use“ (nach Genehmigung durch die Krankenkassen) therapeutisch genutzt werden können (Tabelle 1).
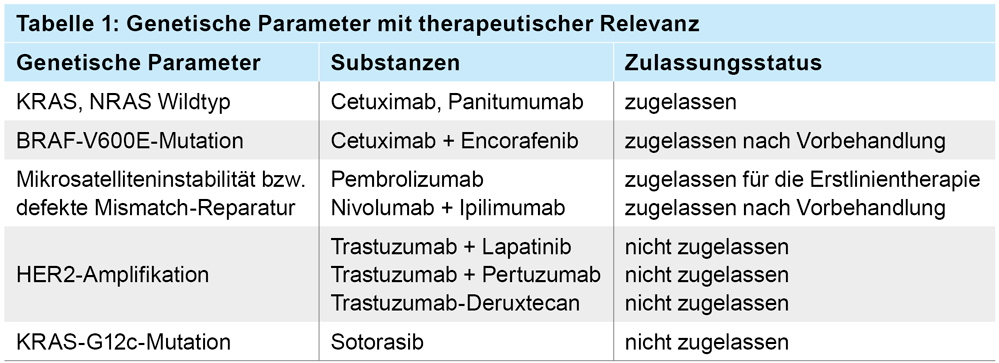
Tabelle 1: Der Zulassungsstatus bezieht sich auf das metastasierte kolorektale Karzinom.
Case Report 2
Medulläres Schilddrüsenkarzinom mit RET-Mutation
Bei einem Mitte 50 Jahre alten Patienten war die Erstdiagnose eines primär metastasierten medullären Schilddrüsenkarzinoms bereits im Jahr 2015 gestellt worden. Nach zervikaler Radiatio erfolgte zunächst eine Therapie mit dem Multikinase-Inhibitor Cabozantinib. Bei Progression der Erkrankung wurde die Behandlung auf den Tyrosinkinasehemmer Vandetanib umgestellt, worunter allerdings nur eine Krankheitsstabilisierung erreicht wurde. Im Juni 2019 wurde der Patient bei fortgeschrittener Erkrankung im interdisziplinären Schilddrüsenzentrum am LMU Klinikum (ISKUM) vorgestellt. Hier sollten weitere therapeutische Optionen evaluiert werden.
Zunächst wurde dort die Indikation zur erweiterten molekularen Diagnostik und zur Vorstellung im Molekularen Tumorboard (MTB) gestellt. Die molekulare Analyse des Tumorgewebes zeigte eine klassische Mutation im RET-Onkogen. Nach interdisziplinärer Diskussion im MTB wurde die Empfehlung zur Therapie mit dem selektiven RET-Inhibitor Pralsetinib (BLU667) gestellt. Der Einschluss in eine klinische Studie war auf Grund internistischer Vorerkrankungen nicht möglich. Das Medikament war jedoch im Rahmen eines Härtefallprogramms verfügbar. Die Therapie mit Pralsetinib konnte, nach Absetzen von Vandetanib, im September 2019 begonnen werden. Insgesamt kam es unter dieser Behandlung zu einem erfreulichen Therapieansprechen und einer längerfristigen Stabilisierung der Erkrankung, die bis zum heutigen Tage andauert.
Diskussion
Tumorgenetisch relevante Alterationen im RET-Onkogen fallen generell in zwei Kategorien: zum einen „aktivierende Mutationen“ und zum anderen „RET-Fusionen“ oder sogenannte „rearrangements“. RET-Fusionen finden sich bei 10 bis 20 Prozent der papillären Schilddrüsenkarzinome, während RET-Mutationen in 60 bis 90 Prozent der medullären Schilddrüsenkarzinome vorkommen [6]. Mittlerweile stehen Patientinnen und Patienten mit RET-alterierten Schilddrüsenkarzinomen mit Selpercatinib [7] und Pralsetinib [8] zwei hochwirksame selektive RET-Inhibitoren zur Verfügung. Der Einsatz dieser neuen Substanzen orientiert sich an der klinischen Situation und sollte im Idealfall in einem interdisziplinären Tumorboard diskutiert werden.
Der skizzierte Fall zeigt, dass die transsektorale Vernetzung im Bereich der personalisierten Onkologie in Zukunft eine noch größere Rolle spielen wird; insbesondere auch, da die Zahl der molekular-zielgerichteten Substanzen und damit die Notwendigkeit zur breiten Tumordiagnostik in den kommenden Jahren erheblich zunehmen wird [9]. Vor diesem Hintergrund ist es wichtig, zu betonen, dass ein Großteil der Deutschen Tumorpatienten außerhalb von (universitären) Zentren versorgt wird [10], während erweiterte molekulare Diagnostik, molekulare Tumorboards und molekular-stratifizierte Studien (noch) überwiegend an spezialisierten Zentren vorgehalten werden [9]. Insofern ist eine Zusammenarbeit auf Augenhöhe absolut notwendig, um Patienten das komplette Spektrum an innovativer Diagnostik und Therapie anbieten zu können, ohne die Behandlungs- und Strukturrealität außer Acht zu lassen.
Um diese notwendige Vernetzung zu unterstützen, wurde am Comprehensive Cancer Center München (CCCM) ein virtuelles MTB etabliert, welches externen Partnern im niedergelassenen- und Klinikbereich niederschwelligen Zugang zur präzisionsonkologischen Expertise am Standort ermöglicht. Des Weiteren wurde das „Molekular-onkologische Netzwerk Bayern – MOONShot Bayern“ ins Leben gerufen, welches externen Zuweisern eine direkte Weiterleitung erhobener molekularpathologischer Befunde an das MTB gestattet (Abbildungen 1 und 2); in diesem Konzept erfolgt eine zentrale Begutachtung der Befunde und eine strukturierte Rückmeldung möglicher therapeutischer Konsequenzen an die beteiligten Institutionen, ohne dass primär eine Vorstellung am Zentrum notwendig wird. So bleibt die gesamte Behandlungsführung im primären Behandlungsteam (Abbildung 1). Patient und Behandlungsteam können dann gemeinsam erörtern, ob eine Mitbehandlung durch das Zentrum sinnvoll und gewünscht ist und weitere mögliche Schritte in die Wege leiten.
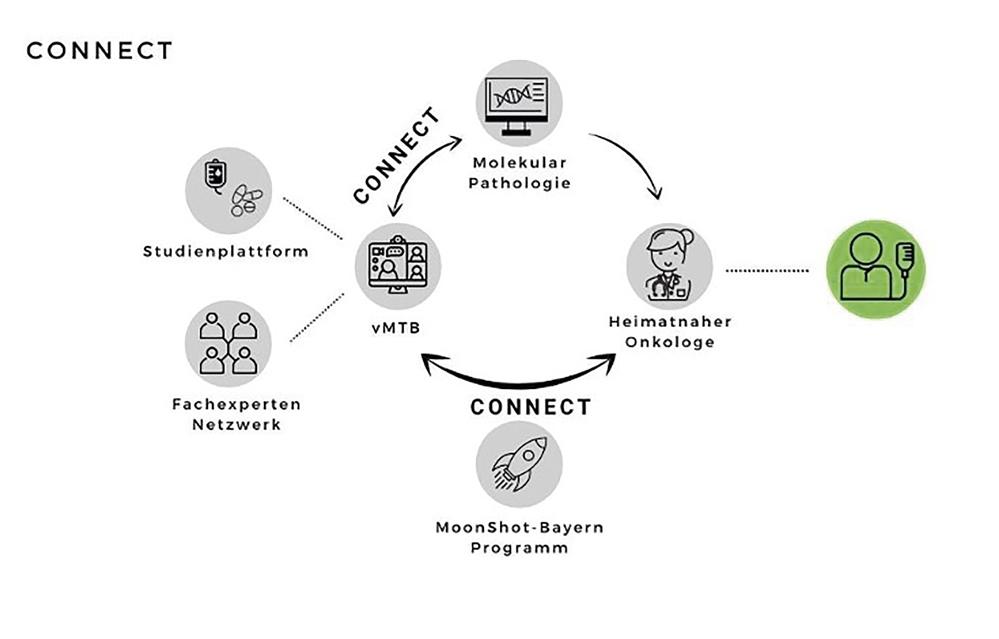
Abbildung 1: MOONshot Bayern-Projekt
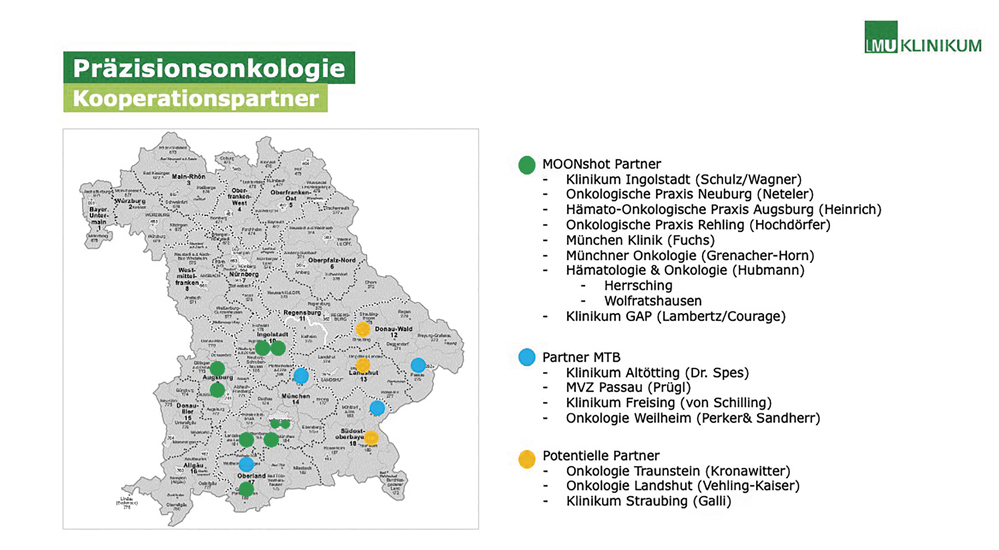
Abbildung 2: Kooperationspartner im Rahmen des MOONshot-Projekts.
Auch über das MOONShot-Netzwerk hinweg, bietet das Programm zur Präzisionsonkologie am CCCM sowohl internen als auch externen Partnern die Möglichkeit, konkret am MTB des Zentrums teilzunehmen (Abbildung 2). Hier werden umfangreiche Informationsmaterialien vorgehalten, darüber hinaus steht eine eigene präzisionsonkologische Hotline für Fragen jederzeit zur Verfügung.
Case Report 3
CD19-CAR-T-Zellen beim rezidivierten hochmalignen B-Zell-Lymphom
Bei einem 64-jährigen Patienten wurde bei Frührezidiv eines hochmalignen B-Zell-Lymphoms („Double-Hit-Lymphom“) nach Erstlinientherapie mit Rituximab+CHOP, Salvage-Therapie mit Rituximab+DHAP (bei unzureichendem bildgebendem Ansprechen unter R-CHOP) und Hochdosischemotherapie (R-BEAM-Protokoll) mit autologem Stammzellsupport die Indikation zur Therapie mit CD19-CAR-T-Zellen gestellt. Im Rahmen dieser Behandlung werden dem Patienten T-Zellen entnommen, die dann im Labor genetisch so verändert werden, dass sie Tumorzellen erkennen und bekämpfen können.
Bei unserem Patienten waren im Rezidiv zehn Monate nach autologer peripherer Blutstammzell-Transplantation (PBSCT) multiple ossäre Manifestationen diagnostiziert worden. Eine Chemotherapie mit R-HyperCVAD (Block A) führte zu keinem metabolischen Ansprechen. Da die Dynamik der Erkrankung aber keine längere Therapiepause zuließ, wurde nach Leukapherese und Gewinnung der autologen T-Zellen die Chemotherapie (HyperCVAD Block B) zunächst weitergeführt.
Die CAR-T-Zell-Herstellung nahm knapp vier Wochen in Anspruch. Unmittelbar vor der CAR-T-Zell-Therapie zeigte sich eine weitere chemotherapierefraktäre Erkrankung mit erneutem ossären Progress. Nach lymphodepletierender Chemotherapie mit Cyclophosphamid und Fludarabin erfolgte die CAR-T-Zell-Transfusion (Axicabtagen-Ciloleucel). Das Fieber im Rahmen eines Cytokine-Release-Syndroms (CRS; Cytokin-Freisetzungs-Syndrom) ab Tag zwei wurde mit einer kalkulierten Antibiose und dem Interleukin-6-Rezeptor-Antikörper Tocilizumab behandelt. Ab Tag fünf traten jedoch neurologische Symptome auf, zunächst mit Veränderungen im CAR-Neurotoxizitäts-Screening (vgl. Schriftprobe, Abb. 3B Mitte). In den folgenden 24 Stunden kamen eine zunehmende motorische Aphasie, Tremor, Apraxie und Orientierungsstörungen trotz zwischenzeitlich eingeleiteter Therapie mit Dexamethason i.v. hinzu. Die notfallmäßige apparative und laborchemische (Liquor-)Diagnostik konnte eine Meningitis, Epilepsie und Meningeosis als Ursache der neurologischen Symptome ausschließen.
Unter dem klinischen Vollbild eines ICANS (immune effector cell associated neurotoxicity syndrome) wurde deshalb die immunsuppressive Therapie auf Methylprednisolon 1 g/Tag i.v. eskaliert, worunter es in den folgenden Tagen zu einer Besserung der neurologischen Symptomatik kam (vergleiche Abb. 3B unten). Der Patient konnte schließlich an Tag 30 nach CAR-T-Zell-Therapie mit langsam reduzierten Steroid-Dosen und unauffälligem neurologischen Befund in sehr gutem Allgemeinzustand entlassen werden. Es bestand zu diesem Zeitpunkt noch eine Bizytopenie (Granulo- und Thrombozytopenie). Unter Gabe von G-CSF kam es in den Folgewochen jeweils zu einem schnellen, aber nicht anhaltenden Anstieg der Granulozyten, sodass ca. einmal wöchentlich G-CSF-Gaben nötig waren, um die Granulozyten bei > 500/µl zu halten.
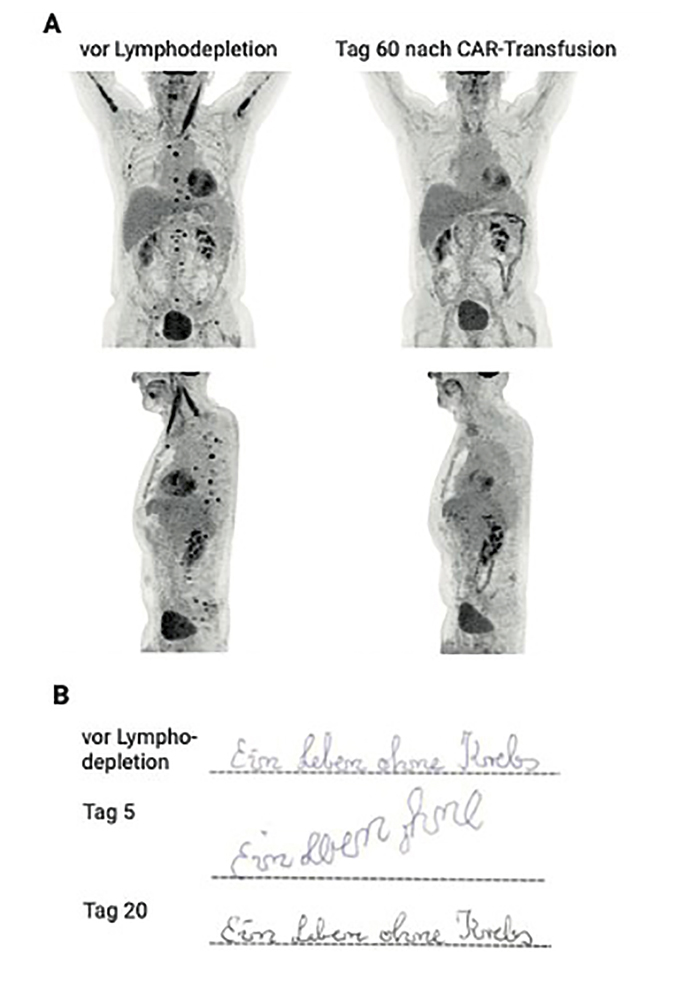
Abbildung 3: A) Radiografisches Ansprechen disseminierter ossärer Lymphom-Manifestationen auf die CD19-CAR-T-Zell-Therapie. PET-Maximumintensitätsprojektion aus Front- und Seitansicht unmittelbar vor (links) und 60 Tage nach CAR-T-Zell-Transfusion. Die Mehrspeicherung im Bereich des M. sternocleidomastoidis links in der Bildgebung vor Therapie erklärt sich aufgrund von Muskelaktivität. B) Ergebnisse der routinemäßig zum Neurotoxizitäts-Screening erhobene Schriftprobe unmittelbar vor (oben), an Tag 5 (bei beginnendem ICANS) und Tag 20 (nach Remission des ICANS) nach CAR-T-Zell-Therapie.
Bildgebend war zwei Monate nach CAR-T-Zell-Therapie im PET/CT eine vollständige metabolische Remission der Erkrankung zu verzeichnen (vergleiche Abb. 3A rechts). Die Thrombozytenzahlen erholten sich im Verlauf nach Therapie langsam und sind aktuell, etwa vier Monate nach CAR-T-Transfusion, bei ~ 75 G/l noch nicht vollständig regeneriert. Auch die Granulopenie besteht weiterhin und die Neutrophilen-Zahlen halten sich bei knapp unter 1 G/l ohne G-CSF-Support. Der Patient ist weiterhin in kompletter Remission, in exzellentem Allgemeinzustand (ECOG 0) und infektfrei.
Diskussion
Der dargestellte Fall illustriert eindrucksvoll, dass mit CD19-CAR-T-Zellen eine hocheffektive Therapieoption für Patienten mit aggressiven B-Zell-Lymphomen zur Verfügung steht, die auch bei chemotherapierefraktärer Erkrankung in einem Teil der Patienten zu dauerhaften Remissionen führen kann. Durch den CAR (chimärer Antigenrezeptor), mit dem die patienteneigenen T-Zellen gentechnisch ausgestattet werden und der gegen das B-Zell-Antigen CD19 gerichtet ist, werden T-Zellen nach Kontakt zu B-Zellen aktiviert und die Zielzellen zerstört. Der Wirkmechanismus von CAR-T-Zellen ist somit völlig abweichend von dem, klassischer Chemotherapeutika. In den zulassungsrelevanten Therapiestudien für Tisagenlecleucel, Axicabtagen-Ciloleucel und Lisocabtagen-Maraleucel (letzteres bisher noch ohne Zulassung in der EU) konnten Ansprechraten von teils > 80 Prozent erreicht werden [11, 12, 13]. Langfristige Remissionen bei 30 bis 40 Prozent aller Patienten bedeuten meist die Heilung, die für Patienten mit chemotherapierefraktärem, aggressiven B-Zell-Lymphom vor wenigen Jahren noch als unerreichbar galt [14].
Der Fall macht jedoch auch ersichtlich, dass die Therapie mit einer Reihe spezifischer, potenziell schwerwiegender Nebenwirkungen einhergehen kann, sodass eine Behandlung mit CAR-T-Zellen durch ein Team speziell geschulter Ärzte und Pflegekräfte erfolgen muss. Die CAR-T-Zell-Aktivierung nach Kontakt mit Zielzellen kann eine immunologische Kaskade auslösen, in deren Folge neben Fieber und CRS auch neurologische Nebenwirkungen auftreten können, die bei 10 bis 30 Prozent aller Patienten schwergradig verlaufen. Das ICANS kann sich in einer Vielzahl unterschiedlicher Symptome von leichtgradigem Tremor bis hin zu schweren Bewusstseinsstörungen und Krampfanfällen manifestieren, und ist wie das CRS am ehesten zytokinvermittelt [15]. Bei ICANS ≥ Grad 2 erfolgt üblicherweise eine steroidbasierte immunsuppressive Therapie. Die neurologischen Beschwerden sind in der absoluten Mehrheit der Fälle bei frühzeitiger Intervention vollständig reversibel [16].
Eine weitere Nebenwirkung, die bisher im Vergleich zu den vorgenannten Nebenwirkungen weniger Beachtung gefunden hat, sind am ehesten immunvermittelte, teils langanhaltende und ebenfalls teils schwergradige (Pan-)Zytopenien nach der Therapie, die nicht nur durch die vorhergehende lymphodepletierende Chemotherapie zu erklären sind. Bei üblicherweise führender Granulopenie gelingt es meist, durch intermittierende G-CSF-Gaben ausreichende Neutrophilen-Zahlen zu erhalten. Dies macht engmaschige klinische und laborchemische Kontrollen des Patienten auch nach Entlassung, teils über Wochen und Monate, notwendig [17].
Neben dem therapierefraktären aggressiven Lymphom sind CD19-CAR-T-Zellen auch für Patienten mit rezidivierter/refraktärer B-Vorläufer-ALL oder therapierefraktärem Mantelzelllymphom zugelassen. Mit Idecabtagen-Vicleucel steht seit neuestem darüber hinaus ein gegen ein neues Zielantigen (B-Zell-Reifungsantigen, BCMA) gerichtetes Zellprodukt zur Verfügung, das bei Patienten mit rezidiviertem Multiplem Myelom zum Einsatz kommt. Es ist mit weiteren Zulassungen von CAR-T-Zellen bei hämatologischen und – in fernerer Zukunft – auch onkologischen Indikationen zu rechnen, sodass der engen, multidisziplinären Zusammenarbeit in der Versorgung der CAR-Patienten auch in Zukunft große Bedeutung zukommen wird.
Das Wichtigste in Kürze
» Die Häufigkeit der Mikrosatelliteninstabilität ist in frühen Tumorstadien deutlich größer als bei metastasierter Erkrankung.
» Die Analyse der Mikrosatellitenstabilität ist beim metastasierten kolorektalen Karzinom die Grundlage für eine Behandlung mit Checkpoint-Inhibitoren.
» Beim metastasierten kolorektalen Karzinom mit Nachweis einer Mikrosatelliteninstabilität bzw. einer defizienten Mismatch-Reparatur sind Checkpoint-Inhibitoren hocheffektiv und können zu einer langfristigen Tumorkontrolle beitragen.
» Bei seltenen Tumorerkrankungen wie dem medullären Schilddrüsenkarzinom kann eine erweiterte molekulare Diagnostik helfen, eine molekular zielgerichtete Therapie zu identifizieren.
» Molekulare Tumorboards können helfen, die molekularen Befunde zu interpretieren und konkrete molekular stratifizierte Behandlungsvorschläge zu entwickeln.
» Bei Vorliegen einer RET-Mutation stehen hochwirksame selektive RET-Inhibitoren für den therapeutischen Einsatz zur Verfügung.
» Die Behandlung mit CAR-T-Zellen erfordert die Verfügbarkeit speziell geschulter Ärzte und Pflegekräfte und kann derzeit nur an hochspezialisierten Zentren durchgeführt werden.
» Bei Patienten mit aggressiven B-Zell-Lymphomen und chemotherapierefraktärer Erkrankung kann die CAR-T-Zelltherapie als effektive Behandlungsoption angeboten werden.
» Neben dem therapierefraktären aggressiven Lymphom sind CD19-CAR-T-Zellen auch für Patienten mit rezidivierter/refraktärer B-Vorläufer-ALL oder therapierefraktärem Mantelzelllymphom zugelassen.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Autoren

Professor Dr. Volker Heinemann 1, 2

Professorin Dr. Marion Subklewe 1
LMU Klinikum München
1 Medizinische Klinik und Poliklinik III
2 Comprehensive Cancer Center München
Korrespondenzadresse:
Professor Dr. Volker Heinemann, 1 Medizinische Klinik und Poliklinik III, 2 Comprehensive Cancer Center München, Ludwig-Maximilians-Universität München, Marchioninistr. 15, 81377 München, E-Mail: Volker.Heinemann@med.uni-muenchen.de
Teilen:
Das könnte Sie auch interessieren:








