Neu in der Geburtshilfe
 Ultraschall in der Geburtshilfe
Ultraschall in der Geburtshilfe
Im Folgenden werden drei Fälle aus der Geburtshilfe vorgestellt. Der erste Fall dreht sich um die bariatrische Chirurgie, die in Deutschland leitliniengerecht angeboten wird a) ab einem BMI von 35 kg/m², mit adipositas-assoziierten Begleiterkrankungen, b) ab einem BMI von 40 kg/m² wenn eine Lebensstilintervention frustran verlaufen ist oder c) primär, wenn der BMI mindestens 50 kg/m² beträgt. Etwa 20 bis 25 Prozent der erwachsenen Frauen in Deutschland gelten als adipös. Ein nicht bekannter Anteil von jungen Frauen lässt sich im Ausland, unter Umständen auch ohne leitliniengerechte Indikationen, bariatrisch operieren.
Der zweite Fall thematisiert die Differenzialdiagnose Präeklampsie und stellt die Frage, was Präeklampsie-Marker im maternalen Serum leisten können. Der dritte Fall dreht sich um das Screening an zellfreier DANN und dem (neuen) nicht-invasiven pränatalen Test (NIPT) und seine unerwünschten Nebenwirkungen.
Schwanger nach bariatrischer Chirurgie – Aufpassen!
Eine 36-jährige Frau stellte sich 2019 im Zustand nach zwei Frühaborten in der 27. Schwangerschaftswoche mit dem Verdacht auf eine intrauterine Wachstumsretardierung vor. Der Body-Mass-Index (BMI) lag zu Beginn der Schwangerschaft bei 30. Die üblichen Schwangerschaftssupplemente (Spurenelemente, Folsäure, Jodid) wurden eingenommen. Der zuvor extern routinemäßig durchgeführte orale Glucosetoleranztest fiel pathologisch aus, die Patientin wurde diabetologisch angebunden und ein insulinpflichtiger Gestationsdiabetes mit niedrig dosiertem Langzeitinsulin (4 IE) therapiert.
Die Anamnese der Patientin zeigte eine Magen-Bypass-Operation, die nach Aussage der Patientin vor neun Jahren im Ausland durchgeführt worden war. Ein OP-Bericht konnte nicht beigebracht werden. 50 Prozent des Magens seien ausgeschaltet, sodass eine Roux-Y-Anastomose vermutet wurde. Da die Patientin ein bis zwei Stunden nach dem Essen regelmäßige Durchfälle angab, vermuteten wir ein Spätdumping-Syndrom. Das Insulin wurde abgesetzt und regelmäßige Blutzuckertagesprofile durchgeführt. Die Patientin erhielt eine Ernährungsberatung, die sie mäßig compliant einhielt.
Das Kind zeigte ein Wachstum entlang der 5. Perzentile (Small for Gestational Age) und wurde alle zwei Wochen in unserer Abteilung zusätzlich zu den Vorsorgen in einer Praxis überwacht. Zwischen der 28. und 30. Schwangerschaftswoche (SSW) wurde die Patientin aufgrund einer umbilikalen Widerstandserhöhung des Kindes stationär aufgenommen, das Kind mit täglichen Kardiotokografien und wiederholten Dopplermessungen überwacht. Entgegen der Erwartungen – bei progredienten Plazentainsuffizienzen – verbesserten sich die Dopplerwerte des Kindes (in der Nabelschnurarterie), sodass die Patientin mit engmaschigen Kontrollen wieder entlassen werden konnte. In der 36 + 3 SSW (4. Tag der 37. SSW) zeigte sich alles stabil. Sieben Tage später stellte sich die Patientin mit einem intrauterinen Fruchttod vor. Nach Geburtseinleitung wurde ein toter Fet mit einem Gewicht von 2.390 Gramm (1. Perzentile) vaginal entbunden.
Was zeigt uns dieser Fall im Zusammenhang mit der derzeit publizierten Datenlage?
1. Bariatrische Operationen werden immer häufiger durchgeführt, über 50 Prozent sind Frauen im reproduktiven Alter. Derzeit stellen etwa 55 Prozent dieser Operationen Schlauchmagen-Operationen (Sleeve gastrectomy) dar [1, 2].
2. Durch Auslandstourismus (unbekannt hohe Dunkelziffer) und Operationen, die in dafür nicht zertifizierten Zentren durchgeführt werden, werden Operationen – geschweige denn Schwangerschaften nach Operationen – nicht in deutschen Nachsorgezentren und Registern erfasst [2].
3. Alle Patienten erleiden nach – egal welcher – bariatrischer Operation Mikronährstoff-, Spurenelement- und/oder Vitamindefizite durch verminderte Resorption im ausgeschalteten Gastrointestinalbereich. Die Nachsorge und somit notwendige konsequente Supplementierung ist schlecht. 15 bis 20 Prozent der Operierten gehen in der Nachbeobachtung verloren (Lost to follow-up) [2].
4. In den ersten zwei Jahren nach diesen Operationen ist die schnelle Gewichtsabnahme am stärksten ausgeprägt, nämlich um bis zu 35 Prozent des Ausgangsgewichtes, weshalb man – empirisch – empfiehlt, erst eineinhalb bis zwei Jahre nach der OP eine Schwangerschaft anzugehen [3, 4].
5. Postoperativ kommt es in den ersten zwei Jahren zu sechs Prozent ungewollten Schwangerschaften, Kontrazeptiva werden unzureichend resorbiert. Eine intrauterine Spirale bzw. hormonabgebende Vaginalringe sind besser geeignet als orale Kontrazeptiva [5].
6. Schwangerschaften nach bariatrischer Chirurgie sind Hochrisikoschwangerschaften, die in der gesamten Schwangerschaft eine engmaschige interdisziplinäre Vernetzung zwischen Chirurgie, Gastroenterologie, Diabetologie und Geburtshilfe benötigen!
7. Orale Glukosetoleranztests sind nicht aussagekräftig – die Resorptionszeiten im Gastrointestinaltrakt sind verändert, es gibt keine hierfür etablierten Normwerte. Zudem ist bei erhöhter oraler Glukoseaufnahme die Gefahr eines akuten oder verzögerten Dumping-Syndroms groß. Besser ist es, den Hba1c-Wert und Blutzuckerlangzeitprofile etwa einmal pro Trimenon zu ermitteln bzw. anzufertigen [4].
8. Zwei große Metaanalysen zeigen eine signifikant erhöhte perinatale Mortalität, kongenitale Malformationen, neonatologische Intensivaufnahmen sowie deutlich erhöhte fetale Wachstumsrestriktions- und Frühgeburtsraten nach bariatrischer Chirurgie. Positive Effekte sind niedrigere Gestationsdiabetesraten, weniger fetale Makrosomien und weniger hypertensive Schwangerschaftserkrankungen [6, 7].
9. Geburtshelfer mutmaßen bei diesen Schwangerschaften atypische Formen von Plazentainsuffizienzen (eventuell Mikronährstoffdefizite nach bariatrischen Operationen), die bislang nur unzureichend verstanden sind und die mit regulären geburtshilflichen Überwachungsmaßnahmen möglicherweise nur unzureichend erkannt werden.
10. Die Kinder zeigen sowohl bei der Geburt geringeres Gewicht als auch später im Leben Auffälligkeiten (andere Fettverteilungsmuster – wie höherer Körperfettgehalt, höhere Taillenumfänge), die auf eine negative intrauterine Prägung hinweisen [8, 9].
11. Nach bariatrischer Chirurgie müssen bei unspezifischen abdominellen Beschwerden einer Schwangeren auch maternale chirurgische Komplikationen umgehend und ausführlich abgeklärt werden. Malrotationen im OP-Gebiet bei größer werden-dem Uterus kommen in zwei bis elf Prozent der Fälle vor und sind potenziell für die Mutter lebensbedrohlich.
Weiterer Verlauf
Die Patientin wurde erneut in den Jahren 2021/2022 von uns in ihrer Folgeschwangerschaft betreut. In Absprache mit Gastroenterologie und Diabetologie wurde sie engmaschig entsprechend der deutschen und internationalen Leitlinien versorgt [3, 4, 10, 11] (Tabelle 1). Sie erhielt gezielte Spurenelement-, Mikronährstoff- und Vitaminsupplemente sowie eine Anleitung zum kontinuierlichen Blutzuckermessen. Eine notfallmäßige stationäre Einweisung musste bei einmaliger symptomatischer Hypoglykämie (am ehesten im Zusammenhang mit einem Dumping-Syndrom) erfolgen. Das Kind wurde in der 36 + 1 SSW nach frustraner Geburtseinleitung per sectionem zur Welt geholt. Es wog 2.700 Gramm (= 30. Perzentile) und zeigte gute APGAR- und Nabelschnur-pH-Werte.
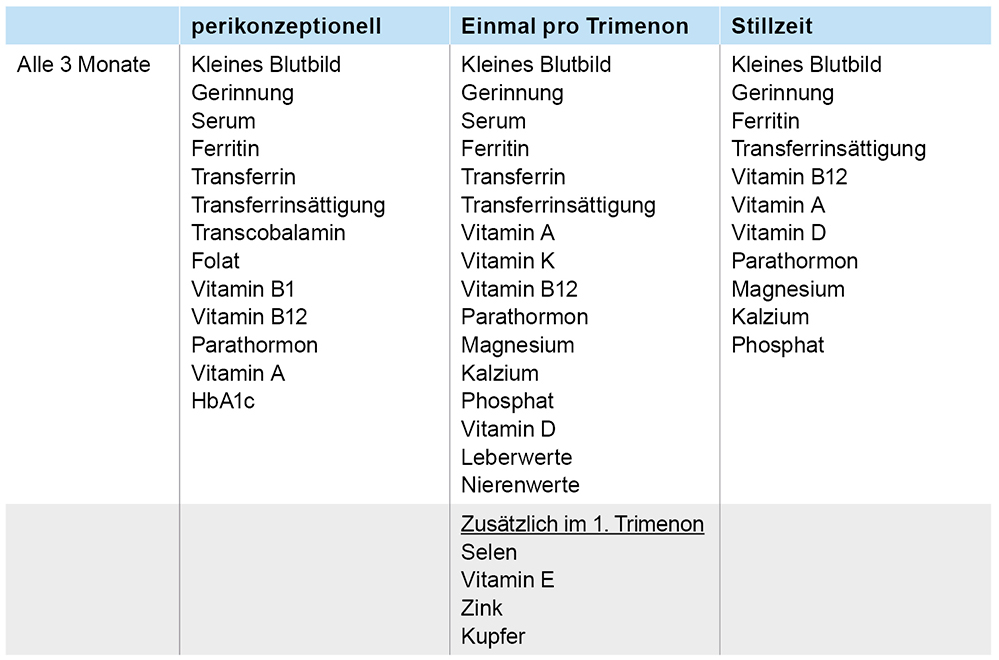
Tabelle 1: Durchzuführende Laboruntersuchungen in der Schwangerschaft im Zustand nach bariatrischer Chirurgie (adaptiert nach [10]).
Differenzialdiagnose Präeklampsie – was können Präeklampsie-Marker im maternalen Serum leisten?
Eine 37-jährige Patientin wurde in ihrer zweiten Schwangerschaft mit massiven Knöchelödemen in der 22. SSW stationär aufgenommen. Die Eiweißausscheidung lag bei 4,7 g/24 h (Normwert: < 0,3 g/24 h), Normotension, leichte Gamma-GT-Erhöhung (Aufnahmewert: 39 U/l – Normwert < 35). Das Kind zeigte ein Wachstum auf der 16. Perzentile, Fruchtwasser und fetomaternale Doppler waren im Normbereich.
Anamnestisch wurde vor 13 Jahren die Diagnose eines systemischen Lupus erythematodes mit einer Polyserositis als Hauptsymptom gestellt. Damals erhielt die Patientin Glukokortikoid- und Hydroxychloroquintherapie. Die letzten acht Jahre vor Schwangerschaft erhielt die Patientin bei Symptomfreiheit keine medikamentöse Therapie mehr. Sie wurde vor drei Jahren, nach unkompliziertem Schwangerschaftsverlauf ohne immunsuppressive Therapie, von einem gesunden Kind entbunden.
Im Aufnahmelabor zeigten sich für eine systemische Lupuserkrankung typisch hochpositive antinukleäre Antikörper, in der Subdifferenzierung ebenfalls in 25 Prozent hierfür typisch SSA-Antikörper (Sjögren-Syndrom-A). Eine Therapie mit Glukokortikoiden und Ciclosporin wurde initiiert. Die Aufnahmediagnose lautete: Lupusnephritis.
Die Patientin verschlechterte sich klinisch zunehmend und kritisch: In der 23. + 5 SSW zeigte sie eine Eiweißausscheidung von 8 g/24 h, hypertensive Blutdruckwerte, massive Ödeme sowie eine Kurzatmigkeit. Die immunsuppressive Therapie wurde um Cyclophosphamid erweitert. Furosemid wurde zur Verbesserung des Lungenödems notwendig, als fetale Medikamentennebenwirkung entwickelte das Kind ein Oligo- bis Anhydramnion. Eine Lungenreifeinduktion (2 x 12 mg Betamethason) wurde appliziert. Die Differenzialdiagnose zwischen vorbekannter Lupusnephritis und einer zusätzlichen Präeklampsie musste gestellt werden. Im Falle der Pfropf-Präeklampsie hätte bei dem kritischen Zustand der Patientin mit sehr hohen maternalen sowie kindlichen Morbiditäts- und Mortalitätsrisiken (Unreife des Kindes) entbunden werden müssen.
Diagnose Präeklampsie [2]
» Jeder (auch vorbestehend) erhöhte Blutdruck ≥ 140/90 mmHg in der Schwangerschaft mit mindestens einer neu auftretenden Organmanifestation, welche keiner anderen Ursache zugeordnet werden kann.
» Die Organmanifestation bei Präeklampsie lässt sich typischer Weise meist an der Niere durch eine Proteinurie ≥ 300 mg/d oder Protein/Kreatinin-Quotient ≥ 30 mg/mmol nachweisen. Bei Fehlen der Proteinurie ist eine Präeklampsie wahrscheinlich, wenn es zusätzlich zur Hypertonie zu neuen Funktionseinschränkungen/pathologischen Befunden folgender typischer Organsysteme kommt: Niere, Leber, respiratorisches System, hämatologisches System, Plazenta (SGA/IUGR), zentrales Nervensystem. Bei pathologischem Befund präeklampsiespezifischer Marker-Systeme (zum Beispiel angiogene Faktoren) zusätzlich zu einer Hypertonie kann auch von einer Präeklampsie ausgegangen werden, wenn andere Organmanifestationen fehlen.
In 25. + 1 SSW verschlechterte sich der Allgemeinzustand weiter: mit nun erhöhten Transaminasen, fallenden Thrombozytenwerten, weiter steigender Proteinurie mit steigenden hypertensiven Werten. Der engmaschig überwachte Fet blieb vital, zeigte eine Abflachung der Wachstumskurve (10. Perzentile) und weiterhin kein Fruchtwasser. Bei nun erhöhten Transaminasen und fallenden Thrombozytenwerten musste jetzt die Differenzialdiagnose zwischen vorbekannter Lupusnephritis zur Pfropf-Präeklampsie und HELLP-Syndrom werden. Im Falle der Präeklampsie und/oder des HELLP-Syndroms hätte bei dem kritischen Zustand der Patientin, mit sehr hohen maternalen Morbiditäts- und Mortalitätsrisiken entbunden werden müssen. Aufgrund des leicht fortgeschrittenen Schwangerschaftsalters waren die kindlichen Morbiditäts- und Mortalitätsrisiken leicht reduziert.
Diagnose HELLP-Syndrom [2]
Typische, in der Schwangerschaft auftretende, Laborkonstellation aus Hämolyse, erhöhten Transaminasen und Thrombozytopenie < 100 G/l, häufig assoziiert mit einer Präeklampsie.
In der 28. + 0 SSW schlug die immunsuppressive Therapie endlich an, der maternale Zustand verbesserte sich zusehends, Furosemid sowie Antihypertensiva konnten ausgeschlichen werden und das Kind fing wieder an, Fruchtwasser zu produzieren. Unter engmaschiger materno-fetaler Überwachung konnte die Patientin sogar zeitweise ambulant weiter betreut werden.
In der 33. + 3 SSW wurde im Rahmen von Erkältungssymptomen eine leichte Transaminasenerhöhung diagnostiziert, was die Geburtseinleitung indizierte. Es wurde vaginal ein gesundes Kind mit guten APGAR- und pH-Werten geboren. Das Wachstum des Kindes war auf der 15. Perzentile, nach einigen Wochen stationärer Überwachung konnte das Kind im korrigierten Alter von 36. + 0 SSW aus der stationären Betreuung entlassen werden.
Die Differenzialdiagnose zur Pfropf-Präeklampsie/HELLP-Syndrom konnte in diesem Fall unter engmaschiger interdisziplinärer Absprache (Nephrologie, Rheumatologie und Geburtshilfe) sowie intensivmedizisch und neonatologisch diskutiert werden. Besonderes Augenmerk wurde hierbei auf die plazentaren Präeklampsie-Marker (sFlt-1/PlGF-Quotient) gelegt, die bei dieser schwer kranken Schwangeren immer im Normalbereich blieben.
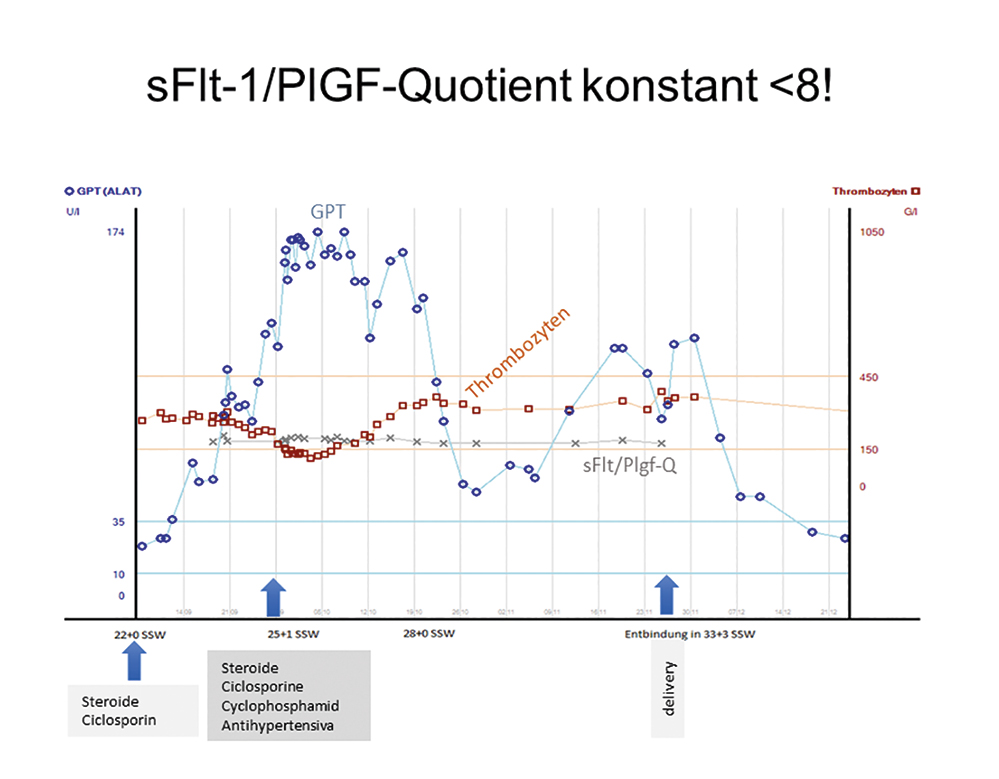
Abbildung 1: Schwerer Schub einer Lupusnephritis mit Leberbeteiligung (hier repräsentativ GPT aufgezeigt) und Abfall der Thrombozyten (Thrombo), während der sFlt-1/PlGF-Quotient sich nicht ändert und im Normalbereich bleibt.
An diesem Fall könnte man sehr viel diskutieren, wenn man allein die potenzielle Teratogenität und Toxizität der verabreichten Medikamente in Bezug auf den Feten betrachtet. Letztendlich befand sich die Patientin beim Beginn der Lupus-Symptomatik in der extremen Grauzone der Überlebensfähigkeit des Kindes, sodass auch der Schwangerschaftsabbruch (aus vitaler maternaler Indikation) und der mögliche intrauterine Fruchttod mit der Patientin und deren Partner diskutiert werden musste. Die Zuversicht, dass die schwere systemische Problematik der Patientin rein maternal und nicht plazentarer Genese ist, ergab sich allein durch die bei der Mutter im Serum bestimmten plazentaren Angio- und Antiangiogenesefaktoren (PlGF und sFlt-1) sowie den immer unauffälligen Dopplerwiderständen der Arteriae uterinae und fetalen Gefäße.
Präeklampsie-Marker (sFlt-1/PlGF-Quotient)
Bei der Plazentaentstehung und ihrem Wachstum während einer Schwangerschaft sind massive neo-angiogenetische Vorgänge notwendig, damit ein ausreichendes Netzwerk von Gefäßen entsteht, um den Gas- und Nährstoffaustausch zwischen mütterlichem und fetalem Organismus zu gewährleisten. Hierfür werden eine Vielzahl pro-angiogenetischer (unter anderem vaskulärer endothelialer Wachstumsfaktor = VEGF, plazentarer Wachstumsfaktor = PlGF) und antiangiogenetischer Faktoren (unter anderem soluble fms-like tyrosine kinase 1 = sFlt-1) von der Plazenta produziert. Für eine gesunde Plazentaentwicklung ist eine ausgeglichene Balance dieser Faktoren wichtig [12]. Die Balance zwischen diesen Faktoren ist gestört, wenn die Produktion antiangiogenetischer Faktoren Überhand gewinnt. Die Folge ist eine systemische endotheliale Dysfunktion im mütterlichen Organismus, die sich in den typischen klinischen Charakteristika einer Präeklampsie und/oder eines HELLP-Syndroms äußert [13].
sFlt-1 antagonisiert die pro-angiogene biologische Aktivität von zirkulierendem VEGF und PlGF, indem es an sie bindet und damit ihre Interaktion mit endogenen Rezeptoren verhindert. Eine erhöhte plazentare sFlt-1-Produktion scheint eine zentrale Rolle in der Pathogenese der Präeklampsie zu spielen. Der wahrscheinlichste Trigger für eine erhöhte sFlt-1-Produktion in der Plazenta scheint eine Ischämie im plazentaren Gewebe zu sein [14].
Seit einigen Jahren wird der sFlt-1/PlGF-Quotient zur Prädiktion einer klinisch relevanten Präeklampsie herangezogen. Ein sFlt-1/PlGF-Quotient von < 38 schließt die Entstehung einer klinisch relevanten Präeklampsie innerhalb der folgenden Woche mit einem negativen prädiktiven Wert (NPV) von 99,3 Prozent aus, während der NPV für die folgenden vier Wochen bei 94,3 Prozent liegt [16]. Abhängig von der jeweiligen Schwangerschaftswoche sind Grenzwerte von > 85 (20. – 33. + 6 SSW) bzw. > 110 (> 34. + 0 SSW) stark mit klinisch relevanten Präeklampsie-Erkrankungen assoziiert [4]. In Hochrisikokollektiven für Pfropf-Präeklampsien (zum Beispiel vorbestehende chronische Hypertension, chronische Nierenerkrankung) wird der Marker zur Einschätzung des weiteren Schwangerschaftsverlaufes zum Teil schon ab der 20. SSW bei asymptomatischen Patientinnen sowie zur Diskriminierung anderer Erkrankungen mit Präeklampsieähnlichen Symptomen herangezogen [17].
In dem hier vorgestellten Fall haben wir den Marker zur Abgrenzung der akut aufgetretenen Symptomatik einer vorbestehenden Grunderkrankung benutzt, die gleiche Symptome wie eine Präeklampsie aufwies (Proteinurie, arterielle Hypertonie, steigende Transaminasen, fallende Thrombozyten). Wäre die plazentare Dysfunktion zusätzlich zu dem ohnehin schon schweren Krankheitsbild der Patientin nachgewiesen worden, hätte man – ungeachtet der Unreife und Überlebenschancen des Kindes – entbinden müssen. Dies, um den mütterlichen Organismus von additiv durch plazentar produzierte antiangiogenetische Faktoren verursachte systemische endotheliale Dysfunktion zu befreien und damit das Outcome der Patientin zu verbessern.
Dennoch muss an dieser Stelle betont werden, dass der hier vorgestellte Biomarker im Laufe der vergangenen Jahre in vielen prospektiven Studien an verschiedenen Patientinnenpopulationen gezeigt hat, (auch Kosten-)effektiv eine Prognoseabschätzung bezüglich der Präeklampsieentstehung vornehmen zu können. Zunehmend implementieren nationale wie internationale Leitlinien die Bestimmung dieses Biomarkers als „Kann-Option“ [18]. Ein 2022 publiziertes Konsensusstatement internationaler Experten versucht die klinische Interpretation, Implementierung für Prädiktion, Diagnose und Management der Präeklampsie für diesen Biomarker zu definieren [17].
Die im vorgestellten Fall hochkomplexe interdisziplinäre Diagnostik und Therapie einer schwer grunderkrankten Frau erfordert weit über den Marker hinausgehende Untersuchungen, Überwachungen, Aufklärungen und – auch seitens der Patientin – Entscheidungen, die in diesem Fall glücklicherweise zu einem guten Ende geführt haben. Die Patientin gehört in eine konsequente rheumatologisch-nephrologische Nachsorge und muss nach aktuellen Leitlinien in einer Folgeschwangerschaft – auch asymptomatisch – nach EULAR-Empfehlungen (European League against Rheumatism) eine immunsuppressive Therapie mit mindestens Hydroxychloroquin sowie eine Präeklampsieprophylaxe mit niedrig dosiertem Aspirin erhalten [19].
Screening an zellfreier DNA – der (neue) nicht-invasive pränatale Test (NIPT) und seine unerwünschten Nebenwirkungen
Eine 42-Jährige (II Gravida I Para) stellte sich nach bislang unauffälliger Schwangerschaft in der 16. SSW zur weiteren Abklärung eines wiederholten Testversagen in einem „whole genome sequencing“ basierten NIPT vor. Der erste NIPT erfolgte in der 13. SSW aufgrund eines im erweiterten, Ultraschall- und Biomarker-basierten Ersttrimesterscreening errechneten intermediären Risikos für eine fetale Trisomie 21 von 1:900. In dem NIPT zeigte sich trotz eines ausreichenden cffDNA-(fetalen DNA-)Gehaltes von 16,3 Prozent kein Ergebnis. Die Wiederholung des Tests in der 14. SSW erbrachte den gleichen ergebnislosen Befund bei einem cffDNA-Gehalt von 11,1 Prozent. Von Seiten des Diagnostik-Herstellers bestand der Verdacht, dass aufgrund von multiplen zirkulierenden DNA-Fragmenten aus mütterlichem Gewebe kein Ergebnis erzielt werden konnte. Eine internistisch-hämatologische Abklärung wurde empfohlen. Die zwei Jahre zuvor vorausgegangene Schwangerschaft verlief komplikationslos, auch da war ein NIPT durchgeführt worden, der ein unauffälliges Ergebnis erbrachte.
In der frühen fetalen Feindiagnostik zeigte sich ein anatomisch unauffälliger, zeitgerecht entwickelter Fet. Aufgrund der Annahme einer mütterlichen Erkrankung als Ursache des Testversagens wurde nach ausführlicher Aufklärung und im informed consent mit der Patientin auf eine Amniozentese verzichtet und eine Tumorsuche initiiert. Dies, zumal die Patientin über eine generelle Abgeschlagenheit und – sie führte es auf Schwangerschaftsübelkeit zurück – über eine Gewichtsabnahme von 3 kg berichtete.
Die körperliche Untersuchung sowie eine erweiterte Labordiagnostik (Differenzialblutbild, Transaminasen, Entzündungswerte, Haptoglobin sowie eine serologische Untersuchung auf Autoimmunerkrankungen ANA, Anti-ds-DNA, C3, C4 sowie der Melanom-Tumormarker S-100B) ergaben keine zielführenden Hinweise, Mammasonografie und dermatologische Untersuchung ebenfalls nicht. Abdominalsonografisch konnte ein malignomverdächtiger Leberherd im Segment VI dargestellt werden. Die histologische Untersuchung zeigte die hepatische Metastase eines Adenokarzinoms ohne Mikrosatelliteninstabilität. In der nun durchgeführten Koloskopie konnte im Bereich der rechten Kolonflexur ein exophytisch wachsender, exulzerierender, stenosierender Tumor festgestellt werden. Somit wurde die Diagnose eines hepatisch metastasierten Kolonkarzinoms mitten in diese Schwangerschaft hineingestellt. Das Staging-MRT der Lunge war ohne suspekte Läsionen, ein PET-CT wurde auf Wunsch der Patientin erst direkt nach der Geburt gewünscht und zunächst eine Hemikolektomie in 18. + 0 SSW sowie daran angeschlossen, eine FOLFOX-Chemotherapie (5-Fluouracil, Oxaliplatin und Folsäure) begonnen. Diese setzte die Patientin auf eigenen Wunsch nicht fort und begab sich extern in eine weitere chirurgische Behandlung zur Entfernung der bekannten Lebermetastase – er-hielt somit eine zweite Laparotomie in der Schwangerschaft. Ein gesunder Junge mit 3 kg (= 36. Perzentile) und guten APGAR- sowie pH-Werten wurde in 37. + 0 SSW nach Geburtseinleitung vaginal geboren. Das am Tag nach der Geburt durchgeführte PET-CT erbrachte bipulmonal kleine Rundherde, eine größere Metastase im rechten Lungenmittellappen sowie eine Lymphknotenmetastase ventral der linken Niere. Das interdisziplinäre Tumorboard empfahl die Fortsetzung der Chemotherapie, dem sich die Patientin erneut widersetzte.
Fazit: Mit dem nicht-invasiven Pränataltest (NIPT) kann man plazentares Erbmaterial aus dem Blut der Mutter isolieren und auf Chromosomenanomalien hin untersuchen. Dieser Test besitzt eine begrenzte Aussagekraft – er kann die Trisomien 21, 18 und 13 sehr zuverlässig erkennen. Wird eine der Trisomien detektiert oder ist der NIPT ergebnislos (wie im geschilderten Fall) muss weiter diagnostisch abgeklärt und obligat eine diagnostische Punktion angeboten werden. Eine Aussage über andere Chromosomenstörungen, unter anderem viel häufiger auftretende Fehlbildungen (zum Beispiel fetale Herzfehler) und Schwangerschaftskomplikationen, die in pränataldiagnostischen Ultraschalluntersuchungen detektiert und/oder antizipiert werden können, kann dieser Test nicht erbringen. Deshalb soll dieser Test nur unter bestimmten Voraussetzungen (unter anderem eine ärztliche Aufklärung, genetische Beratung nach Gendiagnostikgesetz und verbindlich auszuhändigende Versicherteninformation) angewandt werden und keinesfalls die etablierten vorgeburtlichen Untersuchungen wie Ultraschall, erweitertes Erst-, Zweit- und Dritttrimesterscreening ersetzen. Ein wichtiges Qualitätsmerkmal ist der fetale bzw. schwangerschaftsspezifische Anteil zellfreier DNA (fetal fraction), welches großen Einfluss auf die Testgüte hat und von BMI der Mutter, Art der Schwangerschaftsentstehung bis hin zu Mehrlingsschwangerschaften abhängig ist. Die Deutsche Gesellschaft für Ultraschall in der Medizin (DEGUM) hat eine Stellungnahme inklusive zehn Empfehlungen formuliert, die die Handhabung und Entscheidungsfindung für Mediziner und Patientinnen unterstützen soll [20]. Mit diesem Fallbericht wollen wir auf eine weitere, neu entstandene Problematik des „no calls“/ergebnislosen NIPT hinweisen, der in sehr viel differenziertere Abklärungen unter anderem in nicht unerheblichen Anteilen bis hin in die Onkologie weist, was inzwischen in der Literatur vielfältig diskutiert wird [21]. Dies ist nicht der einzige derartige Fall in unserer Klinik – mittlerweile sind allein an unserer Klinik drei weitere, bis dahin okkulte Karzinome durch einen auffälligen NIPT in der Schwangerschaft diagnostiziert worden [22].
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autorin erklärt, dass sie keine finanzielle oder persönliche Beziehung zu Dritten hat, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
Fall 1: Bariatrische oder auch metabolische Chirurgie wird zunehmend bei jungen adipösen Frauen (unter anderem ab BMI > 35 kg/m²) mit dem Ziel der Gewichtsabnahme durchgeführt. Darauffolgende Schwangerschaften sind als Hochrisikoschwangerschaften interdisziplinär zu betreuen.
Fall 2: Die Differenzialdiagnose internistischer, zur Hypertension führender Erkrankungen zu Plazenta-induzierten hypertensiven Erkrankungen, kann man mit sogenannten Präeklampsiemarkern untermauern.
Fall 3: Nicht-invasive pränatale Tests (NIPT) sind nur im Kontext mit etablierten pränatalen Screeningverfahren empfohlen – die Technologie führt immer wieder zu großen Unsicherheiten und unerwarteten Differenzialdiagnosen.
Autorin

Professorin Dr. Bettina Kuschel
Sektion Geburtshilfe und Perinatologie, Frauenklinik des Klinikums rechts der Isar, Technische Universität München, Ismaninger Str. 22, 81675 München
Teilen:
Das könnte Sie auch interessieren:






