Neu in der Gastroenterologie
 Gastroenterologie
Gastroenterologie
Chronisch-entzündliche Darmerkrankungen und infektiöse Komplikationen
Einleitung
Chronisch-entzündliche Darmerkrankungen (CED) wie der Morbus Crohn und die Colitis ulcerosa zeigen eine steigende Inzidenz in den vergangenen Jahren. Durch die Erkrankung selbst, aber auch therapieassoziiert, können vermehrte Infektionen bzw. opportunistische Infektionen auftreten. Durch ein gutes, kontinuierliches Patientenmanagement hinsichtlich Infektionen ab dem Zeitpunkt der Erstdiagnose der Erkrankung können einige dieser Komplikationen vermieden bzw. deutlich reduziert werden.
Fallbericht
Bei der Patientin wurde im Alter von 44 Jahren die Erstdiagnose einer Colitis ulcerosa gestellt. Klinisch waren die ersten Beschwerden blutige Diarrhoen und abdominelle Schmerzen. In einer externen Koloskopie zeigte sich ein linksseitiger Befall. Die Patientin wurde im niedergelassenen Bereich umgehend auf eine Therapie mit Azathioprin, Adalimumab sowie Budesonid eingestellt. Wenige Wochen nach Initiierung dieser dreifachen Therapie wurde die Patientin mit Fieber, Schwäche, AZ-Minderung und Synkope in unsere Klinik eingewiesen. Laborchemisch zeigte sich eine Entzündungskonstellation (CRP 9,5 mg/dl [Normbereich 0 bis 0,5 mg/dl], Leukozyten maximal 13,17/nl [Normbereich 3,0 bis 10,0/nl]) sowie eine Verminderung der Gerinnungswerte (INR 2,98 [Norm 0,9 bis 1,15]). In einem ersten Röntgen-Thorax zeigten sich disseminierte, bilaterale, klein-noduläre retikuläre Verdichtungen mit einer umschriebenen Konsolidierung pulmonal.
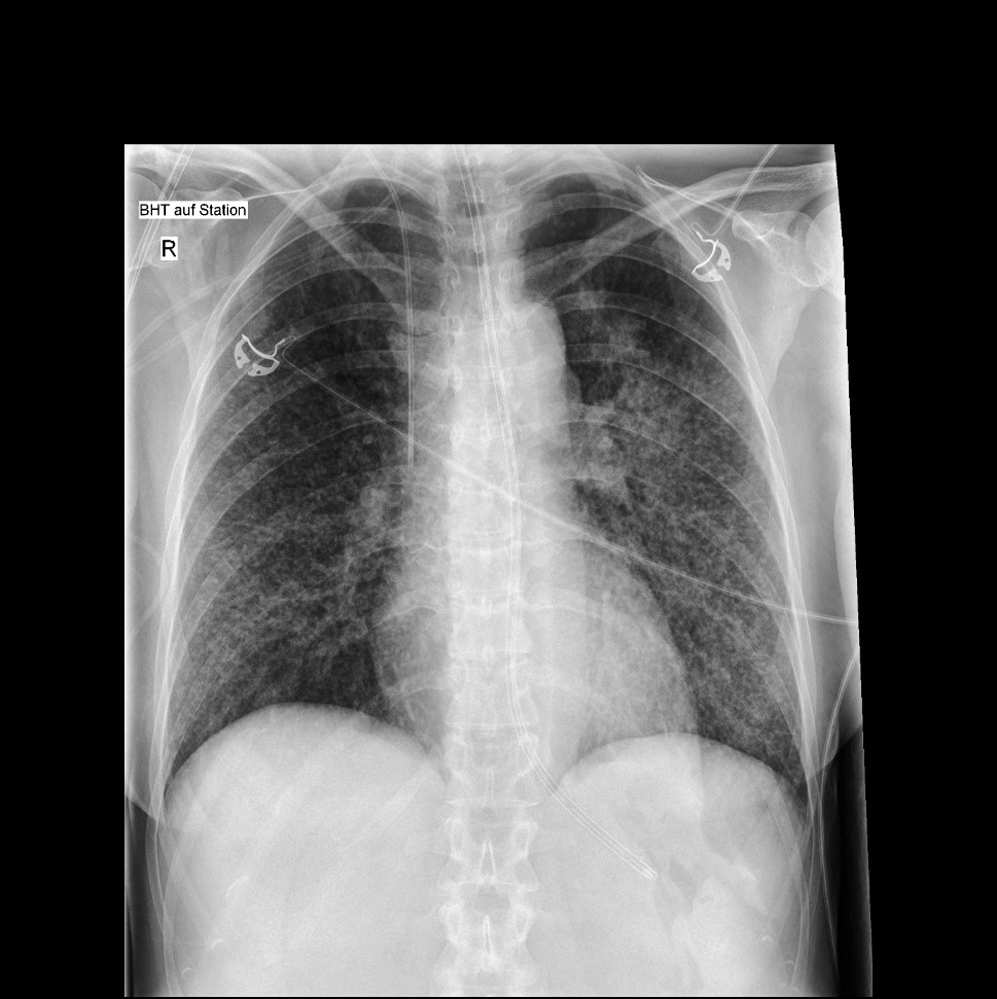
Röntgen-Thorax bei stationärer Aufnahme der Patientin. Bilaterale, nicht segmentale, am ehesten interstitielle Pneumonie mit umschriebener Konsolidierung im linken Oberfeld suprahilär, DD Miliartuberkulose mit beginnender Kaverne im linken Oberlappen.
Eine antibiotische Therapie wurde empirisch begonnen (Piperacillin/Tazobactam intravenös). Ein HR-CT bestätigte das Bild von mikronodulären Verdichtungen beidseits, vereinbar mit einer miliaren Aussaat bei dringendem Verdacht auf eine Tuberkulose, ausgehend vom linken Oberlappen, ohne Nachweis von Kavernen. Bronchoskopisch zeigte sich ein gering akut entzündlich verändertes Bronchialsystem und kaum glasiges Sekret. Es erfolgte der Nachweis säurefester Stäbchen in Magensaft und Urin, somit Bestätigung der Diagnose einer Tuberkulose. Ein Quantiferontest war nach Rücksprache mit dem vorbehandelnden, niedergelassenen Gastroenterologen vor Therapiebeginn negativ.
Im Verlauf trat eine deutliche Verschlechterung der Leberwerte auf, die Gerinnung war zunehmend eingeschränkt. Eine Leberbiopsie ergab eine granulomatöse Entzündung, sodass von einem systemischen Tuberkulose-Befall ausgegangen werden musste. Eine entsprechende tuberkulostatische Therapie wurde initiiert.
Im weiteren Verlauf zeigte sich nur eine langsame Verbesserung der klinischen Beschwerden. Endoskopisch war initial bei Aufnahme weiterhin eine hohe Aktivität der bekannten linksseitigen Colitis ulcerosa darstellbar. Nach Rekonvaleszenz der Patientin wurde daher die Entscheidung zur Einleitung einer remissionsinduzierenden bzw. -erhaltenden Therapie mit Vedolizumab getroffen. Darunter kam es zu keiner erneuten Reaktivierung der Tuberkulose.
Aktuell befindet sich die Patientin nach über drei Jahren unverändert in Remission ihrer Colitis ulcerosa unter dieser Therapie. Eine endoskopische Kontrolle kürzlich zeigte eine histologische Remission unter fortgeführter Therapie mit Vedolizumab. Eine Reaktiverung bei stattgehabter systemischer Tuberkulose trat nicht mehr auf.
Diskussion
Patienten mit chronisch-entzündlichen Darmerkrankungen haben ein erhöhtes Risiko für (opportunistische) Infektionen, insbesondere auch durch die Ausweitung der medikamentösen Therapieoptionen in den vergangenen Jahren. Die neue ECCO-Leitlinie gibt klare Empfehlungen für eine bestmögliche Prävention und Überwachung infektiöser Komplikationen bei CED-Patienten [1]. Dabei soll ein serologisches Screening für bestimmte infektiöse Erkrankungen (unter anderem Hepatitis A, B und C, Epstein-Barr-Virus, Cytomegalivirus) bereits bei Erstdiagnose einer CED erfolgen, spätestens jedoch vor Einleitung einer immunsuppressiven Therapie. Risiko einer immunmodulatorischen/Biologika-Therapie ist die Reaktivierung einer latenten Tuberkulose, wie es im vorliegenden Fall beschrieben wurde. Daher sollte ein Screening dafür auch bei Erstdiagnose, spätestens jedoch vor Einleitung bzw. nochmals bei Umstellung einer immunsuppressiven Therapie erfolgen. Ähnlich wichtig ist auf einen ausreichenden Impfschutz für Patienten mit CED zu achten (Kontaktpersonen sollten zudem über einen ausreichenden Impfschutz informiert werden). In frühzeitigen Behandlungsabschnitten sollte bei fehlendem Impfschutz auf eine Aktualisierung der notwendigen Schutzimpfungen geachtet werden [2]. Insbesondere dürfen Lebendimpfstoffe unter immunsuppressiver Therapie nicht gegeben werden, sodass eine frühzeitige Überprüfung und Auffrischung dieser Impfungen bedacht werden sollte, zumal zeitliche Abstände bis zur Therapieeinleitung nach Erhalt von Lebendimpfstoffen eingehalten werden müssen. Totimpfstoffe sind auch während laufender immunmodulatorischer/Biologika-Therapien möglich. Zusätzlich sollten die Patienten über nötige Impfungen, wie zum Beispiel die jährliche Influenza-Impfung, regelmäßig informiert und erinnert oder über Impfungen hinsichtlich Herpes zoster oder Pneumokokken beraten werden. Ebenso muss durch die Behandler eine adäquate Information und Aufklärung bezüglich der empfohlenen COVID-Impfungen für CED gemäß den aktuellen Empfehlungen erfolgen. Von Seiten der Therapie sollte nach Möglichkeit auf Kombinationstherapien verzichtet werden, da diese das Infektionsrisiko steigern, wie der vorliegende Fall eindrücklich zeigt. Weitere Risikofaktoren für Infektionen sind höheres Patientenalter, Komorbiditäten oder die Mangelernährung, sodass diese Patienten engmaschig überwacht werden müssen [3, 4].
Unter optimierter Aufklärung und frühzeitigem Monitoring der Patienten mit CED können infektiöse Komplikationen verhindert und minimiert werden und so eine bessere Behandlung der Patienten mit CED erreicht werden.
Barrett-Ösophagus
Einleitung
Die endoskopische Diagnostik und Therapie haben in den vergangenen Jahren deutliche Fortschritte gemacht. Obwohl es keine Vorsorgegastroskopie zur Detektion von Barrett-Ösophagus in Deutschland gibt, werden Patienten mit Barrett-Ösophagus überwacht. Frühkarzinome werden entweder im Rahmen einer Surveillanceendoskopie diagnostiziert oder zufällig bzw. im Rahmen einer diagnostischen Endoskopie (zum Beispiel bei Sodbrennen) entdeckt. Die endoskopische Therapie von Frühkarzinomen ist mittlerweile der Goldstandard und hat die Operation verdrängt.
Fallbericht
Ein 52-jähriger Patient stellt sich mit Sodbrennen und retrosternalen Schmerzen zur Ösophagogastroduodenoskopie vor. Ein Barrett-Ösophagus (BÖ) mit einer Ausdehnung von C5M7 nach der Prag-Klassifikation wird festgestellt.
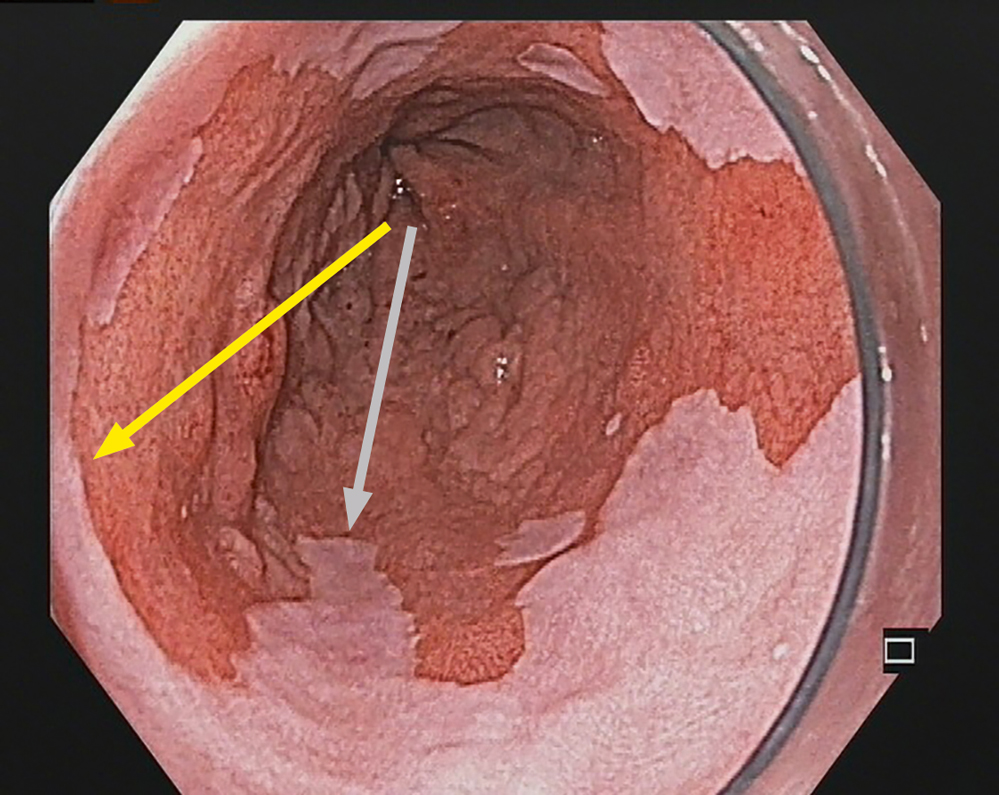
Darstellung der Prag-Klassifkation. Der graue Pfeil zeigt die zirkuläre Ausdehnung (C) der Barrettschleimhaut, beginnend an der Oberkante der Magenfalten, hier mit einer Länge von 5 cm. Der gelbe Pfeil gibt die maximale Länge (M) des Barrettepithel an, hier mit einer Länge von 7 cm. Somit lautet die Prag-Klassifikation C5M7.
Eine fokale Läsion ist nicht erkennbar; es werden Quadrantenbiopsien nach dem Seattle-Protokoll entnommen. Histologisch werden hochgradige Dysplasien und ein mukosales Karzinom in mehreren Proben festgestellt. Der Patient wird zur weiteren Diagnostik und Therapie an die Universitätsklinik Augsburg überwiesen.
Eine eingehende endoskopische Untersuchung mit virtueller Chromoendoskopie (Texture and Color Enhancement Imaging (TXI ®) und Narrow Band Imaging (NBI) zeigt eine flächige Neoplasie (Paris 0-IIa) zwischen 32 cm und 36 cm ab Zahnreihe.
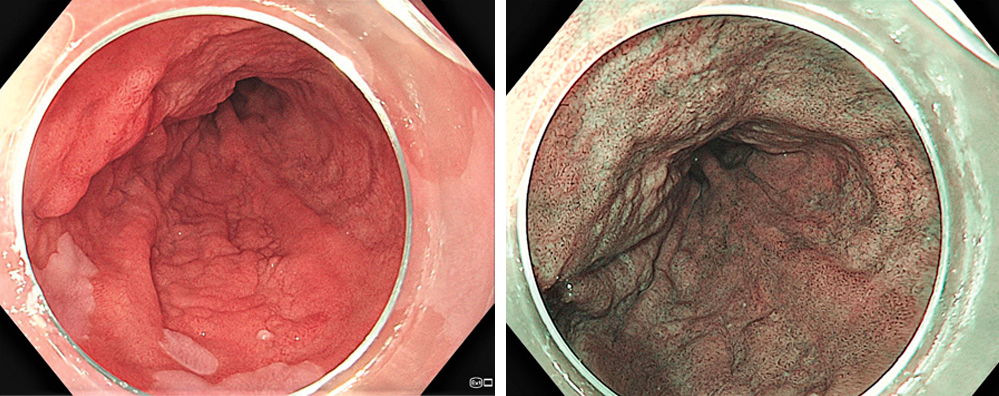
Abbildung 3 (links): Weißlichtendoskopie mit Nachweis einer Barrettneoplasie zwischen 6 Uhr und 12 Uhr. Es finden sich knotige Anteile bei 11 Uhr. Abbildung 4: (rechts) Virtuelle Chromoendoskopie mit Narrow Band Imaging. Die Neoplasie ist besser erkennbar, insbesondere die Außengrenzen.
Der Tumor nimmt ca. 50 Prozent der Zirkumferenz ein. Mit konventioneller Chromoendoskopie (Essigsäure und Indigokarmin) und virtueller Chromoendoskopie (NBI) lässt sich die Neoplasie deutlicher demarkieren. Makroskopisch ist eine Infiltration der Submukosa nicht auszuschließen. Eine anschließende Endosonografie schließt pathologische Lymphknoten aus; eine Infiltration der Submukosa ist nicht sicher erkennbar. Somit lautet das Tumorstadium nach der Endoskopie uT1a N0 M0.
Wegen der Größe und der knotigen Areale wird die Indikation zur endoskopischen Resektion mittels endoskopischer Submukosadissektion (ESD) gestellt. Eine en bloc-Abtragung in Intubationsnarkose gelingt ohne Komplikationen und in einer Interventionszeit von ca. 60 Minuten.
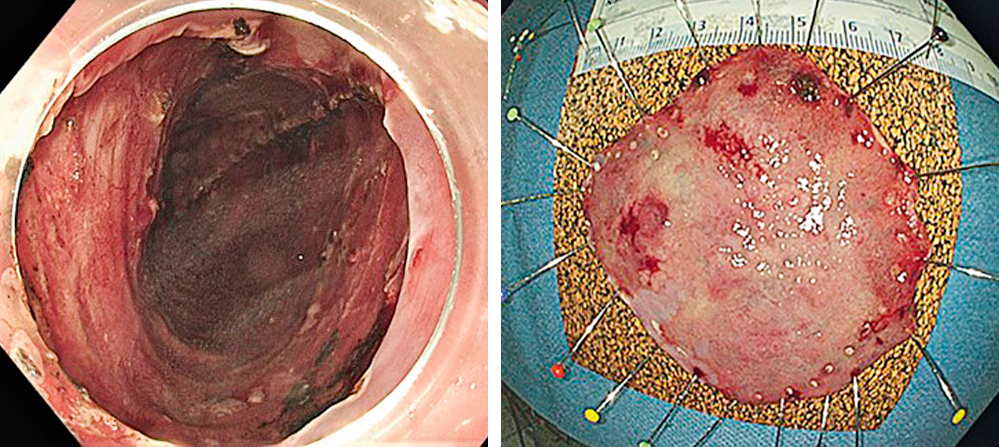
Abbildung 5 a und b: En-bloc-Abtragung mittels endoskopischer Submukosadissektion (ESD).
Die Histopathologie ergibt ein Tumorstadium pT1a (m4) L0 V0 lokal R0. Der Patient kann nach zwei Tagen beschwerdefrei entlassen werden. Die Kontrolle nach drei Monaten zeigt eine vollständige Abheilung der Abtragungsläsion ohne Entwicklung einer Striktur. In der verbliebenen Barrettschleimhaut findet sich kein Verdacht auf eine metachrone Neoplasie. Die Indikation zur vollständigen Ablation der verbliebenen Barrettschleimhaut wird gestellt und erfolgt mittels Radiofrequenzablation (RFA) in zwei Sitzungen. Weitere Kontrollen zeigen jetzt eine vollständige Remission der Barrettschleimhaut.
Diskussion
Die Inzidenz des BÖ und des Barrettkarzinoms (BC) hat in den vergangenen Jahrzehnten in der westlichen Welt um bis zum Siebenfachen zugenommen. Aufgrund des Zusammenhangs mit dem metabolischen Syndrom wird sich dieser Trend möglicherweise fortsetzen [5]. Die frühzeitige Diagnose von BC und Dysplasien im BÖ ist entscheidend für die Prognose, kann aber eine Herausforderung für Endoskopiker darstellen. Barrett-Frühkarzinome und Dysplasien sind oft flach und selbst mit hochauflösenden Endoskopen schwer von der umgebenden nicht-dysplastischen Barrettschleimhaut zu unterscheiden [6]. Das „Seattle-Biopsie-Protokoll“ mit der Entnahme von 4-Quadranten-Biopsien im Abstand von 1 bis 2 cm kann die Diagnose von makroskopisch nicht-detektierten Frühläsionen unterstützen. Allerdings führen „sampling errors“ nicht selten zu falsch-negativen Ergebnissen, insbesondere bei kleinen fokalen Läsionen innerhalb eines langen Barrettsegments [7]. Darüber hinaus ist das Seattle-Protokoll mühsam, und die Biopsieentnahmen deshalb nicht immer vollständig.
Die sorgfältige endoskopische Evaluation des BÖ ist zeitaufwendig. Eine Inspektionszeit von ca. ein bis zwei Minuten pro cm Barrettschleimhaut verbessert jedoch signifikant die Dysplasiedetektionsrate [8]. Analog zur Einhaltung einer Rückzugszeit von mindestens sieben Minuten bei der Vorsorgekoloskopie sollte die Barrettinspektionszeit ebenfalls eingehalten werden, um optimale Ergebnisse zu erzielen. Die Hinzunahme von Essigsäure erleichtert die Erkennbarkeit von Barrettneoplasien und -dysplasien. Nach dem Aufsprühen von 1,5 Prozent Essigsäure auf das Barrettsegment kommt es zur Weißfärbung von nicht-dysplastischen Arealen, während sich Dysplasien und Neoplasien nach ca. ein bis zwei Minuten entfärben (De-Whitening Zeichen) [9].
Zwei endoskopische Klassifikationssysteme, um die Detektion und Charakterisierung von Barrett-Frühkarzinomen und Dysplasien zu verbessern, wurden entwickelt und validiert. Die PREDICT-Klassifikation, basierend auf der Essigsäure-Chromoendoskopie und die BING-Klassifikation mit der Methode der virtuellen Chromoendoskopie mit NBI, verbessern nachweislich die Sensitivität und Spezifität bei der Detektion und Charakterisierung von Frühneoplasien im Barrett-Ösophagus [10, 11].
Für die endoskopische Therapie von Barrett-Frühneoplasien stehen die endoskopische Mukosaresektion (EMR) und die endoskopische Submukosadissektion (ESD) zur Verfügung. Während die EMR gut geeignet ist, kleine Läsionen bis 15 mm Größe und ohne makroskopische Zeichen der Submukosainfiltration zu behandeln, sollte die ESD, insbesondere bei Läsionen größer als 20 mm und mit Zeichen einer Submukosainfiltration, eingesetzt werden. Die Vorteile der ESD liegen in der signifikant höheren en bloc- und R0-Resektionsraten mit geringerer Rezidivrate [12]. In Expertenhänden ist die Komplikationsrate für die EMR und die ESD gleich niedrig. Als kurativ gilt die vollständige Resektion von mukosalen Karzinomen oder Dysplasien. Die R0-Resektion von Submukosa-invasiven Karzinomen bis 500 µm Invasionstiefe gilt ebenfalls als kurativ.
Wegen des Risikos für metachrone Neoplasien sollte im Anschluss an die endoskopische Resektion von Barrettneoplasien die verbliebene Barrettschleimhaut mittels RFA, Argon-Plasma Koagulation (APC) oder Kryoablation (CA) behandelt werden. Für die Ablation der Rest-Barrettschleimhaut wird in der Regel die RFA als Primärtherapie eingesetzt [13]. Daten zeigen jedoch eine ähnliche Effektivität für die CA. Zudem scheint die CA auch als Sekundärtherapie beim Versagen der RFA (Salvagetherapie) effektiv zu sein [14].
Ausblick
Zahlreiche Arbeitsgruppen haben die Effektivität der Künstlichen Intelligenz (KI) bei der Detektion und Charakterisierung von Barrettfrühneoplasien und Dysplasien demonstriert [15]. Einzelne Produkte haben bereits CE- und FDA-Zulassungen erhalten. Ähnlich zu den KI-gestützten Adenomdetektionssystemen im Kolon, wird die KI bei der Evaluation des BÖ mittelfristig regelhaft eingesetzt werden. Die Vorteile einer verbesserten Dysplasiedetektion und einer Verringerung der Anzahl an Quadrantenbiopsien würde möglicherweise die Kosteneffektivität steigern.
Karzinom der Gallenblase und Adenokarzinom des Pankreas
Einleitung
Die individualisierte oder personalisierte Tumortherapie steht mittlerweile im Fokus zahlreicher Tumorerkrankungen und eine interdisziplinäre Zusammenarbeit im klinischen und molekularen Tumorboard ist essenziell. Die Kombination aus Chirurgie, Radioonkologie bzw. interventioneller Radiologie (TACE, SIRT) in Kombination mit Systemtherapie (CTX, Ak-Therapie, Immuntherapie) hat für zahlreiche Tumorerkrankungen das Outcome deutlich verbessert.
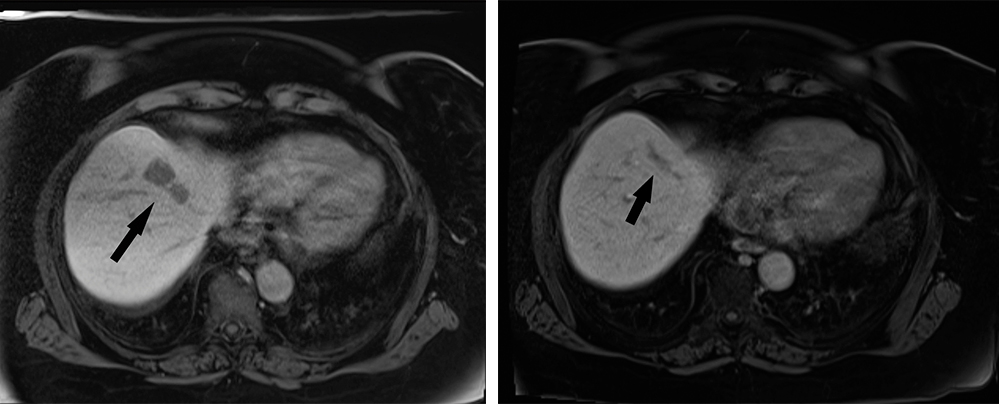
Abbildung 6: Ausgangsbefund 21. August 2018: MRT der Leber mit leberspezifischem Kontrastmittel zeigt zwei Metastasen im Segment 4a der Leber (Pfeil) (Abbildungen wurden von Professor Dr. Thomas Kröncke bereitgestellt). Abbildung 7: Verlaufskontrolle am 23. Oktober 2018 (nach 2 X DSM-TACE): MRT der Leber mit leberspezifischem Kontrastmittel zeigt eine Regredienz der Filiae im Segment 4a der Leber. Es lässt sich nur noch ein Metastasenresiduum abgrenzen (Pfeil).
Fallbericht 1 – Karzinom der Gallenblase
Wir berichten über eine 74-jährige Patientin mit der Erstdiagnose eines hochproliferativen kleinzelligen neuroendokrinen Karzinoms der Gallenblase (Erstdiagnose 09/2016, KI-67 Proliferationsindex > 80 Prozent). Die initiale Vorstellung mit Oberbauchbeschwerden erfolgte in einem auswärtigen Haus. Es erfolgte hier bei auffälliger Gallenblase eine laparoskopische Cholezystektomie. Histologisch ergab sich das Vorliegen eines schlecht differenzierten Gallenblasenkarzinoms mit Serosadurchbruch. Es erfolgte daraufhin eine Komplettierungsoperation mit Nachresektion des Gallenblasenbetts, des Segments IVb und Nachresektion des Ductus cysticus und LK – Dissektion des Ligamentum hepatoduodenale. In der histopathologischen Aufarbeitung zeigen sich Lymphknotenmetastasen sowie intrahepatische Satellitenherde im Nachresektat. Bei tumorfreien Absetzungsrändern und bildmorphologischer Tumorfreiheit erfolgte dann nach Maßgabe unserer interdisziplinären Tumorkonferenz eine adjuvante Systemtherapie mit Carboplatin (AUC6 – area under the curve/Fläche unter der Plasmakonzentrationszeitkurve) d1 und Etoposid 120 mg/m2 d1-3 alle drei Wochen für acht Zyklen. 16 Monate nach Beendigung der adjuvanten Therapie zeigten sich in der Nachsorge neu aufgetretene Leberläsionen in den Segmenten IVa und VIII, sodass erneut eine nun palliative Systemtherapie mit Carboplatin (AUC6) und Etoposid 120 mg/m2 durchgeführt wurde. Diese zeigte im ersten Zwischenstaging nach drei Monaten ein Therapieansprechen. Nach sechs Monaten zeigte sich jedoch ein Progress, sodass eine erneute sonografisch-gesteuerte Biopsie erfolgte und die Therapie auf das FOLFIRI-Schema umgestellt wurde.
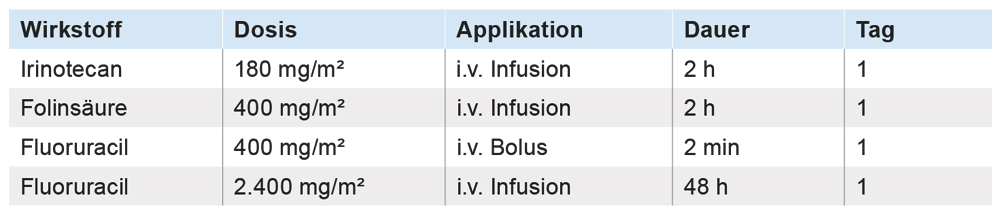
Tabelle: FOLFIRI-Schema.
In der molekulargenetischen Aufarbeitung mittels „next-generation-sequencing“ zeigte sich keine Treibermutation. In der Immunhistochemie konnte ein PD-L1 (programmed death-ligand 1) Positivität mit einem Combined positive score (CPS– gibt den Anteil der PD-L1 positiven Tumorzellen und Immunzellen im Tumor an) von 60 Prozent diagnostiziert werden. Aufgrund dieses Befundes wurde bei erneutem Progress unter FOLFIRI, zunehmend schlechterer Verträglichkeit der Systemtherapie und leberdominanter Erkrankung in unserer Tumorkonferenz die Empfehlung zur Checkpointinhibition und TACE-Therapie (Transarterielle Chemoembolisation – DSM-TACE: durch die Einbringung von mit Chemotherapie beladenen Mirkopartikeln erfolgt eine lokale chemotherapeutische Behandlung sowie eine Devaskularisierung des Tumors) gestellt. Im Juli 2019 erfolgte nach Kassenanfrage die Erstgabe eines PD1-Antikörpers (off-label). Zudem erfolgte eine Lokaltherapie durch die interventionelle Radiologie. Zweimalig erfolgte eine transarterielle Chemoembolisation mittels „degradable starch microspheres“ (DSM-TACE) unter Belegung der Tumorregion (Metastasen in S4/S8) mit 50 mg Cisplatin. Unter Fortführung der Immuntherapie erfolgte dann bei gutem Therapieansprechen noch eine CT-geführte Thermoablation metastatischer Residuen im Segment 8 dreieinhalb Jahre später. Mit Hilfe dieser multimodalen Therapie konnte eine bildmorphologische Komplettremission erzielt werden. Obwohl die Immuntherapie aufgrund einer „immune-related“ Hepatitis Grad 3 vor mehr als einem Jahr dauerhaft abgesetzt werden musste, hält die erzielte Komplettremission bis heute an.
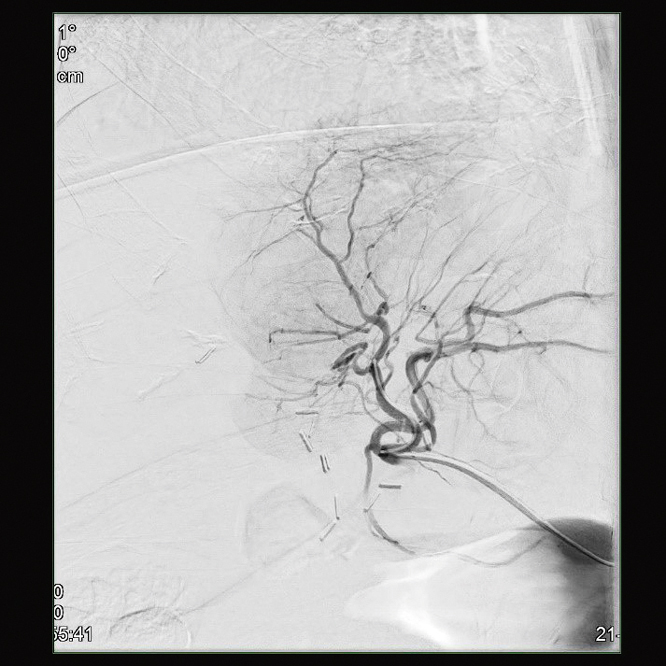
Abbildung 8: Angiografisch zeigen sich gering hypervaskularisierte Filiae vor erster Therapiesitzung mittels DSM-TACE am 24. September 2019.
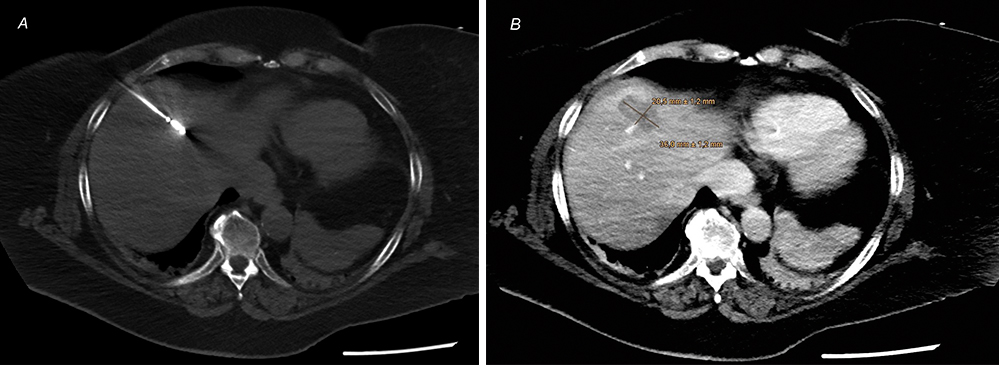
Abbildung 9: Intraprozedurale Aufnahmen während (A) und nach (B) Thermoablation des Metastasenresiduums. A) Mikrowellen-Sonde in situ. B) Die Ablationszone in der kontrastmittelunterstützten CT nach Thermoablation erfasst das Residuum vollständig.
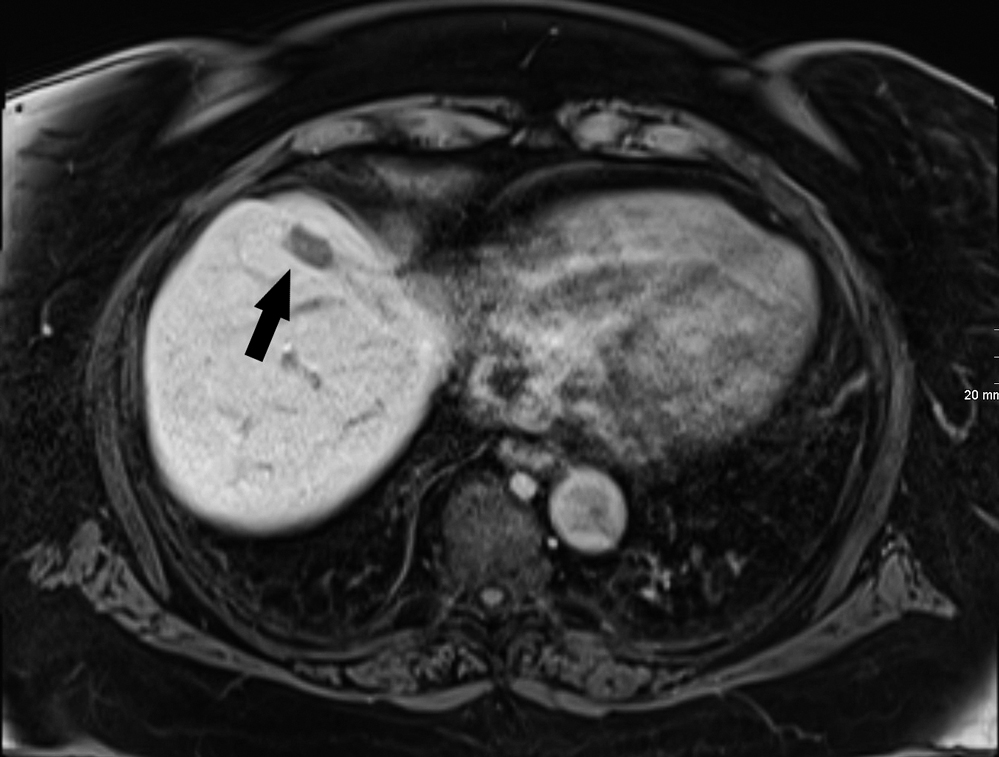
Abbildung 10: Aktuelle Verlaufskontrolle vom 3. März 2022: langsam regrediente Ablationszone. Bildmorphologisch anhaltende lokale Tumorkontrolle ohne Hinweis auf Rezidiv.
Diskussion
Der vorliegende Fall zeigt eindrücklich die erfolgreiche Biomarker-stratifizierte multimodale Behandlung einer seltenen malignen Erkrankung. Neuroendokrine Karzinome des biliären Systems sind hoch aggressive und seltene Erkrankungen. Es existieren nur wenige kontrollierte Studien zur Therapie dieser Entitäten und die klinische Entscheidungsfindung basiert hauptsächlich auf retrospektiven Daten und erfolgt analog zu den Empfehlungen für das kleinzellige Lungenkarzinom (SCLC), wobei eine prophylaktische Ganzhirnbestrahlung nicht generell empfohlen wird [16, 17, 18]. In Fällen von nicht-ösophagealen NECs, in denen eine R0-Resektion möglich erscheint, sollte eine radikale Resektion erfolgen [19].
Als Standard in der Erstlinientherapie im Rezidiv bzw. UICC Stadium IV gilt die Systemtherapie mit Platin und Etoposid [20]. Lokale Therapien können nach den Empfehlungen der North American Neuroendocrine Tumor Society (NANETS) durchgeführt werden [21].
Eine evidenzbasierte Zweitlinientherapie existiert bis dato nicht. Ein Biomarker-stratifiziertes Vorgehen erscheint hier sinnvoll. Eine Zweitlinientherapie mit einem Checkpoint-Inhibitor soll auch nach der Empfehlung der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten e. V. (DGVS-Leitlinie) evaluiert werden [20]. In der nicht-randomisierten Phase 1b Studie KEYNOTE-028 wurden PD-L1 positive solide Tumore mit dem Checkpoint-Inhibitor Pembrolizumab behandelt. In diesem Kollektiv waren auch 16 Patienten mit neuroendokrinen Karzinomen aus dem Gastrointestinaltrakt. Es zeigte sich hier nach sechs Monaten eine PFS-Rate (Progression-free survival ratio) von 40 Prozent. Nach zwölf Monaten lag die PFS noch bei 27 Prozent und das OS bei 87 Prozent [22]. In einer weiteren Phase II Studie, welche 2020 in JAMA Oncology veröffentlicht wurde, konnte gezeigt werden, dass therapierefraktäre Karzinome des biliären Systems, welche eine Überexpression von PD-L1 (CPS > 1) aufweisen, auf eine Therapie mit einem Checkpoint-Inhibitor ansprechen können. Bei mehreren Patienten in dieser Studie hielt das Ansprechen über mehr als ein Jahr an [23].
Fallbericht 2 – Adenokarzinom des Pankreas und Magenausgangsstenose
Bei einem 58 Jahre alten Patienten wurde die Diagnose eines hepatisch metastasierten, mäßig differenzierten Adenokarzinoms des Pankreas mit Duodenalinfiltration gestellt. Nach drei Zyklen palliativ intendierter Chemotherapie gemäß FOLFIRINOX-Schema (Folinsäure, 5-Fluorouracyl, Irinotecan, Oxaliplatin) entwickelte der Patient zunächst Völlegefühl im Oberbauch und in der Folge schwallartiges Erbrechen. Im CT Abdomen zeigten sich ein Größenprogress des Primarius im Pankreaskopf und der Leberfiliae wie auch ein Retentionsmagen. Eine Peritonealkarzinose mit weiter distal gelegenen intestinalen Stenosen war nicht nachweisbar. In der ÖGD war eine mit dem Gerät eben passierbare Bulbusausgangsstenose bedingt durch Tumorkompression sowie eine Refluxösophagitis erkennbar.
In der Folge wurde nach ausführlicher Aufklärung über die therapeutischen Möglichkeiten bei klinisch relevanter Duodenalstenose endosonografisch gestützt eine Gastroenterostomie mittels sogenannter Lumen-adaptierender Metallstents (lumen apposing metal stent, LAMS) geschaffen.
Diskussion
15 bis 20 Prozent der Patienten mit Pankreaskarzinom entwickeln eine Magenausgangsstenose mit den klinischen Folgen von Dehydratation, Malnutrition und Erbrechen. Dies ist mit einer erheblichen Einschränkung der Lebensqualität von Patienten mit ohnehin sehr eingeschränkter Prognose verbunden [24].
Die klassischen therapeutischen Optionen bei maligner Magenausgangsstenose sind die endoskopische Implantation eines Duodenalstents sowie die operative Anlage einer Gastroenterostomie. Die endoskopische Stentanlage zeigt technische und klinische Erfolgsraten von 80 bis 90 Prozent, allerdings kommt es in bis zu 50 Prozent der Fälle zu einer Stentokklusion innerhalb von sechs Monaten [25]. Die chirurgische Gastroenterostomie hingegen zeigt eine gute Langzeitfunktionalität, ist aber mit einem invasiveren Eingriff, längerer Krankenhausverweildauer und Magenmotilitätsstörungen verbunden [26]. Als dritte Therapieoption wurde seit Einführung von sogenannten Lumen-adaptierenden, voll ummantelten Stents (LAMS) die endosonografisch gestützte Anlage einer Gastroenterostomie etabliert. Das Verfahren kann bei maligner, wie auch benigner Magenausgangsstenose angewandt werden. Zum Einsatz kommen voll ummantelte (gecoverte) Stents, die klassischerweise zur Drainage von bewandeten Zysten als Folge einer nekrotisierenden Pankreatitis (walled-off necrosis, WON) Verwendung finden. Durch Konfiguration der Stents mit zwei Tulpen können diese benachbarten Hohlräume, die eine feste Bewandung aufweisen, miteinander stabil verbinden. Diese Eigenschaft lässt sich zur Adaptation von Magen und einer Jejunalschlinge mit Schaffung einer permanenten Verbindung über das Stentlumen nutzen. Mit einem Stentdurchmesser von zwei Zentimetern kann eine Passage für normale Nahrung geschaffen werden.
Die technische Durchführung der Stentplatzierung ist noch nicht standardisiert. In unserer Abteilung erfolgt eine Endoskopie in Sedierung zunächst mit Anlage einer nasobiliären Sonde über die klinisch relevante Stenose, über welche die abführende Dünndarmschlinge mit Flüssigkeit (zum Beispiel Ringer) gefüllt werden kann. Im zweiten Schritt muss endosonografisch eine durch die Flüssigkeitsinstillation distendierte, dem Magen anliegende Dünndarmschlinge detektiert werden, die zur Schaffung der Gastroenterostomie geeignet ist.
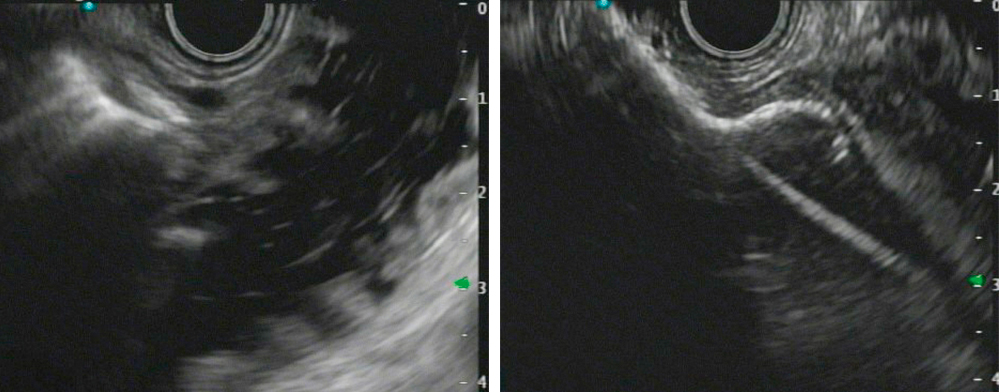
Abbildung 11 (links): Dem Magen anliegende, flüssikgeitsgefüllte Dünndarmschline. Abbildung 12 (rechts): Entfaltung der distalen Stentulpe im Darmlumen.
Schließlich kann das Stentlegebesteck unter endosonografischer Kontrolle mit Hilfe einer kauterisierenden Spitze durch den Arbeitskanal des Echoendoskops direkt vom Magen aus in die Dünndarmschlinge eingebracht werden. Es wird die distale Stenttulpe entfaltet und durch Rückzug des Legebestecks die Dünndarmschlinge in Adaptation mit der Magenwand gebracht.
Schließlich wird im Magen die proximale Tulpe geöffnet und die korrekte Stentlage mittels Durchleuchtung und KM-Abfluss über den liegenden Stent in den abführenden Dünndarm überprüft.
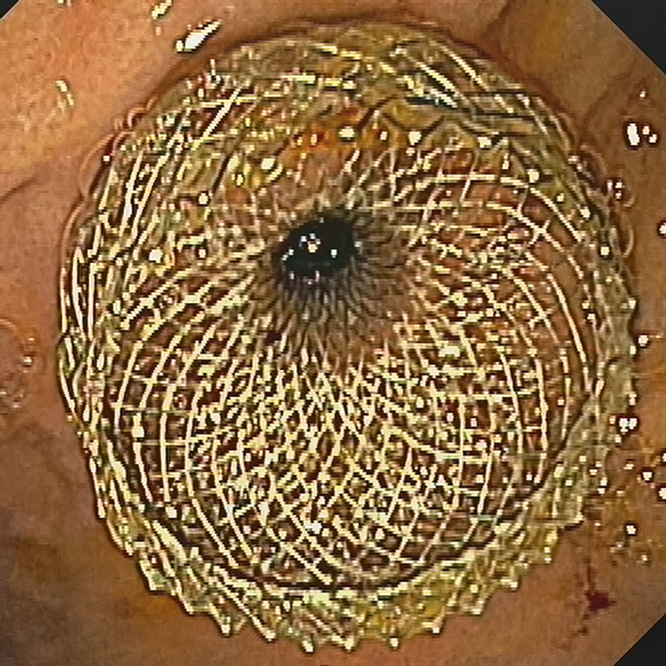
Abbildung 13: Proximale Stenttulpe im Magen, Stentlumen noch nicht ganz entfaltet (finaler Durchmesser 2 cm).
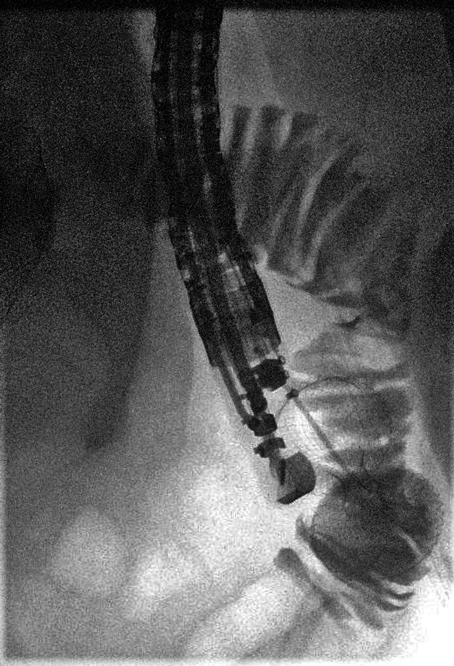
Abbildung 14: Geöffnete Stenttulpen und KM-Abfluss über den Stent in den Dünndarm.
Fallserien mit insgesamt rund 200 Patienten seit 2015 zeigten technische und klinische Erfolgsraten der Endosonografie (EUS)-gesteuerten Gastroenterostomie von ca. 90 Prozent. Die Komplikationsrate umfasst 10 bis 20 Prozent, wobei vor allem eine Fehllage des Stents mit Peritonitis und unter Umständen die Notwendigkeit der operativen Revision sowie Blutungen zu erwähnen sind [27, 28]. Ein retrospektiver Vergleich des enteralen Stentings mit der EUS-gesteuerten Gastrojejunostomie bei 82 Patienten zeigte keine Unterschiede in Hinblick auf technischen und klinischen Erfolg oder Komplikationen, die EUS-gesteuerte Therapie zeigte aber eine bessere Langzeitfunktionalität [27]. Auch im Vergleich mit der chirurgisch angelegten Gastroenterostomie zeigten sich bei der EUS-gesteuerten Methode keine Unterschiede bei technischer und klinischer Erfolgsrate. In dieser Auswertung von 93 Patienten mit maligner Magenausgangsstenose war auch die Komplikationsrate vergleichbar (16 Prozent vs. 25 Prozent p = 0,3). Die Offenheitsraten der endoskopisch oder chirurgisch angelegten Gastroenterostomien waren ebenfalls nicht signifikant verschieden. In einer weiteren retrospektiven Studie wurde die laparoskopische Gastroenterostomie mit der EUS-gesteuerten verglichen [29]. Auch hier zeigten sich bei 54 eingeschlossenen Patienten keine Unterschiede bezüglich technischem und klinischem Erfolg, wohl aber eine signifikant niedrigere Komplikationsrate des EUS-gesteuerten Verfahrens. Bemerkenswert sind diese Ergebnisse insbesondere vor dem Hintergrund, dass die Patienten in der EUS-Gruppe nicht operationsfähig eingestuft und somit mutmaßlich schwerer erkrankt waren als die Patienten in der chirurgischen Gruppe.
Zusammenfassend handelt es sich bei der endosonografisch-gesteuerten Gastroenterostomie um ein vielversprechendes Verfahren, welches ähnlich effektiv wie die konventionellen endoskopischen oder chirurgischen Therapieoptionen bei Magenausgangsobstruktion zu sein scheint. Dabei zeigen sich Vorteile gegenüber dem duodenalen „Stenting“ bzw. der chirurgischen Gastroenterostomie in Hinblick auf Offenheitsraten bzw. Ausmaß des Eingrifftraumas. Zur abschließenden Beurteilung des endosonografischen im Vergleich zu den konventionellen Verfahren wären randomisierte, prospektive Studien erforderlich.
Erfreulicherweise war unser Patient nach dem Eingriff beschwerdefrei und konnte bereits am Folgetag mit dem Kostaufbau beginnen. Nach zeitnaher Entlassung konnte der erste Zyklus der Zweitlinientherapie mit nab-Paclitaxel und Gemcitabine rasch verabreicht werden.
Take Home Message
Infektiöse Komplikationen sind ein häufiges Problem bei Patienten mit chronisch entzündlichen Darmerkrankungen. Durch ein frühzeitiges Monitoring dieser Patienten bereits ab Diagnosestellung hinsichtlich Infektionen, durch regelmäßige Beratung bezüglich notwendiger Impfungen und engmaschige klinische Kontrollen der Patienten, insbesondere hinsichtlich infektiöser (opportunistischer) Infektionen, könne diese Komplikation bei den Patienten mit chronisch entzündlichen Darmerkrankungen auf ein Minimum reduziert werden.
Die frühzeitige endoskopische Detektion von Barrettkarzinomen und Dysplasien ist wichtig für die Prognose. Kleine Läsionen bis 15 mm können mittels EMR reseziert werden, während größere Läsionen und solche mit Verdacht auf Submukosainfiltration mittels ESD behandelt werden sollen. Für die Ablation der verbliebenen Barrettschleimhaut stehen die Radiofrequenzablation, die Argon-Plasma-Koagulation und die Kryoablation zur Verfügung.
Ausgangsstenosen des distalen oberen Gastrointestinaltrakts sind mit einem hohen Leidensdruck der Betroffenen verbunden. Die EUS-gesteuerte Gastroenterostomie ist eine neues, wenig invasives Verfahren mit hoher technischer und klinischer Erfolgsrate bei akzeptablem Eingriffsrisiko zur symptomatischen Therapie, insbesondere maligner Magenausgangs- oder Duodenalstenosen. Prospektiv randomisierte Studien zum Vergleich der EUS-GE mit der chirurgischen Variante sind in Planung.
Die moderne gastroenterologische Onkologie zeichnet sich durch eine enge Kooperation von Gastroenterologen, Onkologen, Chirurgen, Radiologen und Radioonkologen aus. Zusammen können mittels multimodaler Therapiekonzepte in immer mehr Fällen „oligometastatische Konzepte“ umgesetzt werden. Dies führt zu einer individualisierten und hoch effektiven Therapie auch im bereits metastasierten Stadium einer Tumorerkrankung.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autoren

Privatdozentin Dr. Elisabeth Schnoy

Dr. Alanna Ebigbo
Dr. Stefan Eser
Dr. Tobias Weber
Professor Dr. Helmut Messmann
III. Medizinische Klinik, Universitätsklinik Augsburg, Stenglinstrasse 2, 86156 Augsburg
Teilen:
Das könnte Sie auch interessieren:






