Neu in der Endokrinologie
 Neu in der Endokrinologie
Neu in der Endokrinologie
Die Endokrinologie beschäftigt sich einerseits mit häufigen Zivilisationskrankheiten wie Adipositas und Diabetes mellitus, mit den häufigen Erkrankungen der Schilddrüse und des Knochens (Osteoporose) und andererseits mit einer großen Zahl eher seltener (und sehr seltener) Erkrankungen. Beim Management vieler dieser Pathologien konnten im letzten Jahrzehnt große Fortschritte erzielt werden. Auf dem Gebiet der Adipositastherapie, das in den vergangenen Jahrzehnten klar von der Chirurgie dominiert wurde, zeichnen sich interessante medikamentöse Therapieoptionen ab. Diese werden zukünftig helfen, die Adipositaspandemie einzudämmen. Als Sonderfall soll das Krankheitsbild der „hypothalamischen Adipositas“ näher beleuchtet werden. Die Therapieoptionen decken sich prinzipiell mit der klassischen alimentären Adipositas, allerdings sind Unterschiede in der zugrundeliegenden Pathophysiologie zu bedenken. Weiterhin beschäftigen wir uns mit dem Ausschleichen von Glucocorticoiden („Cortison“) und der Diagnostik der tertiären Nebenniereninsuffizienz, Punkte, die sich in der Praxis nicht selten problematisch gestalten. Zum einen gibt es bislang kein etabliertes Schema für die Reduktion der Steroiddosis. Zum anderen sieht man sich häufig mit überlappenden Effekten eines Steroidmangels und eines Steroidentzugs konfrontiert, wodurch das weitere Ausschleichen der Steroidtherapie erschwert wird. Im dritten Teil gehen wir auf die häufigste Ursache der Hypercalciämie näher ein, den primären Hyperparathyreoidismus. Zur Indikationsstellung einer operativen Therapie des asymptomatischen Hyperparathyreoidismus, der in der Regel zufällig entdeckt wird, liegt nun seit letztem Jahr eine neue Leitlinie vor, die hier anhand eines Fallbeispiels genauer beleuchtet wird.
Erster Fall: Therapie der Adipositas am Beispiel der „hypothalamischen Adipositas“
Fallbeschreibung
In der endokrinologischen Ambulanz stellte sich eine 26-jährige Patientin vor. Die junge Frau war im Alter von zehn Jahren an einem Kraniopharyngeom operiert worden, einer seltenen gutartigen Tumorerkrankung des Gehirns, die sich regelhaft im Bereich des Hypothalamus manifestiert. Anamnestisch war es bereits im Vorfeld der Diagnosestellung sowie deutlich aggraviert nach erfolgter Operation zu einer massiven Gewichtszunahme gekommen. Verschiedenste Therapieansätze konnten keine anhaltende Gewichtsreduktion erreichen. Initial stellte sich die Patientin mit einem Gewicht von 188 kg bei einer Größe von 1,72 m vor. Dies entspricht einem Body-Mass-Index von 63,5 kg/m². An Folgeerkrankungen der Adipositas per magna ließen sich eine Hypercholesterinämie sowie ein obstruktives Schlafapnoesyndrom erheben. Bei einem HbA1c von 5,9 Prozent lag zwar eine gestörte Glukosetoleranz vor, ein Diabetes mellitus Typ 2 ließ sich allerdings auch im Glukosetoleranztest nicht diagnostizieren. Bei hypothalamischer/hypophysärer Schädigung waren sämtliche Hormonachsen des Hypophysenvorder- und Hinterlappens im Sinne eines Panhypopituitarismus insuffizient, zum Zeitpunkt der Vorstellung allerdings adäquat substituiert. Insbesondere war die kortikotrope Achse mit 20 bis 25 mg Hydrocortison pro Tag nicht übersubstituiert, auch klinisch zeigten sich keinerlei Zeichen einer Übersubstitution. Der dringlichste Wunsch der Patientin war eine Reduktion des massiven Übergewichts, auch einer bariatrischen Operation stand die Patientin offen gegenüber. Nach Diskussion verschiedener Therapiemöglichkeiten entschieden wir uns für einen Therapieversuch mit Semaglutid. Einem entsprechenden Antrag auf Kostenübernahme stimmte die Krankenkasse der Patientin zeitlich befristet zu. Mit dieser Substanz ließ sich innerhalb von vier Monaten eine Gewichtsreduktion auf zuletzt 165 kg erreichen.
Diskussion
Im Falle der Patientin liegt eine sogenannte hypothalamische Adipositas vor. Dieses Krankheitsbild kann dann angenommen werden, wenn eine Adipositas in engem zeitlichen Zusammenhang zu einem hypothalamischen Schaden (zum Beispiel nach Operation oder Radiatio) auftritt. Die hypothalamische Adipositas ist häufig gekennzeichnet durch eine therapieresistente massive Hyperphagie infolge eines gestörten Sättigungsempfindens, da relevante appetitregulierende Hormone an ihrer Zielstruktur im Hypothalamus nicht mehr (ausreichend) wirken können. Nicht selten kommt es hierbei auch zu nächtlichen Heißhungerattacken. Spezifische medikamentöse Therapieoptionen existieren für diese Erkrankung nicht. Grundsätzlich besteht damit die selbe Problematik wie bei alimentärer Adipositas: Liegt ein Diabetes mellitus als Folgeerkrankung (noch) nicht vor, so ist eine Kostenübernahme von gewichtsreduzierenden Arzneimitteln in der gesetzlichen Krankenkasse durch den „Verordnungsausschluss von Lifestyle Arzneimitteln“ des gemeinsamen Bundesausschusses (G-BA, gesetzliche Grundlage: § 34 Abs. 1 Satz 7 SGB V) ausgeschlossen. Im Falle unserer Patientin besteht zwar eine Indikation zur primären bariatrischen Chirurgie, auch hier ist jedoch aufgrund der Wirkweise der entsprechenden Operationsverfahren (Magenschlauch und Magenbypass) Vorsicht geboten. Diese beiden chirurgischen Verfahren führen als wesentlicher Teil ihrer sehr guten Effektivität zu einer veränderten Hormonantwort nach Nahrungsaufnahme. Hormone wie GLP-1 und PYY, die im Magen-Darm-Trakt nach Nahrungsaufnahme ausgeschüttet werden, können allerdings ihre zentrale Wirkung bei hypothalamischer Schädigung nicht ausreichend gut entfalten. Der Einsatz eines GLP-1-Agonisten, wie zum Beispiel Semaglutid, kann hier insofern Aufschluss geben, als ein Gewichtseffekt einer solchen Substanz zumindest eine (möglicherweise allerdings verringerte) Wirksamkeit auch der bariatrischen Chirurgie nahelegt. Semaglutid mediiert seine gewichtsreduzierenden Effekte auf verschiedene Weise: Zentral unter anderem direkt in entsprechenden Kerngebieten des Hypothalamus, peripher unter anderem über eine verlangsamte Magenentleerung/Magen-Darm-Passage. Als häufigere Nebenwirkung ist, vor allem initial, das Auftreten von Übelkeit zu erwähnen.
Der Fall zeigt anschaulich die grundsätzliche Problematik der konservativen Adipositastherapie bei weiter zunehmenden Adipositaszahlen in der Gesamtbevölkerung. Der sogenannte „Lifestyle-Paragraph“ stellt für die medikamentöse Adipositastherapie auch weiter eine teilweise unüberwindbare Hürde dar, obwohl Substanzen mit guter Wirksamkeit auf das Körpergewicht an sich verfügbar wären. An vorderster Stelle sind hier die GLP-1-Analoga zu nennen, von denen mit Semaglutid die größte Gewichtsreduktion erzielt werden kann (bis minus 14,9 Prozent bzw. ca. minus 15 kg). In einer Dosis von bis zu 2,4 mg ist diese Substanz durch die europäische Arzneimittelagentur als Wegovy® zwar zur Behandlung der Adipositas zugelassen. Auch wenn weitere, nach ersten klinischen Daten sehr effektive medikamentöse Therapieoptionen am Horizont zu sehen sind, insbesondere sei hier der Doubleagonist Tirzepatid zu nennen (Mounjaro®, ein kombinierter GLP-1- und GIP-Agonist), so ist die gesetzliche Grundlage für eine medikamentöse Therapie der Adipositas weiter unzureichend. Selbstverständlich ist eine Rezeptierung auf Privatrezept bei Adipositas ohne Diabetes mellitus Typ 2 möglich, die monatlichen Therapiekosten sind allerdings nicht unerheblich. Alternative Substanzen, wie zum Beispiel der Fettresorptionshemmer Orlistat, sind zwar günstiger, andererseits aber wesentlich nebenwirkungsbehafteter und deutlich weniger effektiv. Aktuell bestehen Lieferschwierigkeiten, insbesondere die Substanz Semaglutid betreffend. Möglicherweise wird hier auch das in Deutschland aktuell noch nicht verfügbare orale Semaglutidpräparat Rybelsus® Abhilfe schaffen. Auf die schon länger bekannten positiven Effekte der Substanzgruppe der GLP-1-Analoga auf kardiale Endpunkte sei hingewiesen, auch positive Effekte auf hepatische Endpunkte (nichtalkoholische Steatohepatitis) sind in ersten klinischen Studien gezeigt worden. Ein großzügiger Einsatz der Substanzen, zumindest bei hochgradiger Adipositas, erscheint somit auch ohne die Folgeerkrankung Diabetes mellitus sehr erstrebenswert.
Zweiter Fall: Die tertiäre Nebenniereninsuffizienz – Hürden und Fallstricke beim Ausschleichen von Glucocorticoiden
Fallbeschreibung
Durch die Kolleginnen und Kollegen der Gastroenterologie wird eine 35-jährige Patientin mit Colitis ulcerosa unter Therapie mit 20 mg Prednison/Tag und monoklonalen Antikörpern (Ustekinumab subkutan alle acht Wochen) vorgestellt. Bei gutem Therpieansprechen auf Ustekinumab soll die Glucocorticoidtherapie ausgeschlichen und beendet werden. Die Patientin wird seit über fünf Jahren mit Prednison behandelt (durchschnittliche tägliche Dosis zwischen 10 und 15 mg). Ein Steroidstoß mit 50 bis 90 mg Prednison/Tag über jeweils fünf bis sieben Tage musste bei rezidivierenden Colitis-Schüben in den letzten zwölf Monaten mehrmals appliziert werden. Im Rahmen der ersten Vorstellung bei uns imponierten ein cushingoider Habitus mit Übergewicht (BMI28 kg/m²), stammbetonter Fettverteilung, Plethora und leichten prätibialen Ödemen. Der Blutdruck stellte sich mit 150/95 mmHg mäßig entgleist dar. Aufgrund des erhöhten Risikos für eine iatrogen-induzierte Nebenniereninsuffizienz besprachen wir die Reduktion der Prednison-Dosis um 5 mg pro Woche über zwei Wochen und anschließend (ab 10 mg Prednison/Tag) in 2,5-mg-Schritten pro Woche bis auf eine Gesamtdosis von 5 mg Prednison/Tag. Nach Reduktion der Dosis auf 7,5 mg Prednison/Tag entwickelte die Patientin generalisierte Muskel- und Gelenkschmerzen, Übelkeit und Fatigue. Die Blutdruckmessungen ergaben normwertige Blutdruckwerte (130-135/70-80 mmHg). Die Dosis wurde daraufhin für zwei Wochen auf 10 mg/Tag gesteigert und anschließend in 2,5-mg-Schritten alle zwei Wochen erneut reduziert.
Nach Erhaltung einer Gesamtdosis von 5 mg Prednison/Tag für insgesamt vier Wochen wurde die Funktion der Nebennierenrinde mittels Messung der basalen Cortisolkonzentration im Serum am frühen Morgen (8:00 Uhr) sowie mittels Stimulation mit ACTH (Synacthen®) getestet. Es ergab sich eine Nebenniereninsuffizienz bei niedrigem basalen Serumcortisol (3.2 µg/dl; Referenzbereich 5-25 µg/dl) und insuffizienter Stimulierbarkeit im ACTH-Test (Anstieg des Serumcortisols auf 9 µg/dl; Referenzbereich > 20 µg/dl). Nach Umstellung von Prednison auf das physiologischere Cortisonpräparat Hydrocortison 20 mg/Tag (15-5-0) für drei Monate erbrachte die erneute Testung eine partielle Erholung der Nebennierenfunktion (basales Serumcortisol 9 µg/dl, stimuliertes Serumcortisol 14 µg/dl). Die Substitution mit Hydrocortison wurde auf 15 mg/Tag (10-5-0) reduziert und nach drei Monaten, nach weiterem Ausschleichen, und dann unauffälliger Testung der Nebennierenfunktion beendet.
Diskussion
Die iatrogen-induzierte (tertiäre) Nebenniereninsuffizienz (NN-Insuffizienz) entsteht durch die Suppression der CRH-Synthese aus dem Hypothalamus infolge längerfristiger (in der Regel > vier Wochen) Therapie mit hochdosierten Glucocorticoiden (≥ 5 mg Prednison-Äquivalent/Tag) und stellt die häufigste Form der NN-Insuffizienz dar. Das Risiko für eine tertiäre NN-Insuffizienz ist wesentlich höher unter systemischen (oralen) und intraartikulären Glucocorticoidtherapien (ca. 50 Prozent) im Vergleich zu inhalativen oder kutanen Applikationen (5 bis 8 Prozent). Fälle mit Iatrogen-induzierter NN-Insuffizienz wurden allerdings unter sämtlichen Applikationsarten und Glucocorticoiddosen beobachtet, und es besteht eine sehr große individuelle Empfindlichkeit, sodass keine Glucocorticoidtherapie per se als risikofrei eingestuft werden kann. Eine unerkannte tertiäre NN-Insuffizienz kann insbesondere in Stresssituationen aufgrund des Risikos für lebensbedrohliche Nebennierenkrisen kritisch sein.
Mit einer tertiären NN-Insuffizienz ist vor allem in folgenden Situationen zu rechnen:
- Behandlungen mit langwirksamen, potenten Glucocorticoiden (Prednison, Dexa-methason)
- Längere Behandlungsdauer (> vier Wochen)
- Dosis ≥ 5 mg Prednison-Äquivalent/Tag
- Abendliche Einnahmen (stärkere Suppression der corticotropen Achse)
- Kombinierte Therapien (oral + inhalativ)
- (Mehrfache) intraartikuläre Gaben
- klinische Merkmale eines Cushing-Syndroms (stammbetonte Adipositas, Plethora, Striae rubrae, Hämatomneigung, Pergamenthaut, Hypertonie)
Hieraus folgt, dass Therapien mit > 5 mg Prednison-Äquivalent/Tag unter Umständen über mindestens vier Wochen auszuschleichen sind, um das Risiko einer (potenziell lebensbedrohlichen) NN-Insuffizienz zu minimieren. Es existiert allerdings keine wissenschaftlich begründbare Empfehlung, in welchen Schritten und in welchem Zeitraum die Dosisreduktion erfolgen soll. Hier spielen in der Regel Faktoren wie die Startdosis, das Risiko eines „Cortisonentzugs“ (generalisiertes Krankheitsgefühl mit Müdigkeit, Gelenk-/Muskelschmerzen, Appetitlosigkeit, gegebenenfalls Fieber, wie bei einem viralen Infekt) und/oder einer klinisch relevanten NN-Insuffizienz beziehungsweise der Erfolg vorheriger Ausschleichversuche eine Rolle. Höhere Dosen (> 40 mg Prednison-Äquivalent/Tag) werden zunächst in größeren Schritten (10 mg/Woche) reduziert, Dosen ab ≤ 20 mg Prednison-Äquivalent/Tag eher in kleineren Schritten (2,5 bis 5 mg/Woche). Die erste Testung der Nebennierenfunktion erfolgt ein bis vier Wochen nach Erreichen und Erhaltung einer Tagesdosis von 5 mg Prednison-Äquivalent/Tag (unterhalb der vermeintlichen „Cushing-Schwelle“). Die Messung des basalen Cortisolspiegels im Serum am Morgen (8:00 Uhr) mindestens 24 Stunden nach letzter eingenommener Glukokortikoiddosis ist ein guter Indikator für die Nebennierenfunktion. Inadäquat niedrige Werte < 3,6 µg/dl (bzw. < 100 nmol/l) beweisen eine NN-Insuffizienz. Bei Werten > 16 µg/dl (bzw. > 450 nmol/l) ist mit hoher Wahrscheinlichkeit von einer regelrechten NN-Funktion auszugehen. In allen anderen Fällen soll eine dynamische Testung der NN-Funktion mittels ACTH-Stimulationstest erfolgen (ein Cortisolanstieg ≥ 18 µg/dl 60 min. nach intravenöser ACTH-Gabe schließt eine relevante NN-Insuffizienz in aller Regel aus).
Nach Ausschluss einer NN-Insuffizienz kann die Steroidtherapie unmittelbar abgesetzt werden. Patientinnen und Patienten mit nachgewiesener NN-Insuffizienz sollten auf eine physiologischere Glucocorticoidsubstitution mit Hydrocortison (zum Beispiel 10 mg – 5 mg – 0 oder 15 mg – 5 mg – 0) umgestellt und nach drei Monaten erneut getestet werden. Die Substitution mit Hydrocortison kann (je nach Klinik) bis auf 10(-15) mg/Tag bis zur erneuten Testung reduziert werden. Tabelle 1 zeigt Glucocorticoidpräparate, die am häufigsten in der Substitutionstherapie eingesetzt werden.
Das Ausschleichen der Steroidtherapie kann durch Symptome eines Cortisonentzugs deutlich erschwert werden. Diese überlappen sich größtenteils mit Symptomen eines Hypocortisolismus (Muskel- und Gelenkschmerzen, Übelkeit, Gewichtsverlust, Fatigue, erhöhter Schlafbedarf, Anorexie) und können auch unter supraphysiologischen Glucocorticoiddosen auftreten. In der Regel sistieren die Symptome innerhalb weniger Tage. Patienten hierüber zu informieren sowie auf die Harmlosigkeit dieser „Entzugsymptomatik“ hinzuweisen ist zum Erhalt der Compliance von großer Bedeutung. Bei ausgeprägter Symptomatik empfiehlt sich die vorübergehende Steigerung der Therapie auf die niedrigstmögliche Dosis, unter der die Symptome als erträglich empfunden werden. Anschließend kann das Ausschleichen gegebenenfalls in kleineren Schritten fortgeführt werden. Hypoglykämien, hypotone Blutdruckwerte und/oder ein rascher Gewichtsverlust deuten allerdings auf eine klinisch relevante NN-Insuffizienz hin. In diesem Fall soll die Steroidtherapie in einer Dosis von 5 mg Prednison-Äquivalent/Tag (idealerweise mittels Hydrocortison 15 bis 20 mg/Tag) fortgeführt und die NN-Funktion frühestens nach drei Monaten getestet werden.
Die ausschleichende Dosisreduktion einer Steroidtherapie ist aus medizinischer Sicht zwar einleuchtend, allerdings bisher immer noch nicht standardisiert. Dieser Aspekt wird aktuell im Rahmen einer internationalen, randomisierten, doppelblinden, placebokontrollierten Multicenter-Studie (Taper Or Abrupt Steroid STop: TOASST trial) untersucht.
Dritter Fall: Diagnostik und Behandlung des primären Hyperparathyreoidismus und des rezidivierenden primären Hyperpara-thyreoidismus
Fallbeschreibung
Eine 55-jährige Patientin stellte sich mit Magenschmerzen und Übelkeit vor. Eine ähnliche Symptomatik war bereits 2015 aufgetreten, im Rahmen einer stationär behandelten Pankreatitis fiel damals eine Hyperkalziämie bei primärem Hyperparathyreoidismus auf. Mittels (Neben-)Schilddrüsen-Ultraschall und Sestamibi-Nebenschilddrüsen-Szintigraphie (Sensitivität 70,8 Prozent, Spezifität 100 Prozent) war seinerzeit ein rechts kranial gelegenes Adenom identifiziert und chirurgisch entfernt worden. In der Folge war der Parathormonspiegel um mehr als
50 Prozent gefallen. Bereits im Vorfeld der Diagnostik und Operation war die Patientin bei einer LWK-Fraktur im Rahmen einer Osteoporose mit Vitamin D und Bisphosphonat behandelt worden.
Laborchemisch zeigte sich in der aktuellen Vorstellung ein hochnormales Albumin-korrigiertes Serumkalzium (2,55 mmol/l [2,15 bis 2,58 mmol/l]) zusammen mit einem gering erhöhten Parathormon (69,5 pg/ml [10,0 bis 65,0 pg/ml]) im Sinne eines normokalzämen Hyperparathyreoidismus. Ein Hinweis auf einen sekundären Hyperparathyreoidismus lag nicht vor, die Nierenfunktion, der Phosphat- und der Vitamin D-Spiegel waren normwertig. Entsprechend der aktuellen Empfehlungen erfolgte bei rascher Besserung der Symptomatik keine medikamentöse oder operative Therapie.
Im Rahmen einer Verlaufskontrolle zwölf Monate später war eine Zunahme der Beschwerden mit Übelkeit und Magenschmerzen zu beobachten. Das Albumin-korrigierte Serumkalzium war nun mit 3,1 mmol/l erhöht, das Parathormon lag bei 72,3 pg/ml. Zusätzlich lag mit einer täglichen Kalziumausscheidung von 8,4 mmol/d [2,5 bis 6,25 mmol/d] eine Hyperkalziurie vor. Somit handelte es sich nun um das klinisch und laborchemisch manifeste Rezidiv eines primären Hyperparathyreoidismus. Aufgrund der Symptomatik sowie der Hyperkalziämie und Hyperkalziurie wurde nun erneut eine Operationsindikation gestellt.
Sonografisch ließ sich ein Adenom rechts kaudal darstellen. Zur genauen präoperativen Lokalisationsdiagnostik und zur Differenzierung eines multiglandulären Hyperparathyreoidismus wurde ein 18F-Cholin-PET/CT durchgeführt. Hierin bestätigte sich das Nebenschilddrüsenadenom rechts kaudal. Dieses wurde in der Folge mittels minimal-invasiver Parathyreoidektomie entfernt, der Parathormonspiegel sank bereits intraoperativ auf 28,3 pg/ml ab.
In der postoperativen Verlaufskontrolle präsentierte sich die Patientin nun beschwerdefrei, das Serumkalzium und Parathormon waren normwertig.
Diskussion
Der primäre Hyperparathyreoidismus zählt mit einer Prävalenz von 100 bis 230 Fällen pro 100.000 Einwohner zu den häufigen Endokrinopathien (Tabelle 2). Er ist in der Regel dann anzunehmen, wenn bei einem erhöhten Serumkalzium ein erhöhtes beziehungsweise im Sinne des Regelkreises inadäquat hohes Parathormon zu messen ist. Die vielfach als klassisch beschriebene Trias aus Knochenmanifestationen (Osteoporose, Knochenschmerzen), Nierenbeteiligung (Nephrolithiasis) und Magenschmerzen im Sinne eines symptomatischen Hyperparathyreoidismus tritt tatsächlich nur bei einem kleinen Teil der Betroffenen auf. Wesentlich häufiger liegt ein asymptomatischer Hyperparathyreoidismus vor, der laborchemisch zufällig entdeckt wird. Davon abzugrenzen ist der normokalzäme Hyperparathyreoidismus (normwertiges Serumkalzium bei erhöhtem Parathormonwert), der zunächst auch im oben geschilderten Fall vorlag. Zur genaueren Einordnung und Diagnosestellung eines primären Hyperparathyreoidismus sind in einem solchen Fall alle Ursachen eines sekundären Hyperparathyreoidismus (zum Beispiel Vitamin D-Mangel, Niereninsuffizienz, renale Hyperkalziurie, Malabsorptionssyndrome) auszuschließen. Aufgrund fehlender Evidenz hinsichtlich der Wirksamkeit einer operativen oder medikamentösen Therapie ist bei normokalzämem Hyperparathyreoidismus aktuell lediglich eine jährliche laborchemische Verlaufskontrolle empfohlen. Falls der normokalzäme Hyperparathyreoidismus im weiteren Verlauf in einen hyperkalzämen Hyperparathyreoidismus übergeht, ist die OP-Indikation erneut zu prüfen. 
Während eine Indikation zur Operation bei symptomatischem Hyperparathyreoidismus immer gegeben ist, bietet sich bei asymptomatischen Patienten die Prüfung der Indikationsstellung anhand der „Guidelines for Surgery in Asymptomatic Primary Hyperparathyreoidism“ des 5. Internationalen Workshops 2022 an (Tabelle 3). Diese OP-Kriterien erfüllen erfahrungsgemäß nur ein (kleiner) Teil der Patienten, sodass der Großteil der Patienten vorerst verlaufsbeobachtet wird.
(Tabelle 3 einfügen)
Falls mindestens sechs Monate nach einer Parathyreoidektomie erneut eine Hyperkalzämie mit erhöhten Parathormonwerten auftritt, spricht man von einem rezidivierenden Hyperparathyreoidismus. Die Häufigkeit hierfür beträgt bis zu zehn Prozent. Die Indikation zur operativen Versorgung folgt in einem solchen Fall den allgemeinen Empfehlungen.
Zur präoperativen Lokalisationsdiagnostik ist immer eine Sonografie der Schilddrüse und Nebenschilddrüsen empfohlen. Im Fall eines hiermit nicht detektierbaren Nebenschilddrüsenadenoms wird ein C11-Methionin- oder 18F-Cholin-PET/CT empfohlen, dessen Verfügbarkeit im ambulanten Bereich jedoch weiterhin eingeschränkt ist. Die Durchführung einer Sestamibi-Szintigrafie ist zwar umstritten, in vielen Fällen aufgrund der guten Verfügbarkeit aber weiter der gangbarste Weg. In 80 bis 85 Prozent der Fälle liegt ein solitäres Nebenschilddrüsenadenom vor, in 10 bis 15 Prozent multiglanduläre Adenome.
Bei bereits in der Vergangenheit erfolgter Thyreoidektomie oder Parathyreoidektomie sollten präoperativ immer zwei Bildgebungsverfahren zur genauen Lokalisationsdiagnostik erfolgen. Neben einer Sonografie ist ein C11-Methionin- oder 18F-Cholin-PET/CT sinnvoll (Sensitivität 90 Prozent, Spezifität 94 Prozent). Aufgrund der schlechten ambulanten Verfügbarkeit des PET/CT kann im ersten Schritt auch eine Sestamibi-Szintigrafie erfolgen (Abbildung 1). Bei diskordanten Ergebnissen hinsichtlich der Lokalisation nach erfolgter Sonografie und Sestamibi-Szintigrafie sollte im zweiten Schritt zunächst ein PET-CT erfolgen. Ist hier die Lokalisation des Adenoms beziehungsweise der Adenome weiterhin nicht eindeutig, ist die Durchführung eines selektiven Nebenschilddrüsenvenenkatheters sinnvoll. Hinsichtlich des chirurgischen Vorgehens wird je nach Befund (nur ein oder mehrere Nebenschilddrüsenadenome) entweder eine minimalinvasive oder explorative Parathyreoidektomie mit introperativer PTH-Messung und Neuromonitoring empfohlen. Nach in der Vergangenheit bereits erfolgter Parathyreoidektomie oder Thyreoidektomie beträgt das Risiko für einen transienten postoperativen Hypoparathyreoidismus bis zu 80 Prozent, für einen chronischen Hypoparathyreoidismus bis zu 13 Prozent, was deutlich macht, dass hier ein postoperatives Screening sinnvoll ist.
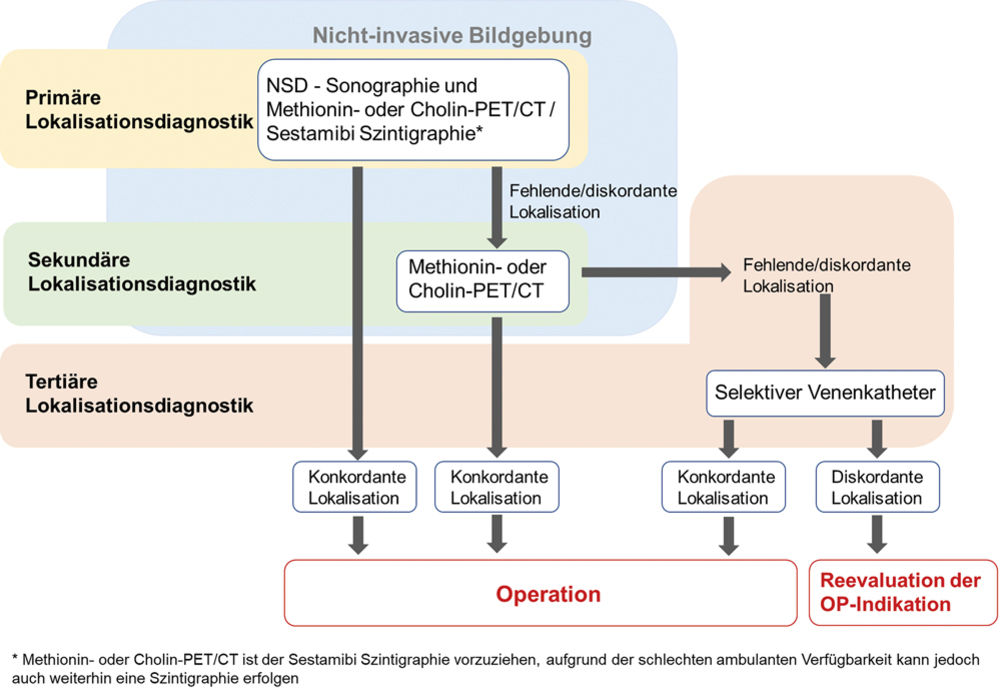
Abbildung 1: Präoperative Lokalisationsdiagnostik bei Patienten mit in der Vergangenheit erfolgter Thyreoidektomie oder Parathyreoidektomie (modifiziert nach Hendricks et al. 2021).
Hingewiesen sei darüber hinaus auf die Möglichkeit eines primären Hyperparathyreoidismus im Rahmen einer Multiplen endokrinen Neoplasie (MEN). Bei einer MEN I tritt dieser in 95 Prozent, bei einer MEN II in 20 Prozent der Fälle auf. In der Regel besteht hierbei eine multiglanduläre Erkrankung, sodass bereits bei der Erstoperation eine bilaterale Exploration der Schilddrüsenloge mit Entfernung aller Nebenschilddrüsen und Reimplantation eines Resektatteils erwogen wird.
Bei Kontraindikation oder Ablehnung der indizierten Operation durch die Patienten ist eine medikamentöse Therapie des primären Hyperparathyreoidismus möglich. Bei erhöhtem Serumkalzium (> 0,25 mmol/l über oberer Normgrenze) kann eine Therapie mit Cinacalcet erfolgen, welches die Parathormonsekretion über eine Modulation des Calcium-sensing Rezeptors reduziert. Eine Therapie mit Bisphosphonaten oder Denosumab ist bei subklinischer Osteoporose zu erwägen, bei manifester Osteoporose empfohlen. Außerdem sollte eine jährliche laborchemische Verlaufskontrolle sowie alle ein bis zwei Jahre eine Knochendichtemessung mittels DXA-Methode erfolgen. Eine kalziumarme Diät wird dezidiert nicht empfohlen. Ein Vitamin-D-Mangel sollte auch im Sinne der Knochengesundheit ausgeglichen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Das Wichtigste in Kürze
» Die hypothalamische Adipositas stellt eine Sonderform der Adipositas mit spezieller Pathophysiologie dar. Die medikamentöse Therapie gestaltet sich allerdings zunächst genauso wie bei alimentärer Adipositas.
» Neue medikamentöse Therapieoptionen (zum Beispiel Tirzepatid) lassen hoffen, dass der Adipositaspandemie zukünftig auch medikamentös effektiver begegnet werden kann.
» Die ausschleichende Dosisreduktion einer Steroidtherapie mit hochdosierten Glucocorticoiden über mindestens vier Wochen ist aufgrund des Risikos für eine tertiäre Nebenniereninsuffizienz indiziert, allerdings bislang immer noch nicht standardisiert.
» Die erste Testung der Nebennierenfunktion mittels Messung des basalen Serumcortisols am Morgen ist frühestens eine Woche nach Erreichen einer stabilen Tagesdosis von 5 mg Prednison-Äquivalent sinnvoll.
» Symptome eines „Cortisonentzugs“ können auch unter supraphysiologischen Glucocorticoiddosen auftreten und die Compliance der Patientinnen und Patienten beeinträchtigen.
» Die klassische Trias aus Knochenmanifestation, Nierenbeteiligung und Magenschmerzen tritt bei einem primären Hyperparathyreoidismus nur bei einem kleinen Teil der Patienten auf, in den meisten Fällen besteht ein asymptomatischer Hyperparathyroeidismus.
» Die Indikation zur Operation bei asymptomatischen Patienten wird aktuell anhand der „Guidelines for Surgery in Asymptomatic Primary Hyperparathyreoidism“ des 5. Internationalen Workshops 2022 gestellt.
» Präoperativ sollte immer eine Sonografie der Schilddrüse und Nebenschilddrüsen erfolgen. Bei nicht detektierbarem Nebenschilddrüsenadenom oder bei bereits in der Vergangenheit erfolgter Thyreoidektomie oder Parathyreoidektomie sollte nach Möglichkeit ein C11-Methionin- oder 18F-Cholin-PET/CT, alternativ eine Sestamibi-Szintigrafie, durchgeführt werden.
Autoren
Universitätsklinikum Würzburg, Lehrstuhl für Endokrinologie und Diabetologie, Oberdürrbacher Str. 6, 97080 Würzburg
Teilen:
Das könnte Sie auch interessieren:









