Neonatologie – highlighted
 Neonatologie – highlighted
Neonatologie – highlighted
Im Gegensatz zu anderen pädiatrischen Subdisziplinen hat die Neonatologie kein Pendant in der Erwachsenenmedizin. Pathophysiologie, Krankheitsbilder und Therapien unterscheiden sich zudem in vielem so sehr von der Pädiatrie wie die Pädiatrie von der Erwachsenenmedizin. Die Neonatologie ist in Weiterbildung und Versorgung elementarer Bestandteil der Pädiatrie. Ihre Bedeutung bei ca. 750.000 Geburten pro Jahr in Deutschland mit ca. neun Prozent Frühgeborenen bedarf keiner weiteren Erläuterung.
Fall 1: Frühgeborenes 27 + 4 Schwangerschaftswochen
Anamnese
Nach mäßiger körperlicher Anstrengung kommt eine 36-jährige 3. Gravida 0 Para (zwei Aborte) bei bisher unauffälliger Schwangerschaft mit tiefsitzender Plazenta zur stationären Aufnahme im Urlaub in der 20 + 2 SSW (Schwangerschaftswoche plus Tage post menstruationem) bei überperiodenstarker vaginaler Blutung. Es findet sich eine intakte Schwangerschaft, kein früher vorzeitiger Blasensprung und keine Muttermunderöffnung. Es erfolgt eine Therapie mit körperlicher Schonung, Magnesium und Progesteron. Beim Nachweis einer Placenta praevia hat die Patientin wiederholte Blutungen und bleibt maximal zwei Tage blutungsfrei. Nach 18 Tagen erfolgt die Verlegung in die Heimatstadt München (22 + 6 SSW), mit unveränderter Symptomatik vor „Beginn der Lebensfähigkeit“.
Die weitere Therapie besteht aus: Lungenreifungsbeschleunigung (Betamethason i. m.) bei nicht sistierenden Blutungen und damit drohender Frühgeburtlichkeit. Es erfolgt eine intensive Betreuung durch das psychosoziale Team des Perinatalzentrums und in Gesprächen mit Geburtshelfer/-innen, Neonatologen/-innen und Hebammen. Die Mutter ist durch die drohende Frühgeburtlichkeit an der Grenze der Lebensfähigkeit durch immer wieder einsetzende Blutungen mit jeweils akuter Betreuung im Kreißsaal belastet. Der Fetus gedeiht gut, liegt nun in Beckenendlage mit zunehmendem Oligohydramnion, hat jedoch keine CTG (Cardiotokogramm)-Auffälligkeiten. Die Patientin muss einmalig mit einem Erythrozytenkonzentrat bei Blutungsanämie transfundiert werden. Dann kommt es zu einem vorzeitigen Blasensprung in der 26 + 3 SSW. Daraufhin erfolgt eine kalkulierte intravenöse antibiotische Therapie und eine Wehenhemmungstherapie. Acht Tage später setzen Wehen ein und nach insgesamt zwei Monaten stationärer Behandlung erfolgt eine Sectio-Entbindung in der 27 + 4 SSW.
Erstversorgung
Ein weibliches Frühgeborenes, zyanotisch ohne Eigenatmung und muskelhypoton wird geboren. Auf der Erstversorgungseinheit erfolgt: Absaugen, Legen eines Nasopharyngealtubus und darüber nicht-invasive Beatmung ohne Besserung der Oxygenierung bei kaum auskultierbarem Atemgeräusch. Tubuslage und Kopfposition werden optimiert sowie Beatmungsdruck und -frequenz und sukzessive die Sauerstoffzufuhr erhöht – ohne Verbesserung. Daraufhin erfolgt die nasotracheale Intubation in der vierten Lebensminute und tracheale Gabe von Surfactant mit kurzzeitiger Besserung unter konventioneller Beatmung. Dann erneut ansteigender Sauerstoffbedarf. Auch die zweite Gabe Surfactant führt nicht zum Abfall des Sauerstoffbedarfs (maximal 90 Prozent; FiO2 0,9). Ein peripherer Venenzugang und ein Nabelvenenkatheter werden angelegt.
Folgende Befunde wurden erhoben: Apgar 3/6/7 nach 1/5/10 min; Nabelschnurarterien-pH (NS-pH) 7,36, Base excess (BE) -4,7; Gewicht 900 g (34. Perzentile), Länge 37,5 cm (66. Perzentile), Kopfumfang 25 cm (34. Perzentile). Das Frühgeborene wurde auf die Neugeborenenintensivpflegestation (NIPS) verlegt.
Der Apgar-Score ist wesentlich für die Zustandsbeurteilung des Neugeborenen und wird ebenso wie der arterielle Nabelschnur-pH postnatal dokumentiert. Der Apgar-Score ist ein Punkteschema von Virginia Apgar, 1952 eingeführt und wird mit 1, 5 und 10 Lebensminuten erhoben. Beurteilt werden die fünf Items: Atmung, Puls, Hautkolorit (Zyanose), Muskeltonus, Reaktion (auf Absaugen) mit jeweils 0 bis 2 Punkten, sodass ein minimaler Wert von 0 Punkten und ein maximaler Wert von 10 Punkten resultiert. Niedrige Apgar-Werte mit 5 Minuten (gegebenenfalls schon unter neonatologischer Behandlung) sind prädiktiv für Mortalität und Morbidität. Problematisch ist, dass die Items nicht unabhängige Parameter sind, da zum Beispiel ein tief bradykardes Kind auch keinen guten Muskeltonus oder Hautkolorit haben kann. Bei extremen Frühgeborenen liegen die Apgar-Werte naturgemäß niedriger als bei reifen gesunden Neugeborenen.
Stationärer Verlauf
Bei anhaltend schwerer Oxygenierungsstörung und zunehmender Hyperkapnie erfolgt die Umstellung von konventioneller Beatmung auf Hochfrequenzoszillationsbeatmung (HFO; Oszillationsfrequenz 600/min). Darunter bessere Ventilation mit Abfall des pCO2, rückläufiger Sauerstoffbedarf auf FiO2 0,3. Bei der Hochfrequenzoszillationsbeatmung werden mit sehr hoher Frequenz (typischerweise 10 Hz = 600/min) Atemzugvolumina erzeugt, die keine alveoläre Ventilation im üblichen Sinne ermöglichen. Eine exakte physikalische Erklärung, wie bei dieser Beatmungsform das CO2 pulmonal eliminiert wird, gibt es nicht. Vorteil sind reduzierte Scherkräfte für die Lunge bei effektiver CO2-Auswaschung und ein stabiler Beatmungsmitteldruck zur Verbesserung der Oxygenierung.
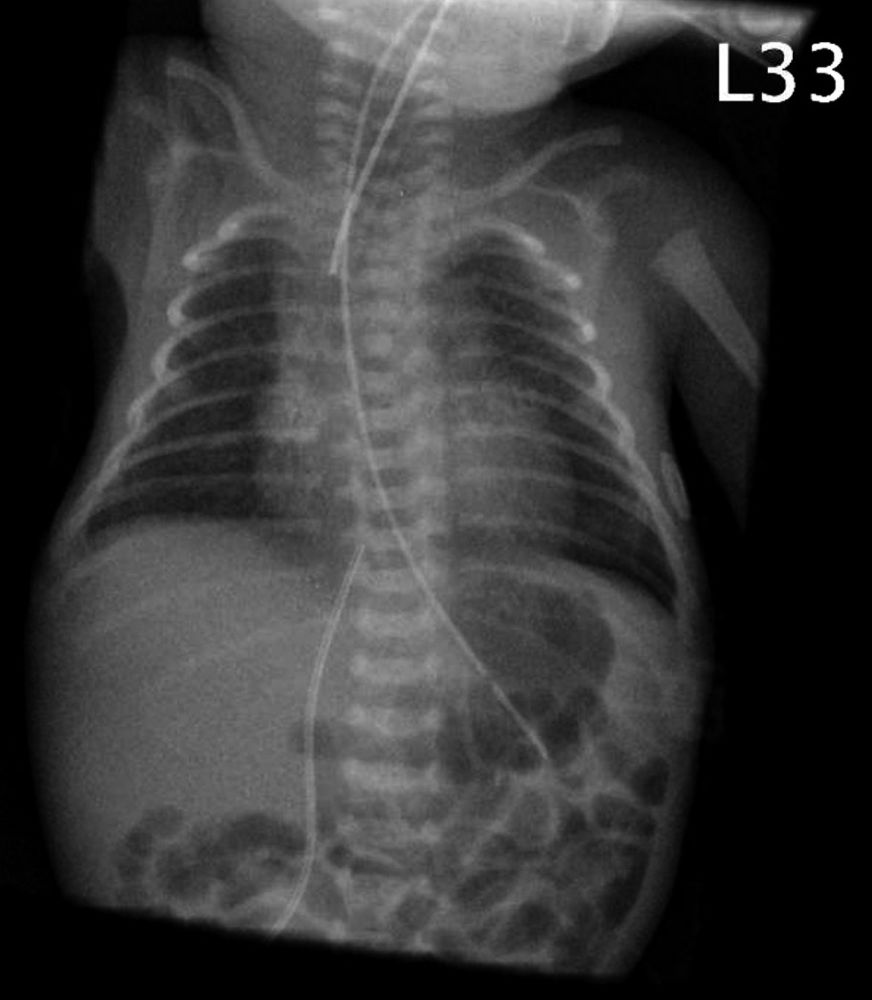
Laura 2. Lebenstag; Abbildung 1: Röntgen-Thorax: pulmonal Residuen des Atemnotsyndroms, einliegender Nabelvenenkatheter, Trachealtubus, Magensonde.
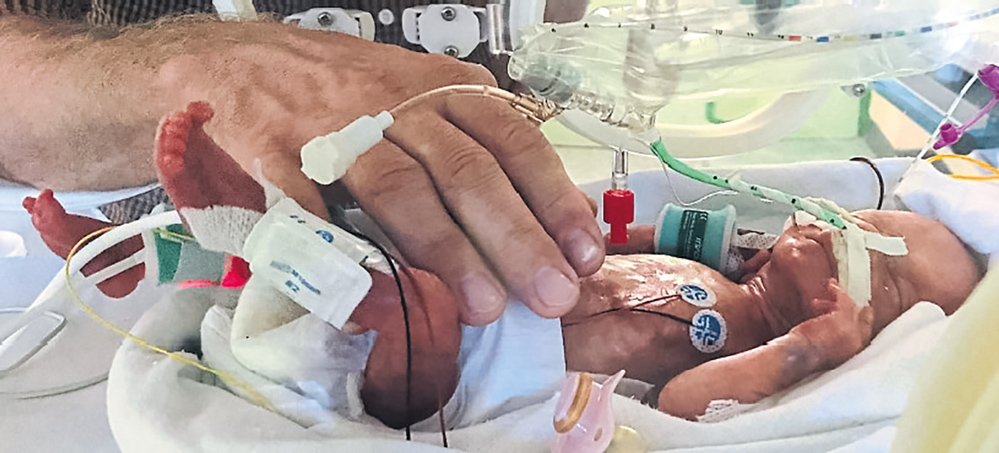
Laura 3. Abbildung 2: Lebenstag im Inkubator, Gewicht 900 g; intubiert beatmet mit Hand des Vaters.
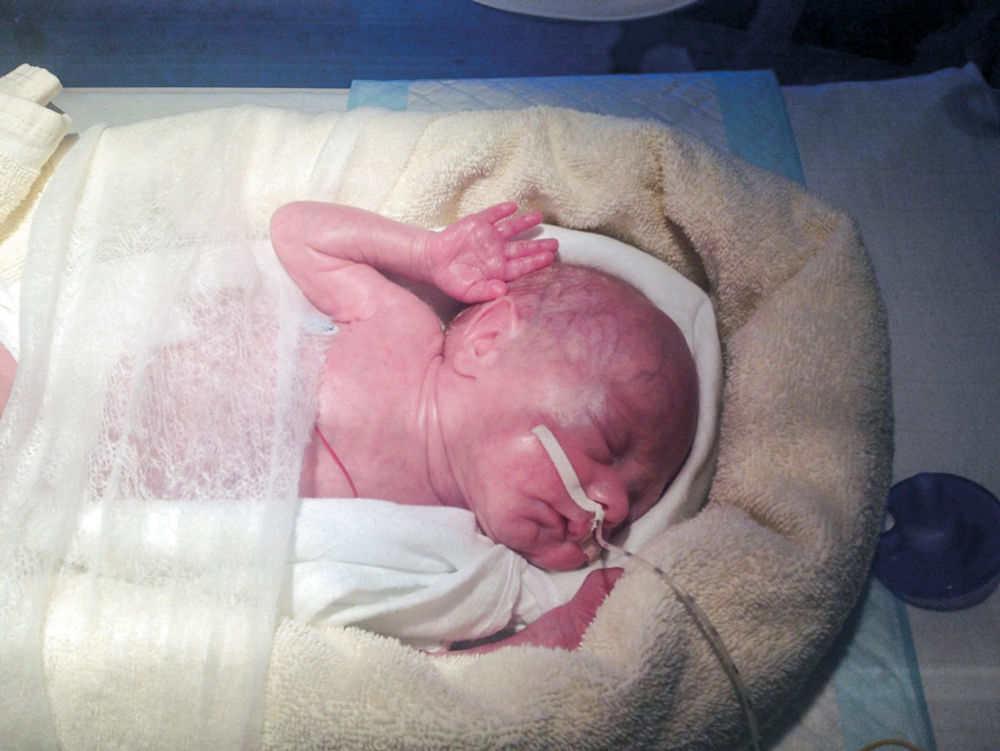
Laura Abbildung 3: 29 Tage alt, Gewicht 1.300 g.

Abbildung 4: Laura knapp sechs Monate chronologisches Alter.
Ab dem zweiten Lebenstag kann Laura rasch von der Beatmung entwöhnt werden mit konventioneller Beatmung und Extubation am dritten Lebenstag ohne zusätzlichen Sauerstoffbedarf. Die Beatmung wird als nicht-invasive Beatmung über binasale Prongs (kurze Silikonkanülen dicht in beiden Naseneingängen) fortgesetzt. Ab dem dritten Lebenstag kann Laura täglich mehrere Stunden auf der Brust der Eltern gelagert werden (Känguru-Pflege = Wärme/Geborgenheit durch Hautkontakt zur Mutter). Nach drei Wochen wird die Patientin auf High-Flow-Nasal-Canula (HFNC) als Atemhilfe umgestellt, nach weiteren drei Wochen stabile Spontanatmung ohne Atemhilfe unter atemanaleptischer Therapie mit Coffein für insgesamt sieben Wochen. Initial erfolgte bei Verdacht auf Amnioninfektions-syndrom eine antibiotische Therapie, gefolgt von nochmals fünf Tagen Antibiotika bei Nabelinfektion im Verlauf. Bei Frühgeborenenanämie musste einmalig eine Eryhtrozytenkonzentrattransfusion erfolgen. Der Nahrungsaufbau über eine orogastrale Sonde ist problemlos. Für zwei Wochen erhält Laura eine (teil)-parenterale Ernährung über einen zentralvenös positionierten Einschwemmkatheter zusätzlich zur Muttermilchernährung über die Magensonde und kann mit sieben Wochen komplett ihre Mahlzeiten trinken. Weitere frühgeborenentypische Komplikationen (Tabelle 1) traten nicht auf: insbesondere klinisch und radiologisch keine Zeichen einer bronchopulmonalen Dysplasie (BPD), keine Auffälligkeiten in der Schädelsonografie, lediglich eine geringgradig ausgeprägte Frühgeborenenretinopathie mit ausgereifter Netzhaut bis zur Entlassung. Bei Hyperbilirubinämie ist eine intermittierende Phototherapie notwendig. Die Impfung wird noch im stationären Setting (Sechsfach-Impfung sowie Pneumokokken-Impfung ab dem 56. Lebenstag) durchgeführt und die monatliche passive Immunisierung gegen das Respiratorische Syncytial-Virus (RSV) im ersten Winter empfohlen.
Die Entlassung erfolgt zwei Monate nach Geburt, vier Wochen vor dem errechneten Geburtstermin, mit einem Gewicht von 2.100 g. Häusliche Unterstützung erhält die Familie durch Pflegekräfte der eigenen Neonatologie im Rahmen des Harl.e.kin – Frühchen-Nachsorge-Programms.
Diskussion
Durch die Placenta praevia-Blutung war die Mutter gefährdet, und es drohte ein Spätabort. Das geburtshilfliche Management ermöglichte nicht nur das Erreichen der Lebensfähigkeit, sondern das Halten der Schwangerschaft bis in die Woche 27 und konsekutiv bis auf das initiale schwere Lungenversagen einen komplikationslosen Verlauf. Die Erfolge der Neonatologie der letzten Jahrzehnte sind die Erfolge der gemeinsamen perinatalogischen Betreuung mit den geburtshilflichen Bausteinen [1] einer
• risikoadaptierten ambulanten Betreuung
• Zentralisierung in Perinatalzentren
• konsequenter Induktion der Lungenreifungsbeschleunigung
• Vermeidung prä- und perinataler
Schädigung des Feten
• schonende Entbindung.
Mit diesen Voraussetzungen ist ein Verlauf wie bei Laura durch eine neonatologische Intensivtherapie mit den wesentlichen Bausteinen [2] optimale(s)
• Erstversorgung,
• Beatmung-, Surfactant- und Sauerstoff- Therapie,
• Steuerung der Hämodynamik,
• Flüssigkeits-, Wärme und Ernährungsmanagement und
• Infektionskontrolle
erreichbar. Für die Bindung und die weitere Entwicklung der Kinder in ihren Familien hat die frühe intensive Einbindung der Eltern mit täglicher Känguru-Versorgung, Muttermilchernährung und Stillen und ein Nachsorgekonzept eine große Bedeutung.
Zur Verbesserung der Surfactantbildung und Freisetzung in der fetalen Lunge ist die beschriebene Steroidtherapie der Mutter elementar. Die intratracheale Surfactantgabe zur Behandlung des Atemnotsyndroms des Frühgeborenen, die in frühen Wochen noch kein Surfactant bilden, ist darüber hinaus ein wesentlicher Faktor für das Überleben. Zugleich ist heute die primäre Form der Atemhilfe auch bei extrem unreifen Frühgeborenen die nicht-invasive Beatmung zur Vermeidung der Komplikationen der Intubation und Beatmung (wie zum Beispiel Barotrauma der Lunge, pulmonale Infektionen) [3]. Die Surfactantgabe erfolgt heute daher zumeist als LISA-Manöver (Less Invasive Surfactant Application): Durch direkte Laryngoskopie und Surfactantgabe über einen unter Sicht tracheal eingeführten dünnen Katheter unter Beibehaltung der Atemhilfe, im Gegensatz zum geschilderten Fall. Es liegt ausreichend Evidenz vor, dass hiermit das Risiko für Komplikationen wie zum Beispiel intraventrikuläre Hämorrhagie signifikant reduziert wird [2, 4, 5].
Häufigkeit/Grenze der Lebensfähigkeit/Prognose
Die Häufigkeit von Frühgeburten (Geburt vor der 37 + 0 SSW) ist in den vergangenen Jahren bei ca. neun Prozent in Deutschland stabil. Vor der 32. Woche kommen ca. 1,5 Prozent aller Kinder zur Welt [6, 7], jährlich in Deutschland also mehr als 10.000 Kinder. Bei stationär aufgenommenen Schwangeren mit Frühgeburtsbestrebungen oder anderen signifikanten schwangerschaftsassoziierten Erkrankungen variiert die Häufigkeit an daraus resultierenden Frühgeburten in deutschen Geburtshilfen [8] wie auch in Europa teilweise erheblich. Es bestehen intensive Bemühungen im Sinne einer primären, sekundären oder tertiären Prävention, die Rate an Frühgeburtlichkeit zu senken [9, 10].
Das Vorgehen an der Grenze der Lebensfähigkeit ist in der AWMF-Leitlinie (Registernummer 024-019) festgelegt. Da es keine definitive Grenze der Lebensfähigkeit gibt, ist in dieser Leitlinie im Bereich von 22 bis 23 Wochen von einer „Grauzone“ die Rede [11].
Ab 24 + 0 Schwangerschaftswochen und einem Geburtsgewicht > 400 g gilt (Auszug): „Die Überlebenschancen behandelter Frühgeborener sind in diesem Fall so hoch, dass im Regelfall eine lebenserhaltende Therapie anzustreben ist“.
Bei Frühgeborenen < 28 SSW ist die Überlebenswahrscheinlichkeit in Deutschland im Vergleich von 2011 bis 2013 und 2014 bis 2016 nochmals gestiegen von 85,8 auf 87,4 Prozent [12]. Trotz Versorgung immer kleinerer Frühgeborener ist die Komplikationsrate in den vergangenen Jahren stabil, nimmt aber in Bezug auf die langfristige Gesundheit der Kinder beeinflussenden Faktoren auch nicht ab. Bei Frühgeborenen mit einem Geburtsgewicht < 1.500 g liegt beispielhaft die Rate an intraventrikulärer Hämorrhagie (inklusive leichter Schweregrade) bei ca. 16 Prozent, die Rate an operationsbedürftiger nekrotisierender Enterokolitis oder therapiebedürftiger Retinopathie jeweils um zwei Prozent. Eine Intelligenzminderung (Wechsler Prescool and Primary Scale of Intelligence < 85) oder eine Zerebralparese findet sich bei 19 Prozent aller Kinder mit starker Abhängigkeit der Häufigkeit von Anzahl und Ausprägung der Komplikationen (zum Beispiel: geringgradige Hirnblutung 21 Prozent, höchster Grad der Hirnblutung 61 Prozent, Darmperforation 52 Prozent) im genannten Gewichtsbereich [13].
Die Reduktion der Morbidität auf der Basis eines besseren Verständnisses der Pathophysiologie der Komplikationen ist daher wichtiges Ziel der Neonatologie zur Verbesserung der Entwicklungsprognose unserer Patienten.
Perinatalzentren
Der gemeinsame Bundesausschuss (G-BA) hat Stufen der perinatologischen Versorgung definiert:
• Versorgungsstufe I: Perinatalzentrum Level 1
• Versorgungsstufe II: Perinatalzentrum Level 2
• Versorgungsstufe III: Perinataler Schwerpunkt
• Versorgungsstufe IV: Geburtsklinik
Die Versorgung von Schwangeren mit Frühgeburtsbestrebungen in frühen Wochen und entsprechenden Frühgeborenen wie im geschilderten Fall, darf nur in Perinatalzentren der höchsten Versorgungstufe erfolgen. Die hohe Spezialisierung der Berufsgruppen und die enge Kooperation von Geburtshilfe und Neonatologie sichert die optimale Versorgung in den Perinatalzentren, sie unterliegen hierbei strengen – jährlich überprüften – ressourcenintensiven Vorgaben der entsprechenden Richtlinie (QFR-RL) des G-BA, unter anderem in Bezug auf das Vorhalten von qualifiziertem Personal sowie der Verfügbarkeit weiterer Fachdisziplinen wie Kinderkardiologie, Kinderchirurgie, Neuropädiatrie, Hygiene und Humangenetik und einer seit Jahrzehnten etablierten Qualitätssicherung.
Fall 2: Persistierende pulmonale Hypertonie des Neugeborenen (PPHN)
Anamnese
Eine 38-jährige 2. Gravida, 1. Para (Zustand nach Spontanpartus vor drei Jahren) entbindet nach unauffälligem Schwangerschaftsverlauf – Blasensprung zwei Stunden vor Geburt – mit 40 + 1 SSW einen 4.000 g schweren Jungen (79.Perzentile), Länge 53 cm (57. Perzentile), Kopfumfang 36,5 cm (75. Perzentile), NS-pH 7,22, BE -4,2. Die Erstversorgung erfolgte durch die Hebammen. Bei verzögerter postpartaler Anpassung mit (APGAR 6/7/8 nach 1/5/10 min), anhaltender Zyanose und Tachydyspnoe wird der ärztliche Dienst der Neonatologie in der siebten Lebensminute hinzugezogen. Zu diesem Zeitpunkt zeigte das Neugeborene bei normaler Herzfrequenz, lebhafter Spontanmotorik und suffizientem Atemantrieb eine deutliche Zyanose, die sich auch unter Maskenbeatmung und zusätzlicher Sauerstoffgabe nicht bessert. Die venöse Blutgasanalyse bei Infusionsanlage ergibt eine kombiniert respiratorisch-metabolische Azidose (pH 7,06; pCO2 74 mmHg; pO2 37 mmHg; HCO3- 20,6 mmol/l; BE -11,9; Laktat 6,8 mmol/l). Nach intravenöser kristalliner Volumengabe und Fortführung der Maskenbeatmung wird das Neugeborene nach Analgosedierung naso-tracheal intubiert und beatmet. Noch in der Kreißsaal- Erstversorgung erfolgt bei tiefer Zyanose eine Röntgen-Thoraxuntersuchung, insbesondere zum Ausschluss eines Enterothorax oder Pneumothorax. Die Röntgenaufnahme zeigt zu diesem Zeitpunkt eine vermehrte Transparenz beider Lungen bei korrekter Tubuslage (Abbildung 5). Unter konventioneller Beatmung mit FiO2 1,0 ist die transkutan pulsoximetrisch gemessene Sauerstoffsättigung (tcSaO2) nur 80 Prozent, die Kreislaufverhältnisse (HF 140/min; RR 55/40/35 mmHg) sind stabil, in diesem Zustand wird der Junge auf die NIPS verlegt.
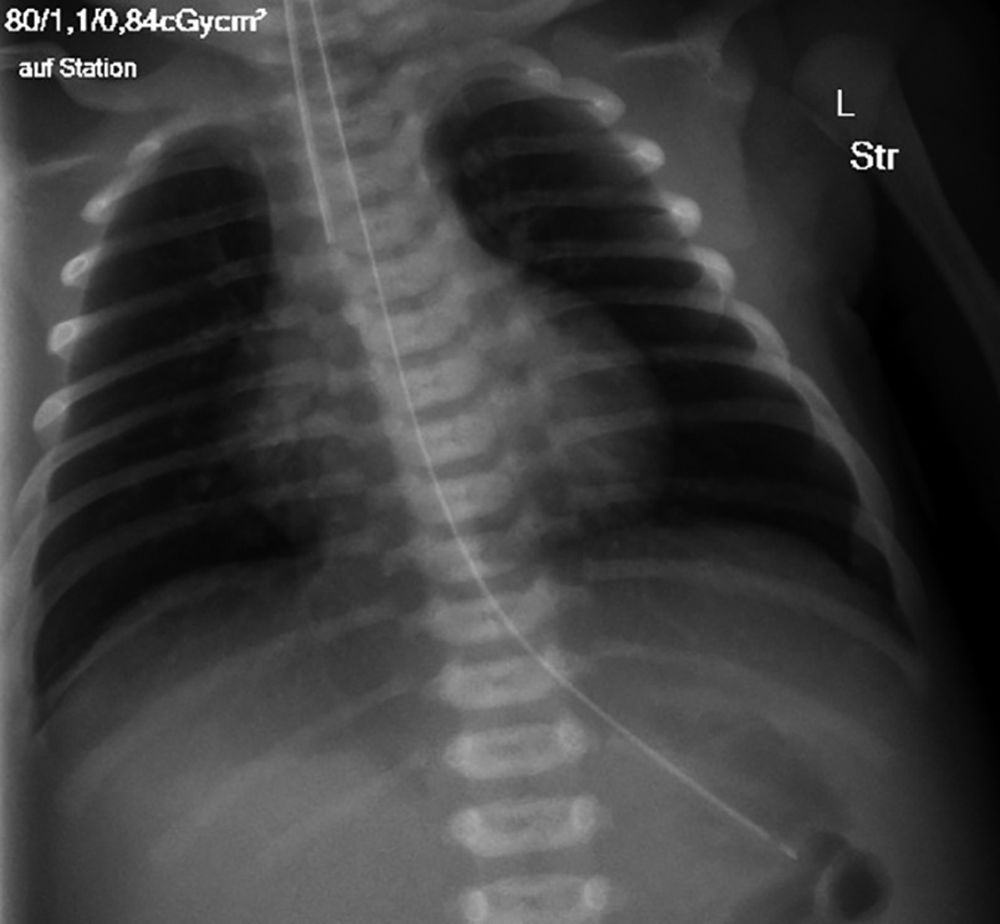
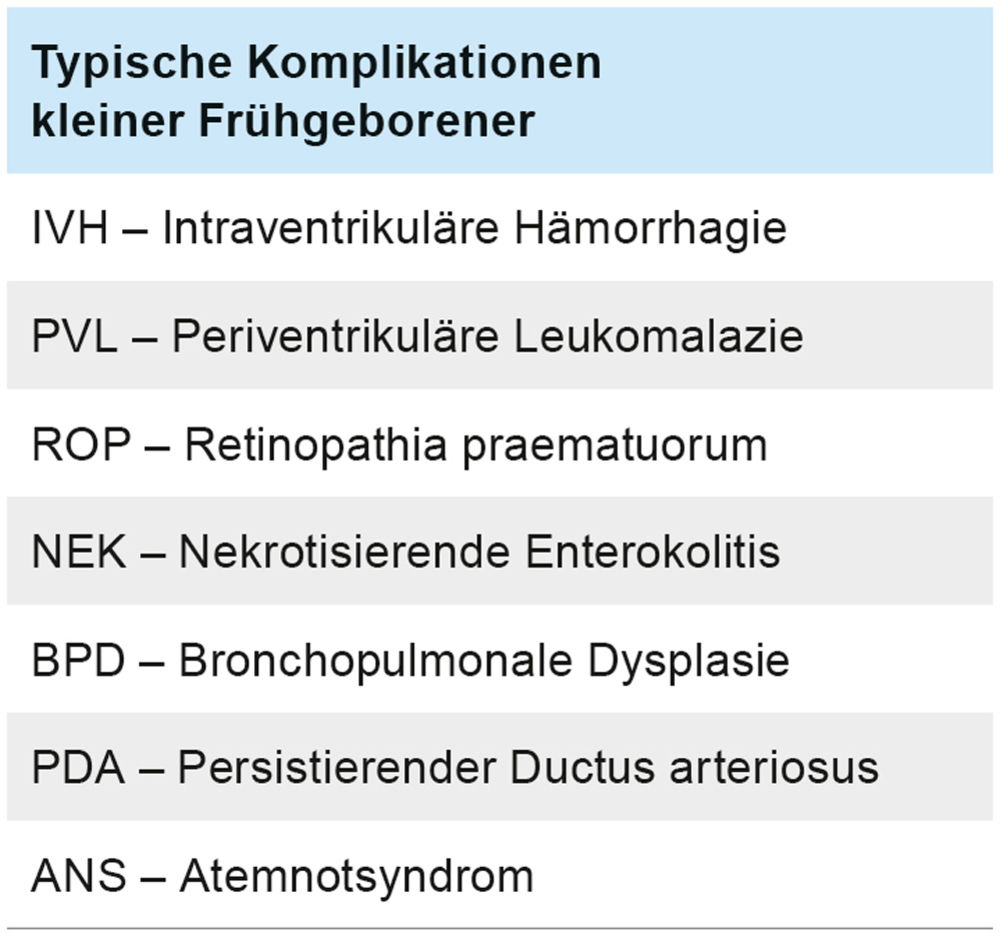
Abbildung 5: Persistierende pulmonale Hypertonie des Neugeborenen (PPHN), Röntgen-Thorax: Transparenzminderung der Lungen bei reduzierter Lungenperfusion.
Stationärer Verlauf
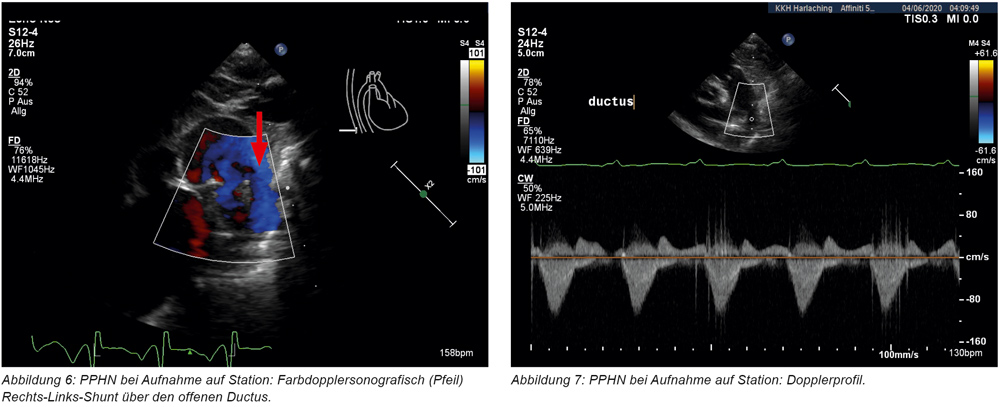
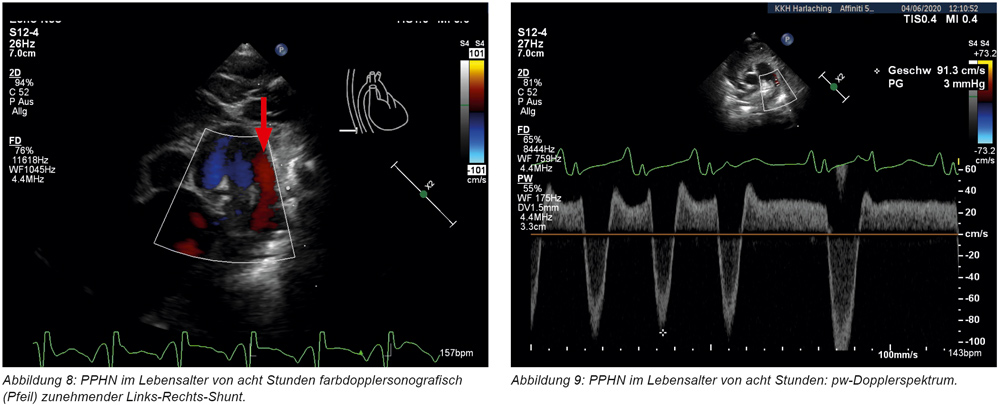
Unmittelbar nach Aufnahme erfolgte eine Echokardiografie, die den Befund eines strukturell unauffälligen Herzens (Ausschluss eines angeborenen Herzfehlers) mit allerdings dilatiertem rechten und schmalem linken Ventrikel bei noch weit offenen fetalen Blutwegen ergibt (weit offener Ductus arteriosus Botalli und gespreiztes Foramen ovale). Sowohl auf Vorhofebene als auch auf Ductusebene besteht zu diesem Zeitpunkt (zweite Lebensstunde) ein unrestriktiver Rechts-Links-Shunt (Abbildungen 6 und 7) bei noch erhöhtem pulmonalvaskulärem Widerstand und suprasystemischem Pulmonalarteriendruck. Die tcSaO2 an der rechten Hand (präductal) liegt mit ca. 90 bis 92 Prozent um 10 bis 12 Prozent über den an den unteren Extremitäten gemessenen Werten (78 bis 80 Prozent). Zur Senkung des pulmonalvaskulären Widerstandes wird daraufhin dem Atemgas Stickstoffmonoxid (NO) beigemischt (40 parts per million) und die konventionelle Beatmung mit einem FiO2 von 1,0 fortgesetzt. Bei erschwerter CO2-Elimination und anhaltender Azidose wird die Beatmung auf Hochfrequenzoszillation umgestellt. Es erfolgt die Anlage eines arteriellen Überwachungskatheters (A. ulnaris rechts) sowie die Anlage eines zentralvenösen Katheters (V. jug. Int.; 4 F, 3 Lumina). Aufgrund der eingeschränkten Funktion des rechten Ventrikels erfolgt eine inotrope Unterstützung mit gleichzeitig nachlastsenkender Wirkung mit dem PDE-3-Hemmer Milrinon-Dauertropfinfusion (DTI) als Inodilatator. Zusätzlich wird der Patient analgosediert (Morphin und Midazolam-DTI) und relaxiert (Mivacurium-DTI). Unter Fortführung dieser Maßnahmen bestehen insbesondere präductal stabile Sättigungen (tcSaO2) von > 90 Prozent, und die postductal gemessenen Werte nähern sich innerhalb von acht Stunden den präductal gemessenen Werten an (Abbildungen 8 und 9).
Das Ausschleichen des NO ist sehr zügig möglich mit Extubation und Umstellung auf CPAP (continuous positive airway pressure) am vierten Lebenstag, ab dem fünften Lebenstag spontan-atmend. Der junge Patient kann mit zwölf Lebenstagen entlassen werden.
Diskussion
Das reife, an sich gesunde Neugeborene, kann postpartal rasch in ein vital bedrohliches kardiorespiratorisches Versagen geraten. Führend in der Differenzialdiagnose sind hierbei die neonatale Sepsis bei Amnioninfektionssyndrom und die schon durch milde Hypoxämie postnatal getriggerte persistierende pulmonale Hypertonie des Neugeborenen (PPHN) als schwerste Form der Adaptationsstörung der Transition von prä- zu postnatalem Leben [14]. Die Persistenz der fetalen Kurzschlussverbindungen führt zu erheblich reduzierter Lungenperfusion bei Gefäßwiderstandserhöhung in der Lunge. Entsprechend wurde das Krankheitsbild früher als persistierende fetale Circulation (PFC-Syndrom) bezeichnet. Es tritt in dieser Ausprägung ohne Risikofaktoren (wie zum Beispiel Lungenfehlbildung, langer vorzeitiger Blasensprung) bei ca. 2/1.000 reifen Neugeborenen (ca. 5/1.000 bei late preterm infants) auf. Wesentliche Differenzialdiagnosen eines tief zyanotischen Neugeborenen sind:
Angeboren
• Lungenfehlbildung
• Vitium cordis
• Zwerchfellhernie
Unter Geburt erworben
• Pneumothorax
• Mekoniumaspiration
• Neugeborenensepsis
• PPHN
Therapeutisch wird die PPHN mit Sauerstoff als potentem Vasodilatator und Stickstoffmonoxid (NO in der Beatmungsluft) zur Senkung des pulmonalarteriellen Widerstandes therapiert. Katecholamine sichern einen ausreichenden Druck zur Perfusion der Lunge. Medikamentös kann der auch in diesem Fall eingesetzte Phosphodi-esterasehemmer die Kontraktilität des rechten Ventrikels unterstützen und die Lungenperfusion verbessern. Zur Widerstandssenkung der Lunge können Sildenafil oder Prostaglandinanaloga (inhalativ) verwendet werden. Mit der Hochfrequenzoszillationsbeatmung ist eine effektive Ventilation im schweren Lungenversagen möglich. Sollte keine ausreichende Oxygenierung zu erzielen sein, ist die extrakorporale Membranoxygenierung (ECMO) auch im Neonatalalter eine etablierte Therapie. Mit der genannten Therapie (ohne Grunderkrankung) gelingt heutzutage die Überwindung der pulmonal-hypertensiven Phase meist – wie im geschilderten Fall – innerhalb weniger Tage. Mit weiterem physiologischen Abfall des Lungengefäßwiderstandes werden die Kinder gesund.
Fall 3: „late preterm infants“
Anamnese
Eine 40-jährige Patientin 1. Gravida mit seit zehn Jahren bestehendem Kinderwunsch und wiederholten Fertilitätsbehandlungen ist jetzt mit Zwillingen nach ICSI (intracytoplasmatische Spermieninjektion) schwanger. Zunächst war eine stationäre Behandlung bei vaginalen Blutungen und Verdacht auf vorzeitige Wehen in der 24. SSW notwendig, ab 30. SSW zeigte sich dann eine zunehmende arterielle Hypertonie mit im Verlauf auch medikamentös nicht mehr suffizienter antihypertensiver dreifach Therapie und Symptomatik der Mutter mit Kopfschmerzen und Schwindel. Daher wurde die Sectioindikation in der 33 + 3 SSW aus mütterlicher Indikation bei nicht mehr adäquat einstellbarer Präeklampsie und fetaler Beckenendlage des führenden Zwillings gestellt.
Erstversorgung
Das erstgeborene Mädchen mit einem Gewicht von 2.160 g (59. Perzentile), NS-pH 7,33; APGAR 6/8/9 mit 1/5/10 min kommt aus Beckenendlage leise schreiend und aktiv auf die Erstversorgungseinheit, gute Adaptation unter initialer Atemunterstützung mit CPAP über nasopharyngealen Tubus. Nach zehn Lebensminuten zeigt sie leises Stöhnen und milde Einziehungen ohne Sauerstoffbedarf. Sie erhält eine Glukose-Infusion über einen peripher-venösen Zugang, anschließend Transport mit CPAP-Atemhilfe auf die NIPS.
Verlauf
Lunge: Weiterhin besteht kein zusätzlicher Sauer-stoffbedarf, bei Tachypnoe und subcostalen Einziehungen erfolgt mit High-Flow-Nasal-Canula (HFNC) die Atemunterstützung bei Raumluft und einem Flow von 8 l/min mit ausgeglichener Blutgasanalyse. Bei „minimal handling“ zur Vermeidung zusätzlicher Atemarbeit stabilisiert das Mädchen rasch respiratorisch und sie lässt sich von der Atemhilfe innerhalb von 24 Stunden entwöhnen. Danach ungestörte Spontanatmung. Ein rascher Nahrungsaufbau im weiteren Verlauf über eine nasogastrale Sonde ist möglich. Erste Trinkversuche gelingen mit fünf Tagen und eine komplette Trinkmenge wird mit zweieinhalb Wochen erreicht. Das Bilirubin steigt auf therapiebedürftige Werte an, zur Vermeidung einer Bilirubin-Enzephalopathie ist eine intermittierende Phototherapie für insgesamt 48 Stunden notwendig. Die Routinediagnostik: Schädelsonografie, Stoffwechseltest, Hörtest, Hüftsonografie sind unauffällig. Eine Entlassung ist nach knapp vier Wochen mit 37 + 1 SSW ohne weitere Auffälligkeiten möglich.
Erstversorgung
Der zweitgeborene Junge mit einem Gewicht von 2.240 g (58. Perzentile), NS-pH 7,24, APGAR 4/8/8 nach 1/5/10 min ist muskelhypoton, zeigt keine Eigenatmung und ist daher zyanotisch (Herzfrequenz 80/min, nicht ansteigend). Nach Stimulation erfolgt rasch die Anlage eines nasopharyngealen Tubus und die nicht-invasive Beatmung mit Raumluft, dadurch rasches Einsetzen von Eigenatmung und Muskeltonus sowie Anstieg der Herzfrequenz stabil > 120/min Langsam wird der Patient rosig, hat jedoch mit acht Lebensminuten subkostale Einziehungen und stöhnt. Die tcSaO2 liegt um 85 Prozent, trotz Erhöhung des positiven endexspiratorischen Drucks (PEEP). Jetzt wird ein venöser Zugang zur Glukose-Infusion angelegt (Blutgasanalyse pH 7,31; pCO2 58 mmHg; HCO3- 22 mmol/l; BE -2,5 mmol/l). Bei weiterer Tachypnoe, Stöhnen und Sauerstoffbedarf, mit 15 Lebensminuten und einem FiO2 0,5 zum Erreichen einer tcSO2 von 90 Prozent entscheiden wir uns zur Surfactantgabe mittels LISA-Manöver. Im Anschluss fällt der Sauerstoffbedarf auf FiO2 0,25 zum Erreichen eines tcSO2 von 92 Prozent. Die nicht-invasive Beatmung über binasale Prongs wird etabliert und der Patient beatmet auf die NIPS transportiert.
Verlauf
Innerhalb der nächsten 24 Stunden fällt der Sauerstoffbedarf auf anhaltend Raumluft ab bei weiter intermittierend stöhnendem Kind. Bei Reduktion der Beatmungsfrequenz oder des Beatmungsdruckes setzt unmittelbar eine Symptomatik mit Tachypnoe, Stöhnen und Abfall des tcSO2 sowie Apnoen ein. Im Röntgen-Thorax sind Residuen des Atemnotsyndroms sichtbar, differenzialdiagnostisch insuffiziente Clearance des Lungenwassers im Sinne einer „Nassen Lunge“ (Abbildung 10). Daher ist ein Weaning von der Beatmung über vier Tage bis zur stabilen Spontanatmung notwendig. Der Patient zeigt wiederholtes Erbrechen bei der Ernährung über orogastrale Sonde und es ist massiv Luft gastral abzusaugen durch die nicht-invasive Atemhilfe, daher war ab Tag zwei eine teilparenterale Ernährung über einen peripheren Einschwemmkatheter für insgesamt neun Tage notwendig. Nach Ende der Atemhilfe ist ein langsamer Nahrungsaufbau möglich und es treten keine weiteren Komplikationen auf. Die Entlassung mit der Zwillingsschwester erfolgt nach knapp vier Wochen stationärer Therapie.
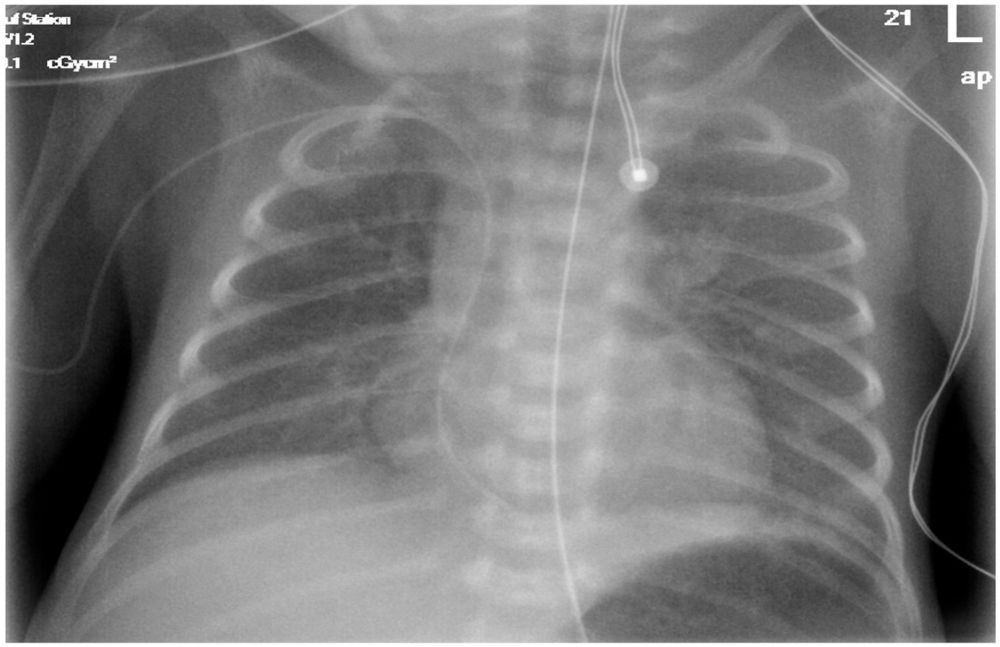
Abbildung 10: „late preterm infant“ – Röntgen-Thorax: Residuen des Atemnotsyndroms DD; nicht ausreichende Clearance des Lungenwassers. Anlage eines peripher eingelegten zentralvenösen Einschwemmkatheters (1 French). Unmittelbarer Rückzug des Katheters auf korrekte Position nach dem Röntgenbild.
Diskussion
Ca. 83 Prozent der Frühgeborenen sind moderately preterm (32 + 0 bis 33 + 6 SSW und late preterm (34 + 0 bis 36 + 6 SSW). Diese große Gruppe von Patienten hat insgesamt eine geringe Mortalität und Häufigkeit an kritischen Komplikationen (im Vergleich zu extrem unreifen Frühgeborenen), im Vergleich zu reifen Neugeborenen sind diese jedoch deutlich erhöht, wie zum Beispiel ein ca. zehnfach erhöhter Anteil an nekrotisierender Enterokolitis oder intraventrikulärer Hämorrhagie [15].
Durch die akute respiratorische Morbidität benötigen ca. 20 Prozent dieser Frühgeborenen eine intensivmedizinische Betreuung mit entsprechendem Ressourcenbedarf [16]. Auch die deutlich erhöhte Rate (im Vergleich zu reifen Neugeborenen) an Infektionen, Ernährungsstörungen, Neugeborenengelbsucht (20 bis 30 Prozent der Patienten) oder Hypoglykämien führt bei diesen Neugeborenen zur stationären Betreuung, selbst bei einem Geburtsgewicht über 2.500 g. Bedeutend sind die Daten über die kognitive Entwicklung bei diesen Kindern, da die fetale Hirnentwicklung erst mit Erreichen der 40. Woche abgeschlossen ist und gerade in den letzten sechs Wochen der Schwangerschaft eine erhebliche Zunahme der grauen Substanz im Cortex cerebri erfolgt [15, 17]. Entsprechend findet sich bis ins Erwachsenenalter eine negative Assoziation von Gestationsalter und kognitiven Fähigkeiten bei allerdings vielen zusätzlichen nicht beeinflussbaren Faktoren. Ob die Unreife ursächlich ist oder die Situation, die zur Frühgeburtlichkeit führt, wie zum Beispiel Mehrlingsschwangerschaft, schwangerschaftsbedingte hypertensive Erkrankungen, mütterliches Alter, Frühgeburtsbestrebungen, bleibt unklar. Wichtige Aufgabe bei diesen Patienten ist die Vermeidung der genannten – nicht per se kritischen Krankheitsentitäten. Mehrlingsschwangerschaften haben durch die Möglichkeiten der Fertilitätsbehandlung in den letzten 30 Jahren deutlich zugenommen und führen in ca. 50 Prozent zur Frühgeburtlichkeit.
Die Klinik für Neonatologie der München Klinik fasst die Level 1 Neonatologien der pädiatrischen Standorte der München Klinik Harlaching und Schwabing seit 2017 unter eigener chefärztlicher Leitung zusammen.
Röntgenbilder: München Klinik Harlaching: Institut für Diagnostische und Interventionelle Radiologie, Neuroradiologie; Chefarzt Professor Dr. Gernot Schulte-Altedorneburg.
Fotos: Mit ausdrücklicher Genehmigung der Eltern.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Autoren
Dr. Olaf Neumann2
Dr. Katrina Kraft2
Professor Dr. Christoph Scholz2
1 Klinik für Neonatologie, München Klinik, Harlaching und Schwabing, Chefarzt Professor Dr. Marcus Krüger
2 Geburtshilfe der Perinatalzentren Schwabing und Harlaching
Teilen:
Das könnte Sie auch interessieren: