Nationale VersorgungsLeitlinie COPD. Wesentliche Inhalte und neuere Entwicklungen im Management der Erkrankung.
 Das Atmungssystem © Science Picture Co. – mauritius-images.com
Das Atmungssystem © Science Picture Co. – mauritius-images.com
Die Nationale VersorgungsLeitlinie COPD (NVL COPD) stammt aus dem Jahr 2005. Eine Novellierung ist geplant, die die Leitlinie der Fachgesellschaften der Pneumologie aus Deutschland und Österreich einbeziehen soll. Letztere Leitlinie soll in diesem Jahr fertiggestellt werden, sodass frühestens im Jahr 2016 eine Novellierung der NVL COPD zu erwarten ist. Der Autor ist an dieser Novellierung beteiligt.
Definition und Basisinformationen
Die chronisch obstruktive Lungenkrankheit (COPD) gilt als vermeidbare und behandelbare Erkrankung, die durch eine persistierende, meist progrediente und nicht vollständig reversible Atemwegsobstruktion gekennzeichnet ist. Sie ist assoziiert mit einer gesteigerten Entzündungsreaktion in den Atemwegen, die durch Exposition gegen inhalative Noxen, insbesondere dem Tabakkonsum, ausgelöst wird. Exazerbationen und Komorbiditäten tragen zur Beeinträchtigung des Patienten wesentlich bei. Der Begriff COPD umfasst die obstruktive Bronchitis und das Lungenemphysem, eine irreversible Erweiterung und Destruktion der Lufträume distal der terminalen Bronchiolen.
Epidemiologie
COPD gehört zu den häufigsten Erkrankungen weltweit und wird laut Schätzungen der Weltgesundheitsorganisation (WHO) bis 2020 die dritthäufigste Todesursache weltweit sein. In Deutschland verstarben im Jahr 2011 ca. 26.000 Patienten an COPD. Die Prävalenz einer ärztlich diagnostizierten COPD liegt mit 7,7 Prozent weit unterhalb der mittels Lungenfunktionsanalyse ermittelten Prävalenz (13,2 Prozent). Dies deutet darauf hin, dass bei vielen Personen die Erkrankung noch nicht diagnostiziert wurde.
Zielsetzung und Fragestellungen der NVL COPD
Die NVL COPD wurde mit dem Ziel erstellt, die Behandlung von Patienten mit COPD in Deutschland auf der Basis evidenzbasierter, angemessener, wirtschaftlicher und qualitätsgesicherter Verfahren der Diagnostik, Prävention und Behandlung unter Einschluss der Rehabilitation zu beschreiben und Empfehlungen für ein strukturiertes Management dieser chronischen Erkrankung zu geben. Bisher unzureichend umgesetzte effektive und kosteneffiziente Maßnahmen wie Raucherentwöhnung oder körperliches Training wurden ebenso dargestellt wie Möglichkeiten zur Optimierung des Managements der Erkrankung durch eine verbesserte Koordination der Versorgung zwischen Hausarzt, Facharzt und Krankenhausarzt im Sinne eines besseren Schnittstellenmanagements. Hierzu wurde ein fachübergreifender Konsens unter Berücksichtigung der Leitlinienempfehlungen aller an der Versorgung beteiligten Fachgesellschaften erzielt.
Die NVL COPD umfasst insbesondere:
- eine abgestufte Diagnostik,
- eine Stufentherapie bei stabiler COPD,
- Präventionsmaßnahmen,
- Maßnahmen bei Exazerbationen der COPD,
- Rehabilitationsmaßnahmen,
- Vorschläge zu einer koordinierten Versorgung von Menschen mit einem erhöhten COPD-Risiko oder manifester COPD.
Die NVL COPD gilt somit als Entscheidungshilfe für alle behandelnden Ärzte (zum Beispiel Allgemeinärzte, Internisten, Pneumologen), ohne das Urteil des behandelnden Arztes ersetzen zu können. Die Empfehlungen richten sich auch an die betroffenen Patienten und ihr persönliches Umfeld. Die wesentlichen Inhalte der NVL COPD werden im Folgenden dargestellt, wobei neue Aspekte im Management seit der Verabschiedung der NVL COPD im Jahre 2005/2006 zusätzlich erörtert werden.
Diagnostik und Differenzialdiagnose
Die Diagnose COPD ergibt sich aus der Anamnese unter Berücksichtigung von Symptomen und Risikofaktoren. Eine Lungenfunktionsdiagnostik zum Ausschluss/Nachweis einer Atemwegsobstruktion zur Differenzialdiagnostik und Festlegung der Schwere der Erkrankung ist erforderlich.
Symptome
Chronischer Husten ist häufig das Initialsymptom. Gelegentlich entwickelt sich auch eine Atemwegsobstruktion ohne Husten. Jede Form chronischen Auswurfs kann ein Indikator der chronischen Bronchitis sein. Häufig suchen Patienten aber erst wegen Atemnot, die zunächst unter Belastung, später auch in Ruhe verspürt wird, den Arzt auf. Bei Patienten mit Emphysem dominiert die Atemnot, Husten und Auswurf können fehlen.
Anamnese
Bei der Anamnese sollte gezielt gefragt werden nach:
- Verlauf und Intensität der Symptomatik,
- Exposition gegenüber Tabakrauch („Pack years“) und anderen Risikofaktoren (80 Prozent der COPD-Patienten sind Raucher oder Ex-Raucher),
- Inhalative Belastung am Arbeitsplatz,
- Angabe über Asthma, Allergien, Sinusitiden, Nasenpolypen, Atemwegsinfekte und Lungenkrankheiten in der Familie,
- Häufigkeit und Schwere von Exazerbationen, frühere Krankenhausaufenthalte wegen einer Lungenkrankheit,
- Komorbiditäten (insbesondere kardiovaskuläre Erkrankungen und Krankheiten des Bewegungsapparates),
- Gewichtsverlust.
Zur Erfassung der Symptome existieren verschiedene Fragebögen, von denen sich insbesondere der COPD-Assessment-Test (CAT) etabliert hat. Dieser Fragebogen (Abbildung 1) enthält acht Fragen nach typischen COPD-Symptomen (Husten, Auswurf, Engegefühl in der Brust, körperliche Belastbarkeit und andere); für jede dieser Fragen werden null bis fünf Punkte vergeben und insgesamt sind bis zu 40 Punkte erreichbar. Je höher die Punktzahl, desto ausgeprägter ist die Symptomatik des Patienten und seine Alltagsbeeinträchtigung. Der CAT ist international verfügbar und gut validiert und kommt auch in Deutschland bei Lungenärzten häufig zum Einsatz. Dieses Instrument lag zum Zeitpunkt der Erstellung der NVL COPD noch nicht vor, wird aber in der novellierten Leitlinie enthalten sein.
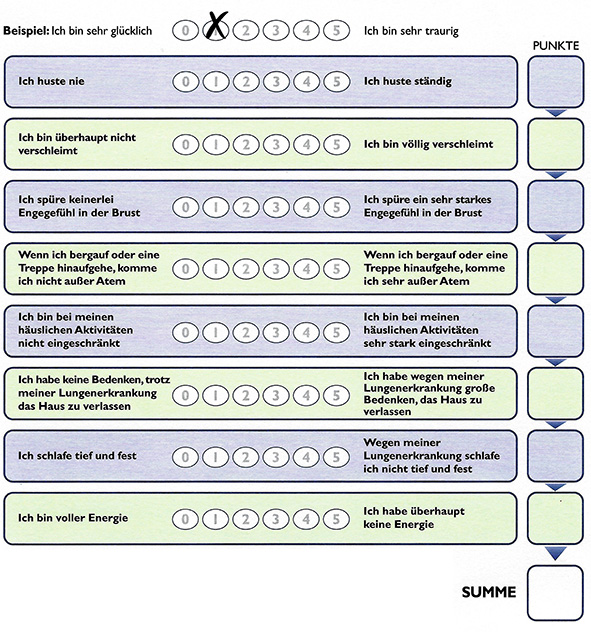
Abbildung 1: COPD-Assessment-Test (CAT).
Körperliche Untersuchung
Bei geringer Ausprägung der COPD kann das Ergebnis der körperlichen Untersuchung unauffällig sein. Im körperlichen Untersuchungsbefund sollten pathologische Geräusche wie Giemen, Pfeifen und Brummen, ein verlängertes Exspirium wie auch die Zeichen der Lungenüberblähung mit tiefstehendem, wenig atemverschieblichem Zwerchfell und hypersonorem Klopfschall dokumentiert werden. In fortgeschrittenen Stadien können Zyanose, periphere Ödeme und eine pulmonale Kachexie auftreten.
Lungenfunktionsanalyse
Bei Verdacht auf COPD sollte eine Atemwegsobstruktion diagnostisch gesichert werden. Für die Diagnosestellung und die Abschätzung der Schwere der Erkrankung ist die Spirometrie die am besten validierte lungenfunktionsanalytische Methode (mit den die Obstruktion charakterisierenden Kenngrößen Einsekundenkapazität (FEV1), Vitalkapazität (VC) und die Bestimmung des Verhältnisses FEV1/VC). Bei Vorliegen einer Obstruktion liegt der Wert von FEV1/VC unter 70 Prozent. Normale Werte der FEV1/VC schließen die Diagnose COPD aus, nicht jedoch eine chronische Bronchitis. Die Peak-Flow-Messung ist zur Diagnostik der COPD ungeeignet, Peak-Flow-Messwerte führen meist zu einer Unterschätzung des COPD-Schweregrades. Werte von mehr als 80 Prozent des Sollwertes schließen eine COPD nicht aus.
Reversibilitätstest mit Bronchodilatatoren
Die Messung der Reaktion der Atemwegsob-struktion auf Bronchodilatatoren (kurzwirksame Beta-2-Sympathomimetika, Anticholinergika) wurde in der NVL COPD zur Differenzialdiagnose zwischen Asthma und COPD vorgeschlagen. Das Testergebnis erlaubt jedoch keine Aussage über das langfristige Ansprechen der Obstruktion auf die verwandte Testsubstanz. Im Gegensatz zu den Aussagen in der NVL kann eine Zunahme der FEV1 15 bis 30 Minuten nach Inhalation eines kurzwirksamen Beta-2-Sympathomimetikums bzw. Anticholinergikums um mehr als 15 Prozent des Ausgangswertes und mehr als 200 ml nicht nur bei Patienten mit Asthma, sondern auch bei der COPD angetroffen werden.
Bildgebung
Ein Röntgenbild der Thoraxorgane ist bei Erstdiagnose in zwei Ebenen durchzuführen, damit größere Emphysemblasen identifiziert und bedeutsame weitere Erkrankungen wie das Lungenkarzinom oder eine Lungenstauung erkannt werden können. Es trägt zur Diagnose der COPD durch Ausschluss anderer Erkrankungen mit ähnlicher Symptomatik bei, reicht aber nicht zur Charakterisierung eines Lungenemphysems, die am besten mit dem hochauflösenden Computertomogramm des Thorax (HR-CT) erfolgt (Abbildung 2).
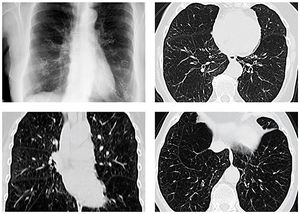
Abbildung 2: Röntgenaufnahme des Thorax in pa-Projektion und HR-CT einer 72-jährigen Patientin mit COPD und unterlappenbetontem Lungenemphysem. Zustand nach Implantation von Coils in beide Unterlappen.
Elektrokardiogramm (EKG)
Das EKG liefert Informationen über das Vorliegen einer koronaren Herzkrankheit und von Herzrhythmusstörungen, bei chronischem Cor pulmonale können typische Zeichen der Rechtsherzbelastung gefunden werden. Ihr Fehlen schließt aber eine solche nicht aus.
Echokardiografie
Die Echokardiografie erlaubt eine valide Abschätzung der pulmonalen Hypertonie und der Dimensionen des linken Ventrikels. Bei ausgeprägtem Emphysem ist die Aussagekraft dieser Untersuchungsmethode eingeschränkt.
Laboruntersuchungen
Bei Exazerbationen der COPD ist die Bestimmung der Blutkörperchen-Senkungsgeschwindigkeit (BSG), des Blutbildes und des C-reaktiven Proteins (CRP) in Übereinstimmung mit den Angaben der NVL COPD nach wie vor sinnvoll. Eine arterielle/kapilläre Blutgasanalyse (BGA) ist wichtig zur Festlegung der Gefährdung des Patienten. Bei Patienten unter 45 Jahren mit Zeichen eines Lungenemphysems sollte eine Screening-Untersuchung bezüglich eines Alpha-1-Proteinase-Inhibitormangels durchgeführt werden.
Die Pulsoxymetrie ersetzt die direkte Analyse der arteriellen/kapillären Blutgase aus dem hyperämisierten Kapillarblut des Ohrläppchens nicht, insbesondere nicht bei klinischer Verschlechterung des Patienten oder beim Auftreten von Komplikationen. Die Analyse der Blutgase wird außerdem zur Charakterisierung unklarer Atemnot unter Belastung eingesetzt.
Verlaufskontrolle
Die Verlaufskontrolle mit oder ohne Therapie erfolgt mittels standardisierter Anamnese, klinischem Befund, Lungenfunktionsdiagnostik und gegebenenfalls auch Bildgebung.
Diagnostisches Vorgehen bei Verdacht auf COPD
Zur initialen Diagnostik gehören Anamnese, körperliche Untersuchung, die Thoraxaufnahme in zwei Ebenen und die Spirometrie. Der Reversibilitätstest mit Bronchodilatatoren dient der Differenzierung zwischen Asthma und COPD, er ist nur im Falle einer vollständigen Reversibilität der Obstruktion in der Differenzialdiagnostik bezüglich der Diagnose Asthma relevant. Bei Lungenemphysem ist eine weiterführende Diagnostik mittels Blutgasanalyse, Bodyplethysmografie, Bestimmung der CO-Diffusionskapazität und Belastungstests sinnvoll.
Die in der NVL COPD getroffene Schweregradeinteilung (Tabelle 1) als Grundlage zur Therapiesteuerung wurde von der GOLD-Gruppe („Global Initiative for Chronic Obstructive Lung Disease“) 2011 modifiziert. Argumente hierfür sind, dass die Beschwerden der Patienten unzureichend mit der Lungenfunktion korrelieren. Weiterhin stellt die Häufigkeit von Exazer-bationen unabhängig von der funktionellen Beeinträchtigung einen Risikofaktor für eine rasche Progression der Erkrankung dar. Anhand der im Jahre 2011 erstmals vorgeschlagenen Einteilung wird das Ausmaß der Symptomatik anhand von Fragebögen, zum Beispiel des erst nach Erscheinen der NVL publizierten CAT-Scores, erfasst. Zusätzlich zur Lungenfunktion wird die Anzahl und Schwere der Exazerbationen (Abbildung 3) berücksichtigt. Kritisch anzumerken ist, dass der mMRC-Dyspnoe-Score und der CAT-Score in den vorgeschlagenen Einstellungen nicht äquivalent sind
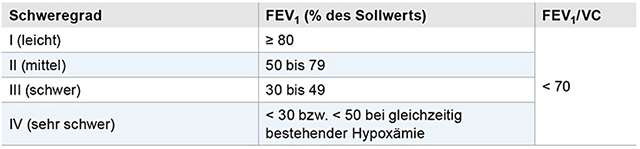
Tabelle 1: Spirometrische Klassifikation der chronisch obstruktiven Lungenerkrankung nach der GOLD-Gruppe („Global Initiative for Chronic Obstructive Lung Disease“). FEV1-Werte (% vom Soll) nach Bronchodilatation bei stabiler COPD.
Nach der neuen COPD-Klassifizierung werden vier Patientengruppen (Abbildung 3) unterschieden:
- Patientengruppe A (niedriges Risiko, geringe Symptomatik): Patienten mit COPD im Stadium I oder II der früheren COPD-Einteilung (Tabelle 1) und/oder maximal einer Exazerbation pro Jahr und einem CAT-Score < 10 bzw. einem mMRC-Score < 2
- Patientengruppe B (niedriges Risiko, intensivere Symptomatik): Patienten mit COPD im ehemaligen COPD-Stadium I und II oder II nach Einteilung durch die Lungenfunktion und/oder maximal einer Exazerbation pro Jahr bei einem CAT-Score > 10 und mMRC-Score ≥ 2
- Patientengruppe C (erhöhtes Risiko, geringe Symptomatik): Patienten mit COPD im Stadium III oder IV nach der früheren Einteilung und/oder ≥ zwei Exazerbationen pro Jahr und einem CAT-Score < 10 oder einem mMRC-Score < 2
- Patientengruppe D (erhöhtes Risiko, intensivere Symptomatik): Patienten mit COPD im Stadium III oder IV (Tabelle 1) und/oder ≥ zwei Exazerbationen pro Jahr und einem CAT-Score > 10 oder einem mMRC-Score ≥ 2
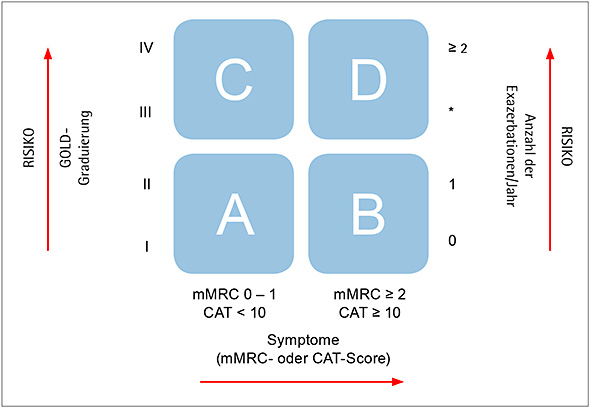
Abbildung 3: COPD-Assessment und Risiko. Einteilung der COPD in die vier Gruppen A, B, C und D in Abhängigkeit vom Ausmaß der Symptomatik der Einschränkung in der Lungenfunktion und der Zahl bzw. Schwere der Exazerbationen. * ≥ eine Hospitalisation
Bei der Erfassung des Risikos wird das jeweils höhere Risiko angewendet, wobei eine Exazerbation mit Krankenhausaufenthalt so viel wie mindestens zwei leichtere Exazerbationen pro Jahr zählt. Einen Patienten mit einem CAT-Score von 20 Punkten, einer COPD im lungenfunktionsanalytisch festgelegten Stadium II und drei Exazerbationen im vergangenen Jahr würde man also in die Patientengruppe D einordnen.
Pulmonale Komorbiditäten
Gegenüber den Angaben der NVL COPD hat sich gezeigt, dass bei COPD häufig eine Reihe anderer Erkrankungen beobachtet wird, die den Verlauf der COPD wesentlich beeinflussen. Die häufigsten relevanten Komorbiditäten sind in Tabelle 2 dargestellt. Die Therapie der Komorbiditäten kann grundsätzlich gemäß gültiger Leitlinien erfolgen. Während Beta-Blocker bei Patienten mit Asthma bronchiale kontraindiziert sind, profitieren COPD-Patienten, die aufgrund einer Herzerkrankung Beta-Blocker erhalten, von dieser Therapie.
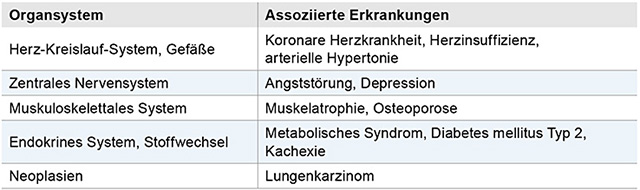
Tabelle 2: Häufige Komorbiditäten bei der COPD.
Differenzialdiagnose Asthma
Für das Management der COPD ist die differenzialdiagnostische Abgrenzung zum Asthma wesentlich (Tabelle 3). Gegenüber den Angaben in der noch gültigen NVL COPD ist zu betonen, dass der Nachweis der Reversibilität der Obs-truktion im Bronchodilatationstest keine eindeutige Differenzierung zwischen Asthma und COPD erlaubt mit Ausnahme einer vollständig reversiblen Obstruktion die für Asthma spricht.

Tabelle 3: Differenzialdiagnose Asthma bronchiale – COPD.
Therapie
Die Therapie umfasst Tertiärprävention, medikamentöse Behandlung, Schulung mit dem Ziel, den Patienten aktiv an der Bewältigung seiner Erkrankung zu beteiligen, Atemphysiotherapie, körperliches Training, Ernährungsberatung, apparative Therapieoptionen und möglicherweise operative oder interventionelle Behandlungsverfahren bei ausgeprägtem Lungenemphysem, ferner das Management akuter Exazerbationen.
Raucherentwöhnung
Tabakrauchen ist der wichtigste Risikofaktor für das Auftreten der COPD. Die Tabakentwöhnung ist die wirksamste und kosteneffektivste Einzelmaßnahme, um das Risiko der Entstehung zu verringern und die Progression der Erkrankung zu stoppen. Die höchsten Abstinenzraten werden durch eine Kombination aus verhaltenstherapeutischen Maßnahmen und einer begleitenden Pharmakotherapie mit Nikotinersatzstoffen und/oder Vareniclin bzw. Bupropion erreicht.
Patientenschulung
Körperliches Training, das zu einer Steigerung der Lebensqualität, einer Besserung der Belastbarkeit und einer geringeren Morbidität führt, sollte nach der NVL COPD Bestandteil einer Langzeittherapie sein, ebenso die strukturelle Patientenschulung, die über Selbstkontrolle und eine gesteigerte Effizienz der Selbstmedikation zu Reduktion von Exazerbationen und zu einer höheren Lebensqualität beiträgt. Weiter empfohlen wird die physiotherapeutische Atemtherapie.
Schutzimpfungen
In der NVL COPD, wie inzwischen auch in den Empfehlungen der GOLD-Gruppe, werden die Influenza- und Pneumokokkenschutzimpfungen empfohlen.
Medikamentöse Langzeittherapie
Die Steuerung der Medikation erfolgt in erster Linie neuerdings in Abhängigkeit von der Symp-tomatik sowie der Häufigkeit und Schwere von Exazerbationen. Zudem wurde die Medikation durch neue langwirksame Bronchodilatatoren, die Kombination von Bronchodilatatoren und des Phosphodiesterase-4-Hemmers Roflumilast, erweitert. Ziele der Pharmakotherapie sind die Linderung der Symptome Atemnot, Husten und Auswurf, eine Zunahme der körperlichen Belastbarkeit und eine Steigerung der Lebensqualität, ferner eine Prävention und Reduktion von Exazerbationen.
Bronchodilatatoren
Die Empfehlungen der GOLD-Gruppe für die Langzeitbehandlung sind in Tabelle 4 zusammengefasst. Die Therapie mit inhalativen Medikamenten ist bei der COPD grundsätzlich systemisch wirksamen Medikamenten vorzuziehen. Wesentlich für die Effizienz der Inhalativa ist die korrekte Inhalationstechnik mit den verschiedenartigen Inhalatoren.

Tabelle 4: Initiale medikamentöse Langzeittherapie der stabilen COPD. ICS = inhalierbares Glukokortikoid, LABA = langwirksames Beta-2-Mimetikum, LAMA = langwirksames Anticholinergikum, PDE4H= Phosphodiesterase-4-Hemmer, SABA = kurzwirksames Beta-2-Mimetikum, SAMA = kurzwirksames Anticholinergikum. Die alternativen Medikamente können einzeln oder in Kombination mit den Medikamenten der ersten Wahl eingesetzt werden.
Anticholinergika
Anticholinergika führen zu einer signifikanten Verbesserung von Lungenfunktion, Symptomatik und Lebensqualität sowie Exazerbationsfrequenz. Für Tiotropium ergaben sich Hinweise für eine Überlegenheit gegenüber Salmeterol hinsichtlich der Reduktion von Exazerbationen. Mit Glykopyrronium und Aclidinium wurden zwei weitere langwirksame Anticholinergika (LAMA) zugelassen. Glykopyrronium wird wie Tiotropium einmal täglich, Aclidinium zweimal täglich inhaliert. Ob die unterschiedliche Pharmakokinetik Auswirkung auf die Effizienz hat, ist Gegenstand aktueller Untersuchungen.
Die Kombination aus Glykopyrronium und Indacaterol, einem Beta-2-Sympathomimetikum mit einer Wirkdauer von 24 Stunden, besteht als Fixkombination auf dem Markt, die eine noch stärkere Bronchodilatation als die Einzelsubstanzen hervorruft und zur Linderung der Dyspnoe beiträgt. Ferner wurde das 24 Stunden langwirksame Umeclidinium mit dem langwirksamen Beta-2-Agonisten Vilanterol auf den Markt gebracht.
Beta-2-Sympathomimetika
Beta-2-Sympathomimetika wirken atemwegs-erweiternd, verbessern die Lungenfunktion, reduzieren die Atemnot, steigern die Lebensqualität und führen auch zu einer Reduktion von Exazerbationen. Neben kurzwirksamen Beta-2-Sympathomimetika (SABA) für die Bedarfs- und Notfalltherapie stehen mit Formoterol, Salmeterol (Wirkdauer von zwölf Stunden) nun auch Indacaterol und Vilanterol (Wirkdauer von 24 Stunden) langwirksame Substanzen (LABA) zur Verfügung.
Anticholinergika und Beta-2-Sympathomimetika sind bezüglich der Bronchodilatation als gleichwertig zu betrachten; die Prävention von Exazerbationen gelingt hingegen durch den Einsatz von LAMA besser als durch LABA.
Unverändert mit den Angaben der NVL COPD sind inhalative Kortikosteroide (ICS) bei Patienten mit schwerer oder sehr schwerer COPD sowie häufigen Exazerbationen (zwei oder mehr pro Jahr) in den aktuellen Empfehlungen und Leitlinien einsetzbar. Ob der Einsatz von ICS bei Patienten mit schwerer COPD erforderlich ist, wird gegenwärtig diskutiert. Entgegen dieser Empfehlung werden aktuell etliche Patienten mit ICS behandelt, die diese Kriterien nicht erfüllen. Grundsätzlich sollten ICS in der Behandlung der COPD nur in Kombination mit LABA und/oder LAMA eingesetzt werden, eine Monotherapie wie bei Asthma ist nicht indiziert. Ob die gesteigerte Pneumonierate ein substanzspezifischer oder dosisabhängiger Effekt ist, kann noch nicht eindeutig festgelegt werden.
Systemische Kortikosteroide sollten nicht in der Langzeittherapie eingesetzt werden, da sie auch in geringen Dosen zu einer Myopathie mit Einschränkung der Belastbarkeit der Patienten führen können. Die Wirksamkeit ist nur für die Behandlung der Exazerbation gut belegt.
Kombinationspräparate
Aktuell sind Kombinationspräparate aus Kombinationen von LABA/LAMA und LABA/ICS im Handel. Vorzüge derartiger Kombinationen sind der gesteigerte Patientenkomfort und eventuell eine höhere Therapieadhärenz durch die geringere Zahl notwendiger Inhalationen.
Phosphodiesterase-4-Hemmer (PDE4H)
Die Phosphodiesterase 4 ist ein Schlüsselenzym bei der Inflammation der für die COPD relevanten Zelltypen. Roflumilast ist als erster Vertreter der PDE4H erst nach Erscheinen der NVL COPD auf den Markt gekommen. Das Präparat ist bei Patienten mit häufigen Exazerbationen und ausgeprägter Symptomatik zur Reduktion der Exazerbationsfrequenz indiziert. Wesentlichste unerwünschte Wirkungen sind Übelkeit und Durchfall.
Mukopharmaka
Der Einsatz von N-Acetylcystein, Ambroxol und Myrtol zur Sekretelimination wird in der NVL COPD nicht allgemein empfohlen. Für Cineol konnte inzwischen allerdings eine Reduktion von Exazerbationsraten nachgewiesen werden, für Acetylcystein mit einer Dosis von zweimal 600 mg pro Tag ebenfalls eine deutliche Reduktion der Exazerbationsrate.
Langzeitsauerstofftherapie (LTOT) und Heimbeatmung
Die Angaben der NVL COPD zur Langzeitsauerstofftherapie bei Patienten mit chronischer Hypoxämie bzw. zur Heimbeatmung bei zusätzlich vorliegender chronischer Hyperkapnie sind mit den angegebenen Indikationen unverändert gültig. Die nicht invasive Beatmung mit positivem Druck kann nach einer kürzlich erschienenen Untersuchung die Prognose der Patienten bei PaCO2-Werten > 51,8 mmHg deutlich verbessern.
Management von Exazerbationen
Die Exazerbation kann als akute Verschlechterung mit Zunahme der Symptome (Atemnot, Husten, Auswurf, thorakale Beklemmung, Fieber) der bronchialen Obstruktion definiert werden, die eine Änderung des Managements notwendig macht. Häufigste Ursache sind virale und/oder bakterielle Atemwegsinfekte. Differenzialdiagnostisch abzugrenzen sind Pneumonien, Herzinsuffizienz, Pneumothorax, Pleuraergüsse, Lungenembolien, Arrhythmien oder ein Thoraxtrauma. Zwei oder mehr Exazerbationen pro Jahr gelten als Risikofaktor für eine rasche Verschlechterung der Lungenfunktion und somit für einen schweren Verlauf der Erkrankung.
Bei einer COPD-Exazerbation sollte eine Intensivierung der inhalativen Therapie, die systemische Gabe von Glukokortikoiden und eine Behandlung mit Antibiotika erwogen werden (Abbildung 4). Eine Intensivierung der anti-obstruktiven Behandlung kann mit SABA und/oder SAMA erfolgen. Die Dauertherapie mit langwirksamen Bronchodilatatoren und/oder ICS sollte unverändert fortgesetzt werden.
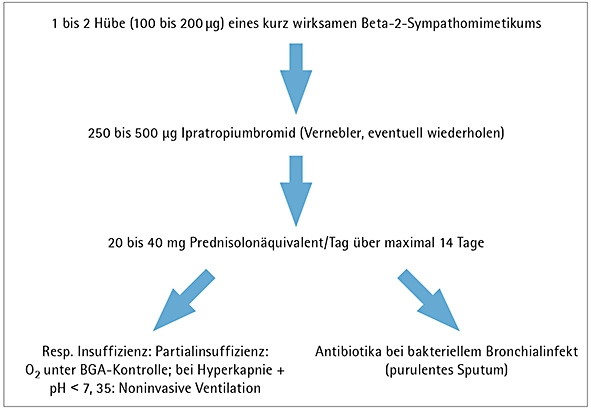
Abbildung 4: Medikamentöse Therapie der akuten COPD-Exazerbation.
Bei mittelschweren Exazerbationen mit deutlicher Zunahme von Atemnot und/oder Husten sowie Verschlechterung der Lungenfunktion kann eine morgendliche Einmaldosis von 20 bis 40 mg Prednisolon über fünf bis 14 Tage als ausreichend angesehen werden. Eine Langzeitbehandlung mit systemischen Kortikosteroiden ist bei der COPD mit vermehrten Nebenwirkungen, insbesondere Muskelschwund und Osteoporose, verbunden und daher kontraindiziert.
Antibiotikatherapie
Antibiotika sind nur bei Exazerbationen infolge eines bakteriellen Atemweginfektes wirksam (NVL COPD). Charakteristikum bakterieller Exazerbationen ist neben einer Zunahme von Dyspnoe, Husten und Sputummenge das Auftreten eines purulenten Sputums. In Abhängigkeit von der lokalen Resistenzlage kommen in erster Linie Aminopenicilline (gegebenenfalls plus Beta-Laktamase-Inhibitoren), orale Cephalosporine oder Makrolide in Betracht. In unkomplizierten Fällen können auch Tetracycline eingesetzt werden.
Empfohlene Maßnahmen zur Exazerbationsprophylaxe sind (siehe GOLD-Leitlinie 2015):
- Raucherentwöhnung,
- Meidung von inhalativen Noxen (Arbeitsplatz, Hobby) und Kälte,
- Schutzimpfungen gegenüber Influenza und Pneumokokken,
- Anticholinergika,
- Inhalative Glukokortikoide,
- Roflumilast,
- Langwirksame Beta-2-Sympathomimetika,
- Cineol,
- Patientenschulung.
Operative und interventionelle Verfahren
Von den in der NVL COPD angegebenen operativen Verfahren (Lungenvolumenreduktion, Lungentransplantation, Bullektomie) hat sich insbesondere die interventionell bronchoskopisch durchgeführte Lungenvolumenreduktion bei Patienten mit heterogenem Lungenemphysem und einer FEV1 zwischen 15 und 45 Prozent des Sollwertes weiter entwickelt. Bei heterogenem Emphysem im CT und Zeichen der Überblähung (Totalkapazität > 100 Prozent des Sollwertes und Residualvolumen > 150 bis 200 Prozent des Sollwertes) konnte durch den Einbau von Ventilen bzw. Spiralen (Coils) eine moderate Besserung der Lungenfunktion, der körperlichen Belastbarkeit sowie eine Linderung der Symptome gezeigt werden. Nach der Implantation werden gelegentlich Hämoptysen und auch Exazerbationen beobachtet. Zusätzliche Daten von größeren Kollektiven sind erforderlich, um den Stellenwert der interventionellen Techniken klar zu definieren.
Nachsorge/Rehabilitation
Eine Stärke der NVL COPD ist die Darstellung der Versorgungskoordination in Deutschland unter Einbeziehung aller an der Versorgung Beteiligten. Die Langzeitbetreuung des Patienten und die Koordination der Versorgung sowie deren Dokumentation im Rahmen eines strukturierten Behandlungsprogramms erfolgt grundsätzlich durch den Hausarzt, gegebenenfalls auch durch den Pneumologen. Bei unzureichendem Therapieerfolg trotz intensivierter Behandlung, nach vorausgegangener Notfallbehandlung, zur Beendigung einer entzündungshemmenden Dauertherapie, bei bedeutsamen Komorbiditäten sowie bei Verdacht auf berufsbedingte Atemwegserkrankungen sind die Pneumologen bzw. qualifizierten Fachärzte einzubeziehen. Bei Hinweisen auf schwere Exazerbationen, einen progredienten Verlauf trotz intensiver ambulanter Behandlung sowie bei unzureichender häuslicher Betreuung ist die Einweisung in ein Krankenhaus notwendig. Die Indikation zur Rehabilitation besteht, wenn trotz adäquater kurativer Behandlung beeinträchtigende körperliche oder psychosoziale Krankheitsfolgen persistieren, die die Möglichkeiten von alltagsrelevanten Aktivitäten sowie die Teilnahme am normalen privaten, öffentlichen und beruflichen Leben behindern. Wesentlich für den Erfolg der pneumologischen Rehabilitation ist der motivierte Patient. Positive Effekte bezüglich Zunahme der Belastbarkeit, Abnahme der Dyspnoe und Steigerung der Lebensqualität sind sowohl für stationäre als auch für ambulante Rehabilitationsprogramme dokumentiert.
Schlussfolgerungen
In der NVL COPD sind die zum damaligen Zeitpunkt wesentlichen evidenzbasierten Empfehlungen zum Management der COPD enthalten. Positiv hervorzuheben sind klare Angaben über die Koordination der Versorgung der Patienten zwischen Hausarzt, Facharzt, Akutkrankenhaus und rehabilitativer Einrichtung. Gegenüber den im Jahre 2005/2006 gemachten Aussagen sind bei der notwendigen Aktualisierung der NVL COPD folgende Punkte besonders zu berücksichtigen:
- Stärkere Bewertung des zukünftigen Risikos infolge der Häufigkeit und Intensität von Exazerbationen für die Therapie,
- Bessere Erfassung der Symptomatik der Patienten, auch durch evaluierte Fragebögen,
- Neubewertung der inhalativen Kortikosteroide in der medikamentösen Therapie der COPD,
- Berücksichtigung neuer langwirksamer Bronchodilatatoren und Kombinationen in der Langzeittherapie,
- Berücksichtigung bisher nicht aufgeführter Substanzen wie Roflumilast,
- Bewertung der endoskopisch durchgeführten Lungenvolumenreduktion,
- Management der Komorbiditäten.
Zusammengefasst sind wesentliche Grundzüge des COPD-Managements, die in der NVL COPD niedergelegt sind, nach wie vor gültig. Dies gilt insbesondere auch für die Versorgungs-koordination. Unverändert ist festzuhalten, dass wesentliche Punkte in der Umsetzung der COPD-Leitlinie, wie etwa die Nutzung der Bewegungstherapie in der Langzeitbehandlung der Patienten und die Raucherentwöhnung in Deutschland, zu wenig genutzt werden.
Das Literaturverzeichnis kann beim Verfasser angefordert oder im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Der Autor erklärt, dass er keine finanziellen oder persönlichen Beziehungen zu Dritten hat, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Professor Dr. Heinrich Worth, Wolfsleithe 1, 90556 Cadolzburg, E-Mail: heinrich.worth(at)t-online.de
Teilen:
Das könnte Sie auch interessieren: