KDIGO-Leitlinien zum akuten Nierenversagen
 Nierenquerschnitt
Nierenquerschnitt
Um den Prozess der Leitlinienentwicklung auf hohem Niveau und effektiv zu gestalten, gibt es in der Nephrologie einen internationalen Verband, der globale Leitlinien entwickelt: „Kidney Disease – Improving Global Outcomes“ (KDIGO). Im März 2012 hat die KDIGO erstmals eine Leitlinie zum akuten Nierenversagen („Acute Kidney Injury“, AKI) publiziert [1]. Diese Leitlinie fasst bestehende Evidenzen zur Diagnose, Prävention und Therapie des AKIs zusammen und gibt Empfehlungen von unmittelbarer klinischer Relevanz. Die Leitlinie berücksichtigt hierbei die wissenschaftliche Literatur bis Februar 2011. Um den Grad der zugrunde liegenden Evidenz und die Stärke der Empfehlungen transparent zu machen, werden alle Aussagen nach den international etablierten GRADE-Kriterien („Grading of Recommendations Assessment Development and Evaluation“) graduiert (Tabelle 1). Die Graduierungen zeigen an, wo wir auf gut gesichertes Wissen, auf nur schwache Evidenz oder gar nur auf Expertenmeinungen zurückgreifen können. Aber auch an diesen Stellen wird die enorme Bedeutung dieser Leitlinie klar, weil sie auf wichtige ungelöste Forschungsfragen aufmerksam macht. KDIGO fordert dazu auf, die Relevanz der globalen Leitlinien regional zu diskutieren. Die KDIGO-AKI ist zwischenzeitlich durch verschiedene Fachgesellschaften analysiert worden, was zu nationalen Kommentierungen geführt hat. So gibt es regionale Kommentierungen durch entsprechende Arbeitsgruppen europäischer („European Renal Best Practice“, ERBP) [2, 3], US-amerikanischer [4] und deutscher Nephrologen und Intensivmediziner [5, 6]. In diesen Kommentaren sind die KDIGO-Empfehlungen vielfach auch mit zwischenzeitlich erschienener, aktuellerer Literatur abgeglichen worden und es wurden regionale Besonderheiten berücksichtigt. Die im Text verwendeten Abkürzungen finden Sie erklärt in unserem Glossar.
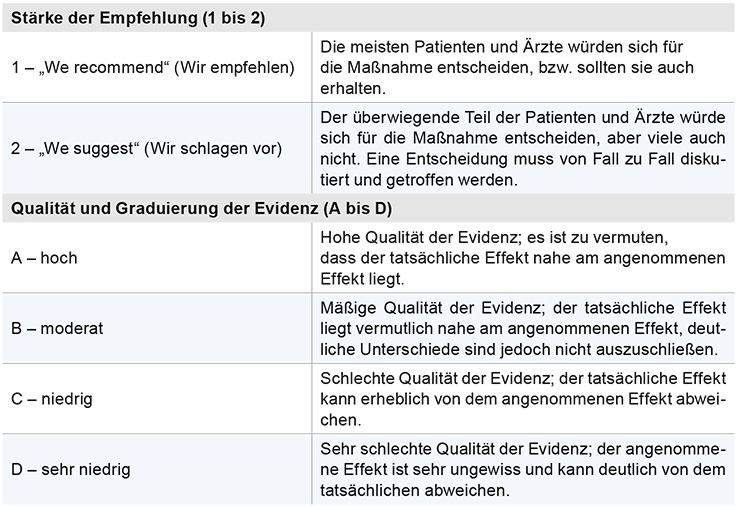
Tabelle 1: Graduierung der zugrunde liegenden Evidenzen.
AKI-Definition
Um eine einheitliche Definition des „Akuten Nierenversagens“ zu schaffen, waren 2004 zunächst die RIFLE-Kriterien (Akronym für „Risk“, „Injury“, „Failure“, „Loss“ und „End stage renal disease“) und 2006 die auf drei Stadien reduzierten AKIN-Kriterien („Acute Kidney Injury Network“) definiert worden. Gleichsam etablierte sich in begrifflicher Abgrenzung zu dem früheren unscharfen Begriff „Akutes Nierenversagen“ (bzw. „Acute Renal Failure“) der Terminus akute Nierenschädigung (bzw. „Acute Kidney Injury“). Die KDIGO-Definition führt nun die beiden parallelen Klassifikationen zu einer einheitlichen Definition zusammen. Die Einteilung des AKIs in drei Stadien (AKI/KDIGO 1 bis 3) erfolgt anhand von drei Kriterien: Kreatininanstieg, geschätzte glomeruläre Filtrationsrate (estimated GFR; eGFR) und Urinmenge (Tabelle 2). Diese vereinheitlichte Definition des AKIs ermöglichte es erstmals, größere epidemiologische Analysen durchzuführen. Hierbei stellte sich heraus, dass auch schon geringe Anstiege des Serum-Kreatinins von nur 0,3 mg/dl (26,5 µmol/l) in 48 Stunden oder ein 50-prozentiger Anstieg im Vergleich zur Baseline in sieben Tagen (AKI-Stadium 1) mit einer deutlich erhöhten Morbidität und Mortalität der Betroffenen einhergeht und sich das Risiko linear mit dem Grad der Nierenschädigung weiter erhöhte. Entsprechend empfiehlt die KDIGO-Leitlinie, alle Patienten mit AKI nach Stadien einzuteilen, möglichst die Ursache des AKIs zu verstehen (n. g.) und individuelle (und vielleicht vermeidbare) Risikofaktoren zu identifizieren (1B), um möglichst rechtzeitig Handlungspfade erstellen zu können (n. g.). Da ungefähr bei der Hälfte der Patienten, die ein AKI durchlaufen haben, eine chronisch renale Schädigung bestehen bleibt, die oft jedoch subklinisch verläuft (eGFR-Erniedrigung, Proteinurie), wird angeraten, drei Monate nach einem AKI alle Patienten auf klinische Zeichen einer chronischen Nierenerkrankung (Chronic Kidney Disease; CKD) zu untersuchen (n. g.) und gegebenenfalls dann nach der KDIGO-CKD-Leitlinie (www.kdigo.org) zu behandeln (n. g.). Die ERBP-Arbeitsgruppe ergänzt in ihrer Kommentierung, dass zur Bestimmung des Kreatininausgangswertes nicht ein errechneter oder historischer Wert herangezogen, sondern der erste verfügbare Wert verwendet werden soll (1C) und die Diuresemenge besser auf das ideale und nicht das tatsächliche Körpergewicht bezogen werden soll, da beispielsweise ausgeprägte Ödeme den Wert deutlich verfälschen würden [2].

Tabelle 2: KDIGO-Stadieneinteilung der AKI-Stadien.
Allgemeine Handlungsempfehlungen
Nach wie vor existiert keine gesicherte, evidenzbasierte pharmakologische Therapie eines AKIs. Umso wichtiger erscheint die Umsetzung einfacher, allgemeiner Behandlungsleitlinien zu sein. Neben der frühzeitigen Identifizierung von Risikopatienten wird in der KDIGO-Leitlinie ein stadienbasiertes Management eines AKI vorgeschlagen (Tabelle 3). Auch wenn es sich um sehr allgemeine Behandlungsmaßnahmen handelt, haben Studien [7] zeigen können, dass eine möglichst rasche Umsetzung unter der Konsultation eines Nephrologen eine große Bedeutung haben kann.
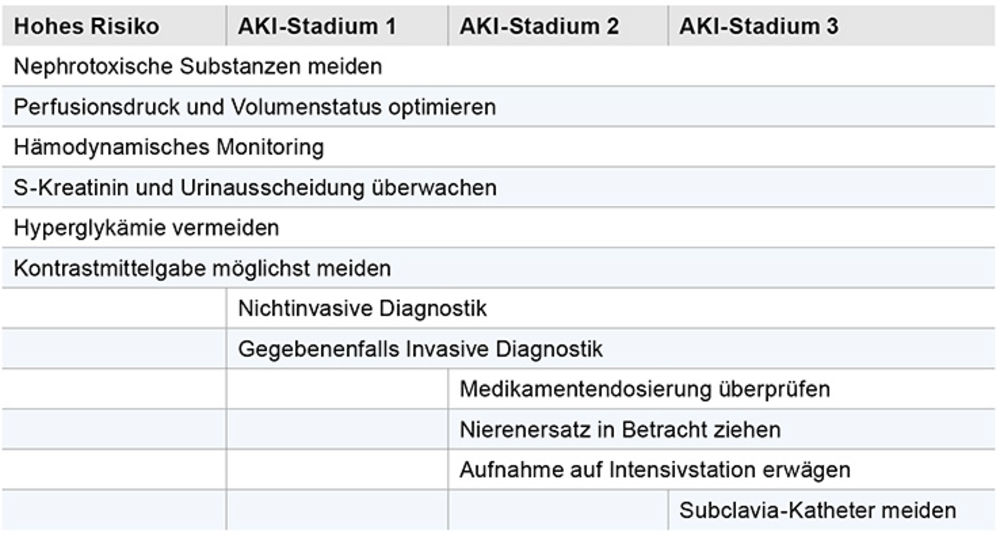
Tabelle 3: Indikationen zur Nierenersatztherapie/Handlungsempfehlungen entsprechend der AKI-Stadien (modifiziert nach [1, 5]).
Prävention und Therapie: AKI bei Sepsis oder auf der Intensivstation
Die renale Minderperfusion infolge eines reduzierten Perfusionsdruckes und eines Volumenmangels stellt einen Risikofaktor für ein AKI dar. Um dem entgegenzuwirken, wird primär ein Volumenersatz mit isotonen kristalloiden Lösungen, jedoch nicht der Einsatz kolloidaler Lösungen (Hydroxyethylstärke – HAES – oder Albumin) empfohlen (2B). Besteht eine Hypotonie oder ein Schock, so werden Vasopressoren parallel zu den Kristalloiden empfohlen (1C), um einen arteriellen Mitteldruck von mindestens 65 mmHg zu erreichen. Die Schocktherapie sollte hierbei optimalerweise protokollgesteuert erfolgen (2C). In der Literatur wird hier Noradrenalin der Vorzug gegeben. Vasopressin zeigte keine Vorteile und wird daher nicht empfohlen. Auch Dopamin (wie in Studien gezeigt werden konnte) in der sogenannten „renalen Dosis“, welches früher auf Intensivstationen – in der Hoffnung, die Diurese zu steigern – eingesetzt wurde, sollte bei fehlendem Wirksamkeitsnachweis und möglichen Nebenwirkungen nicht zum Einsatz kommen (1C).
Die Frage des Volumenersatzes wurde in den vergangenen Jahren in Deutschland sehr kontrovers diskutiert. KDIGO gab den kristalloiden gegenüber den kolloidalen Lösungen den Vorzug aufgrund der mit HAES verbundenen erhöhten AKI-Inzidenz. Diese renalen Nebenwirkungen haben zwischenzeitlich zu einer Zulassungsbeschränkung von HAES durch die European Medicines Agency (EMA) geführt. Eine aktuelle randomisierte Studie (RCT), die Albumin als kolloidalen Volumenersatzstoff bei septischen Patienten untersucht [8], bestätigt die Nicht-Empfehlung in der KDIGO-Leitlinie, da sie keine Mortalitätsvorteile für Albumin zeigen konnte. Kritisch ist nach neuester Studienlage mittlerweile auch der Einsatz von isotoner kristalloider Kochsalzlösung (0,9 Prozent) zu betrachten. In einer in der KDIGO-Leitlinie noch nicht berücksichtigten Observationsstudie wurde gezeigt, dass die mit isotoner Kochsalzgabe einhergehende hyperchlorämische Azidose mit einer erhöhten AKI-Inzidenz assoziiert war [9]. Nach aktueller Studienlage sind daher vermutlich besser balancierte kristalloide Lösungen (zum Beispiel Ringer-Laktat, Ringer-Acetat) einzusetzen.
Entsprechend der „Meilenstein“-Studie von Rivers et al. (2002) und dem darauf aufbauenden Konzept der „Early goal directed therapy“ (EGDT) [10], die unter Berücksichtigung der zentralvenösen Sauerstoffsättigung, des arteriellen Mitteldruckes, des zentralen Venendrucks und der Urinausscheidung zum Standard der Akutversorgung septischer Patienten weltweit geworden ist, empfiehlt KDIGO auch ein protokollbasiertes Schockmanagement. Die US-amerikanische Kommentierung wies bereits darauf hin, dass die EGDT in multizentrischen Studien zu überprüfen sei [4]. Mittlerweile sind drei große Studien (RCTs) zur frühzeitigen Volumentherapie veröffentlicht worden (ARISE, ProCESS und ProMISe) [11, 12, 13]. Dabei ließ sich kein Überlebensvorteil oder anderweitiger Vorteil hinsichtlich der Notwendigkeit für Nierenersatzverfahren (und auf die Mortalität) nachweisen. Berücksichtigt werden muss dabei sicherlich, dass im Verlauf der Jahre auch im Bereich der üblichen Therapie (Kontrollarm in den drei Studien) Annährungen an die Standards von EGDT erfolgt sind. Inwieweit diese Ergebnisse zu einem Paradigmenwechsel in unseren zwischenzeitlich fest etablierten Intensivversorgungsstandards führen sollten, wird aktuell aber diskutiert.
Ernährung und metabolische Kontrolle sind wichtige Probleme bei kritisch Kranken im Stressstoffwechsel. Zwei große monozentrische Studien [14, 15] hatten gezeigt, dass die absolute AKI-Inzidenz durch strengere Blutzuckerkontrolle um vier Prozent gesenkt werden konnte. Da jedoch nachfolgende Studien diesen Effekt nicht bestätigen konnten und andererseits mehr kritische Hypoglykämien auftraten, empfiehlt KDIGO einen Blutzuckerzielwert von 110 bis 149 mg/dl (6,1 bis 8,3 µmol/l) unter Insulintherapie (2C). Die ERBP-Arbeitsgruppe ist noch ein wenig vorsichtiger und schlägt 110 bis 180 mg/dl vor. Weiterhin empfiehlt KDIGO, um eine Mangelernährung kritisch Kranker möglichst zu vermeiden, eine Kalorienzufuhr von 20 bis 30 kcal/kg (2C). Eine Proteinbeschränkung, um durch eine reduzierte Harnstoffbildung eine Nierenersatztherapie potenziell herauszuschieben, wird nicht als sinnvoll angesehen. Im Gegenteil: um einem Mangel an Aminosäuren entgegenzuwirken, sollten – je nachdem, ob der Patient katabol ist und eine kontinuierliche Hämofiltration (CVVH) durchgeführt wird, 0,8 bis 1,0 (nicht-katabol, kein Nierenersatz), 1,0 bis 1,5 (nicht-katabol aber Nierenersatz) oder sogar 1,7 g/kg/d Protein (hyperkatabol und Nierenersatz) (2D) möglichst enteral (2C) zugeführt werden. Entsprechend ist es nicht sinnvoll, Patienten am Nierenersatz mit proteinreduzierten, kalium- und phosphatarmen Ernährungslösungen („Nephro“-Sonden) zu behandeln. Das Serum Kalium sollte besser nach intensivmedizinischen Regeln eingestellt werden, das Phosphat ist – anders als bei chronischen Dialysepatienten – oft durch die kontinuierlichen Nierenersatzverfahren häufig sogar kritisch erniedrigt und muss gegebenenfalls substituiert werden.
Entäuschenderweise zeigten alle bisherigen Studien, die versuchten, ein AKI medikamentös zu verhindern oder abzumindern, negative Ergebnisse. Das gilt für Fenoldopam, atriale natriuretische Peptide, Insulin-Like Growth Factor-1, Dopamin und auch für Diuretika. Diuretika haben weder einen präventiven Effekt, noch konnten sie ein AKI reduzieren oder abkürzen; sie können lediglich bei einem nicht-oligurischen AKI zur Volumenkontrolle dienen (2C). Eine Ausnahme in Bezug auf Medikamentenempfehlungen stellt die Einzeldosis von Theophyllin bei Neugeborenen mit schwerer perinataler Asphyxie dar, die weiter empfohlen wird (2B).
Zur Prävention oder auch, um ein Aggravieren eines bestehenden AKIs zu vermeiden, ist es wichtig, nephrotoxische Medikamente zu vermeiden. Als nephrotoxisches Antibiotikum spielen hier Aminoglykoside eine wichtige Rolle, die optimalerweise gar nicht gegeben werden sollten (2A) oder möglichst topisch appliziert werden sollten (zum Beispiel inhalativ, 2B). Bei intravenöser Applikation sollte eine einmal tägliche Gabe bevorzugt werden (2B), da ihre Wirksamkeit durch einen hohen Spitzenspiegel und einen postantibiotischen Effekt gekennzeichnet ist. Kommen Aminoglykoside mehr als 48 Stunden zum Einsatz, sollten Spiegelkontrollen erfolgen (2C). Bei Amphotericin B wird empfohlen, die liposomalen Darreichungsformen zu verwenden, da sie vermutlich weniger nephrotoxisch sind (2A) oder das Amphotericin besser gleich durch Azole oder Echinocandine zu ersetzen (1A), soweit das infektiologisch vertretbar ist.
Kontrastmittelnephropathie (CIN)
Als „Contrast Induced Nephropathy“ (CIN) wird traditionellerweise der Anstieg des Kreatinins um 0,5 mg/dl innerhalb von 48 Stunden nach Kontrastmittelgabe definiert. KDIGO schlägt – entsprechend der Vereinheitlichung der AKI-Definitionen – nun auch für die CIN die Verwendung der dreistufigen KDIGO-Klassifikation vor (n. g.). Als wichtig wird erachtet, Patienten mit einem erhöhten Risiko für eine CIN (vorbestehende CKD, Diabetes, Hypertonus) zu identifizieren (n. g.) und gegebenenfalls möglichst wenig (n. g.), möglichst isoosmolares Kontrastmittel (1B) zu verwenden oder über alternative Bildgebungsverfahren nachzudenken (zum Beispiel MRT). Als prophylaktische Maßnahmen wird die intravenöse Gabe von Kochsalz 0,9 Prozent oder von isoosmolarem Bikarbonat (1A), gegebenenfalls ergänzt durch orales N-Acetylcystein (2D), vorgeschlagen. Andere Substanzen oder eine periprozedurale Hämodialyse zur Entfernung des Kontrastmittels werden nicht empfohlen (2C).
Nierenersatztherapie
Wann? Leider gibt es in der wissenschaftlichen Literatur weiterhin keinen klaren Konsens zur Frage, wann ein Nierenersatzverfahren begonnen werden soll. Die KDIGO-Leitlinie fällt entsprechend eher vage aus und empfiehlt, bei lebensbedrohlichen Veränderungen des Wasser-, Elektrolyt- und Säure-/Basenhaushaltes möglichst unter Berücksichtigung des individuellen klinischen Kontextes, einen Nierenersatz zu beginnen (n. g.) und gegebenenfalls wieder zu beenden (n. g.). Bei wieder einsetzender Diurese wird die in der klinischen Praxis häufig praktizierte Diuretikagabe zur Unterstützung der renalen Erholung nicht empfohlen (2B). Interessant ist, dass die KDIGO-Arbeitsgruppe sich nicht zu einer Empfehlung hinsichtlich eines frühen oder späten Nierenersatzbeginns durchringen konnte, obwohl mehrere Observationsstudien und eine Metaanalyse aus dem Jahr 2012 [16] zu dem Ergebnis kommen, dass ein früher Beginn eines Nierenersatzes sinnvoll ist. Eine klare Empfehlung ist jedoch unter anderem dadurch erschwert, dass der Begriff meist früh an die Höhe des Serum-Harnstoffes gekoppelt ist und von daher kein wirkliches zeitliches Kriterium darstellt. Auch die Heterogenität der Studien in Bezug auf Qualität und Design macht eine Empfehlung schwierig.
Wie? Als Antikoagulation für die kontinuierlichen Verfahren wird primär eine regionale Citratantikoagulation vorgeschlagen (2B), soweit keine Kontraindikationen vorliegen, die dazu zwingen, entweder Heparin zu verwenden oder gar keine Antikoagulation durchzuführen (2C). Hier wird Citrat unmittelbar hinter dem Dialysekatheter zugeführt, das dann zur Chelatierung des für die Gerinnung notwendigen Kalziums führt. Das ionisierte Kalzium sollte dann ca. 0,3 mmol/l im CVVH-System betragen, womit eine Gerinnung kaum mehr möglich ist. Vor Rückführen des Blutes in den Patienten wird wieder Kalzium zugeführt, sodass das Kalzium im Blutkreislauf des Patienten unbeeinträchtigt ist. Als Kontraindikation für Citrat gilt eine schwere Leberinsuffizienz, da das Citrat primär über die Leber metabolisiert wird und von daher dann akkumulieren und als schwache Säure zu einer Azidose führen kann. Bei einer Heparin-induzierten Thrombozytopenie (HIT) sollten zur Antikoagulation direkte Thrombininhibitoren (Argatroban) oder Faktor-Xa-Inhibitoren zur Nierenersatztherapie vorgezogen werden (1A). Als Dialysekatheter im Akutsetting werden nicht getunnelte Katheter empfohlen. Die präferentielle Lokalisation ist (1) die rechte Vena jugularis, (2) die Vena femoralis, (3) die linke Vena jugularis und (4) – erst zuletzt (!) – die Vena subclavia. Hintergrund dieser Empfehlung ist, dass die linksjuguläre Anlage zur Biegung des Katheters in situ führt. Ebenso wie die Anlage in die Vena subclavia kann dies mit späteren Thrombosen und Stenosen assoziiert sein und vor allem auch bei späteren Dialyse-Shuntanlagen problematisch werden.
Die Frage, ob ein kontinuierliches oder ein intermittierendes Nierenersatzverfahren besser ist, wurde in zahlreichen Studien untersucht. Einen Mortalitätsvorteil für eines der Verfahren konnte aber nicht festgestellt werden. Entsprechend klassifiziert KDIGO beide Verfahren als komplementär (n. g.), die je nach Erfordernissen des Patienten einsetzbar sind. Die Leitlinie bestärkt jedoch die gängige klinische Einschätzung, hämodynamisch instabile Patienten seien besser mit einem kontinuierlichen Verfahren zu versorgen (2B). Ebenfalls wird empfohlen, ein kontinuierliches Verfahren bei allen Patienten mit der Gefahr eines erhöhten Hirndruckes (Gehirnverletzungen, Hirnödem, hepatische Enzephalopathie) anzuwenden, da die intermittierenden Schwankungen osmotisch aktiver Blutbestandteile und des Wasser-haushaltes bei intermittierenden Verfahren ein Hirnödem verstärken können (2B). Sowohl in der deutschen als auch in der europäischen Kommentierung wird zusätzlich auch auf den möglichen Stellenwert neuer hybrider Verfahren des Nierenersatzes hingewiesen. Hierzu gehört die „Slow-Extended Dialysis“ (SLED), die intermittierend verwendet und mit deutlich längeren Laufzeiten (bis zu 16 bis 24 Stunden) eingesetzt werden kann und daher potenziell Vorteile beider Verfahren vereinigt.
Wieviel? Ein weiterer wichtiger Punkt der KDIGO-Leitlinie betrifft die Frage der Dialyse-dosis. Seit eine Studie im Lancet 2000 nahegelegt hatte [17], dass eine höhere Hämofiltrationsdosis zu einem besseren Überleben besonders in der Sepsis führte, haben zwei große multizentrische Studien (ATN, RENAL [18, 19]) mit kumulativ fast 3.000 Patienten Effekte einer höheren Filtrations- oder Dialysedosis untersucht. Als Filtrationsdosis eines kontinuierlichen Verfahrens bezeichnet man die Menge des Ultrafiltrats und gegebenenfalls eines Dialysatflusses (bei Hämodiafiltrationen). Da sowohl die ATN- als auch die RENAL-Studie keine Vorteile für eine höhere Dosis (35 bzw. 40 ml/kg/h) zeigen konnten, empfiehlt KDIGO eine moderate Standarddosis von 20 bis 25 ml/kg/h, zumal bestimmte unerwünschte Wirkungen (zum Beispiel Nährstoffverluste, Antibiotika-clearance) darunter weniger ausgeprägt waren (1A). Zu berücksichtigen ist jedoch in der klinischen Praxis, dass die erreichte Filtrationsdosis aufgrund von zeitlichen Unterbrechungen oft geringer ist als die errechnete Dosis. Daher empfiehlt die ERBP-Arbeitsgruppe, eine etwas höhere Dosis anzusetzen (30 ml/kg/h). Bei den intermittierenden Verfahren zur AKI-Therapie wird die aus der chronischen Dialysetherapie gängige Formel Kt/V verwendet. Hier handelt es sich um eine einheitslose Kennzahl, die sich aus der Harnstoffclearance „K“, der Dialysezeit „t“ und des Verteilungsvolumens für Harnstoff „V“ errechnet und im chronischen Dialysebereich möglichst > 1,3 liegen sollte. Entsprechend empfiehlt KDIGO, die Dialysedosis immer festzulegen (1B) und ein Kt/V von 3,9/Woche (drei Dialysen x 1,3 Kt/V) zu erreichen (1A). Da eine Kt/V-Bestimmung in der Praxis vor allem bei Intensivpatienten kaum möglich erscheint, wird in den europäischen Kommentaren von diesem Vorgehen aber abgeraten. Ergebnisse aus früheren Arbeiten, die nahelegten, dass eine tägliche intermittierende Hämodialyse das Outcome der Patienten verbessert, konnten in der ATN-Studie ebenfalls nicht bestätigt werden. Dementsprechend wird die tägliche Hämodialyse als pauschale Maßnahme nicht empfohlen.

Professor Dr. Carsten Willam
Professor Dr. Stefan John
Professor Dr. Kai-Uwe Eckardt
Teilen:
Das könnte Sie auch interessieren: