Kardiologie – highlighted
 Kardiologie
Kardiologie
Die Kardiologie ist ein innovatives Fachgebiet, in welchem durch stetige technische Neuerungen sowohl umfassende diagnostische Möglichkeiten als auch zunehmend hochkomplexe minimalinvasive Eingriffe realisiert werden können. Diese umfassen koronarinterventionelle Maßnahmen, elektrophysiologische Prozeduren einschließlich der Devicetherapie (Herzschrittmachertherapie, implantierbare Defibrillatoren, Implantation von Eventrekordern etc.), die minimalinvasive Behandlung von Klappenerkrankungen sowie das Einbringen von Verschlusssystemen zur Vermeidung eines Schlaganfalls. Die drei nachfolgend dargestellten Fälle repräsentieren Beispiele eines abwendbaren gefährlichen Verlaufs (Fall 1), einer Notfallsituation (Fall 2) sowie einer häufigen Behandlungssituation (Fall 3), welche eine unerwartete Wendung nimmt.
Fall 1: „Paradoxer Effekt“ – ein abwendbarer gefährlicher Verlauf
Anamnese
Eine 74-jährige Patientin stellt sich fußläufig über die zentrale Notaufnahme des Rotkreuzklinikums München vor. Sie beklagt eine seit drei Tagen bestehende Ruhe- sowie Belastungsdyspnoe, Palpitationen und Schwindel. Ferner besteht eine Ruhe-Angina Pectoris (Ruhe-AP). Klinisch imponiert die Patientin blass und kaltschweißig. Aufgrund der Anamnese sowie des klinischen Aspektes wird sie gemäß Manchester-Triage-System als „rot“ kategorisiert („sofort“, 0 Min. Wartezeit) und umgehend ärztlich gesichtet.
Die erweiterte Anamnese der im Hause bekannten Patientin beinhaltet ein Asthma bronchiale, ein paroxysmales Vorhofflimmern mit Zustand nach Ablationsbehandlung vor 18 Monaten sowie eine Hypothyreose. Eine Koronare Herzkrankheit (KHK) wurde vor vier Jahren invasiv ausgeschlossen. Die medikamentöse Anamnese umfasst einen Protonenpumpenhemmer, Candesartan, L-Thyroxin und das NOAK Apixaban (neues orales Antikoagulans). Ferner wurde vor Kurzem bei einem Rezidiv von Vorhofflimmern eine Therapie mit dem Antiarrhythmikum Flecainid durch den behandelnden Internisten eingeleitet und im Verlauf auf die Maximaldosis (2 x 150 mg) ausdosiert.
Verlauf
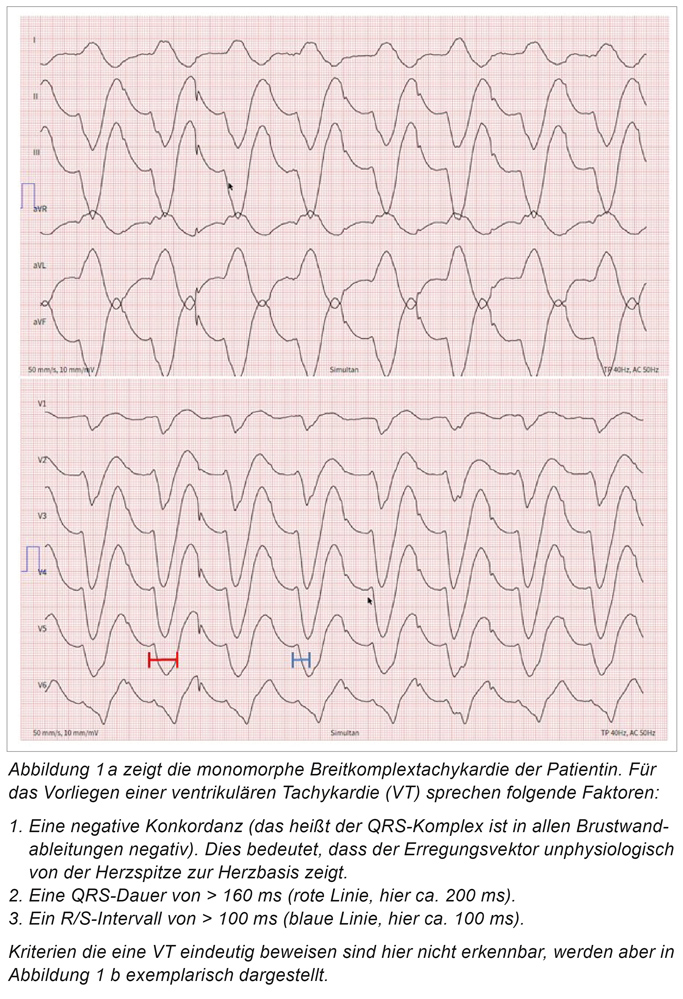
Die initial erhobenen Vitalparameter zeigen eine Hypotonie mit einem systolischen Blutdruck bei 70 mmHg, eine Tachykardie bei 100/min, eine Tachypnoe bei 18/min und eine unauffällige Körperkerntemperatur. Im 12-Kanal-EKG findet sich eine regelmäßige Breitkomplextachykardie mit einer Kammerfrequenz bei 100/min (Abbildung 1a). Die Abbildungen 1a und 1b erläutern in diesem Zusammenhang Kriterien, die bei einer Breitkomplextachykardie für das Vorhandensein einer ventrikulären Tachykardie (VT) sprechen bzw. diese beweisen. Folglich ist im geschilderten Fall differenzialdiagnostisch am ehesten von einer VT auszugehen. Die Notfallechokardiografie zeigt eine global hochgradig reduzierte linksventrikuläre Pumpfunktion. Mit der Arbeitsdiagnose „kardiogener Schock bei anhaltender ventrikulärer Tachykardie (slow VT)“ erfolgt noch in der Notaufnahme die externe Kardioversion in einen stabilen Sinusrhythmus ohne erkennbare ischämietypische Erregungsrückbildungsstörungen. Schon nach kurzer Zeit kommt es zu einer Normalisierung der hämodynamischen Situation, die Patientin ist jetzt nahezu beschwerdefrei. Laborchemisch kann eine diskrete Troponinerhöhung auf 224 ng/l sowie ein Anstieg des BNP-Wertes auf 682 ng/l (Referenzbereich < 100 ng/l) nachgewiesen werden.
Im weiteren Verlauf wird eine umfassende invasive und nichtinvasive Diagnostik der jetzt durchwegs stabilen Patientin durchgeführt. Koronarangiografisch kann erneut eine stenosierende KHK ausgeschlossen werden. Im Verlauf normalisiert sich die linksventrikuläre Funktion (LV-Funktion), sodass die zuvor hochgradig eingeschränkte Pumpfunktion am ehesten im Rahmen einer Tachymyopathie gewertet wird. In der elektrophysiologischen Untersuchung können keine anhaltenden supraventrikulären oder ventrikulären Tachykardien induziert werden. Die kardiale MRT-Untersuchung ist unauffällig.
Unter Zusammenschau der Gesamtsituation ergibt sich das Bild einer ventrikulären Tachykardie, am ehesten bei Proarrhythmie unter Flecainid-Therapie bei strukturell herzgesunder Patientin. Bei einem retrospektiven Abgleich der 12-Kanal-EKGs, vor und nach initiierter Flecainid-Therapie, lässt sich eine Zunahme der QRS-Dauer von 100 ms auf 140 ms (> 25 Prozent) bei unveränderter QTc-Zeit nachvollziehen. Die QTc-Zeit entspricht dabei der frequenzkorrigierten QT-Zeit und wird durch die Bazettformel berechnet. Aufgrund dessen wurde Flecainid bereits bei der Aufnahme abgesetzt. Eine Pulmonalvenen Re-Isolation bei initial erfolgreicher Ablationstherapie wird in Absprache mit dem hausärztlichen Internisten geplant.
Diskussion
Vorhofflimmern stellt die am häufigsten vorkommende anhaltende Herzrhythmusstörung dar [1]. Neben dem prognostisch relevanten potenziellen Risiko eines Schlaganfalls oder einer tachykardieinduzierten Kardiomyopathie schränkt diese Herzrhythmusstörung bei vielen Patienten die Lebensqualität in erheblichem Maße ein [2].
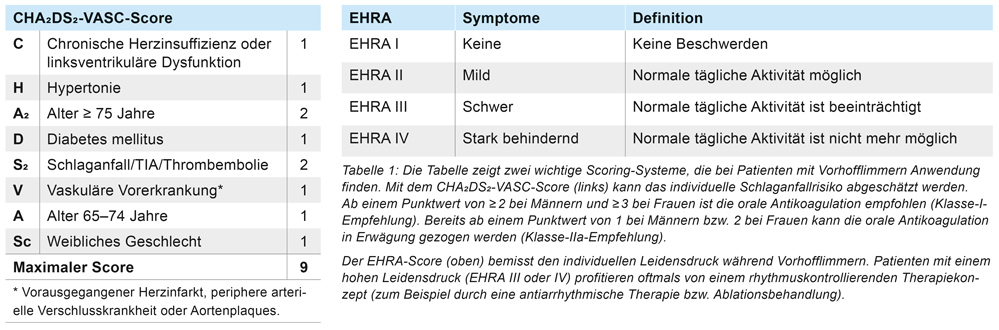
Im Rahmen der Therapieplanung ist zunächst die Indikation zur Einleitung einer oralen Antikoagulation gemäß dem CHA2DS2-VASC-Score (Tabelle 1) zu prüfen, unabhängig davon ob ein paroxysmales oder persistierendes Vorhofflimmern vorliegt. Im nächsten Schritt unterscheidet man zwischen einer rein „frequenzkontrollierenden Therapie“ bei asymptomatischen Patienten (gegebenenfalls orale Antikoagulantien – OAK – und Kontrolle der Herzfrequenz, zum Beispiel mittels Betablocker) versus einer „echten“ Rhythmuskontrolle des Vorhofflimmerns bei symptomatischen Patienten, falls diese nach Frequenznormalisierung nicht beschwerdefrei sind. Der individuelle Leidensdruck wird dabei über einen Score der European Heart Rhythm Association (EHRA-Score I–IV) [2] ermittelt (Tabelle 1). Eine Rhythmuskontrolle kann medikamentös (durch Antiarrhythmika) bzw. interventionell (durch eine Pulmonalvenen-isolation = PVI) erfolgen. Im vorliegenden Fall wurde bereits eine PVI durchgeführt. In manchen Fällen ist jedoch eine Re-PVI erforderlich, um eine effektive Rezidivprophylaxe sicherzustellen. Bei dieser Patientin wurde als alternative Option eine antiarrhythmische Therapie mit dem Klasse IC-Antiarrhythmikum Flecainid eingeleitet.
Flecainid ist ein langsam dissoziierender Natrium-Kanalblocker. Nach hepatischer Metabolisierung zu inaktiven Metaboliten wird das Medikament zu 95 Prozent renal ausgeschieden. Die Indikation umfasst supraventrikuläre Tachykardien (dabei insbesondere das Vorhofflimmern) sowie lebensbedrohliche ventrikuläre Tachykardien. Bei Vorhofflimmern erfolgt die Gabe als Dauertherapie zur Rezidivprophylaxe oder als Einmalgabe im Rahmen eines „pill in the pocket“ Prinzips zur Unterbrechung paroxysmaler Episoden. Durch die therapeutische Leitungsverlangsamung kann es zu einer Regularisierung von Vorhofflimmern mit Konversion in Vorhofflattern kommen. Hier besteht bei gleichzeitig positiv dromotroper Wirkung die Gefahr einer 1:1 AV-Überleitung (atrioventrikuläre Überleitung) und damit auch das Risiko lebensbedrohlich tachykarder Kammerfrequenzen. Daher sollte stets eine begleitende Therapie mit einem Betablocker erfolgen. Zudem können Antiarrhythmika, insbesondere aber die Klasse-I-Antiarrhythmika auch proarrhythmogene Effekte bis hin zu malignen ventrikulären Herzrhythmusstörungen, einhergehend mit einem plötzlichen Herztod, verursachen. Dies ist insbesondere der Fall bei Vorliegen einer strukturellen Herzerkrankung [3] (zum Beispiel LV-Hypertrophie, signifikante koronare Herzerkrankung bzw. bei Zustand nach Myokardinfarkt oder eingeschränkter LV-Funktion). Eine Proarrhythmie bei strukturell herzgesunden Patienten ist in seltenen Fällen ebenfalls möglich [4]. Daher sollten bei Einleitung einer Flecainid-Therapie bzw. Dosisänderung wiederholt EKG-Kontrollen durchgeführt werden. Bei einer Verlängerung der QRS-Dauer um mehr als 25 Prozent oder der PQ-Zeit um mehr als 50 Prozent bzw. einer QT-Verlängerung auf mehr als 500 ms oder einer Zunahme schwerwiegender Herzrhythmusstörungen sollte eine kritische Überprüfung der Therapienotwendigkeit erfolgen.
Im vorliegenden Falle wurde eine Ausdosierung des Klasse-I-Antiarrhythmikums auf die Maximaldosis mit einer erst post hoc nachgewiesenen Verlängerung der QRS-Dauer um ca. 25 Prozent vorgenommen. Möglicherweise hätte dieser Verlauf durch eine engmaschigere EKG-Kontrolle mit Beurteilung der QRS-Dauer und vorzeitigem Absetzen des Medikaments abgewendet werden können. Alternativ hätte bei initial erfolgreicher Ablationsbehandlung zunächst eine Pulmonalvenen Re-Isolation in Erwägung gezogen werden können.
Fall 2: „Todesursache COVID-19?“ – eine Notfallsituation
Anamnese
Ein 30-jähriger Patient wird während der COVID-19-Pandemie über den Rettungsdienst im Rahmen einer laufenden kardiopulmonalen Reanimation in den Schockraum unserer Klinik eingeliefert. Fremdanamnestisch habe er sich seit drei Tagen krank gefühlt. Die Mutter des Patienten berichtet, er habe die letzten Tage über Husten, Diarrhoen und hohes Fieber (bis 40° C) jedoch nicht über Dyspnoe geklagt. Ca. 30 Minuten nach dem letzten Patientenkontakt wird dieser von der Mutter leblos auf dem Boden liegend vorgefunden. In der erweiterten Anamnese ist in der Familie ein Brugada-Syndrom (primär angeborene Kardiomyopathie) bekannt. Der Vater des Patienten wurde aufgrund dessen bereits mit einem implantierbaren Kardioverter-Defibrillator (ICD) versorgt, ein Cousin des Patienten sei im Rahmen eines plötzlichen Herztodes verstorben.
Verlauf
Aufgrund des jungen Alters wird der Patient unter fortgesetzten Reanimationsmaßnahmen über den herbeigerufenen Notarzt in den Schockraum verbracht. Hier zeigt sich nach ausgedehnten Reanimationsbemühungen eine Asystolie. Echokardiografisch sind keine relevanten Rechtsherzbelastungszeichen als indirekter Ausdruck einer Lungenembolie erkennbar (was diese nicht sicher ausschließt). Nach Reanimationsbemühungen über eine Stunde Dauer, einem pH-Wert von 6,5 und fehlendem ROSC (Return of spontaneous circulation – Rückkehr eines Spontankreislaufes) werden die Reanimationsmaßnahmen bei infauster Prognose im Konsens eingestellt. Später finden sich laborchemisch deutlich erhöhte D-Dimere, ein Kaliumwert bei 8,0 mmol/l, ein leicht erhöhtes Troponin sowie deutlich erhöhte Transaminasen und LDH-Werte. Alle Parameter sind vermutlich im Rahmen der lang anhaltenden Reanimationsmaßnahmen zu werten. Das Drogenscreening ist negativ.
Diskussion
Die Todesursache des Patienten ist letztlich unklar. Bei einem anamnestischen Hinweis auf ein akutes Infektgeschehen, differenzialdiagnostisch bei COVID-19 (Fieber, Husten, Diarrhoe) erscheint ein respiratorisches Versagen als unmittelbare Todesursache unwahrscheinlich, da der Verlauf eher auf einen plötzlichen Herztod (PHT) hindeutet. Dieser könnte zum Beispiel infolge einer akuten infektassoziierten Myokarditis aufgetreten sein. Bei vorliegender Anamnese ist jedoch noch eine weitere Differenzialdiagnose zulässig: in der Familie des Patienten ist ein Brugada-Syndrom anamnestizierbar. Dabei ist bekannt, dass insbesondere hohes Fieber zum Beispiel im Rahmen eines viralen Infekts das Auftreten maligner Herzrhythmusstörungen bei Patienten mit einem Brugada-Syndrom begünstigen kann [5].
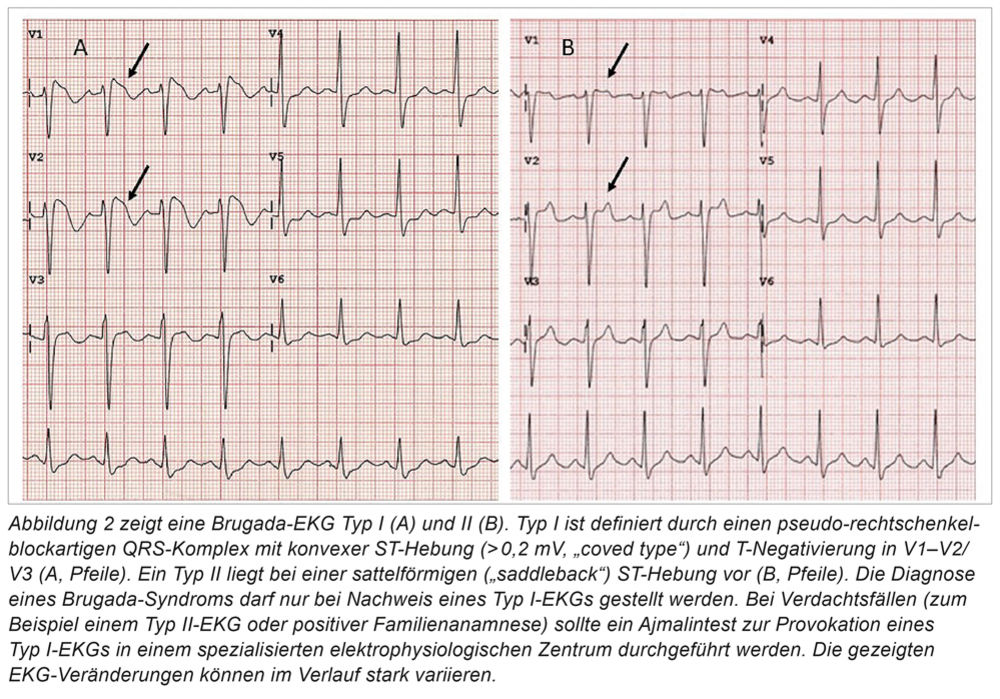
Beim Brugada-Syndrom handelt es sich um eine autosomal-dominant vererbte Ionenkanalerkrankung mit variabler Penetranz. Die Prävalenz eines Brugada-typischen EKGs wird zwischen 0,1 und 1 Prozent angegeben, wobei Männer zwei bis neun Mal häufiger betroffen sind. Das Brugada-Syndrom ist eher selten [6]. Bei bis zu 30 Prozent der Patienten liegt ein Defekt des SCN5A- und/oder SCN10A-Gens vor [7]. Aufgrund des hereditären Ionenkanaldefekts werden insbesondere die Transporteigenschaften der kardialen Natrium- und Kaliumkanäle beeinflusst, was die elektrischen Leitungseigenschaften des ventrikulären Myokards (Heterogenität der Refraktärperiode benachbarter Myozyten) verändert. Dieser Umstand bildet zum Zeitpunkt der Repolarisation das Substrat für potenziell maligne ventrikuläre Herzrhythmusstörungen wie zum Beispiel Kammerflimmern. Phänotypisch können die ansonsten strukturell herzgesunden Patienten entweder nur durch spezifische diagnosebildende EKG-Veränderungen (Abbildung 2) oder auch durch maligne ventrikuläre Herzrhythmusstörungen einhergehend mit Synkopen und/oder einem PHT imponieren. Wichtig ist daher zwischen einem Brugada-typischen EKG ohne Klinik („Brugada pattern“) und einem Brugada-Syndrom zu differenzieren. Bei Letzterem kommt es neben den typischen EKG-Veränderungen auch zu malignen Kammertachykardien mit entsprechender Klinik. Der regelhaften Risikostratifizierung kommt somit eine besondere Bedeutung zu, da das Auftreten maligner ventrikulärer Herzrhythmusstörungen im Verlauf bei initial asymptomatischen Patienten möglich ist. Es gilt auch zu beachten, dass die typischen EKG-Veränderungen oft undulierend auftreten und somit verkannt werden können. Fieber, Kokain bzw. die Gabe von Klasse-I-Antiarrhythmika (zum Beispiel Ajmalin) können ein Brugada-EKG erst als solches erkennbar machen bzw. eine Konversion von einem Brugada-Typ II-EKG zu einem Brugada-Typ I-EKG bedingen (Abbildung 2). Diesen Effekt macht man sich im Rahmen eines „Ajmalin-Tests“ zu Nutze, um die Diagnose zu untermauern. Prädiktoren für eine erhöhte Mortalität sind vor allem Synkopen sowie der Nachweis anhaltender ventrikulärer Tachykardien bzw. ein überlebter PHT. Prädiktoren zweiter Ordnung sind Vorhofflimmern, männliches Geschlecht sowie eine positive Familienanamnese im Hinblick auf einen PHT. Die genetische Analyse liefert zur Risikostratifizierung keine valide Aussage. Auch die elektrophysiologische Untersuchung wird kontrovers diskutiert, wobei die Induktion von malignen Kammertachykardien bei asymptomatischen Patienten einen Hinweis auf ein erhöhtes PHT-Risiko geben kann [8].
Bei Hochrisikopatienten sollte ein ICD implantiert werden. Bei asymptomatischen Patienten mit Brugada-typischen EKG-Veränderungen sind Verlaufsbeurteilungen sowie die Vermeidung von zum Beispiel Fieberspitzen im Rahmen eines Infekts durch eine frühzeitige antipyretische Therapie sinnvoll. Ferner ist darauf zu achten, dass diverse Medikamente kontraindiziert sind, da hierdurch das Auftreten von Kammerflimmern begünstigt werden kann. Daher sollte die Medikation dieser Patienten kritisch geprüft werden (entsprechende Listen mit kontraindizierten Medikamenten sind ähnlich wie beim Long-QT-Syndrom im Internet verfügbar). Die Gabe von Chinidin hingegen kann die Rezidivhäufigkeit von Kammerflimmern minimieren und wird zum Beispiel bei rezidivierenden Schockabgaben durch einen ICD bei Brugadapatienten eingesetzt. Familienangehörige ersten Grades müssen bei der Diagnose eines Brugada-Syndroms entsprechend evaluiert werden.
Im genannten Fall zeigt sich im Nachgang die PCR bezüglich COVID-19 negativ. Dennoch besteht die differenzialdiagnostische Möglichkeit eines durch Fieber getriggerten PHT bei Brugada-Syndrom. Der Patient wurde soweit bekannt nicht als Hochrisikopatient identifiziert und daher nicht mit einem ICD versorgt.
Fall 3: „Unerwartete Wendung“ – bei einer häufigen Behandlungssituation
Anamnese
Ein 51-jähriger bis dato gesunder Patient stellt sich über den hausärztlichen Kollegen zur weiterführenden stationären Abklärung am Rotkreuzklinikum München vor. In den vergangenen zwei Tagen war es zu rezidivierenden Synkopen mit Verdacht auf eine rhythmogene Genese gekommen. Anderweitige kardiovaskuläre Beschwerden werden verneint. Der Patient beklagt jedoch eine ausgeprägte Fatigue-Symptomatik.
Verlauf
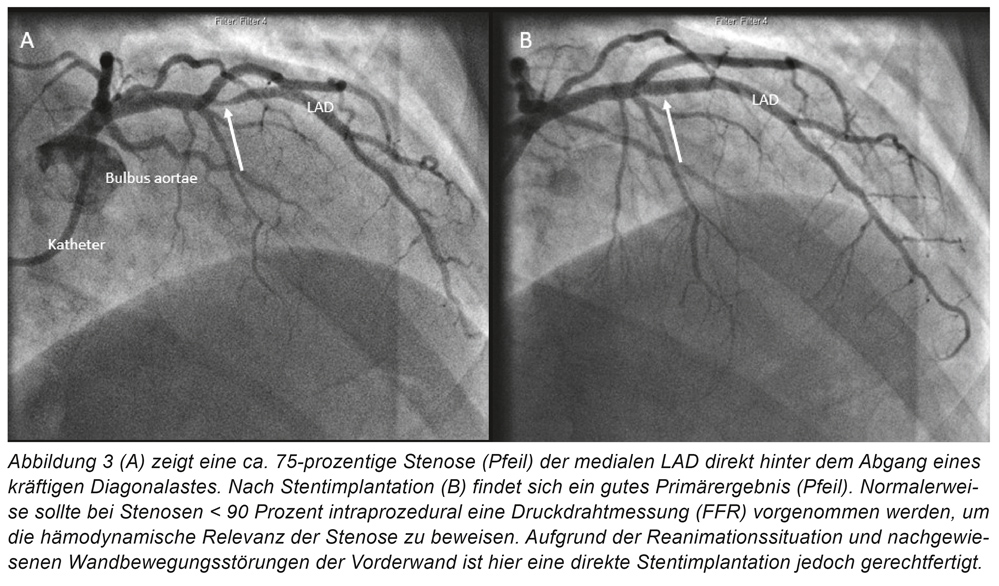
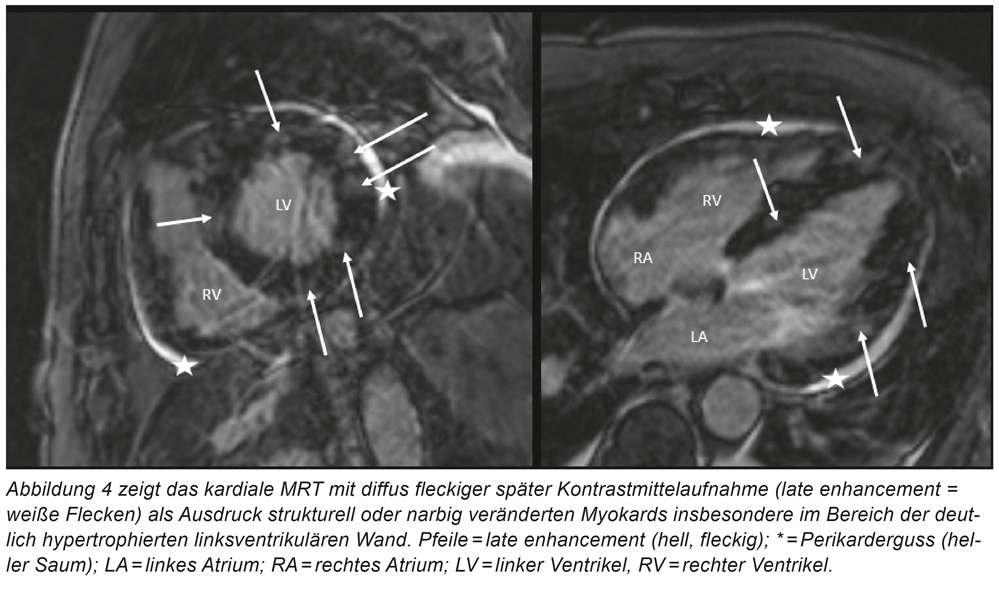
Bei anamnestisch kurz aufeinanderfolgenden Synkopen mit Verdacht auf rhythmogene Genese wird der Patient zunächst telemetrisch überwacht. Echokardiografisch zeigt sich eine mittelgradig eingeschränkte linksventrikuläre Pumpfunktion sowie eine deutliche konzentrische Hypertrophie mit angedeuteten Wandbewegungsstörungen der Vorderwand. Stunden nach der Aufnahme kommt es plötzlich zu Kammerflimmern, der Patient wird erfolgreich reanimiert. Es erfolgt eine notfallmäßige Herzkatheteruntersuchung. Hier wird eine höhergradige Stenose der medialen LAD („left anterior descending“; „Ramus interventricularis anterior“) mit einem Drug-Eluting-Stent (DES) versorgt (Abbildung 3). Zunächst könnte somit von einer häufigen Behandlungssituation im Sinne einer arrhythmogen bedingten Synkope bei Vorderwandischämie ausgegangen werden. Allerdings wird angezweifelt, ob die gezeigte Stenose tatsächlich für die polymorphen Kammertachykardien verantwortlich ist. Aufgrund dessen wird eine ergänzende kardiale MRT-Diagnostik geplant, welche eine diffuse Hypertrophie des Myokards mit früher Kontrastmittelaufnahme und einem ubiquitären punktförmigen „late enhancement“ zeigt (Abbildung 4). Auch im Verlauf kommt es wiederholt zu polymorphen Kammertachykardien woraufhin eine Aufsättigung mit Amiodaron und bei jetzt rhythmusstabiler Situation eine ICD-Implantation erfolgt. Ferner wird eine kathetergestützte Myokardbiopsie aus dem linken Ventrikel entnommen. In der initialen immunhistologischen Begutachtung zeigen sich Hinweise auf eine fokal granulomatöse Entzündung mit aktivierten Makrophagen und T-Lymphozyten, sodass jetzt von einer kardialen Sarkoidose ausgegangen und mit einer Prednisolon-Therapie begonnen wird.
Innerhalb von vier Wochen verschlechtert sich der Allgemeinzustand des Patienten dramatisch. Neben einer progredienten Herzinsuffizienz finden sich nun polypoide malignomsuspekte Wucherungen im Bereich der dorsalen Harnblasenwand sowie multiple disseminierte pulmonale und auch subkutane Noduli. Dabei ist das ganze Integument des Patienten knotig durchsetzt. Histopathologisch wird jeweils ein mesenchymales Malignom mit aberranter Keratinexpression, differenzialdiagnostisch ein epitheloides Sarkom nachgewiesen. In der Nachbefundung der myokardialen Histologie kann nun auch kardial ein entsprechender Befund erhoben werden. Nach kurzem Krankheitsverlauf verstirbt der Patient im Rahmen einer Palliativsituation.
Diskussion
Zusammenfassend findet sich ein metastasiertes Malignom mit intramyokardialer Beteiligung. Bei Aufnahme dominieren die kardialen Symptome. Die eigentliche Ursache wurde anfänglich verkannt, da eine häufige Behandlungssituation „ventrikuläre Herzrhythmusstörung bei myokardialer Ischämie“ differenzialdiagnostisch abbildbar ist.
Primäre Herztumoren sind insgesamt selten, das gutartige intrakavitär wachsende Myxom stellt hier gefolgt vom papillären Fibroelastom die häufigste Entität dar [9]. Zu den malignen Erkrankungen des Herzens zählt das Sarkom sowie weit häufiger eine myokardiale Metastasierung, die bei einem von fünf Patienten, welche an einem Krebsleiden versterben, im Rahmen der Obduktion gefunden wird [10]. Diese kann bei zunächst rein kardialen Symptomen unentdeckt bleiben. Im vorliegenden Fall wird erst durch das Herz-MRT der eigentliche Mechanismus für die malignen Herzrhythmusstörungen aufgezeigt. Bei ausgeprägter Hypertrophie sowie einem diffusen „late enhancement“ kommen neben einem Malignom differenzialdiagnostisch insbesondere die Sarkoidose aber auch Speichererkrankungen wie die kardiale Amyloidose, Hämochromatose oder ein Morbus Fabry in Betracht. Ferner stellt die hypertrophe Kardiomyopathie als hereditäre Erkrankung eine wichtige Differenzialdiagnose bei linksventrikulärer Hypertrophie dar. Bei progredienter Herzinsuffizienz und malignen Rhythmusstörungen ist die Myokardbiopsie zur Diagnosesicherung angezeigt. Erst durch den dramatischen Krankheitsverlauf mit Nachweis eines mesenchymalen Tumors konnte hier auch eine myokardiale Metastasierung nachgewiesen werden. Vor dem Hintergrund einer malignen Erkrankung mit in dieser Konstellation geringer Lebenserwartung (< 1 Jahr) ist im Nachhinein die ICD-Implantation kritisch zu bewerten. Diese erfolgte allerdings in Unkenntnis der metastasierenden Tumorerkrankung und infausten Prognose. Bei der koronaren Eingefäßerkrankung handelt es sich am ehesten um einen nicht relevanten „Bystander“.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Der Autor erklärt, dass er keine finanziellen oder persönlichen Beziehungen zu Dritten hat, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
Der erste Fall verdeutlicht, dass die medikamentöse antiarrhythmische Therapie trotz technischer Neuerungen in der Kardiologie weiterhin eine wichtige Rolle mit entsprechender Tragweite einnimmt. Dies beinhaltet insbesondere auch potenzielle therapieassoziierte Komplikationen.
Der zweite Fall zeigt, dass eine umfassende Risikostratifizierung gerade bei jungen Patienten mit Familienanamnese eines plötzlichen Herztodes von großer Bedeutung ist, diese jedoch nicht immer einen fulminanten Verlauf verhindert.
Der dritte Fall demonstriert, wie sich eine komplexe Systemerkrankung hinter dem Bild einer häufigen kardiologischen Behandlungssituation verbergen kann.
Autor

Professor Dr. Christian von Bary
Chefarzt, Medizinische Klinik I, Rotkreuzklinikum München – Akademisches Lehrkrankenhaus der Technischen Universität München, Tel. 089 1303-2501, Fax 089 1303-2508, E-Mail: christian.vonbary(at)swmbrk.de
Teilen:
Das könnte Sie auch interessieren: