Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms

Brustkrebs ist die häufigste Krebserkrankung der Frau in der westlichen Welt. Insgesamt erkranken ca. 70.000 Frauen jährlich alleine in Deutschland [1] und ein Drittel dieser Frauen wird an der Erkrankung versterben. Trotz massiver Weiterentwicklung der Früherkennung, der Diagnostik, der Therapie und der Nachsorge stellt Brustkrebs weiterhin die häufigste Todesursache bei Frauen weltweit dar. Ziel der Leitlinie ist die Optimierung der medizinischen Versorgung durch Vermittlung von aktuellem Wissen, evidenz- und konsensbasiert, und folgend eine Senkung der Mortalität und Erhöhung der Lebensqualität.
Die aktuelle Leitlinie zum Mammakarzinom der Frau wurde am 2. Juli 2012 erstellt und ist bis zum 30. Juni 2017 gültig [2].
Der wesentliche Inhalt der Leitlinie beschäftigt sich mit der Diagnostik, der operativen Versorgung, der Arzneimitteltherapie, der Strahlentherapie und der Nachsorge, aber auch Empfehlungen zu komplementärmedizinischen Maßnahmen und zur psychosozialen Betreuung von Brustkrebspatientinnen finden hier ihren Stellenwert. Die im Text verwendeten Abkürzungen finden Sie erklärt in unserem Glossar.
Diagnostik des Mammakarzinoms
Zur Senkung der Mortalität stellen die Früherkennung (Sekundärprävention) und eine Verbesserung der Therapie den erfolgversprechendsten Ansatz dar. Ziel der Früherkennung ist es, die Anzahl höhergradiger Tumorstadien, das heißt fortgeschrittener Brustkrebs mit Lymphknotenbefall oder metastasierte Situationen, zu verringern und Brustkrebs in frühem, kurativem Stadium zur erkennen. Dies verspricht bessere Heilungschancen auf der einen Seite und den Erhalt der Integrität der Frau durch schonendere operative Maßnahmen auf der anderen Seite.
In diesem Zusammenhang wird immer wieder der Nutzen eines flächendeckenden Mammografie-Screenings diskutiert. Die Leitlinie nimmt hierzu eindeutig Stellung, basierend auf dem Empfehlungsgrad A und Level of Evidence (LoE) 1a, sprich dem höchsten Empfehlungsgrad (siehe hierzu auch Artikel „Leitlinien in der klinischen Praxis – Erkennen, worauf es ankommt“ Bayerisches Ärzteblatt 1-2/2015), wie folgt: „Qualitätsgesichertes Mammografie-Screening in zweijährigen Abständen bei Frauen zwischen 50 und 70 Jahren ist zur Früherkennung des Mammakarzinoms geeignet. Die Mammografie ist zurzeit die einzige für die Erkennung von Brustkrebsvorstufen oder frühen Tumorstadien allgemein als wirksam anerkannte Methode.“ [3].
Kritisch ist vor allem eine mögliche Übertherapie von Krebsvorstufen, dem duktalen Carcinoma in situ (DCIS), zu sehen, dessen vermehrte Diagnose zu keiner Reduktion der Inzidenz der invasiven Formen führt [4]. Konkret heißt das: eine 68-jährige Patientin, bei welcher im Rahmen des Mammografie-Screenings eine vier Millimeter große Vorstufe diagnostiziert und operiert wird, wäre an diesem Befund auch ohne Entfernung und Folgetherapie nicht verstorben.
Ein besonderes Augenmerk gilt Patientinnen in einer Hochrisikosituation. Das sind zum Beispiel Frauen mit einer positiven Familienanamnese mit Vorliegen einer genetischen Mutation, zum Beispiel innerhalb des BRCA-1- oder BRCA-2-Gens, oder Patientinnen, welche an einem Lymphom erkrankt waren und im Rahmen dieser Erkrankung eine Bestrahlung der Thoraxregion erhalten haben. Diese Ratsuchenden müssen einer intensivierten Früherkennung [5] an spezialisierten Brustkrebszentren zugeführt werden. Diese beinhaltet eine risikoadaptierte Diagnostik mittels Palpation alle sechs Monate durch den Arzt ab dem 25. Lebensjahr bzw. fünf Jahre vor dem frühesten Erkrankungsalter in der Familie, einen Brustultraschall alle sechs Monate, eine Mammografie alle zwölf Monate ab dem 30. Lebensjahr (bei hoher Brustdrüsendichte ab dem 35. Lebensjahr) und eine Kernspinuntersuchung der Brust alle zwölf Monate bis zum 55. Lebensjahr.
Folgende diagnostische Methoden stehen neben der Anamnese und der klinischen Untersuchung zur Verfügung:
» Mammografie, inklusive Zusatzaufnahmen (zum Beispiel Vergrößerung, Tomosynthese),
» Sonografie mit Hochfrequenzsonden,
» interventionelle Methoden wie Stanzbiopsie und Vakuumbiopsie,
» Magnetresonanztomografie (MRT) mit Kontrastmittelgabe in gesonderten Einzelfällen,
» Galaktografie, das heißt die röntgenologische Darstellung der Milchgänge nach Kontrastmittelgabe,
» in speziellen Einzelfällen die Feinnadelpunktion (zum Beispiel Lymphknotenpunktion der Axilla).
Ziel oben genannter Untersuchung ist die Abklärung suspekter Befunde und die Gewinnung einer Histologie. Bildbeispiele sind in Abbildungen 1 a bis d dargestellt. Im Rahmen der prätherapeutischen Diagnostik erfolgt die Festlegung eines TNM-Stadiums, welches als Grundlage der weiteren Therapieplanung dient. Hierzu gehört auch das Staging, das heißt die gezielte Untersuchung der Patientin auf Metastasen der Knochen, Lunge und Leber, mittels Röntgen-Thorax, Abdomen-Sonografie und Skelett-Szintigrafie. Schematisch ist der Behandlungsablauf in Abbildung 2 dargestellt.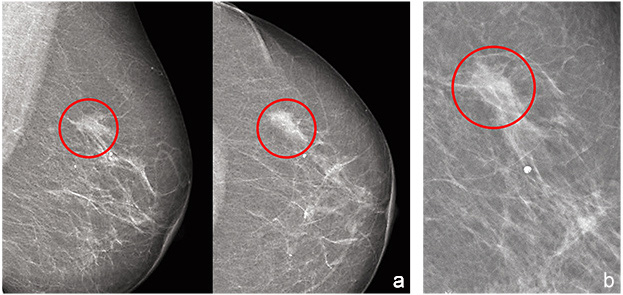
Abbildung 1 a: Mammografie in medio-latero-oblique (links) und craniocaudal (rechts) Orientierung, Tumor markiert. Abbildung 1 b: Zusatzaufnahme Spot-Vergrößerungsaufnahme.
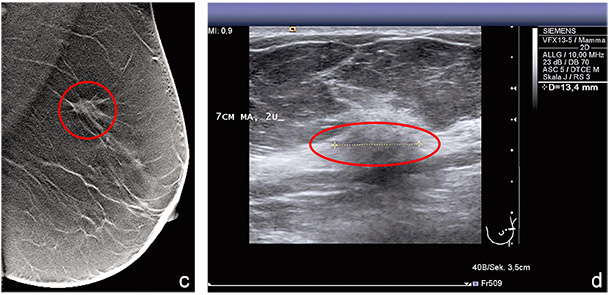
Abbildung 1 c: Zusatzaufnahme Tomosynthese in medio-lateral. Abbildung 1 d: Sonografie.
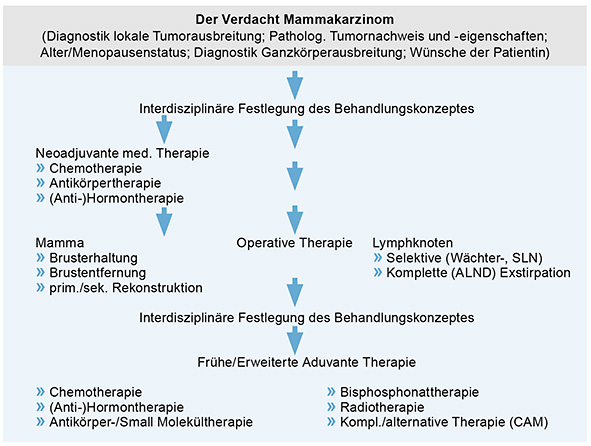
Abbildung 2: Algorithmus des Behandlungsablaufes.
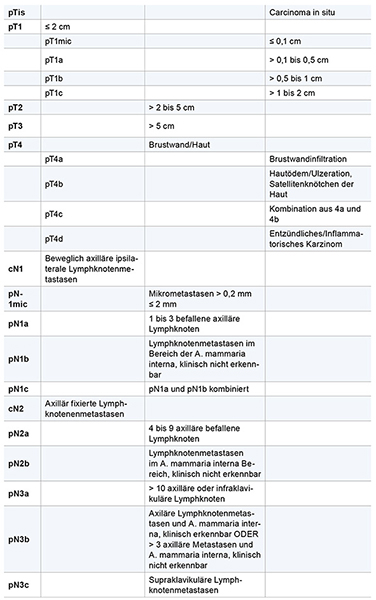
Tabelle: TNM-Klassifikation maligner Tumoren [18].
Therapie
Die Therapie des Mammakarzinoms basiert im Wesentlichen auf einer lokalen Komponente, hierzu gehört die Operation und die Strahlentherapie, und einer systemischen Komponente, bestehend aus Chemotherapie, Antihormontherapie, Antikörpertherapie, zielgerichteter Therapie und Osteoonkologika. Als Grundlage dienen das ermittelte Tumorstadium und die histopathologischen Informationen, inklusive Immunhistologie. Ein Behandlungskonzept sollte im Rahmen eines interdisziplinären Tumorboards erstellt werden, um jeder Patientin ein Maß an Qualität und das bestmögliche Behandlungskonzept zu bieten. Dies ist in der aktuellen Version der Leitlinie nicht explizit erwähnt, allerdings Teil der Voraussetzung zertifizierter Brustzentren, um zentrumsübergreifend leitlinienkonforme, interdisziplinäre Behandlungskonzepte zu garantieren.
Operation
Ziel der operativen Therapie ist die Tumorentfernung, dabei ist eine brusterhaltende Therapie (BET) – siehe Abbildung 3 – mit nachfolgender Bestrahlung einer modifiziert radikalen Mastektomie (MRM) in Bezug auf das Überleben gleichwertig [6]. Eine präoperative Beratung der Patientin sollte gemeinsam mit dem Operateur erfolgen, um Möglichkeiten und Limitationen einer Operation der Patientin zu erläutern und die Patientin gemäß ihrer Wünsche kompetent beraten zu können. Hierzu gehört auch die Beratung über rekonstruktive Maßnahmen mittels Fremd- bzw. Eigengewebe, wenn von einer brusterhaltenden Therapie Abstand genommen werden muss, zum Beispiel bei einem inflamma-torischen Mammakarzinom, Nichterreichen eines R0-Status trotz Nachresektion oder Ablehnung einer Strahlentherapie durch die Patientin, und eine Mastektomie notwendig wird.
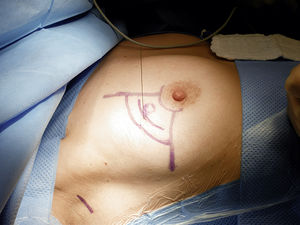
Abbildung 3: OP-Situs einer brusterhaltenden Segmentresektion nach Drahtmarkierung rechts.
Zu der Operation gehört neben der Entfernung des Tumors der Brust die Bestimmung des histologischen Nodalstatus (pN) der Axilla. Im Laufe der Jahrzehnte und mit zunehmendem Verständnis der Erkrankung als Systemerkrankung kam es hier zum Paradigmenwechsel – weg von einer kompletten Axilladissektion hin zu schonenden Methoden. Bei palpatorisch unauffälliger Axilla (cN0) ist die Sentinelbiopsie die OP-Technik der Wahl und hinsichtlich der lokalen Kontrolle bei tumorfreiem Wächterlymphknoten einer Axilladissektion gleichwertig [7]. Hierbei wird der erste und zum Teil nachgeschaltete Lymphknoten im Lymphabflussgebiet mittels radioaktiv markierter Tracer und Blaumarkierung detektiert und selektiv entfernt ohne eine komplette Ausräumung der Axilla. Die Frage nach der Notwendigkeit einer kompletten Axilladissektion bei tumorbefallenden Wächterlymphknoten ist Inhalt vieler Expertendiskussionen. Die Veröffentlichung der ACOSOG Z0011-Studie weist eventuell den Weg zu einem noch schonenderen Vorgehen [8], auch wenn diese Daten kritisch zu betrachten sind und Teile des Effekts durch die tangentiale Erfassung der Axilla bei der Bestrahlung der Brust zu erklären sind.
Postoperative Strahlentherapie
Bei invasivem Karzinom soll eine Bestrahlung der betroffenen Brust nach brusterhaltender Operation durchgeführt werden (Empfehlungsgrad 1, LoE 1a). Dies geschieht durch eine perkutane Homogenbestrahlung. Hierdurch wird die Verbesserung der lokalen Tumorkontrolle gewährleistet und es kommt zu einer Verbesserung des Gesamtüberlebens [9], am ehesten durch die Vermeidung der Entstehung von Lokalrezidiven. Des Weiteren sollte eine Dosisaufsättigung, eine sogenannte Boost-Bestrahlung des Tumorbettes erfolgen, welche die lokale Rezidivrate senkt (Empfehlungsgrad A, LoE 1a) [10]. Nachweislich ist dieser Effekt vor allem bei jüngeren Patientinnen und Frauen mit erhöhtem Lokalrezidivrisiko. Zur Boost-Bestrahlung kommen folgende Methoden zum Einsatz: Multikatheter- oder Ballonkathetertechniken, dreidimensionale konformale perkutane sowie intraoperative Bestrahlungen in Form von Photonen, Elektronen und interstitieller Bestrahlungsformen.
Die hypofraktionierte Bestrahlung hat in der aktuellen Leitlinie noch keinen größeren Stellenwert gefunden. Obwohl im Ausland bereits als Standard geführt, wird in Deutschland dieses Thema derzeit in verschiedenen Fachgesellschaften noch kontrovers diskutiert. Die Daten der START-Studie, einer prospektiv randomisierten Studie, konnten einen Trend hinsichtlich einer verbesserten lokoregionären Kontrolle nachweisen [11]. Die Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) bewertet diese Bestrahlungsart mit einer Doppelempfehlung in ihren aktuellen Empfehlungen.
Medikamentöse Therapie in der Adjuvanz
Für jede Frau mit einem invasiven Mammakarzinom muss ein individuelles Konzept erstellt werden, welches auf die Tumorbiologie abgestimmt ist. Dieses beinhaltet unter anderem eine systemische Therapie in Form einer Antihormontherapie, Chemotherapie und Antikörpertherapie oder einer Kombination bzw. einer Sequenz dieser Therapieformen vor einer kurativen Operation (neoadjuvant) oder nach der Operation (adjuvant). Durch die systemische Therapie können Rezidivrate und Mortalität in Abhängigkeit der Risikokonstellation gesenkt werden. Bei der Indikation der Therapiemaßnahmen sind Komorbiditäten, Allgemeinzustand und Wunsch der Patientin zu berücksichtigen, das kalendarische Alter sollte hierbei keine Rolle spielen und eine ältere Patientin sollte eine den jüngeren Patientinnen vergleichbare systemische Therapie erhalten (Empfehlungsgrad B, LoE 1a – siehe hierzu auch Artikel „Leitlinien in der klinischen Praxis – Erkennen, worauf es ankommt“ Bayerisches Ärzteblatt 1-2/2015). Zu der Erstellung des Gesamtkonzeptes gehört bei prämenopausalen Frauen mit noch nicht abgeschlossener Familienplanung ebenfalls die Aufklärung über fertilitätserhaltende Maßnahmen vor einer Chemotherapie.
Indikationen für eine Chemotherapie sind:
» HER2-positive Tumoren, neben der zielgerichteten Therapie mit Trastuzumab ist hier die Kombination mit einer (neo-)adjuvanten Chemotherapie Standard,
» Rezeptornegative Tumoren,
» Nodal-positive Erkrankung,
» wenig differenzierte Tumoren (G3),
» junges Erkrankungsalter (< 35 Jahre).
Die adjuvante Chemotherapie sollte ein Taxan enthalten. Eine anthrazyklin- und taxanhaltige adjuvante Standard-Chemotherapie dauert 18 bis 24 Wochen (Empfehlungsgrad B, LoE 1b). Bei Patientinnen mit hohem Risiko (≥ vier befallene Lymphknoten) ist eine dosisintensivierte, dosisdichte Chemotherapie Standard [12].
Indikation für eine Trastuzumab-Therapie sind HER2-überexprimierende Tumoren ≥ 1 cm (Empfehlungsgrad A, LoE 1b). Voraussetzung ist die qualitätsgesicherte Bestimmung des HER2-Status durch die Pathologie. Durch den Einsatz von Trastuzumab kann die Rezidivrate bei HER2-überexprimierenden Tumoren um 45 bis 50 Prozent gesenkt und die Mortalität um ca. 30 Prozent gesenkt werden [13]. Eine Verbesserung des Gesamtüberlebens erfolgt allerdings nur bei einer simultanen Kombination mit einer Chemotherapie [14]. Unter den Experten wird eine Gabe der gezielten Therapie bereits bei Tumoren unter 1 cm Größe empfohlen, da es laut Zulassung in der Adjuvanz einer Kombination mit Chemotherapie bedarf. Hier wird allerdings bei kleinen Tumoren die Gabe einer Monochemotherapie, zum Beispiel mit Paclitaxel diskutiert.
Bei Patientinnen mit einem hormonrezeptorpositivem Mammakarzinom ist eine endokrine Behandlung indiziert (Empfehlungsgrad A, LoE 1a). Diese soll erst nach Abschluss der Chemotherapie begonnen werden (Empfehlungsgrad A, LoE 1a) und wird in Abhängigkeit des Menopausenstatus festgelegt. Bei prämenopausalen Patientinnen wird laut Leitlinie eine Antihormontherapie mit Tamoxifen 20 mg/d über fünf Jahre empfohlen. Anhand der Daten der aTTom-Studie und der ATLAS-Studie konnte gezeigt werden, dass eine zehnjährige adjuvante Therapie trotz erhöhter Inzidenz des Endometriumkarzinoms zu einer Verbesserung des rezidivfreien und des brustkrebsspezifischen Überlebens führt [15]. In ganz aktueller Diskussion ist der Einsatz von Aromataseinhibitoren (AI) in Kombination mit einer Ovarsupression für fünf Jahre bei sehr jungen Patientinnen unter 35 Jahren aufgrund der TEXT/SOFT-Studiendaten [16]. Bei der postmenopausalen Frau sind Aromatasehemmer dem Tamoxifen hinsichtlich des krankheitsfreien Überlebens überlegen. Laut Expertenmeinung (GCP) können folgende Therapieschemata zum Einsatz kommen:
» fünf Jahre Tamoxifen,
» fünf Jahre AI,
» zwei bis drei Jahre Tamoxifen gefolgt von AI bis zu einer Gesamtdauer von fünf Jahren,
» zwei bis drei Jahre AI gefolgt von Tamoxifen bis zur einer Gesamtdauer von fünf Jahren,
» fünf Jahre Tamoxifen gefolgt von fünf Jahren AI.
Eine erweiterte Antihormontherapie mit AI über fünf Jahre hinweg wird bei Patientinnen in der Risikosituation diskutiert, allerdings sind hier die Nebenwirkungen gegenüber dem Nutzen mit jeder einzelnen Patientin im Dialog zu klären.
Ein weiteres viel diskutiertes Thema ist der Einsatz der Bisphosphonate in der adjuvanten Therapiesituation. In der Leitlinie wird auf die AGO-Empfehlungen verwiesen, welche auch in der aktuellen Version die Verwendung der Bisphosphonate bei der postmenopausalen Frau in Form von Zoledronat intravenös alle sechs Monate aufgrund der Ergebnisse der ZoFAST-Studie empfiehlt.
Zwei Drittel aller Patientinnen können mit oben genannten Therapien geheilt werden. In fünf bis zehn Prozent der Fälle treten nach brusterhaltender Operation mit konsekutiver Bestrahlung Lokalrezidive auf, welche weiterhin eine kurative Situation darstellen, solange keine Fernmetastasierung aufgetreten ist. Prognostische Faktoren für das Auftreten eines Rezidivs sind Anzahl der befallenen Lymphknoten, Tumorgröße, Grading, Rezeptorstatus, Resektionsstatus und Fokalität. Eine komplette Exzision des Rezidivtumors ist anzustreben.
Zur Wertigkeit der postoperativen Systemtherapie bei lokoregionalen Rezidiven wird in der Leitlinie noch auf fehlende Daten bezüglich des Gesamtüberlebens verwiesen. Dies ist mittlerweile durch Veröffentlichung der CALOR-Studie überholt, sodass Patientinnen nach erfolgreicher Operation eines Lokalrezidivs zu einer Chemotherapie geraten werden muss, vor allem bei Patientinnen mit hormonrezeptor-negativen Karzinomen [17].
Sobald Fernmetastasen vorliegen, ist eine Langzeitheilung nur in wenigen Ausnahmefällen zu erreichen. In diesem Stadium ist das Ziel der Behandlung der Erhalt einer hohen Lebensqualität und Symptomfreiheit. Somit stellt die endokrine Therapie die Therapie der Wahl bei positivem Rezeptorstatus dar (Empfehlungsgrad A, LoE 1b). Dieser sollte nach Möglichkeit auf einer aktuellen Histologie basieren, das heißt nach Möglichkeit sollte eine histologische Sicherung der Metastasierung erfolgen. Aufgrund der Heterogenität der Metastasen und der individuellen Krankheitsverläufe kann keine einheitliche Strategie vorgegeben werden, dies gilt vor allem für den Einsatz der Chemotherapie. In der Vergangenheit haben sich zahlreiche neue Therapieoptionen ergeben. Gerade bei der zielgerichteten Therapie bei Patientinnen mit HER2-positivem Mammakarzinom kam es zur Zulassung einiger neuer Subs-tanzen, welche in der geltenden Leitlinie nicht erwähnt sind. Klinischer Standard ist in der First-Line-Therapie des HER2-positiven metastasierten Mammakarzinoms die Kombination aus Chemotherapie (Docetaxel) und einer dualen zielgerichteten Therapie aus Pertuzumab und Trastuzumab. Einige weitere vielversprechende Therapeutika, zum Beispiel T-DM1 beim HER2-positiven Mammakarzinom, Everolimus beim hormonrezeptorpositiven Mammakarzinom in Kombination mit Exemestan kommen bereits zum Einsatz, welche ebenfalls in der aktuellen Version der Leitlinie nicht erwähnt sind.
Die medikamentöse Therapie entwickelt sich immer weiter hin zu einer auf den Tumor und die Patientin präzisierte und individuell abgestimmte Behandlung. Als Ausblick sind die PARP-Inhibitoren zu nennen, welche im Rahmen von Studien bei Patientinnen mit metastasiertem Mammakarzinom und BRCA-Mutation Anwendung finden. Der Trend in der Therapie des Mammakarzinoms geht zur „precision medicine“ – im Zuge des Verständnisses der Erkrankung weniger Radikalität bezogen auf die operative Therapie und eine „maßgeschneiderte“ medikamentöse Therapie.

Das Literaturverzeichnis kann bei den Verfassern angefordert oder im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.

Professor Dr. Matthias W. Beckmann

Professor Dr. Rüdiger Schulz-Wendtland
Teilen:
Das könnte Sie auch interessieren: