Infektiologie: Fachdisziplin im Wandel und neue Erkenntnisse für die Praxis
 Infektiologie
Infektiologie
Die Einführung der neuen Facharztkompetenz Infektiologie und Innere Medizin, sicherlich durch die COVID-19-Pandemie beschleunigt, ist der Grund für das Titelthema „Fachdisziplin im Wandel und neue Erkenntnisse für die Praxis“. Den vorliegenden Text publizieren wir aus aktuellem Anlass und außerhalb der Titelserie, geht es diesmal doch nicht um die neuen Entwicklungen eines Fachs anhand von drei ausgewählten Kasuistiken.
Eine Nachricht aus der Infektiologie ist möglicherweise durch COVID-19 und Affenpocken (Mpox) in den Hintergrund geraten: Der Deutsche Ärztetag hat 2021 die Einführung der Facharztkompetenz für Innere Medizin und Infektiologie in die (Muster-)Weiterbildungsordnung beschlossen, und die Landesärztekammern sind bundesweit diesem Beschluss weitestgehend gefolgt. In diesem Beitrag sollen deshalb sowohl die neue Facharztkompetenz als auch die neuen Erkenntnisse aus der Infektionsmedizin der vergangenen Jahre (auch diese sind durch COVID-19 verdeckt worden) dargestellt werden.
Die Bedeutung von Infektionskrankheiten wurde im 20. Jahrhundert in der Medizin wie in der Öffentlichkeit als immer geringer eingeschätzt – bessere Lebensbedingungen, Impfungen und zuletzt Antibiotika hatten die Häufigkeit und Schwere von Infektionskrankheiten dramatisch reduziert.
Drei Entwicklungen haben unabhängig voneinander zu einer Umkehr dieses Prozesses geführt: Erstens die wiederholte zoonotische Übertragung und epidemische Ausbreitung vorher unbekannter Erreger durch die Veränderung menschlicher Siedlungsräume (emerging infections). Zweitens die Zunahme der Zahl von Menschen mit besonderen Infektionsrisiken durch medizinische Behandlungen und Eingriffe, wie zum Beispiel immunsuppressive Therapien oder implantierte Fremdmaterialien und drittens die rasche Zunahme und Verbreitung von Bakterien mit Antibiotikaresistenzen.
Neue Infektionskrankheiten - häufig durch zoonotische Übertragung

Abbildung 1: Borna bei Leipzig
Bei den neuen Infektionskrankheiten sind vor allem die zoonotischen Übertragungen im Fokus. Eine der ersten zoonotischen Übertragungen einer vorher nicht bekannten Erkrankung im 20. Jahrhundert war der Ausbruch des Marburg-Virus, parallel in Marburg, Frankfurt und Belgrad [1]. Aus Uganda für die Impfproduktion importierte grüne Meerkatzen brachten das Virus mit, das an drei Orten (darunter Marburg) zu Über-tragungen auf den Menschen mit tödlichem Ausgang führte. Primaten sind nicht der ursprüngliche Wirt des Virus, dies sind wie für das verwandte Ebola-Virus Fledermäuse. Marburg- und vor allem Ebola-Virus-Ausbrüche sind seither mehrfach aufgetreten, nur beim Ausbruch 2014 in Westafrika mit einer größeren Verbreitung. Infektionen mit dem HIV wurden 1981 erstmals in den USA diagnostiziert. Der zoonotische Ursprung aus Afrika wurde erst sehr viel später geklärt, das Virus wurde von Primaten auf Menschen übertragen, zuerst in einzelnen Infektionen und in den 1970er-Jahren im Kongo durch medizinische Maßnahmen und sexuelle Kontakte verbreitet, bevor es in den USA entdeckt wurde und zu mittlerweile mehr als 100 Millionen Infektionen und vielen Todesfällen führte. Allein seit dem Jahr 2000 sind eine Reihe von Viruserkrankungen erstmals aufgetreten. Unter diesen sind häufige, aber auch seltene Infektionen, wie das Borna-Virus (entdeckt im 19. Jahrhundert in Borna bei Leipzig), das seit dem ersten Nachweis menschlicher Infektionen 2018 auch bei einer Reihe von Enzephalitis-Fällen als Erreger gefunden wurde [2]. Die seit 2000 entdeckten Infektionen sind tabellarisch ohne Anspruch auf Vollständigkeit in Tabelle 1 aufgeführt. Der letzte Eintrag in dieser Liste betrifft einen Ausbruch mit schweren Hepatitiden bei Kindern, der zunächst auf Adenoviren zurückgeführt wurde. Eine intensive Analyse zeigte, dass ein bisher als apathogen geltendes Virus, das Adeno-assoziierte Virus Typ 2 vermutlich in Kombination mit anderen Infektionen zu den schweren Verläufen geführt hat [3].
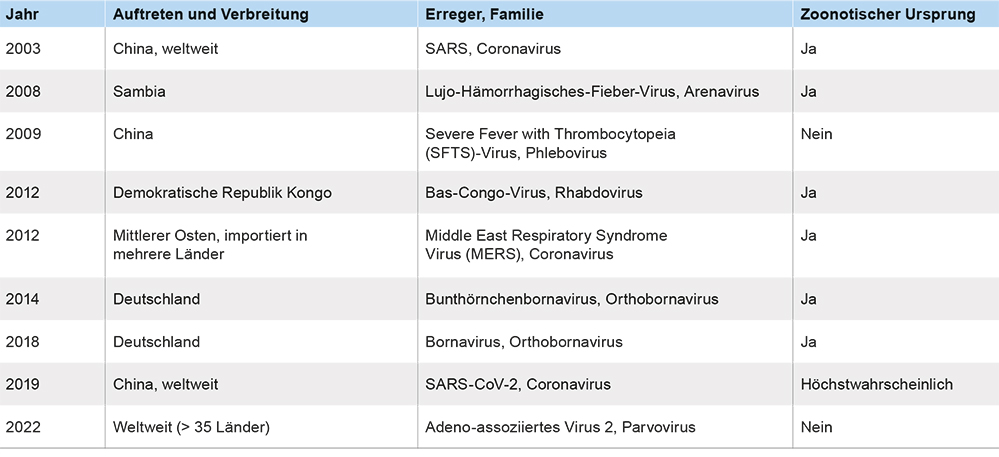
Tabelle 1: Neue Virusinfektionen seit 2000
Neben den Ausbrüchen mit neuen Viren sind andere Infektionen in Regionen aufgetreten, in denen sie vorher nicht entdeckt worden sind, so zum Beispiel West-Nil-Virus in den USA und zunehmend in Osteuropa, Zika-Virus-Infektionen im Pazifikraum und in Süd-/Mittelamerika, Dengue-, Chikungunyavirus-Infektionen in Asien, mit Ausbrüchen auch im Mittelmeerraum und zuletzt ein weltweiter Ausbruch von Mpox (früher monkey pox), der weit überwiegend durch sexuelle Übertragung zwischen Männern, die Sex mit Männern ha-ben, verbreitet wurde [4].
Die HIV-Pandemie hat vermutlich den größten Einfluss auf die Entwicklung der Infektionsmedizin genommen. Anfänglich war die Behandlung seltener und schwerer opportunistischer Erkrankungen die größte Herausforderung, dann die Entwicklung der antiretroviralen Therapie und deren Anwendung in den Ländern südlich der Sahara. Es bildete sich rasch eine internationale Gemeinschaft engagierter Ärztinnen und Ärzte, die ein globales Netzwerk aufbauten. Das Stigma der HIV-Infektion als sexuell übertragbare Infektion behinderte viele Entwicklungen, schmiedete aber auch eine enge Allianz der Infektiologen. Mit vielen neuen Erkenntnissen aus der immunologischen Forschung und den neuen Therapiestrategien, die die HIV-Infektion zu einer chronischen gut behandelbaren Infektion machten, wurden Infektionsmediziner für die neuen Herausforderungen der Infektionsmedizin gewappnet. Durch die Erfolge der Transplantationsmedizin wurden auch bei Organ- und Stammzelltransplantierten Patientinnen und Patienten opportunistische Infektionen häufiger und die gemachten Erfahrungen konnten in neue Tätigkeitsfelder übertragen werden.
Das Auftreten neuer Infektionskrankheiten und die Ausbreitung bzw. geografische Veränderung bekannter Infektionskrankheiten wird mit dem Schlagwort „Emerging Infectious Diseases“ belegt. Für die Ausbreitung bekannter Infektionskrankheiten ist ein Einfluss des Klimawandels klar erkennbar, aber auch eine Zunahme zoonotischer Übertragungen durch Kontakte zu Tierspezies trägt hierzu bei. Alle drei kürzlich beim Menschen aufgetretenen Coronaviren (SARS-CoV, MERS-CoV und SARS-CoV-2) haben als ursprüngliche Wirte Fledermausspezies. Fledermäuse sind die größte Gruppe von Säugerspezies, die zudem in großen sozialen Gruppen leben. Sie stellen vermutlich auch für zukünftige zoonotische Ausbrüche ein wichtiges Reservoir dar.
Wie können wir solche Risiken beobachten oder bewerten? Eines der neuen Instrumente zur Überwachung solcher Infektionen ist die genomische Surveillance. Dabei werden ganze Genome oder Teile des Genoms aus klinischen oder Umweltproben sequenziert und können in internationale Datenbanken hochgeladen werden, um anschließend analysiert und verglichen zu werden. Hiermit können Evolutionsprozesse oder -schritte detailliert beobachtet werden. Die genomische Surveillance wurde zuerst für Influenzaviren (Global Initiative on Sharing All Influenza Data, GISAID) etabliert und hat in der COVID-19-Pandemie wertvolle Dienste geleistet.
Für die derzeit weltweit bei Vögeln auftretenden H5N1-Influenzainfektionen kann damit zum Beispiel auch eine Adaptation an Säugerspezies untersucht werden, die für eine Übertragung auf Menschen essenziell sein könnte. H5N1 hat bisher bei Menschen etwas über 200 Infektionen weltweit verursacht, durch die intensive Surveillance sind auch die vereinzelten menschlichen Infektionen mit anderen aviären Influenzaviren (H3N8, H5N6, H7N4, H7N9, H9N2 und H10N3) entdeckt worden.
Vor allem die bisher letzte Pandemie mit SARS-CoV-2 hat noch einmal gezeigt, dass Kenntnisse in der Epidemiologie, Prävention und Immunologie von übertragbaren Erkrankungen gerade bei Ausbrüchen neuer Infektionen sowohl zur Eindämmung von Ausbrüchen wie auch zur Behandlung der Erkrankungen wertvoll und übertragbar sind. Wie auch bei den anderen kürzlichen großen und umwälzenden Erfolgen der Infekti-onsmedizin (Entwicklung der HIV-Therapien, Heilung von Hepatitis C) war auch hier das Muster des Fortschritts identisch: ein Hand in Hand von Grundlagenforschung (Entschlüsselung von Virusstruktur und Replikationsmechanismen), pharmakologischer Forschung („Designer-Drugs“ mit gezielter Bindung an pivotale Strukturen der Virusreplikation), klinischer Forschung (spezialisierte Durchführung klinischer Studien am Menschen nach den Regeln der Good Clinical Practice) und Versorgungsforschung mit Einführung der neuen Medikamente in Praxis und Klinik.
Komplizierte Infektionen und Infektionen bei besonderen Wirtsfaktoren
Der Benefit spezialisierter infektiologischer Expertise ist am deutlichsten bei komplizierten und bei Infektionen bei Patienten mit besonderen Wirtsfaktoren zu sehen. Auch im Zeitalter der Antibiotika sind bakterielle Infektionen mit einer hohen Krankheitslast assoziiert: bakterielle Infektionen sind weltweit für 13,6 Prozent aller Todesfälle verantwortlich. Staphylococcus aureus ist eines der fünf am häufigsten hierfür verantwortlichen Pathogene, bei den besonders gefährlichen Blutstrominfektionen ist S. aureus für 30 Prozent der Todesfälle in den reichsten Ländern der Welt verantwortlich, in den ärmsten Regionen für fünf Prozent [5]. Der Zugang zu Antibiotika kann in den reichsten Ländern sicherlich keine Ursache für diese Todesfälle sein, allerdings sind Adipositas bzw. Diabetes mellitus Typ 2 Risikofaktoren für die Entwicklung einer S. aureus-Bakteriämie (SAB). Aufgrund der hohen Mortalität der SAB haben viele Studien Risikofaktoren für die Sterblichkeit bei dieser Erkrankung untersucht. Positiv wird die Sterblichkeit beeinflusst durch die gezielte Therapie, durch adäquate Suchen nach möglichen Foci und Kontrolle der Therapiewirksamkeit. Hier ist der wichtigste Faktor, dass durch mehrfache Abnahme von Kontrollblutkulturen untersucht wird, ob die Therapie erfolgreich ist. Bei persistierend positiven Blutkulturen muss von einem nicht sanierten Fokus ausgegangen werden und dieser gesucht und saniert werden.
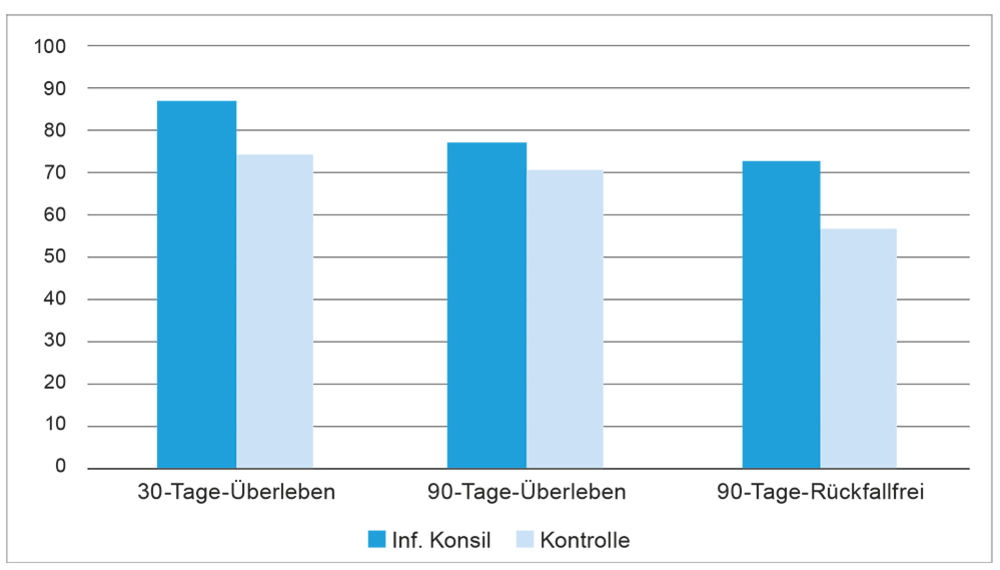
Abbildung 2: Behandlungserfolge (%) bei Patienten mit SAB nach infektiologischem Konsil vs. Kontrollen [6].
Eindeutig ist in diesen Studien zu sehen, dass die Einbeziehung von klinischen Infektiologen ein wesentlicher Garant für den Therapieerfolg ist. In einer kürzlichen Metaanalyse zeigt sich sowohl eine niedrigere 30-Tage-Mortalität wie eine geringere 90-Tage-Mortalität, wenn klinische Infektiologen in die Behandlung involviert wurden [6]. Infektiologen achten auf die Einhaltung der wichtigen Therapiemaßnahmen – vermutlich senkt das die Mortalität.
Diese Ergebnisse sind auch auf die Endokarditis übertragbar. Ein neuer Standard für die Endokarditis ist nach den aktuellen europäischen und amerikanischen Leitlinien eine interdisziplinäre Behandlung durch ein Team von Kardiologen, Kardiochirurgen und Infektiologen. Eine weitere Neuerung ist die erfolgreiche klinische Prüfung und Einführung einer zumindest teilweisen oralen Antibiotikatherapie. Zumindest bei einem Teil der Patienten mit Endokarditis kann nach einer initialen intravenösen Therapie auch eine Umstellung auf eine orale Antibiotikagabe erfolgen. In der Studie war dieser Anteil ca. ein Fünftel der in den Kliniken vorstelligen Patienten mit einer Endokarditis. Die ursprüngliche randomisierte Studie zu dieser Therapieform zeigte bereits kurzfristig eine gleichwertige Wirksamkeit der Therapie. Langzeitergebnisse wurden im vergangenen Jahr publiziert und zeigten, dass auch nach fünf Jahren keine erhöhte Rückfallrate zu beobachten ist [7].
Die rasche Entwicklung der Transplantationsmedizin, neue Substanzen zur Behandlung von autoimmunen bzw. autoinflammatorischen Erkrankungen und eine wachsende Zahl von Patienten mit implantierten Fremdmaterialien hat die Zahl der Menschen mit höheren oder besonderen Infektionsrisiken deutlich erhöht. Sowohl Behandlung wie auch Prävention dieser Infektionen werden in der Regel kooperativ mit den primär behandelnden Fachdisziplinen durchgeführt. Diese Arbeitsteilung ist aufgrund der zunehmenden Spezialisierung auf beiden Seiten fast unerlässlich [8].
Auch ältere Menschen, eine in der jetzigen demografischen Entwicklung weltweit wachsende Gruppe, haben höhere Infektionsrisiken. Für diese Menschen ist in den vergangenen Jahren durch Entwicklung neuer Impfstoffe ein erheblicher Fortschritt erreicht worden. Bei der Influenza, die bei älteren Menschen viele Komplikationen und Todesfälle verursacht, sind die bisherigen Impfstoffe nur begrenzt wirksam, sowohl die Bildung von Antikörpern wie auch die Schutzwirkung ist geringer als bei jüngeren Menschen (zum Beispiel unter 60 Jahren). Eine Verbesserung haben hier Hochdosisimpfstoffe gebracht, aber auch hiermit wird noch keine Schutzwirkung von 75 Prozent erreicht. Eine der ersten für ältere Menschen hervorragend wirksamen Impfstoffe war der rekombinante adjuvantierte Proteinimpfstoff gegen Herpes zoster. Mit diesem Impfstoff war auch bei Menschen über 70 Jahren ein Impfschutz von etwa 90 Prozent erreichbar. In der COVID-19-Pandemie zeigte sich ebenfalls eine hervorragende Schutzwirkung mit den neuen mRNA- und Adenovirus-Impfstoffen, initial gegen Infektionen aber vor allem auch langfristig bei mindestens dreimal geimpften oder geimpften und später infizierten Menschen gegen einen schweren Verlauf der Infektion. Diese Reihe von neuen Impfstoffen ist gerade mit der erfolgreichen Prüfung neuer Impfstoffe gegen das RSV fortgesetzt worden. Das Respiratorische-Synzytien-Virus (RSV) verursacht vor allem bei Kindern im ersten Lebensjahr und bei Menschen über 60 Jahren schwere Infektionen der Atemwege und Lunge, die Krankheitslast ist bei älteren Menschen etwa gleich groß wie für das im Bewusstsein viel präsentere Influenzavirus. Die neuen Vakzine zeigen alle einen Impfschutz von etwa 80 Prozent, mit einer Zulassung dieser Impfstoffe wird 2023/24 in der EU gerechnet. Bisher ist keine dieser Impfungen für Kinder geprüft oder gar zugelassen, eine Impfstudie bei schwangeren Frauen hat aber bereits gezeigt, dass mit der Impfung Schwangerer ein guter Nestschutz für die ersten Lebensmonate erreicht werden kann [9].
Antibiotika-Einsatz, -Resistenz und Antibiotic Stewardship
Die Entwicklung von Antibiotika seit den 1940er-Jahren hat eine Reihe von Therapiemodalitäten der modernen Medizin erst möglich oder sicher gemacht. Dazu gehören die Behandlung von Wundinfektionen, die moderne Chirurgie und vor allem viele Behandlungsmodalitäten, die mit besonderen Risiken für akute bakterielle Infektionen assoziiert sind: zytoreduktive Chemotherapie, Implantation von prothetischem oder anderem Fremdmaterial und andere operative Eingriffe.
Die hohe Sicherheit und Verträglichkeit von Antibiotika hat dazu beigetragen, dass diese nicht nur bei Infektionen oder bei gerechtfertigter Prophylaxe eingesetzt worden sind, sondern auch zum Beispiel bei oberen Atemwegsinfektionen, die fast ausschließlich viral bedingt sind. Bei 50 Prozent aller hospitalisierten Patienten werden sie mindestens einmal eingesetzt. In der ambulanten Versorgung ist der Antibiotikaeinsatz niedriger, aber hier sind große Unterschiede, zum Beispiel zwischen den europäischen Ländern zu beobachten. Besonders hohe Verbräuche gibt es dort, wo es keine Verschreibungspflicht für Antibiotika gibt, sondern Antibiotika einfach käuflich zu erwerben sind. Bei kritischer Betrachtung zeigt sich in vielen Situationen ein inadäquater Einsatz von Antibiotika.
Nahezu alle Antibiotika wurden aus Naturstoffen, meist mikrobiellen Stoffwechselprodukten entwickelt. Resistenzmechanismen gegen diese Produkte sind bereits sehr lange bei Bakterien vorhanden – lange vor dem Einsatz von Antibiotika in der Medizin.
Resistenzentwicklung und deren Ausbreitung sind seit Beginn der Antibiotikaära eng mit dem Einsatz dieser Substanzen verknüpft. Dies gilt für den Einsatz bei Menschen wie in der Tiermedizin und -haltung, es gibt meistens eine klare Korrelation zwischen Intensität des Einsatzes und den Resistenzraten für Antibiotika.
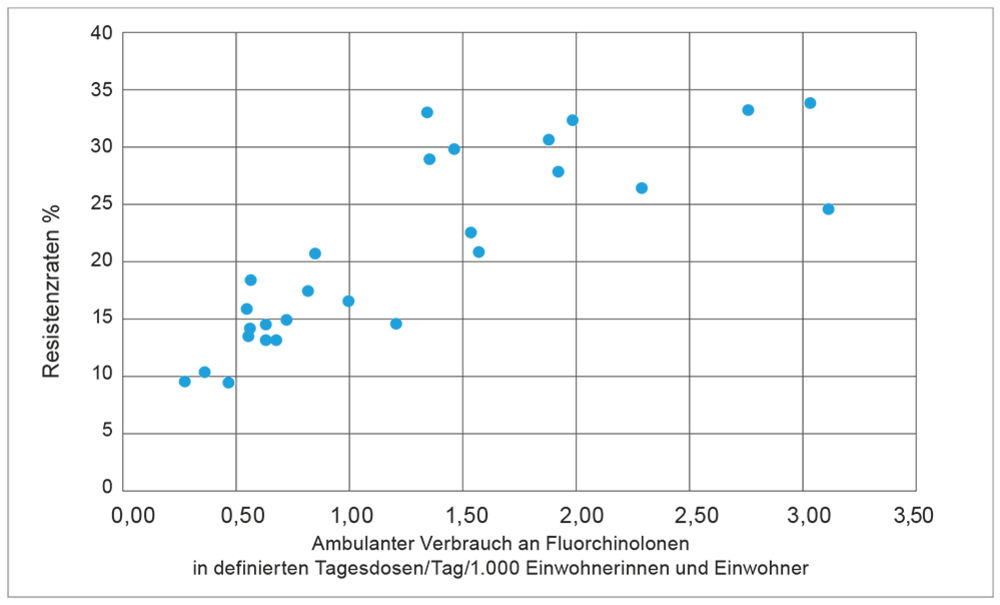
Abbildung 3: Einsatz von Fluorchinolonen in der ambulanten Medizin und Fluorchinolon-Resistenz bei E-scherichia coli in 29 europäischen Ländern (jedes Land stellt einen Punkt dar, Daten aus dem ESAC bzw. EARS-Register [13, 14]).
Bei den resistenten und mehrfach resistenten Bakterien hat ab 1990 zunächst die Kenntnis, Diagnostik und Bekämpfung der resistenten S. aureus in Form von MRSA im Zentrum der Bemühungen gestanden. Durch viele Einzelmaßnahmen von Hygiene bis hin zu Schulungen ist es mittlerweile gelungen, Inzidenz und Prävalenz der Kolonisierung und nosokomialen Infektion durch MRSA wieder zu verringern. Dies ist mittlerweile ein Trend in fast allen europäischen Ländern über mehrere Jahre.
Verschiedene Faktoren haben jedoch dazu beigetragen, dass gramnegative Enterobakterien (zum Beispiel E. coli, Klebsiella sp., Pseudomonas) zunehmend Resistenzen aufweisen. Eine dramatische Beschleunigung dieser Entwicklung mit der weltweiten Ausbreitung von „extended-spectrum-ß-lactamases“ (ESBL) ist in den vergangenen zehn Jahren beobachtet worden und hat nun dazu geführt, dass mittlerweile Bakterienstämme isoliert wurden, die nicht mehr durch Antibiotika abzutöten sind. Die Neuentwicklung von Antibiotika hat mit dieser Entwicklung kaum mehr Schritt halten können. Damit ist das wichtige Gut Antibiotika in Bedrängnis, manche Experten haben bereits eine „postantibiotische Ära“ beschworen.
Der inadäquate und zu häufige Einsatz bietet ein offensichtliches Potenzial für Verbesserungen der Therapie und gleichzeitig für Maßnahmen gegen die Resistenzentwicklung. Rasch wurde klar, dass hierfür Änderungen der Therapiegewohnheiten notwendig sind, die nicht einfach durch Aufklärung oder Fortbildung erreicht werden können. Klinische, mikrobiologische und pharmakologische Expertise in Kombination mit Managementmethoden sind hier notwendig. Diese beinhalten zum Beispiel die Auswahl und den Einsatz geeigneter Strategien zur Überzeugung und Motivierung der verschreibenden Ärzte, spezifische Interventionen in Kliniken oder Abteilungen, das Monitoring des Erfolgs und die Rückkopplung der Ergebnisse, also Elemente, die über die eigentliche klinische Arbeit am Patienten hinausgehen [10]. Für diese Strategie hat sich der Begriff „Antibiotic Stewardship“ eingebürgert. Dieser Begriff ist neu und nicht einfach übersetzbar. „Stewardship“ ist abgeleitet von „Steward“ (als Hausdiener bzw. Verwalter) und stand für die verantwortungsvolle Übernahme häuslicher Pflichten. In der Kombination mit Antibiotikaeinsatz bezeichnet er die Übernahme der Verantwortung für den rationalen Einsatz dieser Ressourcen. Die Optimierung des Einsatzes zielt dabei auf den klinischen Erfolg wie auf Vermeidung des inadäquaten Einsatzes, eine Kostenreduktion ist nicht primäres Ziel dieser Programme, ebenso wenig wie restriktive, nicht klinisch adäquate Maßnahmen.
Mittlerweile sind solche Programme in vielen Krankenhäusern weltweit etabliert und haben Erfolge erzielt [11]. Weniger etabliert sind bisher Programme in ambulanten Behandlungsstrukturen, prinzipiell sind sie aber dort ebenso anwendbar. Diese Strategie ist ebenso übertragbar auf andere Antiinfektiva (zum Beispiel antivirale und antimykotische Substanzen, „Antimicrobial Stewardship“). Beide Begriffe werden heute fast synonym gebraucht, dabei ist der Einsatz von Antibiotika als weitaus größte und am häufigsten eingesetzte Substanzgruppe für die Resistenzentwicklung bei Infektionserregern das wichtigste Ziel der Interventionen.
Eine wichtige und viele Indikationen übergreifende Erkenntnis hat die Beschäftigung mit einem rationalen Antibiotikaeinsatz zusätzlich erbracht: viele übernommene Empfehlungen für die Dauer einer Antibiotikatherapie konnten revidiert werden. So kann die Dauer einer Antibiotikatherapie für die ambulant erworbene Pneumonie heute in fast allen Fällen auf fünf bis sieben Tage, die Therapie von intraabdominalen Infektionen nach Fokussanierung auf 4,6 Tage verkürzt werden.
Das neue Berufsbild Klinische Infektiologie
Die drei oben skizzierten Entwicklungen formen auch das Profil der modernen Infektionsmedizin: die Behandlung der häufigsten Infektionen verbleibt in den Organdisziplinen, spezialisierte Infektionsmediziner sind (außerhalb von Pandemien oder anderen Ausbrüchen) in der klinischen Medizin zuständig für die Behandlung komplizierter Infektionen, Infektionen bei besonderen Patientengruppen kooperativ mit allen Fachdisziplinen. Eine weitere wichtige Aufgabe ist das Antibiotic Stewardship, die Steuerung des Antibiotikaeinsatzes, auch in den anderen Disziplinen, um durch einen rationalen Einsatz den Erfolg zu maximieren und die Resistenzentwicklung zu minimieren (Antibiotic Stewardship).
Derzeit sind die meisten Infektiologie-Abteilungen in Kliniken als klassisches Querschnittsfach überwiegend konsiliarisch tätig und darin auch durchaus effektiv [12]. Allerdings wird der Wissens- und Erfahrungsschatz auch in der Infektionsmedizin zunehmend komplexer und erfordert und fördert Spezialisierung, zum Beispiel in der Behandlung von Patienten mit HIV-Infektion, langer Vortherapie und entsprechender Akkumulation von Resistenzen oder in der Differentialtherapie bei multiresistenten gramnegativen Erregern oder Tuberkelbakterien. Die neue Weiterbildungsordnung mit der Infektiologie nun als ebenbürtiges Gebiet der Inneren Medizin und nicht nur als Zusatzbezeichnung trägt dem Rechnung. Dies fördert die Spezialisierung, was unter Berücksichtigung aller Aspekte zu begrüßen ist. Die Verankerung im Gebiet der Inneren Medizin ist Garant für die Erdung des Schwerpunkts, eine Spezialisierung ist nur als Aufbau auf einer breiten Basis denkbar. Eine wichtige Aufgabe der nächsten Jahre wird die Weiterbildung einer ausreichenden Zahl von Fachärztinnen und Fachärzten sein, die Entwicklung der bisherigen Zusatzweiterbildung zeigt das hohe Interesse und den Bedarf für diese Spezialkenntnisse.
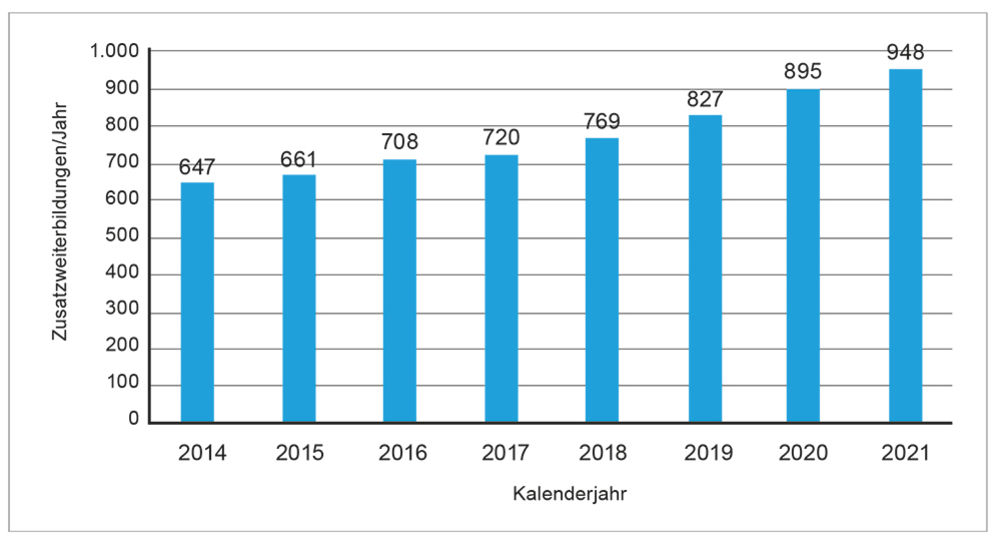
Abbildung 4: Entwicklung der bisherigen Zusatzweiterbildung Infektiologie (Ärztestatistik, Bundesärztekammer 2022)
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autoren

Professor Dr. Bernd Salzberger 1

Professor Dr. Johannes Bogner 3
1 Abteilung für Krankenhaushygiene und Infektiologie, Universitätsklinikum Regensburg
2 Abteilung für Klinische Infektiologie, Kliniken Südostbayern
3 Sektion Klinische Infektiologie, Medizinische Klinik und Poliklinik IV, Klinikum der Universität München
Korrespondenz:
Professor Dr. Bernd Salzberger, Abt. Krankenhaushygiene und Infektiologie, Universitätsklinikum Regensburg, Franz-Josef-Strauss-Allee 11, 93053 Regensburg, E-Mail: Bernd.salzberger@ukr.de
Teilen:
Das könnte Sie auch interessieren: