Ernährungsmedizin – highlighted
 Ernährungsmedizin
Ernährungsmedizin
In den vergangenen Jahren hat sich die Ernährungsmedizin als wichtiger Eckpfeiler in der Therapie von zahlreichenden Erkrankungen herauskristallisiert. Die ernährungsmedizinische Intervention kann nicht nur die Lebensqualität der Patientinnen und Patienten verbessern, sondern sich auch auf die Prognose von bestimmten Erkrankungen positiv auswirken. Bei chronischen Erkrankungen mit erhöhtem Risiko für eine Sarkopenie kann eine kombinierte ernährungs- und sportmedizinische Therapie den Muskelstatus stabilisieren und somit den Verlauf der Erkrankung positiv beeinflussen.
Fall 1: Glutenunverträglichkeit bei einer Patientin mit Reizdarmsyndrom
Das Reizdarmsyndrom (RDS) ist charakterisiert durch chronische Bauchschmerzen, Stuhlunregelmäßigkeiten und Blähungen/Flatulenz. Die Patienten verspüren hierunter eine deutliche Minderung ihrer Lebensqualität, sodass eine weiterführende Diagnostik und Therapie notwendig wird. Kennzeichnend für das RDS ist, dass meist keine zugrundeliegende organische Erkrankung gefunden wird. Eine wichtige Therapiesäule stellt die Ernährungstherapie dar. Eine FODMAP-reduzierte Ernährung (fermentierbare Oligo-, Di-, Monosaccharide und Polyole) scheint bei einem Großteil der Patienten die gastrointestialen Beschwerden zu lindern. Diese Diät bedeutet einen weitgehenden Verzicht auf Lactose-, Fructose-, Sorbit- und Mannit-haltige Lebensmittel sowie auf Produkte mit hohem Gehalt an Fructanen oder Galaktanen, wie bestimmte Gemüse- (zum Beispiel Artischocken, Blumenkohl, Bohnen, Lauch, Erbsen, Zwiebel) oder Getreidesorten (zum Beispiel Weizen, Roggen, Gerste). Es gibt Hinweise, dass ein Teil der Patienten mit RDS auch unter einer glutenfreien Ernährung eine Linderung der intestinalen und auch der extraintestinalen Beschwerden verspürt. Eine Glutensensitivität ist definiert als eine Unverträglichkeit gegenüber Gluten, nachdem Zöliakie und eine Weizenallergie ausgeschlossen wurden. Die klinische Symptomatik kann innerhalb von wenigen Stunden nach dem Verzehr von glutenhaltigen Nahrungsmitteln auftreten und kann einer Zöliakie oder Weizenallergie stark ähneln. Unter einer glutenfreien Diät erfahren die Patienten eine rasche Besserung der Beschwerden [1]. Den Patienten wird empfohlen, über vier bis fünf Wochen eine glutenfreie Diät einzuhalten und im weiteren Verlauf Gluten wieder langsam einzuführen, um die individuelle Toleranzschwelle zu finden. Im Vergleich zu einer Zöliakie wird keine strikt glutenfreie Ernährung benötigt.
Anamnese:
Eine 37-jährige Patientin stellte sich in normalen Ernährungszustand (Body-Mass-Index [BMI] 25) in unserer Ernährungssprechstunde zur Abklärung von nahrungsmittelabhängigen, abdominellen Beschwerden vor. Seit ihrer Rückkehr aus dem Urlaub aus Thailand vor ca. zwei Jahren, wo sie einen akuten Magen-Darm-Infekt erlitten haben soll, leide sie an chronischen, abdominellen Beschwerden. Mehrmals die Woche habe sie starke Blähungen, abdominelle Schmerzen bis hin zu Bauchkrämpfen und Stuhlunregelmäßigkeiten im Wechsel mit Durchfällen und Verstopfung. Ferner fühlte sich die Patientin seit mehreren Monaten sehr müde und antriebslos, berichtete über häufige Kopfschmerzen sowie Gelenkschmerzen. Bei der Ernährungsanamnese fiel auf, dass die Patientin versucht hat, sich weitgehend ausgewogen zu ernähren. Aufgrund der zum Teil sehr belastenden Beschwerden kam es zu einer reduzierten Nahrungsaufnahme, sodass es zu einer ungewollten Gewichtsabnahme kam. Dies führte zu einer zusätzlichen körperlichen Schwäche und einem Leistungsknick.
Im Rahmen der hausärztlichen Betreuung und einer gastroenterologischen Untersuchung wurden serologisch, histologisch und durch Stuhluntersuchungen eine Zöliakie, eine chronisch entzündliche Darmerkrankung, eine akute und chronische Infektion und weitere organische Erkrankungen ausgeschlossen und die Überweisung in unsere gastroenterologische Klinik veranlasst. Zuletzt wurde der Verdacht auf ein RDS postuliert.
Diagnose und Therapie:
Im Rahmen der weiterführenden Untersuchung in unserer Abteilung wurden H2-Atemtests auf Laktose-, Fruktose- und Sorbitintoleranz durchgeführt. Hierbei ließ sich eine Laktoseintoleranz nachweisen. Die Fruktose- und Sorbit-Testungen waren unauffällig. Eine Bestimmung des GesamtImmunglobulins E (IgE) erbrachte keinen Hinweis auf eine Nahrungsmittelallergie. Bei der Ösophago-Gastro-Duodenoskopie zeigte sich makroskopisch bis auf eine Refluxösophagitis kein wegweisender Befund. Histopathologisch zeigten sich entzündliche Veränderungen im distalen Ösophagus. Histologisch präsentierten sich im Duodenum leichtgradig erhöhte intraepitheliale Lymphozyten 22 IEL/100 Enterozyten. Es lagen keine Zottenatrophie oder Kryptenhyperlasie vor, so dass eine Zöliakie ausgeschlossen werden konnte. Serologisch zeigten sich keine Auffälligkeiten, mit Ausnahme eines erniedrigten Vitamin-D-Spiegels und leicht erhöhtem IgG-Serumantikörper gegen Gliadine (12,5 units/ml; Grenzwert 7 units/ml). Die zöliakietypischen Antikörper gegen die Transglutaminase 2 waren nicht erhöht. Eine IgA-Defizienz lag nicht vor.
Die Refluxösophagitis wurde durch Gabe von Protonenpumpeninhibitoren (PPI) behandelt. Ernährungstherapeutisch wurde zunächst, unter Beachtung der Laktoseintoleranz, auf eine mediterrane Ernährung umgestellt. Nach vier Wochen berichtete die Patientin nur von einer leichten Verbesserung der klinischen Symptomatik. Bei Verdacht auf ein RDS wurde leitliniengerecht (S3-Leitlinie Reizdarmsyndrom) eine vierwöchige FODMAP-arme Diät durchgeführt [2]. Unter dieser Diät wurde bereits nach einer Woche eine Verbesserung der gastrointestinalen Symptome erzielt. Die Blähungen und abdominellen Schmerzen besserten sich. Die Patientin klagte jedoch weiterhin über Müdigkeit, Kopf- und Gelenkschmerzen. Hin und wieder kam es noch zu abdominellen Beschwerden.
Im nächsten Schritt wurde die Reduktion von glutenhaltigen Nahrungsmitteln empfohlen. FODMAPs wurden wieder in die Ernährung eingeführt, Lebensmittel mit hohem FODMAP-Gehalt wurden in Maßen erlaubt (zum Beispiel Milchprodukte, Honig, Äpfel, Birnen, Kohlsorten oder Zwiebel). Nach vier Wochen glutenfreier Diät war die Patientin beinahe beschwerdefrei. Ihre Kopfschmerzen und Müdigkeit haben sich im Verlauf deutlich reduziert, die Gelenkschmerzen waren nur noch gering ausgeprägt.
In der Zusammenschau der Befunde wurde bei bekanntem RDS eine zusätzlich vorliegende Glutensensitivität postuliert. Zur Absicherung der Diagnose wurde eine verblindete Glutenprovokation durchgeführt. Die Patientin ernährte sich weiterhin glutenfrei und erhielt in der ersten Woche von uns hergestellte, glutenfreie Muffins. In der zweiten Woche erhielt sie Muffins, die je acht Gramm Gluten (Vitalkleber) enthielten. Bereits am zweiten Tag unter der Glutenprovokation klagte die Patientin über Kopfschmerzen, abdominelle Beschwerden und zwei Aphten im Mund. Bei nachgewiesener Glutensensitivität wurde im weiteren Verlauf eine glutenarme Ernährung durchgeführt. Unter diätetischer Beratung wurden in den folgenden Wochen wieder geringe Mengen an Gluten eingeführt. Mittlerweile kann die Patientin wieder geringe Mengen glutenhaltige Nahrungsmittel verzehren, ohne eine klinische Symptomatik zu entwickeln [3].
Im Verlauf erfolgte eine erneute Ösophago-Gastroduodenoskopie. Makro- und mikroskopisch war die Refluxösophagitis erfolgreich behandelt. Histopathologisch zeigte sich ebenfalls in den duodenalen Gewebeproben ein Normalbefund, insbesondere in Bezug auf die intraepithelialen Lymphozyten. Die geringgradige entzündliche Aktivität in der Mukosa normalisierte sich unter einer glutenfreien Diät [4]. Serologisch waren ferner keine erhöhten IgG gegen deamidierte Gliadine mehr nachweisbar (Abbildung 1).
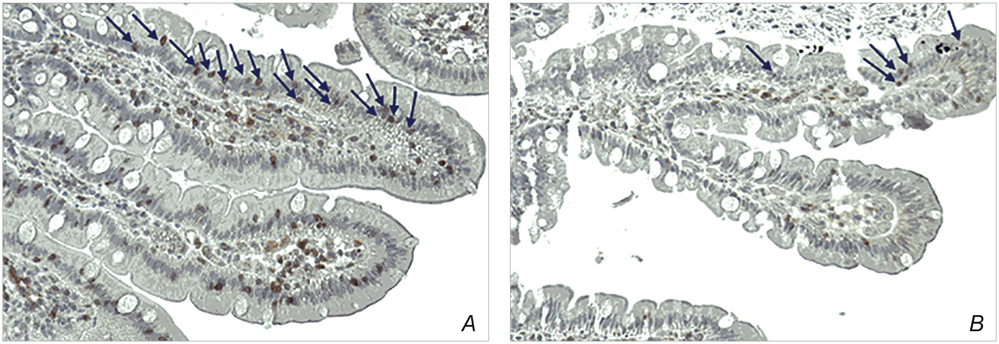
Abbildung 1: Nachweis der intraepithelialen Lymphozyten (CD3+) einer Patientin mit Glutensensitivität: A) vor glutenfreier Diät; B) nach acht Wochen glutenfreier/glutenarmer Diät (GFD).
Fazit:
Bei der Patientin ließ sich eine Glutensensitivität nachweisen. Eine Nahrungsumstellung auf mediterrane Kost sowie eine FODMAP-arme Ernährung brachten bei der Patientin zwar eine Verbesserung der gastrointestinalen Symptomatik, aber erst die glutenfreie Ernährung konnte die intestinalen und die extraintestinalen Beschwerden deutlich lindern und die Lebensqualität der Patientin wiederherstellen. Entsprechend den Empfehlungen wurde die glutenfreie Diät nicht so streng wie bei einer Zöliakie eingehalten. Es wird geschätzt, dass ein Drittel der Patienten mit Reizdarmsymptomatik eine Glutensensitivität haben, sodass eine glutenfreie Ernährung eine weitere therapeutische Option darstellen kann.
Fall 2 – Kombinierte Ernährungs- und Sporttherapie bei Tumorkachexie
Anamnese:
Bei einer 42-jährigen Patientin, verheiratet, zwei Kinder, wurde im April 2018 ein duktales Adenokarzinom des Pankreas mit hepatischer und pulmonaler Metastasierung diagnostiziert (UICC-Stadium IV). Sie berichtete über einen hohen, ungewollten Gewichtsverlust von sieben Kilogramm in den vergangenen drei Monaten (10,6 Prozent ihres üblichen Körpergewichtes), Kurzatmigkeit bei körperlicher Belastung, mäßigen Appetit, ausgeprägte Fatigue und Bauchschmerzen. Das aktuelle Gewicht betrug 59,2 kg und der BMI 19,5 kg/m2. Im „Nutritional Risk Screening-2002“ (NRS-Screening) zeigte sich aufgrund des Gewichtsverlusts, der verminderten Nahrungsaufnahme und der Krankheitsschwere mit vier Punkten ein hohes Risiko für Mangelernährung (Tabelle 1).

In der interdisziplinären Tumorkonferenz wurde die Empfehlung zur palliativen Chemotherapie (FOLFIRINOX-Protokoll) gegeben, die erstmals am 30. April 2018 verabreicht wurde. Gleichzeitig wurde die Patientin an das „Hector-Center für Ernährung, Bewegung und Sport“ des Universitätsklinikums Erlangen angebunden. Hier wurde die Patientin in ein klinisches Ernährungs- und Sportkonzept aufgenommen. Dabei erfolgte parallel zur onkologischen Therapie über drei Monate eine kombinierte, individualisierte Ernährungs- und Sporttherapie mit dem Ziel, den Ernährungs- und Muskelstatus, die körperliche Leistungsfähigkeit und die Lebensqualität zu stabilisieren sowie die Verträglichkeit der Chemotherapie zu verbessern.
Diagnostik, Therapie und Verlauf:
Bei der Patientin lag aufgrund der aggressiven, malignen Grunderkrankung, eines hohen, ungewollten Gewichtsverlustes und einer reduzierten Nahrungsaufnahme ein ausgeprägtes Tumorkachexiesyndrom vor.
Laut Ernährungsanamnese nahm die Patientin bei mäßigem Appetit nur etwa drei Viertel der üblichen Portionen zu sich. Der Stuhl war breiig-flüssig (Bristol-Stuhl-Skala 6 bis 7 – Tabelle 2). Die Patientin wurde wiederholt alle vier Wochen ernährungstherapeutisch durch eine qualifizierte Ernährungsfachkraft zu einer eiweißreichen Kost beraten, da aufgrund einer anabolen Resistenz und eines gesteigerten Ganzkörper- und Muskelproteinumsatzes bei Krebserkrankungen eine erhöhte Proteinzufuhr empfohlen wird. Ergänzend erhielt sie entsprechendes Informationsmaterial zur Optimierung der oralen Ernährung (Liste mit eiweißreichen Lebensmitteln, Rezeptvorschläge). Als Zielzufuhr sollte die Patientin leitlinienkonform 1,2 bis 1,5 g Eiweiß/kg Körpergewicht zuführen, entsprechend 70 bis 90 g pro Tag [6].

Ebenfalls mit Start der Chemotherapie begann die Patientin ein Muskeltraining mittels Ganzkörper-Elektromyostimulation (WB-EMS – Abbildung 2). Bei dieser zeiteffizienten Methode wird in einer 20-minütigen Trainingseinheit mittels elektrischer Impulse in Kombination mit leichten dynamischen Körperübungen ein Großteil der Körpermuskulatur aktiviert (Rumpf-, Oberarm-, Oberschenkel-, Gesäßmuskulatur). Dieses Training führte die Patientin zweimal pro Woche im Sportzentrum des Hector-Centers unter Anleitung geschulter Physio- und Sporttherapeuten durch. Das erste WB-EMS-Training absolvierte die Patientin 14 Tage nach der ersten Chemotherapiegabe. Bei den ersten beiden Trainingseinheiten war die Patientin noch deutlich geschwächt, sie stabilisierte sich aber zunehmend und konnte von 24 geplanten Trainingseinheiten in den drei Monaten 22 Trainings in vollem Umfang durchführen. Unerwünschte Ereignisse traten dabei nicht auf.
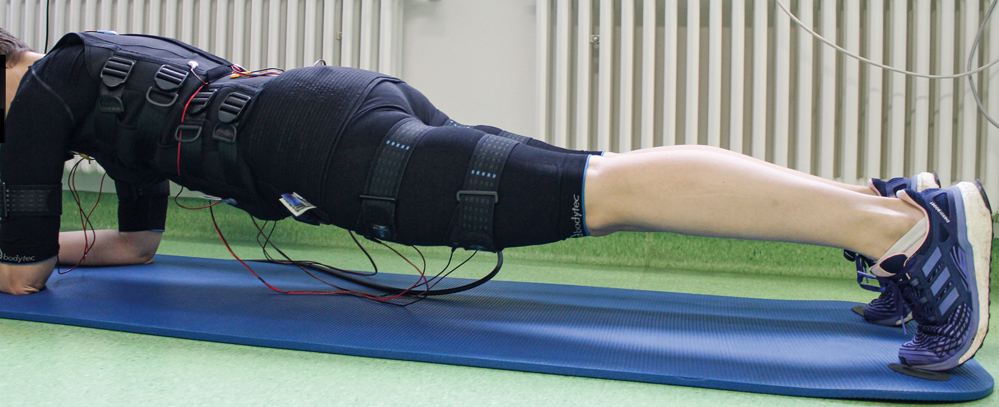
Abbildung 2: Muskeltraining mittels Ganzkörper-Elektromyostimulation.
Die Patientin setzte auch die Vorgaben zur eiweißreichen Ernährung sehr gut um. Die Analyse der Drei-Tage-Ernährungsprotokolle im Verlauf zeigte eine Zufuhr im oberen Zielbereich von ca. 90 g hochwertigen Proteinen pro Tag bei einer bedarfsdeckenden Energiezufuhr von 1.900 bis 2.000 kcal.
Die Messung der Körperzusammensetzung mittels multifrequenter Bioimpedanzanalyse zeigte nach drei Monaten einen Anstieg der Skelettmuskelmasse von 19.9 kg auf 21.0 kg. Nicht nur die Muskelmasse, auch die körperliche Funktionalität (Muskelkraft und kardio-pulmonale Leistungsfähigkeit) verbesserte sich: Die Patientin steigerte sich im Sechs-Minuten-Gehtest um 30 Prozent von 600 m auf 780 m und bei der Handkraft um 13,3 Prozent von 30 kg auf 34 kg. Weiterhin verbesserte sich der Karnofsky-Index (Tabelle 3) von 60 auf 80.

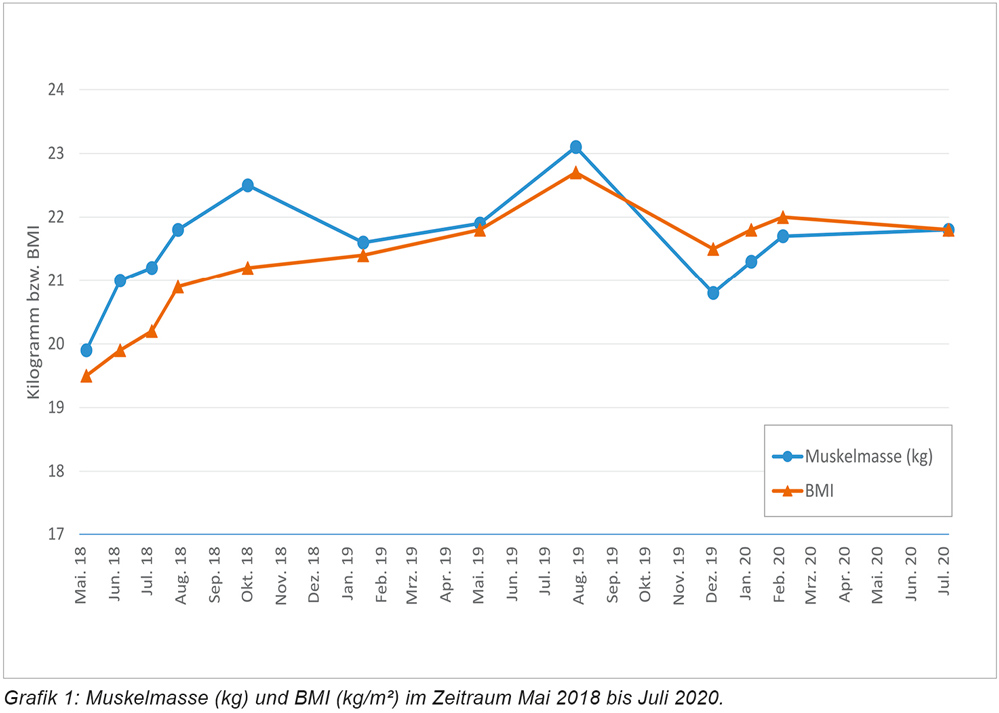
Nach Abschluss des Programmes Ende Juli 2018 führte die Patientin auf eigenen Wunsch die kombinierte Ernährungs- und Sporttherapie weiter fort. Erfreulicherweise blieben der Ernährungszustand und der muskuläre Status der Patientin unter diesen Maßnahmen auch im Langzeitverlauf stabil (Grafik 1). Die Chemotherapie konnte mit neun Zyklen FOLFIRINOX planmäßig und in unveränderter Dosierung von April bis September 2018 durchgeführt werden. Es zeigte sich ein sehr gutes Therapieansprechen mit deutlichem Regress der Metastasen, woraufhin ab September 2018 auf eine orale Erhaltungstherapie mit Olaparib (PARP-Inhibitor – nur für Tumoren mit BRCA-Genmutation) umgestellt wurde.
Im Hinblick auf die Verbesserung der kardiorespiratorischen Fitness besprachen wir mit der Patientin, zusätzlich zum Krafttraining ein Fahrradergometertraining durchzuführen. Die Patientin nahm dieses Angebot sehr gerne an und absolvierte im Rahmen einer laufenden Pilotstudie und ergänzend zum WB-EMS-Training zweimal wöchentlich ein hocheffizientes Herz-Kreislauftraining in Form eines 15-minütigen, hochintensiven Intervalltrainings (HIIT) auf dem Fahrradergometer (Abbildung 3). Zur Ermittlung der individuellen Trainingsintensität wurde die maximale Sauerstoffaufnahme (VO2max) mittels Spiroergometrie gemessen. Die Patientin absolvierte dieses intensive, zeiteffiziente Training mit großer Motivation über zehn Wochen, bis aufgrund der Corona-Pandemie das Training in unserem Zentrum vorübergehend eingestellt werden musste.

Abbildung 3: Patientin beim hochintensiven Intervalltraining (HIIT).
Im onkologischen Verlauf wurde die orale systemische Therapie mit Olaparib von der Patientin weitgehend nebenwirkungsfrei vertragen, und in den Restaging-Untersuchungen zeigte sich eine stabile Krankheitssituation. Im Januar 2020 erfolgte eine Radiofrequenzablation und im Mai 2020 eine Re-Ablation einer progredienten Lebermetastase.
Der beschriebene Fallbericht zeigt eindrücklich die hohe Relevanz, Krebspatienten auf ihren Ernährungszustand hin zu screenen und frühzeitig sowie parallel zur antitumoralen Therapie eine individualisierte, kombinierte Ernährungs- und Sporttherapie durchzuführen [8]. Die frühzeitige orale Ernährungstherapie konnte bis jetzt invasive ernährungstherapeutische Maßnahmen vermeiden. Das effektive und zeiteffiziente Muskeltraining konnte gut in den onkologischen Behandlungsablauf integriert werden und verbesserte in Kombination mit der eiweißreichen Ernährungstherapie den muskulären Status und die Leistungsfähigkeit der Patientin trotz der belastenden Chemotherapie deutlich. Zudem unterstützte der gute körperliche und muskuläre Zustand den Erfolg der Chemotherapie, indem diese bei sehr guter Verträglichkeit planmäßig durchgeführt werden konnte. Die Kombination aller Maßnahmen hat entscheidend zu dem bisher günstigen Verlauf der schweren Tumor-erkrankung beigetragen.
Die an diesem Fallbericht gezeigten positiven Effekte (Steigerung der Muskelmasse, Verbesserung der körperlichen Funktionalität und Leistungsfähigkeit) durch proteinreiche Ernährung in Kombination mit einem effektiven Muskeltraining konnten wir in randomisierten und kontrollierten klinischen Studien sowohl bei Patienten mit fortgeschrittenen soliden Krebserkrankungen (n=131) als auch bei hämatoonkologischen Patienten (n=31) beobachten [9, 10, 11].
Ernährung und Sport: Wichtige Bausteine einer multimodalen Therapie des Tumorkachexiesyndroms
Krebserkrankungen sind mit einem hohen Risiko für eine Mangelernährung und einen progressiven Muskelabbau verbunden (Tumorkachexie) [12]. Die Tumorkachexie ist multifaktoriell bedingt und sollte daher multimodal therapiert werden [13, 14]. Häufig findet sich ein systemisches Inflammationssyndrom, das sich auf den Protein-, Kohlenhydrat- und Lipidstoffwechsel der Leber und der peripheren Organe auswirkt und die Nährstoffverwertung beeinträchtigt. Neben einer schlechteren Verträglichkeit der onkologischen Behandlungsmaßnahmen und einem erhöhten Morbiditäts- und Mortalitätsrisiko führt der Verlust an Muskelmasse und -funktionalität zu einer verminderten körperlichen Aktivität und Leistungsfähigkeit sowie zur Einschränkung der Selbstständigkeit und Selbstbestimmung des Patienten im Alltag – mit negativen Auswirkungen auf die Lebensqualität [15]. Für Patienten mit Krebserkrankungen, die nicht mehr kurativ behandelt werden können, ist die Erhaltung oder Verbesserung der Leistungsfähigkeit und Lebensqualität ein primäres Ziel des onkologischen Behandlungskonzeptes. In dieser Situation werden ernährungs-, sport- und bewegungstherapeutische Maßnahmen als wesentliche Elemente der Supportivtherapie empfohlen [16].
Fall 3: D-Laktatazidose bei einer Patientin mit Kurzdarmsyndrom
Anamnese:
Eine 25-jährige Patientin mit Kurzdarmsyndrom (KDS) bei Zustand nach mehrfachen Dünndarmresektionen infolge Bridenilei, ausgehend von einer Appendektomie und Meckel-Divertikel-Exzision im Alter von 8 Jahren (Restdünndarm 90 bis 100 cm, Kolon in Kontinuität), stellte sich am 5. Juli 2020 in der internistischen Notaufnahme des Universitätsklinikums Erlangen vor. Die Patientin ist seit zwei Jahren in der Spezialsprechstunde für Kurzdarmpatienten angebunden. Ihr Gesundheits- und Ernährungszustand war im Verlauf unter optimierter oraler Ernährung und ergänzender parenteraler Nährstoff- und Flüssigkeitszufuhr stabil (täglich 1.000 ml Voll-Elektrolytlösung, einmal wöchentlich parenterale Ernährung mit 1.070 kcal als industrieller Dreikammerbeutel inklusive Vitamine und Spurenelemente). Die Stuhlfrequenz betrug zuletzt im Mai 2020 unter Einnahme von Tinctura opii (täglich 15 Tropfen) zwischen vier bis zehn Stuhlgängen pro Tag (Bristol-Stuhl-Skala 5 bis 7).
Sie berichtete nun über seit zwei Wochen bestehenden Schwankschwindel, Konzentrationsschwäche, pulsierende Kopfschmerzen, inspiratorisch thorakales Beklemmungsgefühl, Schwächegefühl sowie Muskelkrämpfe in den Waden. Vor acht Tagen stellte sie sich bereits mit dieser Symptomatik in einer Klinik in der Notaufnahme vor. Die dort durchgeführte arterielle Blutgasanalyse zeigte eine kompensierte metabolische Azidose mit erhöhter Anionenlücke, die restliche umfangreiche klinische Diagnostik zeigte einen Normalbefund. Zum Zeitpunkt der erstmaligen Beschwerden hatte die Patientin unter T. opii lediglich noch ein bis zwei Stuhlgänge täglich.
Diagnostik und Therapie:
Die Patientin wurde stationär aufgenommen. Die initial angefertigte Laboruntersuchung war weitestgehend unauffällig. Die venöse Blutgasanalyse zeigte einen pH von 7,30 und einen Base Excess von -1,1 mmol/l. Die übrigen Blutwerte, inklusive Elektrolyte und Thiamin, zeigten einen normalen Befund. Die durchgeführte Diagnostik (Neurologie, HNO, transthorakale Echokardiographie, Lungenfunktion) war unauffällig. Aufgrund der Beschwerdesymptomatik und des Ausschlusses anderer Ursachen gingen wir von einer D-Laktatazidose aus. Die Bestimmung des D-Laktats im Blut bestätigte die Diagnose (0.97 mmol D-Laktat/l; Normwert: < 0.2 mmol/l).
Wir begannen mit der täglichen Infusion von Natriumbikarbonat (1 mmol/kg Körpergewicht über vier Stunden). Bereits nach zwei Infusionen besserten sich die Beschwerden deutlich (keine Muskelkrämpfe, Patientin konnte wieder eigenständig gehen). Lediglich die Konzentrationsschwäche persistierte, sodass wir am dritten Tag eine weitere Bikarbonatinfusion in derselben Dosierung durchführten. Danach war auch die Konzentrationsschwäche nicht mehr vorhanden. Parallel zur Bikarbonatinfusion begannen wir mit einer oralen antibiotischen Therapie (550 mg Rifaximin 1–1–1) zur Behandlung der Darmmikrobiota und damit zur Reduktion der Produktion von D-Laktat.
Ernährungstherapeutisch erfolgte die Nährstoffzufuhr bedarfsdeckend komplett parenteral über den liegenden Portkatheter. Durch die Nahrungskarenz sollte vermieden werden, dass unverdaute Nährstoffe, insbesondere fermentierbare Kohlenhydrate, in die unteren Darmabschnitte gelangen und dort durch die Darmflora zu D-Laktat oder anderen unerwünschten Substraten verstoffwechselt werden.
Verlauf:
Unter den beschriebenen Maßnahmen waren die neurologischen Symptome rasch komplett rückläufig, und der klinische Zustand stabilisierte sich. Bereits drei Tage nach Therapiebeginn befand sich der Blutspiegel von D-Laktat wieder im Normbereich. Nach Entlassung wurde die Antibiose bis Tag 14 fortgeführt, ebenso die bedarfsdeckende parenterale Ernährung. Mit Ende der Antibiotikatherapie wurde die orale Nahrungszufuhr sukzessive gesteigert und die parenterale Ernährung entsprechend reduziert.
D-Laktatazidose bei KDS
Die D-Laktatazidose ist eine seltene Komplikation bei Patienten mit KDS. Sie äußert sich durch neurologische Symptome und kann zu schwerwiegenden Komplikationen führen [17]. Durch die verkürzte gastrointestinale Transitzeit können unverdaute Kohlenhydrate, inklusive FODMAPs, in die unteren Darmabschnitte gelangen und dort bakteriell fermentiert werden. Das resultierende saure Milieu begünstigt das Wachstum D-Laktat-produzierender Bakterien. In der Folge akkumuliert D-Laktat im Blut, begleitet von neurologischen Symptomen.
Diagnostische Kriterien sind eine metabolische Azidose mit erhöhter Anionenlücke, normales L-Laktat, Ausschluss anderer metabolischer Ursachen für eine Azidose, Vorliegen eines KDS oder anderer Formen der Malabsorption und charakteristische neurologische Symptome. Ein erhöhter D-Laktat-Blutspiegel bestätigt die Diagnose [18].
Beginn und Schweregrade der D-Laktatazidose sind jedoch bisher kaum verstanden, ebenso wenig wie die Stoffwechselwege im Metabolismus von D-Laktat und die pathophysiologischen Mechanismen der neurologischen Symptome. Da keine eindeutige Korrelation zwischen den D-Laktat-Konzentrationen und dem neurologischen Phänotyp nachgewiesen wurde, wird vermutet, dass die neurologischen Symptome durch andere spezifische Stoffwechselprodukte des Bakterienwachstums verursacht werden können, wie zum Beispiel Neurotoxin-Mercaptane, Aldehyde oder andere Stoffe, die als falsche Neurotransmitter fungieren könnten [19].
Bei Patienten mit KDS sollte bei neurologischen Symptomen frühzeitig an eine D-Laktatazidose gedacht werden. Der pH-Wert in der venösen Blutgasanalyse kann trotz bestehender D-Laktatazidose unauffällig sein. Die Therapie besteht in der Korrektur der Azidose durch Infusion von Natriumbikarbonat, der antibiotischen Sanierung der Darmflora (nicht resorbierbares Breitbandantibiotikum, zum Beispiel Rifaximin, über zehn bis 14 Tage) und möglichst einer – vorübergehenden – oralen Nahrungskarenz. Die Nährstoffzufuhr sollte bedarfsdeckend parenteral erfolgen. Mit Beendigung der Antibiotikagabe kann die parenterale Ernährung wieder reduziert und Kohlenhydrate inklusive FODMAPs sollten langsam wieder in die normale Ernährung eingeführt werden.
Definition chronisches Darmversagen inklusive Kurzdarmsyndrom (KDS)
Der Begriff Darmversagen bezeichnet die Unfähigkeit, wegen einer eingeschränkten resorptiven Kapazität des Darms (Obstruktion, Dysmotilität, chirurgische Resektion, kongenitale Erkrankung, krankheitsassoziierte verminderte Absorption) die Protein-, Energie-, Flüssigkeits- und Mikronährstoffbilanz aufrechtzuerhalten.
Der Begriff KDS bezeichnet ein Darmversagen nach ausgedehnter Resektion des Dünndarms. Wegen der eingeschränkten resorptiven Kapazität des Restdarms kann die Energie-, Nährstoff- und Flüssigkeitsbilanz mit einer konventionellen Diät nicht aufrechterhalten werden [20].
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Wichtigste in Kürze
zu Fall 1: Laut Leitlinien (S3-Leitlinie Reizdarmsyndrom) kann bei RDS eine FODMAP-arme Diät ausgetestet werden. Bestehen unter dieser speziellen Diätform jedoch weiterhin Beschwerden oder bei Non-Compliance der Patienten, kann alternativ eine glutenfreie Diät angewandt werden. Patienten mit Reizdarmsymptomatik können unter Umständen eine Glutensensitivität besitzen. Bei klinischem Verdacht auf eine Glutenunverträglichkeit sollten jedoch unter glutenhaltiger Diät eine Zöliakie und eine Weizenallergie ausgeschlossen werden. Patienten mit Glutensensitivität können nach anfänglich strikter Diät meist wieder geringe Mengen an glutenhaltigen Nahrungsmittel tolerieren. Es existiert ein individueller Schwellenwert.
zu Fall 2: Mit dieser Kasuistik soll auf die Bedeutung kombinierter ernährungs- und sportmedizinischer Maßnahmen in der Behandlung von Tumorpatienten hingewiesen werden. Als wesentliche Bausteine einer multimodalen Therapie des Tumorkachexiesyndroms können sie den körperlichen und muskulären Status der Patienten stabilisieren, die Leistungsfähigkeit und Lebensqualität steigern und die Verträglichkeit der antitumoralen Therapie verbessern. Die Kasuistik zeigt eindrucksvoll deren Wirksamkeit und Nutzen, wenn sie frühzeitig und mit Beginn der onkologischen Therapie initiiert sowie auf den individuellen Ernährungs- und Leistungsstatus sowie das onkologische Behandlungskonzept abgestimmt werden. Sie zeigt auch, wie wichtig die multidisziplinäre Zusammenarbeit zwischen Ernährungsmedizinern, nicht-medizinischen Ernährungsfachkräften, Sportmedizinern und Onkologen ist.
zu Fall 3: Bei plötzlich auftretenden neurologischen Symptomen sollte bei Kurzdarmpatienten an eine D-Laktatazidose gedacht werden. Die Therapie besteht in der Korrektur der Azidose, der antibiotischen Behandlung der Darmmikrobiota und einer vorübergehenden Nahrungskarenz bei bedarfsdeckender parenteraler Ernährung.
Die dritte Kasuistik soll am Beispiel der seltenen D-Laktatazidose die Komplexität der Betreuung von Patienten mit KDS verdeutlichen. In der Adaptationsphase des KDS sollte eine besonders engmaschige Betreuung durch ein spezialisiertes Team erfolgen, um die meist notwendige parenterale Ernährungs- und Flüssigkeitszufuhr der sich ändernden Resorptionsleistung des verbliebenen Restdarmes anzupassen. Die Anbindung an ein für dieses Krankheitsbild spezialisiertes Team ist für die Patienten auch im Langzeitverlauf wichtig, um beispielsweise seltene Komplikatio-nen frühzeitig zu erkennen und zu therapieren oder neue medikamentöse Therapieoptionen (zum Beispiel GLP-2 Analoga) zu erwägen.
Autoren

Professorin Dr. med. Yurdagül Zopf

Privatdozentin Dr. rer. nat. Walburga Dieterich

Dr. oec. troph. Hans Joachim Herrmann
Universitätsklinikum Erlangen, Medizinische Klinik 1, Hector-Center fürErnährung, Bewegung und Sport, Ulmenweg 18, 91054 Erlangen
Teilen:
Das könnte Sie auch interessieren:







