Drei Highlights aus der Rheumatologie
 Rheumatologie © reineg – fotolia.de
Rheumatologie © reineg – fotolia.de
In den vergangenen zwei Jahrzehnten hat die Rheumatologie bedeutende, vor allem medikamentöse Innovationen und Entwicklungen durchlebt. Dadurch kann ein Großteil der chronisch-entzündlichen Systemerkrankungen, zum Beispiel rheumatoide Arthritis, Psoriasisarthritis, Gruppe der Spondyloarthritiden, sehr effektiv behandelt werden. Die Therapieziele sind heute klar in den geltenden nationalen wie internationalen Leitlinien formuliert – insbesondere optimaler Behandlungserfolg mit möglichst Krankheitsstillstand (Remission) durch schnelle Diagnosestellung, umgehenden gezielten Therapiebeginn und ein strategisches Vorgehen (treat-to-target). Hierbei stehen uns neben symptomatischen (zum Beispiel NSAR, Glukokortikoide) mittlerweile eine Vielzahl von gezielten krankheitsmodifizierenden Medikamenten zur Verfügung:
» konventionelle synthetische Disease-modifying-antirheumatic-drugs (csDMARDs, zum Beispiel Methotrexat – MTX, Leflunomid)
» biologische DMARDs einschließlich Biosimilars (bDMARDs)
» neue, auf die Molekularstruktur zielgerichtete (targeted) synthetische orale DMARDs wie Januskinase-Inhibitoren (tsDMARDs)
Glukokortikoide haben immer noch ihren Stellenwert in der Akuttherapie, im Langzeitverlauf sollten sie aber möglichst vermieden bzw. notfalls in der niedrigst möglichen Dosierung komedikativ eingesetzt werden.
Rheumatische Erkrankungen sind überwiegend Systemerkrankungen und betreffen nicht nur den Bewegungsapparat, sondern auch potenziell viele andere Organe. Deshalb sollten Ärzte gerade in Zeiten zunehmender Spezialisierung mehr als das fachbezogene erkrankte Organ sehen und zugleich die in den vergangenen Jahren mehr und mehr in den Fokus gerückten (insbesondere kardiovaskulären) Komorbiditäten konsequent mitbehandeln. Der „klassische“ Rheumapatient stirbt in der Regel nicht an seiner primären rheumatischen Erkrankung, sondern an den Folgen von Komorbiditäten und Komplikationen (zum Beispiel kardiovaskulär, infektiös etc.). Insbesondere hinsichtlich der erhöhten Infektionsgefahr spielen Glukokortikoide dosisabhängig bei Weitem die größte Rolle!
Die Rehabilitation mit ihrem ganzheitlichen Ansatz (bio-psycho-soziales Modell) hat das klare Ziel, die Partizipation von Patienten sowohl am Arbeitsplatz als auch am alltäglichen Leben zu erreichen bzw. wiederherzustellen. Dabei ist wichtig, dass sowohl individuelle patientenbezogene als auch Umweltfaktoren berücksichtigt werden. Durch umfassende Informationen (Schulungen, Vorträge, Seminare), aktive bewegungs-/sporttherapeutische, passive balneo-physikalische Maßnahmen und darüber hinaus Ergotherapie, psychologische Verfahren, Diätberatung und vieles mehr, versucht die Rehabilitation, neben der wichtigen Krankheitsbewältigung die Patienten zu einem dauerhaft gesünderen Lebensstil und mehr Eigenverantwortung und Eigeninitiative zu animieren. Der zunehmende Anteil von Patienten mit chronischen Schmerzen und/oder psychosomatischer Krankheitskomponente spiegelt den Praxisalltag auch in der Rehabilitation wider, sodass die korrekte sozialmedizinische Leistungsbeurteilung hinsichtlich Beruf bzw. letzter ausgeübter sozialversicherungspflichtiger Tätigkeit und allgemeinem Arbeitsmarkt immer wieder eine Herausforderung darstellt. Es treten häufig Erkrankungen auf, mit denen auch Hausärzte oder andere Fachärzte jederzeit konfrontiert werden können.
Fall 1
Eine 48-jährige, verheiratete, kinderlose Patientin, die von Beruf Lehrerin in Vollzeit und seit drei Jahren Konrektorin ist, empfinde ihre Tätigkeit als zunehmend „stressig“. Sie habe eine hohe Verantwortung und viele organisatorische Aufgaben zusätzlich zu ihrem Unterricht. Der Umgang mit ihren Schülern werde immer schwieriger. Zu schaffen mache ihr vor allem der rüde Ton, die mangelnde Disziplin und die zunehmende Respektlosigkeit gegenüber Vorgesetzten. Zu ihrem Direktor und ihren Kolleginnen habe sie ein gutes Verhältnis.
Sie klagt seit ca. 1,5 Jahren über zunehmende, ziehend-drückende, teils nach distal ausstrahlende Schmerzen im muskulären Bereich von Nacken-/Schulterregion, gesamtem Rückenbereich, Armen und Beinen mit lokal zunehmender Druckempfindlichkeit. Gelenksbezogene Schmerzen und Schwellungen seien nicht aufgetreten. Eine vom behandelnden Orthopäden verordnete Massagebehandlung musste die Patientin schmerzbedingt abbrechen. Die Schmerzen treten in Ruhe und Belastung auf, seien ständig vorhanden, wenn auch in wechselnder Intensität, schmerzfrei sei sie überhaupt nicht mehr. An Vorerkrankungen sei eine Psoriasis vulgaris seit der Jugend bekannt. 2012 wurde eine Psoriasisarthritis diagnostiziert mit blandem Verlauf unter effektiver medikamentöser Einstellung (Haut und Gelenke) mittels MTX und bedarfsweise (selten) NSAR/topischen Dermatika. An zusätzlichen Symptomen werden rezidivierende Schlafstörungen, Tagesmüdigkeit, Erschöpfungssymptomatik, Kopfschmerzen, Konzentrationsstörungen und weitere vegetative Symptome (unter anderem Verdauungsstörungen und Stuhlunregelmäßigkeiten) angegeben. Umfangreiche internistische, orthopädische und neurologische Abklärungen ergaben bisher keinen pathologischen Befund. An Medikamenten wurden neben MTX 15 mg pro Woche s. c. und Folsäure 5 mg am Folgetag, bedarfsweise zuletzt Analgetika wie Paracetamol, Ibuprofen, Novamin, jeweils ohne subjektiv befriedigende Wirkung, eingenommen. Gelegentlich werden topische Dermatika (wegen blander Psoriasis vulgaris) angewendet. Eine vor Jahren diagnostizierte Hypothyreose ist adäquat euthyreot substituiert. Bei ambulanter Arbeitsdiagnose eines chronischen Schmerzsyndroms und wegen seit über fünf Monaten bestehender Arbeitsunfähigkeit wurde eine stationäre Rehabilitation initiiert.
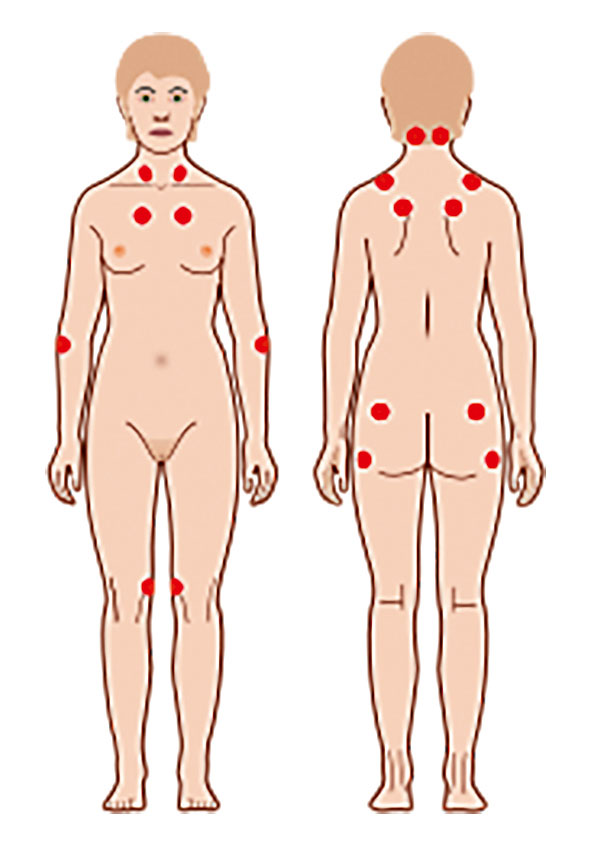
Abbildung 1: Fibromyalgie-Syndrom (FMS) – 18 definierte Tender Points der ACR-1990-Klassifikationskriterien (mindestens elf der 18 Tender Points müssen empfindlich sein).
Die körperliche Untersuchung zeigte einen unauffälligen internistischen Aufnahmebefund, auffällig polytope Druck- und Berührungsempfindlichkeit an zwölf von 18 typischen Tender Points (Abbildung 1), zusätzlich deutlicher Druckschmerz auch an diversen anderen Kontrollpunkten (Muskel-/Weichteilbereich im Rumpf- und Extremitätenbereich). Von rheumatologischer Seite (seit Jahren bekannte) Daktylitis II. Zehe rechts ohne lokalen Druckschmerz, auch sonst keine zusätzlichen geschwollenen oder druckschmerzhaften Gelenke feststellbar, Wirbelsäulenbereich mit diskreter Skoliose, altersentsprechend beweglich, beidseits waren deutliche paravertebrale Muskelverspannungen im Bereich der Hals- und Brustwirbelsäule vorhanden. Es zeigten sich minimale Psoriasis-Effloreszenzen über der Ellbogenstreckseite beidseits. Es lagen weder eine Nagel- noch eine Kopfhautbeteiligung vor. Neurologisch waren keine sensomotorischen Ausfälle zu verzeichnen. Auf der Schmerzskala (Numerische Rating-Skala – NRS) wurde 7/10 genannt, der Symptomschwere-Score (SSS) lag bei 8 (Tabelle 1, Abbildung 2).
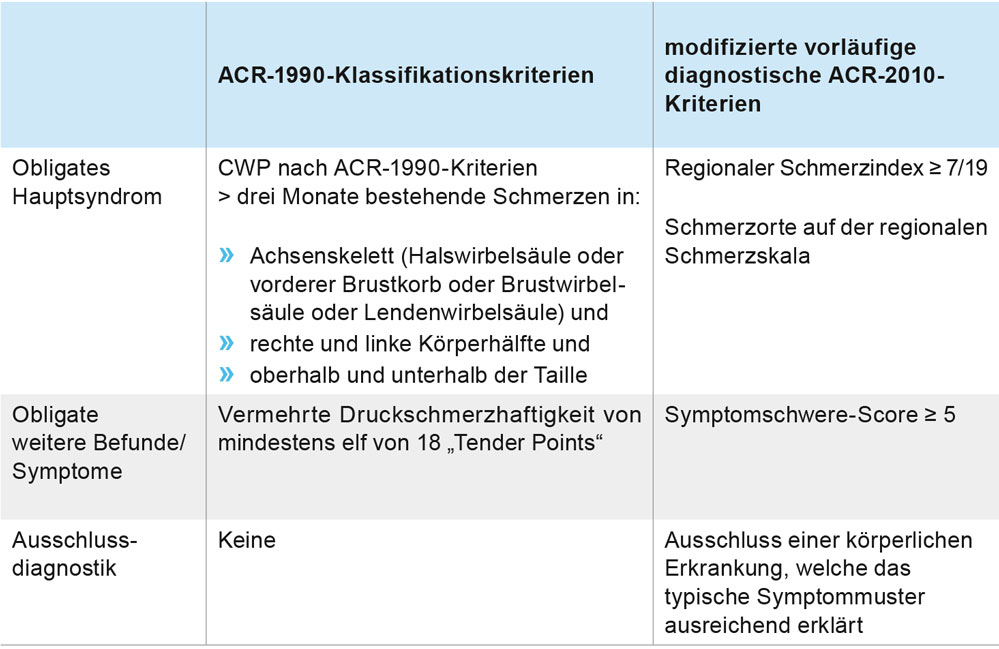
Tabelle 1: ACR-Krititerien 1990 und 2010 für das Fibromyalgie-Syndrom (FMS). CWP = „chronic widespread pain“, Symptomschwere-Score (SSS): Summe von Müdigkeit, nichterholsamen Schlaf, kognitiven Problemen (0 = nicht vorhanden bis 3 = extrem ausgeprägt), Kopfschmerzen, Bauchschmerzen, Depression (jeweils 0 = nicht vorhanden, 1 = vorhanden), Spannweite des Summen-Scores: 0 bis 12 (siehe auch Abbildung 2 und 3, Teil I+II).
Das ausführliche internistische Aufnahmelabor (einschließlich BKS, CRP, Blutbild, TSH basal, Vitamin D, CK, Krea/GFR, Elektrolyte, Leberwerte usw.) war bis auf ein leicht erhöhtes Gesamt-Cholesterin unauffällig. Die von der Patientin mitgebrachten umfangreichen ärztlichen Vorbefunde (Labor, Bildgebung usw.) ergaben keinen Hinweis auf eine zusätzliche somatische Erkrankung, weswegen wir von einer weiteren spezifischen Diagnostik absahen (leitlinienkonform). Ein Screening auf vermehrte seelische Symptombelastung (Angst, Depression) ergab Hinweise auf eine leichte Depressivität.

Abbildung 2: Fibromyalgiesymptom-Fragebogen (Teil I bis IV) – Der Gesamtscore (maximal 31 Punkte) des Fragebogens ist die Summe des Symptomschwere-Scores SSS (Teil I+II, maximal zwölf Punkte) und des Regionalen Schmerzindex (Teil III, maximal 19 Punkte), leichtere Form des FMS: Gesamtscore zwölf bis 19, schwerere Form: Gesamtscore 20 bis 31.
Somit waren die ACR-Kriterien (ACR = American College of Rheumatology) für ein Fibromyalgie-Syndrom (FMS) erfüllt. Die Patientin erhielt leitliniengerecht ein multimodales Behandlungsprogramm aus unter anderem aktiver Bewegungstherapie, passiven Behandlungsverfahren und psychoedukativen Therapien (Einzelgespräche, Schmerz-/Stressgruppe, Progressive Muskelrelaxation – PMR – als Entspannungsverfahren), von medikamentöser Seite niedrigdosiert Amitriptylin (anfangs 10, dann 25 mg/die). Während des vierwöchigen Reha-Verlaufs kam es zwar zweimal zu einer kurzzeitigen Schmerzverstärkung, was am ehesten mit der Dauer/Intensität des absolvierten Sport- und Bewegungsprogrammes korrelierte, am Ende berichtete die Patientin jedoch über eine deutlich gebesserte Schmerzsymptomatik (NRS: 7/10 auf 3/10). Ebenfalls deutlich gebessert waren Kopfschmerzen, Schlafverhalten und Tagesmüdigkeit, sie fühle sich insgesamt körperlich deutlich fitter. Die psychoedukativen Therapien in der Klinik haben ihr sehr geholfen, einiges im privaten und beruflichen Bereich in Zukunft „anders zu machen“.
Zur Stabilisierung des Reha-Erfolgs wurde als ambulante sportliche Nachsorgeleistung in Heimatnähe Rehabilitationssport (Trocken- und Wassergruppe) für sechs Monate verordnet, über den psychologischen Dienst der Klinik wurde der Weg für eine ambulante psychotherapeutische Vorstellung (Weiterbehandlung) am Heimatort geebnet. Die Patientin ist zuversichtlich, unter weiterer Stabilisierung ihres Gesundheitszustandes in absehbarer Zeit wieder in ihrem Beruf als Lehrerin arbeiten zu können.
Das FMS ist ein funktionelles somatisches Syndrom (Beschwerdekomplex) mit den Kernsymptomen chronischer Schmerz in mehreren Körperregionen, Schlafstörungen bzw. nicht erholsamer Schlaf und Müdigkeit bzw. Erschöpfungsneigung (körperlich und/oder geistig). Die aktuelle Studienlage erlaubt keine Aussagen zur Pathophysiologie des FMS. Vermutet wird, dass im Rahmen eines bio-psycho-sozialen Krankheitsmodells äußere Faktoren, wie zum Beispiel kritische Lebensereignisse oder Vorerkrankungen und lernabhängige Faktoren (inadäquate Strategien zur Trauma-/Stressbewältigung) bei entsprechender genetischer Prädisposition zu Veränderungen des zentralen, peripheren und autonomen Nervensystems führen. Dies führt zu einem heterogenen Beschwerdebild mit Schmerz, Fatigue, Schlafstörungen, vegetativen und psychischen Symptomen (Tabelle 2) [1].

Tabelle 2: Mögliche funktionelle Störungen.
Die klinische Diagnose des FMS kann nach den ACR-Klassifikationskriterien von 1990 oder den modifizierten ACR-Kriterien von 2010 gestellt werden (Tabelle 1) [1, 2]. Sie beruht auf der Anamnese des typischen Symptomkomplexes, der klinischen Untersuchung und dem Ausschluss anderer als Ursache in Frage kommender Erkrankungen. Die Diagnose kann also auch ohne Untersuchung der Tender Points gestellt werden. Das FMS ist nicht pauschal mit einer anhaltenden somatoformen Schmerzstörung (ICD-10: F45.40) bzw. einer chronischen Schmerzstörung mit psychischen und somatischen Faktoren (ICD-10: F45.41) bzw. einer somatischen Belastungsstörung gleichzusetzen. Unterschiedlich schwere Verlaufsformen existieren, eine allgemein anerkannte Schweregradeinteilung existiert jedoch nicht. Empfohlene krankheitsspezifische Testinstrumente sind der FM-Symptom-Fragebogen (Abbildung 2) [1, 3], der Patient-Health-Questionnaire 15 (PHQ-15-Score) [1, 4] und der Fibromyalgia-Impact-Questionnaire (FIQ) [1, 5]. Die obligate somatische Diagnostik bei Erstevaluation eines möglichen FMS umfasst:
» Ausfüllen einer Schmerzskizze/Schmerzskala und des Fibromyalgie-Symptom-Fragebogens
» Gezielte Exploration weiterer Kernsymptome (Müdigkeit, Schlafstörungen, Konzentrationsstörungen)
» Vollständige medizinische Anamnese inklusive Medikamentenanamnese
» Vollständige körperliche Untersuchung (inklusive Haut-, neurologischem und orthopädischem Befund)
» Basislabor (unter anderem BKS, CRP, CK, Calcium, TSH basal, 25-OH-Vitamin D3)
» Screening auf vermehrte seelische Symptombelastung (Angst und Depression), zum Beispiel mittels Gesundheitsfragebogen PHQ-4 [1, 6].
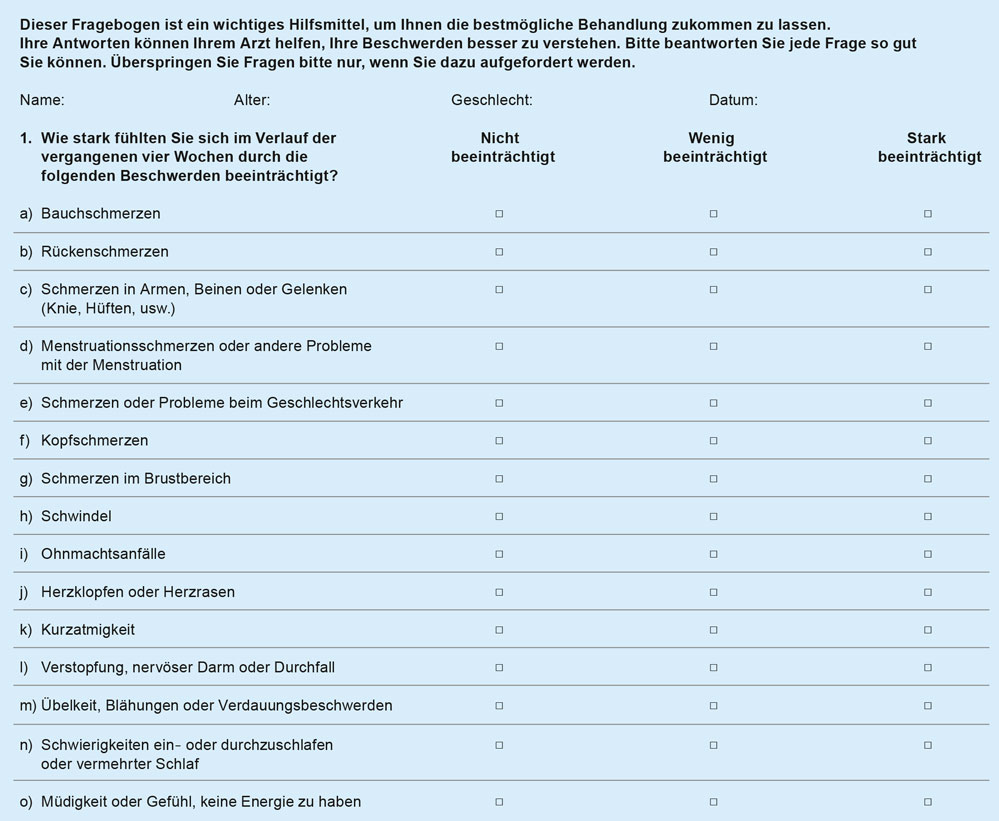
Abbildung 3: Gesundheitsfragebogen PHQ-15 – nicht beeinträchtigt = 0, wenig beeinträchtigt = 1, stark beeinträchtigt = 2; Berechneter Skalensummenwert: 0 bis 4 = minimale somatische Symptomstärke/Somatisierung, 5 bis 9 = milde somatische Symptomstärke/Somatisierung, 10 bis 14 = mittelgradig ausgeprägte Symptomstärke/Somatisierung, 15 bis 30 = schwer ausgeprägte Symptomstärke/Somatisierung
Eine fachpsychotherapeutische Untersuchung wird bei bestimmten Konstellationen (Tabelle 3) empfohlen [7].

Tabelle 3: Indikationen zu fachpsychotherapeutischer Abklärung.
Bei typischem Beschwerdekomplex und fehlenden klinischen Hinweisen auf internistische, orthopädische oder neurologische Erkrankungen wird empfohlen, keine weitere apparative Diagnostik durchzuführen.
Zu Beginn der Behandlung ist eine ausführliche Information des Patienten über die Diagnose eines FMS in folgenden Punkten wichtig:
» Keine organische Krankheit, sondern eine funktionelle Störung
» Legitimität der Beschwerden
» Erklärung der Beschwerden mithilfe eines bio-psycho-sozialen Krankheitsmodells in anschaulicher Weise, zum Beispiel durch das Vermitteln psycho-physiologischer Zusammenhänge (Stress, Teufelskreis-Modell)
» Normale Lebenserwartung
» Linderung der Beschwerden durch eigene Aktivitäten der Patienten
Für das Behandlungskonzept wichtig sind:
» Erarbeitung individueller und realistischer Therapieziele
» Partizipative Entscheidungsfindung mit Besprechung eines möglichen Nutzens oder Schadens von (nicht-)medikamentösen Therapieoptionen
» Behandlung häufiger komorbider seelischer (zum Beispiel Depression) und körperlicher (Kreuzschmerz) Störungen entsprechend aktueller Leitlinien
» Regelmäßige Überprüfung des Nutzens (Symptomreduktion und Verbesserung der Leistungsfähigkeit versus Nebenwirkungen und Aufwand) einer eingeleiteten Therapie, Fortsetzung einer Therapie nur im Falle eines positiven Nutzens
» Berücksichtigung von Präferenzen/Komorbiditäten der Patienten
» Bei leichter Ausprägung des FMS Ermutigung zu angemessener körperlicher und psychosozialer Aktivierung
» Bei schwererer Ausprägung des FMS Besprechen multimodaler Therapien und einer zeitlich befristeten medikamentösen Therapie
Behandlungsmöglichkeiten des FMS mit hohem Evidenzlevel sind:
» Ausdauertraining mit geringer bis mittlerer Intensität zwei- bis dreimal pro Woche über mindestens 30 Minuten, zum Beispiel schnelles Spazierengehen, Walking, Fahrradfahren, Ergometertraining, Tanzen, Aquajogging
» Wasser-/Trockengymnastik mit geringer bis mittlerer Intensität zwei- bis dreimal pro Woche über mindestens 30 Minuten
» Kognitive Verhaltenstherapie
» Entspannungsverfahren (zum Beispiel PMR), nur in Kombination mit anderen Verfahren
» Meditative Bewegungstherapien (zum Beispiel Tai Chi, Qigong, Yoga)
» Multimodale Therapie (mindestens ein aktives und ein passives Verfahren)
» Zeitlich befristet (drei bis sechs Monate) medikamentöser Einsatz von Amitriptylin (10 bis 50 mg/die)
» Weitere zeitlich befristete medikamentöse Therapiemöglichkeiten sind der selektive Serotonin-Noradrenalin-Wiederaufnahmehemmer (SSNRI) Duloxetin (bei komorbider Majordepression und/oder generalisierter Angststörung) sowie das zur Gruppe der Antikonvulsiva gehörende Pregabalin (bei komorbider generalisierter Angststörung). Nicht empfohlen werden starke Opioide und NSAR/COX-2-Hemmer).
Basierend auf zahlreichen Studien und breitem Konsens zwischen den Fachgesellschaften hat die 2017 veröffentlichte S3-Leitlinie zu einer Versachlichung der Diskussion über das FMS geführt und gleichzeitig evidenzbasierte Maßnahmen bezüglich Diagnostik, Therapie, Rehabilitation und ICF-basierter Begutachtung etabliert.
Fall 2
Bei einem 56-jährigen Patienten wurde im Juni 2011 eine rheumatoide Arthritis festgestellt. Er wurde anfangs mit Glukokortikoiden und NSAR und seit Juli 2017 mit DMARD MTX oral behandelt. Wegen insuffizienter Wirkung erfolgte eine Dosissteigerung von MTX und parenteraler Gabe. Im weiteren Verlauf wurde wegen anhaltender Krankheitsaktivität auf eine Kombination von MTX mit Leflunomid umgestellt. Ab Oktober 2012 wurde dann wegen insuffizienter Wirkung eine Kombination von MTX mit erstem Biologikum (TNF-alpha-Hemmer) gegeben. Ab März 2016 erfolgte eine Umstellung auf MTX und zweitem Biologikum (TNF-alpha-Hemmer). Seither zeigt sich ein stabiler Krankheitsverlauf. Eine Glukokortikoid-Gabe war in den vergangenen zwei Jahren nicht mehr notwendig. An Komorbiditäten sind bekannt: diätetisch beherrschbarer Diabetes mellitus Typ 2, Hypercholesterinämie und seit Kurzem arterielle Hypertonie. Bei Aufnahme zeigten sich laborchemisch keine erhöhten Entzündungsparameter, leicht erhöhte Transaminasen und S-Harnsäure von 8,4 mg/dl. Klinisch war ein Gelenk leicht geschwollen (Fingergrundgelenk II rechts) und keine relevante Morgensteifigkeit vorhanden. Disease-Activity-Score (DAS) 28 von 2,2 (entsprechend Remission), an Medikamenten wurden zu dem Zeitpunkt ein Statin, ASS 100 mg, ACE-Hemmer/HCT und 10 mg MTX s. c. in Kombination mit dem Biologikum Etanercept (TNF-alpha-Hemmer) verabreicht.
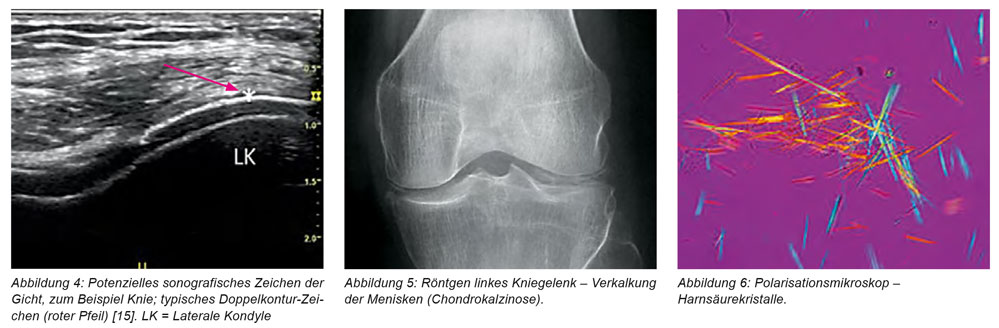
Während des stationären Reha-Aufenthaltes (am elften Tag) trat akut eine nächtliche Monarthritis des linken Kniegelenkes mit Überwärmung, Rötung und heftigsten Schmerzen auf. Anamnestisch berichtete der Patient, vor ca. zehn Wochen auf das linke Kniegelenk gestürzt zu sein, eine damalige orthopädische Abklärung einschließlich Röntgen habe keinen wegweisenden traumatischen Befund erbracht. Er habe ca. eine Woche entzündungshemmende Schmerzmittel eingenommen und das Kniegelenk geschont, nach drei Wochen sei er diesbezüglich ohne Medikamente beschwerdefrei gewesen. Zum Zeitpunkt der Kniegelenksarthritis zeigte sich sonografisch eine deutliche lokale Ergussbildung, minimale synoviale Proliferationszeichen, keine spezifischen pathologischen Knorpel-/Knochenstrukturen (zum Beispiel Doppelkonturzeichen bei Gicht, Abbildung 4). Das mitgebrachte Röntgenbild des linken Kniegelenkes zeigte neben leichtgradigen degenerativen Veränderungen feine Verkalkungen des Gelenkknorpels medial und lateral (Abbildung 5), aktuell laborchemisch deutlich erhöhte humorale Entzündungsparameter (BKS, CRP, Leukozytose), Harnsäure 7,2 mg/dl, übriges Routinelabor unauffällig. Zur differenzialdiagnostischen Abklärung (zum Beispiel Schub der rheumatoiden Arthritis, septische Arthritis, Pseudo-Gicht, Gicht usw.) wurde eine umgehende Gelenkpunktion durchgeführt. Dabei waren ein makroskopisch milchig-trüber Erguss, in der Synoviaanalyse eine hohe Zellzahl/Neutrophilenanteil, im Polarisationsmikroskop (Abbildung 6) nadel-/stäbchenförmige, negativ doppelbrechende, teils intrazelluläre Kristalle nachweisbar. Damit war die Diagnose „akute Arthritis urica“ gestellt.
Die 2016 aktualisierte Therapieleitlinie (S2e-Leitlinie) der Deutschen Gesellschaft für Rheumatologie [8] sieht für die Akuttherapie der Gicht in Abhängigkeit bestehender Komorbiditäten/Kontraindikationen mehrere medikamentöse Optionen vor: NSAR/COX-2-Hemmer, Colchicin oder Glukokortikoide. Wir entschieden uns aufgrund der Komorbiditäten (arterielle Hypertonie, Diabetes mellitus Typ 2) für Colchicin (Aufsättigung mit 1 mg, dann 3 x 0,5 mg/die bis zum Sistieren der Beschwerden, danach zur Anfallsprophylaxe 2 x 0,5 mg/die), zusätzlich lokale antiphlogistische Maßnahmen. Darunter kam es zu einer raschen Beschwerdelinderung. Parallel dazu begannen wir mit einer kausalen harnsäuresenkenden Therapie mit Allopurinol, bei normaler Nierenfunktion Startdosis 100 mg/die (empfohlene Dosissteigerung zum Beispiel alle zwei bis vier Wochen um 100 bis 200 mg bis zum Erreichen des Serumharnsäure-Zielwertes von < 6 mg/dl). Die Standarddosis beträgt 300 mg/die, die maximale Dosis bis 800 mg/die [8, 9]. Weitere zugelassene harnsäuresenkende Medikamente sind das Urikostatikum Febuxostat (bevorzugt bei eingeschränkter Nierenfunktion), Urikosurika (Benzbromaron, Probenecid) und in Kürze auch eine (6/2018 von der EMA zur Zulassung empfohlene, bereits über die internationale Apotheke erhältliche) fixe Kombination aus Allopurinol und Lesinurad (neues Wirkprinzip, ORAT1-Inhibitor).
Entgegen früheren Empfehlungen kann gemäß der Leitlinie von 2016 [8] schon vor Abklingen eines akuten Gichtanfalls mit der urikostatischen Therapie (Allopurinol/Febuxostat) begonnen werden. Auch eine bereits begonnene Urikostatika-Therapie sollte nicht wegen eines darunter (erneut) auftretenden Gichtanfalls unterbrochen werden, da Schwankungen des Serumharnsäurespiegels wiederum Gichtanfälle begünstigen können.
Die Prophylaxe mit Colchicin sollte in der Regel für ca. drei bis sechs Monate durchgeführt werden (Dosis: 0,5 bis 1 mg/die). Der dauerhafte Zielwert der Serumharnsäure nach einem Gichtanfall liegt bei < 6 mg/dl, bei Nachweis von Gichttophi < 5 mg/dl [8, 9, 10].
Als Ursache des erhöhten Harnsäurespiegels mit erstmaligem Gichtanfall kommt anamnestisch am ehesten eine vor ca. drei Monaten begonnene antihypertensive Therapie (Kombination aus ACE-Hemmer und HCT) infrage. Die Recherche bezüglich früherer Laborkontrollen ergab konstant Serum-Harnsäurewerte im (hoch-)normalen Bereich (maximal 7,1 mg/dl), die Alkoholanamnese des Patienten war fortlaufend blande. Neben einer Ernährungsberatung modifizierten wir die antihypertensive Medikation (Austausch von HCT durch einen Calcium-Antagonisten) und eliminierten dadurch einen häufig in der Praxis auftretenden Auslöser erhöhter Harnsäurewerte und möglicher Gichtanfälle [8, 9, 10].
Der Patient war durch die eingeleiteten Therapiemaßnahmen innerhalb weniger Tage beschwerdefrei und konnte die stationäre Rehabilitation erfolgreich fortsetzen.
Fall 3
Bei einer 61-jährigen Patientin sind folgende Erkrankungen bekannt: Diabetes mellitus Typ 2, Hyperlipidämie, Adipositas Grad I, chronisch erhöhter Nikotinkonsum (15 Zigaretten täglich seit ca. 25 Jahren), bekannte Coxarthrose beidseits und ein degenerativ-fehlstatisches Wirbelsäulensyndrom. Vor ca. einem Jahr setzte ein relativ akuter Krankheitsbeginn mit Kopfschmerzen, Abgeschlagenheit, B-Symptomatik, subfebrilen Temperaturen, bilateralen Schulterschmerzen, Nackenschmerzen und ausgeprägter Morgensteifigkeit ein. Laborchemisch zeigten sich deutlich erhöhte Entzündungsparameter (Sturzsenkung, hohes CRP).
Nach weiterer Diagnostik von haus-/fachärztlicher Seite erfolgte die Diagnosestellung einer Polymyalgia rheumatica (ohne klinischen Hinweis auf Riesenzellarteriitis). Daraufhin wurde mit einer Glukokortikoidtherapie (Prednisolon 30 mg/die) begonnen, Dosisreduktion zunächst auf 25 mg, dann 20 mg/die unter regelmäßiger Kontrolle von Labor/Klinik.
Der Versuch einer weiteren schrittweisen Prednisolon-Dosisreduktion um 2,5 mg [11, 12] gelang jedoch leider nicht, es kam zweimal (bei Tagesdosis von 15 bzw. 12,5 mg) zu einer Rezidivsymptomatik. Deshalb erfolgte ambulant eine weitere ausführliche, insbesondere apparativ-technische Diagnostik (einschließlich PET-CT), die jedoch keinen Hinweis auf einen malignen Tumor (paraneoplastisches Syndrom!) oder auch Riesenzellarteriitis (Großgefäßvaskulitis) ergab. Daraufhin wurde eine immunmodulierende Therapie mit dem cDMARD MTX subkutan (15 mg pro Woche) eingeleitet (Ziel: kummulativ steroidsparender Effekt und bessere Wirkung als unter GK-Monotherapie). Ca. acht Wochen nach MTX-Beginn gelang eine langsame, schrittweise Dosisreduktion des Prednisolons (zunächst in 2,5-mg-Schritten) auf 10 mg/die, danach weitere Reduktion in 1-mg-Schritten. Die aktuelle Dosis lag bei 8 mg/die mit begleitender Vitamin-D-Einnahme (diese erfolgte seit etwa sechs Monaten, jedoch nach anamnestischen Angaben unregelmäßig), anamnestisch „normale“ Ernährungsgewohnheiten, keine Nahrungsmittelunverträglichkeiten bekannt.
Vor ca. sechs Monaten erlitt die Patientin eine Ermüdungsfraktur im Mittelfußbereich rechtsseitig nach längerer Wanderung (konservative Behandlung). Eine weitere Diagnostik erfolgte nicht. Die jetzige stationäre Rehabilitation erfolgte wegen einer Coxarthrose beidseits, eines bekannten degenerativen Wirbelsäulensyndroms und der Polymyalgia rheumatica. Die Patientin erhielt ein individuelles und auf ihre rheumatologischen/orthopädischen Erkrankungen abgestimmtes physiotherapeutisches und balneophysikalisches Therapieprogramm. Nach ca. einer Woche kam es im Rahmen einer Gruppengymnastik zu einem akuten Schmerzsyndrom im Bereich der rechten dorsolateralen Thoraxregion. Zunächst wurde symptomatisch analgetisch therapiert, aufgrund progredienter Schmerzen erfolgte die weitere diagnostische Abklärung (Röntgen, CT). Dabei wurde eine nicht dislozierte Rippenfraktur (7. Rippe) nachgewiesen. Zur weiteren Abklärung wurde eine Knochendichtemessung (DXA) durchgeführt mit dem Befund einer höhergradigen Osteoporose (T-Score LWS: -3,5; T-Score Schenkelhals: -3,9; NW: > -1,0; Osteopenie: -1,0 bis -2,5; Osteoporose: < -2,5). Die Indikation für eine spezifische Osteoporosetherapie war somit gegeben [13].
Laborchemisch war das 25-OH-Vitamin D3 mit 18 ng/ml unterhalb des empfohlenen Normbereichs (ca. 35 bis 60 ng/ml). Die Patientin wurde ausführlich über die generellen Empfehlungen wie körperliche Aktivität, kalziumreiche Ernährung, allgemeiner Lebensstil (Nikotinabstinenz!) und die medikamentösen Therapiemöglichkeiten aufgeklärt, eine forcierte, vorübergehend höherdosierte orale Vitamin-D-Substitution wurde eingeleitet. Zugelassen zur Therapie einer Glukokortikoid-induzierten Osteoporose sind laut AWMF-Leitlinie bei der postmenopausalen Frau die Bisphosphonate Alendronat, Risedronat und Zoledronat, das humane rekombinante Parathormon-Fragment Teriparatid [13, 14] und seit 2018 auch der RANKL-Inhibitor Denosumab. Die Patientin wurde ausführlich über das Nebenwirkungsprofil der spezifischen Osteoporose-Medikamente aufgeklärt, insbesondere sollte vor Therapiebeginn eine zahnärztliche Untersuchung (cave: seltene Nebenwirkung Kiefernekrose!) erfolgen. Ein zahnärztlicher Termin poststationär am Heimatort wurde vereinbart, um dann mit der leitliniengerechten Osteoporosetherapie möglichst schnell beginnen zu können. Die Patientin konnte die stationäre Rehabilitation nach Modifizierung des aktiven/passiven Therapieprogramms unter symptomatischer Analgetika-Gabe (Metamizol) erfolgreich beenden.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-ärzteblatt.de (Aktuelles Heft) abgerufen werden.
Der Autor erklärt, dass er keine finanziellen oder persönlichen Beziehungen zu Dritten hat, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Autor
Dr. Alex Höfter
Facharzt für Innere Medizin, Schwerpunkt Rheumatologie
Reha-/Rheuma-Zentrum Bad Aibling, Ärztlicher Direktor, Klinik Wendelstein, Deutsche Rentenversicherung Bund, Kolbermoorer Straße 56, 83043 Bad Aibling
Chefarzt, Rheumaklinik Bad Aibling, Deutsche Rentenversicherung Nordbayern, Ghersburgstraße 20, 83043 Bad Aibling
Bildnachweis Autorenbild
© flownet Claus Speier/CAO Photograhie
Teilen:
Das könnte Sie auch interessieren: