Drei Highlights aus der Nephrologie – Schwerpunkt akutes Nierenversagen
 Schwerpunkt akutes Nierenversagen
Schwerpunkt akutes Nierenversagen
Die Nieren haben eine zentrale Rolle im menschlichen Organismus. Nierendysfunktionen haben Einfluss auf Blutdruckregulation, Elektrolyt-, Wasser- und Säure-Basen-Haushalt sowie Blutbildung und Knochenstoffwechsel. Die Nephrologie deckt daher eine große Bandbreite an Erkrankungen ab, entsprechend sind auch Ärzte anderer Fachrichtungen immer wieder mit nephrologischen Problemen konfrontiert.
Nachfolgend werden drei Fälle von akutem Nierenversagen geschildert, mit denen sowohl niedergelassene als auch in der Klinik tätige Ärzte in Kontakt kommen können, und die ein differenzialdiagnostisches Vorgehen verlangen.
Fall 1 – Rückenschmerzen mit akutem Nierenversagen
Anamnese
Ein 33-jähriger Patient stellte sich wegen Rückenschmerzen in unserer Notaufnahme vor. In der vergangenen Woche hatte er unter Kopf- und Gliederschmerzen gelitten, weshalb er über fünf Tage insgesamt 2.800 mg Ibuprofen (sieben Tabletten à 400 mg) eingenommen hatte. Die Einnahme von leistungssteigernden Substanzen, Drogen oder Nahrungsergänzungsmitteln wurde verneint. An Vorerkrankungen war ein allergisches Asthma bronchiale bekannt, eine regelmäßige Medikamenteneinnahme erfolgte nicht. Klinische Hinweise auf eine Infektion oder Systemerkrankung bestanden nicht. Auf gezieltes Nachfragen gab er an, vor ca. drei Wochen seinen Keller ausgeräumt zu haben.
Diagnostik
Im Untersuchungsbefund zeigten sich eine erhöhte Körpertemperatur von 38,2 °C sowie ein Klopfschmerz über dem linken Nierenlager auffällig. Weitere Vitalparameter und Organstatus waren unauffällig.
Die Labordiagnostik erbrachte ein Kreatinin von 2,2 mg/dl (0,7 bis 1,2) und Harnstoff 54 mg/dl (19 bis 44) im Serum (i. S.); Elektrolyte, Säure-Basen-Haushalt und Blutbild waren unauffällig. Aufgrund des akuten Nierenversagens erfolgte eine Sonografie der Nieren. Hierbei zeigten sich beide Nieren vergrößert (> 12 cm; Normwert 10 bis 12 cm) mit echoarmen Parenchymsaum und entdifferenzierter Mark-Rindengrenze im Sinne eines akuten Nierenschadens. Ein Harnstau konnte ausgeschlossen werden. In der weiteren Labordiagnostik war die Immunserologie (ANA, ANCA, Anti-GBM) unauffällig. Auch die Hanta-Virus-Serologie war negativ. In der Urinuntersuchung lag eine Eiweißausscheidung von 0,6 g/g Kreatinin (< 0,1) vor. Das Urinsediment zeigte vereinzelte Leukozyten, keine Erythrozyten und war damit nicht hinweisend auf eine glomeruläre Erkrankung, bei der ein sogenanntes „aktives Sediment“ mit dysmorphen Erythrozyten (Akanthozyten) zu erwarten wäre.
Aufgrund des im weiteren Verlauf ansteigenden Kreatinins i. S. auf max. 3,2 mg/dl stellten wir die Indikation zur Nierenbiopsie. Histopathologisch zeigte sich ein interstitielles entzündliches Zellinfiltrat mit Eosinophilie und Ödem, passend zu einer medikamentös-toxisch bedingten interstitiellen Nephritis, in diesem Fall nach Einnahme von nicht-steroidalen Antirheumatika (NSAR), sowie eine schwere Tubulusnekrose (Abbildung 1).
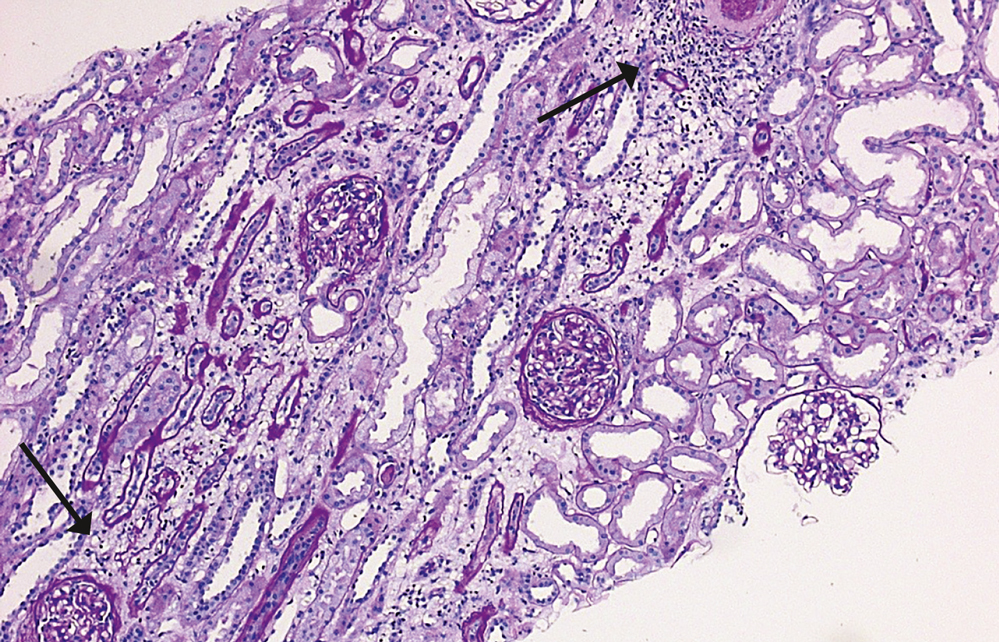 Abbildung 1: Histologisch zeigen sich typischerweise ein akuter Tubulusepithelschaden mit weit gestellten Tubuli, ein interstitielles Ödem mit auseinandergedrängten Tubuli und eine interstitielle Entzündungsreaktion, teilweise mit einer Eosinophilie [10]. Die Pfeile zeigen die Zellinfiltration des Interstitiums als Ausdruck der Entzündungsreaktion (PAS-Färbung).
Abbildung 1: Histologisch zeigen sich typischerweise ein akuter Tubulusepithelschaden mit weit gestellten Tubuli, ein interstitielles Ödem mit auseinandergedrängten Tubuli und eine interstitielle Entzündungsreaktion, teilweise mit einer Eosinophilie [10]. Die Pfeile zeigen die Zellinfiltration des Interstitiums als Ausdruck der Entzündungsreaktion (PAS-Färbung).
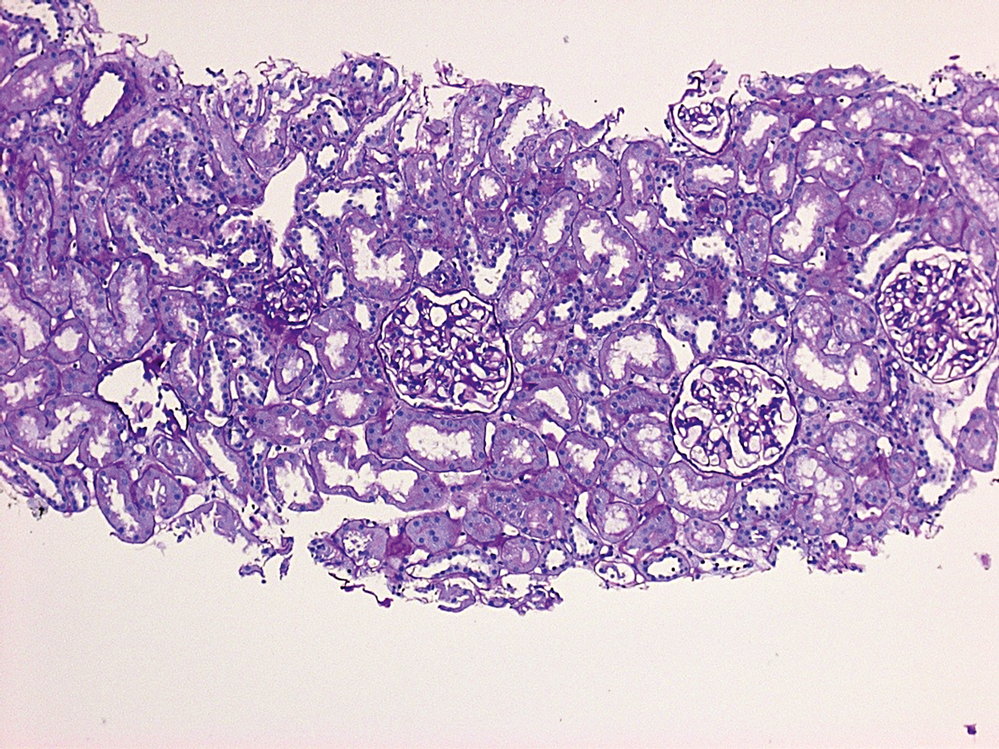 Abbildung 2: Im Vergleich hierzu gesundes Nierengewebe (PAS-Färbung) mit dicht liegenden Tubuli.
Abbildung 2: Im Vergleich hierzu gesundes Nierengewebe (PAS-Färbung) mit dicht liegenden Tubuli.
Diagnose
Akutes Nierenversagen bei medikamentös induzierter akuter interstitieller Nephritis (AIN).
Verlauf
Nach Beendigung der Medikamenteneinnahme kam es nach wenigen Tagen zu einem Abfall des Kreatinins, sodass keine immunsuppressive Therapie notwendig wurde. Die Diurese war zu jedem Zeitpunkt erhalten; bei zunehmender Erholung der Nierenfunktion setzte eine polyurische Phase ein, das Flüssigkeitsdefizit wurde mit oraler Flüssigkeitssubstitution ausgeglichen. Zum Entlasszeitpunkt lag das Kreatinin i. S. bei 1,7 mg/dl, in weiteren ambulanten Kontrollen konnte ein normwertiges Kreatinin verzeichnet werden.
Die initial zur Aufnahme führenden Rückenschmerzen können durch die Schwellung der Nieren erklärt werden. Wir besprachen mit dem Patienten die Notwendigkeit, in Zukunft konsequent die Einnahme von Ibuprofen und anderer NSAR, auch in Form von Salben, zu meiden.
Die AIN entspricht meist einer „allergischen“ Hypersensitivitätsreaktion in den Nieren und wird am häufigsten durch die Einnahme von Medikamenten verursacht, kann jedoch auch durch Infektionen oder systemische Erkrankungen ausgelöst werden. Theoretisch kann jedes Medikament eine AIN verursachen (Tabelle 1). Der Erkrankungsbeginn liegt zwischen drei Tagen und mehreren Wochen nach Einnahme des auslösenden Agens. Die Entstehung einer medikamentös-induzierten AIN ist nicht dosisabhängig und kann bei erneuter Einnahme des gleichen oder eines verwandten Medikamentes jederzeit wieder auftreten [1]. Daher ist eine gute Information des Patienten wichtig, um eine Re-Exposition zu verhindern.
 Auswahl an Medikamenten, die eine akute interstitielle Nephritis verursachen können.
Auswahl an Medikamenten, die eine akute interstitielle Nephritis verursachen können.
Genaue Daten zur Prävalenz existieren nicht, dies liegt zum einen daran, dass die Diagnose oft nicht gestellt wird und zum anderen, dass die Inzidenz durch frei verkäufliche Medikamente in den vergangenen Jahren steigt. Menschen über 65 Jahre sind häufiger von einer medikamentös induzierten AIN betroffen als jüngere. Nur wenige Patienten (ca. zehn Prozent) zeigen begleitend zum Nierenversagen die „klassische Trias“ aus Hautausschlag, Eosinophilie und Fieber. Die meisten Patienten weisen nur unspezifische Symptome auf oder sind komplett asymptomatisch, sodass der Kreatininanstieg oft ein Zufallsbefund ist [2]. Typischerweise tritt, wie auch in unserem Fall, keine Proteinurie über 1 g/g Kreatinin auf; ebenso findet sich kein aktives Sediment. Häufiger sind Leukozyturie und erhöhte tubuläre Marker im Urin (alpha1-Mikroglobulin). Die definitive Diagnose wird durch die Nierenbiopsie gestellt. Auf diese kann bei passender Anamnese und rascher Besserung der Nierenfunktion nach Absetzen des auslösenden Agens verzichtet werden.
Die wichtigste therapeutische Maßnahme ist das Absetzen und zukünftig konsequente Meiden des auslösenden Medikamentes. Hierauf kommt es bei den meisten Patienten zu einem Abfall des Kreatinins. Sollte dies nicht der Fall sein oder besteht ein schweres akutes Nierenversagen, kann eine Kortisontherapie erwogen werden, welche dann über wenige Wochen ausgeschlichen werden soll. Die Steroidtherapie wird jedoch kontrovers diskutiert, da hierzu keine randomisierten, kontrollierten Studien vorliegen.
Der Verlauf der akuten interstitiellen Nephritis ist bei frühem Absetzen des auslösenden Medikamentes oft günstig, selbst bei Patienten, die passager eine Nierenersatztherapie benötigen. Die Erholung der Nierenfunktion ist jedoch oft nicht vollständig [3]. Bei längerfristiger oder wiederholter Medikamenteneinnahme droht hingegen die anhaltende Dialysepflichtigkeit.
Merke
- Die akute interstitielle Nephritis ist eine schwere allergische Reaktion in den Nieren, meist auf ein Medikament.
- Die häufigsten Auslöser sind leider auch häufig verordnete Medikamente (NSAR, Protonenpumpenhemmer, Allopurinol, Antibiotika).
- Eine Re-Exposition ist – wie bei anderen schweren Allergien – unbedingt zu vermeiden.
Fall 2 – Akutes Nierenversagen mit dunklem Urin
Anamnese
Ein 19-jähriger Patient stellte sich wegen Fieber und Kopfschmerzen beim Hausarzt vor. Er bemerkte seit einigen Tagen einen dunklen Urin (Abbildung 3); Brennen beim Wasserlassen wurde verneint. Vorerkrankungen bestanden nicht, ebenso keine regelmäßige Medikamenteneinnahme; aufgrund der Kopfschmerzen hatte er am Vortag zwei Tabletten Ibuprofen 400 mg eingenommen. Die Einnahme von leistungssteigernden Substanzen, Drogen oder Nahrungsergänzungsmitteln wird verneint, es besteht ein Nikotinkonsum von zehn Zigaretten/Tag. In der Labordiagnostik des Hausarztes war ein Kreatinin i. S. von 2,9 mg/dl (0,7 bis 1,2) aufgefallen, weshalb die Zuweisung in unsere Klinik erfolgte.
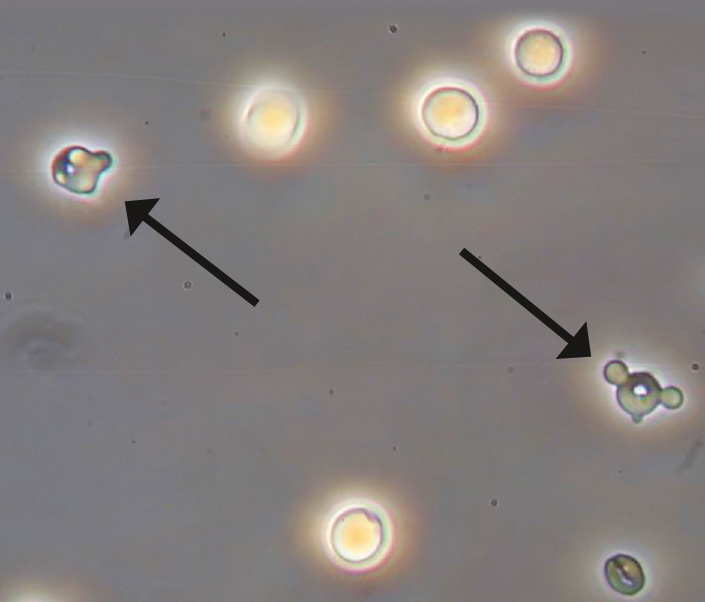
Abbildung 3: Urin des Patienten, makroskopisch und mikroskopisch zeigt sich eine ausgeprägte Hämaturie. Inset: Urinsediment mit vier unauffälligen und zwei dysmorphen Erythrozyten (Akanthozyten; Pfeile).
Diagnostik
Im Untersuchungsbefund zeigte sich eine leicht erhöhte Körpertemperatur (37,8 °C) sowie ein Blutdruck von 154/89 mmHg, sonst war der Organstatus unauffällig. In der Labordiagnostik lag das Kreatinin i. S. nun bei 4,8 mg/dl, Harnstoff 68 mg/dl (19 bis 44), Elektrolyte und Säure-Basen-Haushalt waren ausgeglichen. Sonografisch waren beide Nieren vergrößert (bds. 16 cm im Längsdurchmesser) mit echoarmen Parenchymsaum und unscharfer Mark-Rindendifferenzierung im Sinne eines akuten Nierenschadens. Ein Harnstau konnte ausgeschlossen werden. In der Immunserologie zeigten sich ANA und ANCA negativ, jedoch konnten noch am Aufnahmetag hochtitrige Anti-GBM-Antikörper nachgewiesen werden. Passend hierzu zeigte sich im Urinsediment ein „aktives Sediment“ mit dysmorphen Erythrozyten (Akanthozyten; Inset in Abbildung 3).
Im Verlauf entwickelte der Patient diskrete Hämoptysen, in der CT-Thorax und Bronchiallavage konnte jeweils eine alveoläre Hämorrhagie gesichert werden.
Diagnose
Anti-Glomeruläre-Basalmembran (GBM)-Antikörper-Erkrankung (Goodpasture-Syndrom)
Verlauf
Unter der klinischen Diagnose einer Anti-GBM-Erkrankung wurde unmittelbar eine Plasmapheresebehandlung eingeleitet. Parallel erhielt er eine immunsuppressive Induktionstherapie mit intravenösen Steroid-Boli und nachfolgend oraler Steroid- sowie Cyclophosphamidgabe. Einige Tage später erfolgte zur Diagnosesicherung und Prognoseabschätzung eine Nierenbiopsie, wobei sich die Diagnose bestätigte und zusätzlich ein schwerer akuter Schaden ohne chronische Veränderungen wie Vernarbungen zeigte (Abbildung 4). Da histologisch ein Erholungspotenzial gegeben war, wurde die Therapie unverändert fortgeführt. Leider war das Kreatinin trotz umgehend eingeleiteter Maximaltherapie weiter ansteigend und die Diuresemenge abnehmend, sodass eine Hämodialysetherapie vorübergehend notwendig wurde. Im weiteren ambulanten Verlauf konnte die Dialysefrequenz bei wieder einsetzender Diurese und Entgiftungsfunktion reduziert und schlussendlich ganz beendet werden. Die Kortisontherapie wurde ausgeschlichen und nach insgesamt neun Monaten erfolgreich beendet. Das Kreatinin lag ein Jahr nach der Erstdiagnose stabil bei 2,3 mg/dl. Pulmonale Probleme traten nicht mehr auf.
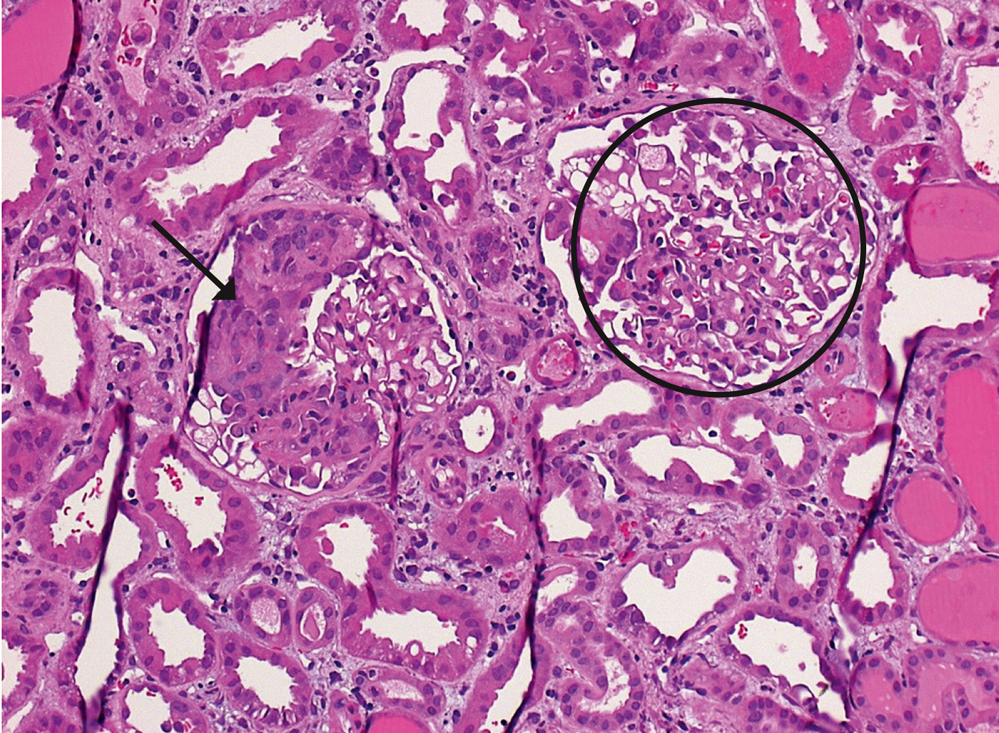 Abbildung 4: Histologisch zeigt sich als Ausdruck der rapid-progressiven Glomerulonephritis eine extrakapilläre Zellproliferation, die das glomeruläre Kapillarkonvolut verdrängt (sogenannter „Halbmond“) (Pfeil). Zum Vergleich dient rechts ein nur gering betroffener Glomerulus mit weitgehend erhaltenem Kapillarkonvolut (schwarzer Kreis).
Abbildung 4: Histologisch zeigt sich als Ausdruck der rapid-progressiven Glomerulonephritis eine extrakapilläre Zellproliferation, die das glomeruläre Kapillarkonvolut verdrängt (sogenannter „Halbmond“) (Pfeil). Zum Vergleich dient rechts ein nur gering betroffener Glomerulus mit weitgehend erhaltenem Kapillarkonvolut (schwarzer Kreis).
Die Anti-GBM-Erkrankung ist eine Form der rapid-progressiven Glomerulonephritis (RPGN) und mit einer geschätzten Inzidenz von < 1:1 Millionen/Jahr eine seltene Erkrankung. Bevorzugt betroffen sind vor allem Männer unter 40 Jahren. Es handelt sich um eine Erkrankung, bei der Antikörper gegen eine bestimmte Kollagenkette (Kollagen Typ IV, alpha 3; Bestandteil der glomerulären und alveolären Basalmembranen) gebildet werden. Da nur die glomerulären und alveolären Basalmembranen diese Kollagenkette enthalten, manifestiert sich diese Krankheit spezifisch als pulmo-renales Syndrom ohne weitere Organmanifestation (oder isoliert renal, selten isoliert pulmonal). Es finden sich entsprechend Zeichen der akuten Glomerulonephritis mit rasch ansteigendem Serum-Kreatinin, einem aktiven Urinsediment (dysmorphe Erythrozyten) und Albuminurie. Die Patienten präsentieren sich bis auf die Hämaturie im Frühstadium oft symptomarm. In ca. 60 Prozent der Fälle findet man auch eine Lungenbeteiligung, die wie in unserem Fall auch weniger ausgeprägt und erst im Verlauf klinisch apparent werden kann.
Die Diagnose wird durch den serologischen Nachweis von Anti-GBM-Antikörper sowie der Histologie gestellt. Eine Nierenbiopsie soll möglichst immer durchgeführt werden, da zum einen die Genauigkeit der serologischen Testung variiert und zum anderen die Histologie eine Einschätzung des Aktivitätsgrades und der Prognose erlaubt.
Der entscheidende Faktor bezüglich des Therapieerfolges und der Langzeitprognose sowohl für das Gesamtüberleben als auch für die Nierenfunktion ist die frühzeitige Diagnose und rasche Therapieeinleitung. Die Therapieindikation besteht grundsätzlich für alle Patienten mit Lungenbeteiligung sowie für Patienten mit renaler Beteiligung, die zum Zeitpunkt der Diagnosestellung nicht dialysepflichtig sind. Für alle anderen Patienten muss individuell nach Abschätzung der Prognose und des Therapierisikos eine Behandlung erwogen werden. Die Therapie besteht aus einer schnellstmöglich zu beginnenden Plasmaaustauschbehandlung sowie einer immunsuppressiven Therapie mit Kortison, Cyclophosphamid und gegebenenfalls Rituximab. Die Steroidtherapie sollte anschließend über sechs bis neun Monate ausgeschlichen werden [4].
Unbehandelt führt die Erkrankung in bis zu 90 Prozent der Fälle zur terminalen Niereninsuffizienz und zeigt auch unter Behandlung eine relevante Letalität von bis zu 20 Prozent im ersten Jahr. Je früher die Therapie eingeleitet wird, umso eher kann die Nierenfunktion langfristig erhalten werden.
Merke
- Bei akutem Nierenversagen mit glomerulärer Erythrozyturie („aktives Urinsediment“) ist eine rasche diagnostische Klärung, meist mit Nierenbiopsie, notwendig.
- Die Anti-GBM-Erkrankung (Goodpasture-Syndrom) ist eine fulminant verlaufende Autoimmunerkrankung der Niere und Lunge.
- Nur eine sofortige intensive immunsuppressive Therapie inklusive Plasmaaustausch kann die Prognose verbessern.
Fall 3 – Akute Herz- und Niereninsuffizienz
Anamnese
Eine 73-jährige Patientin stellte sich wegen Dyspnoe in unserer Notaufnahme vor. Es sei in den vergangen Wochen zu einer Gewichtszunahme von mindestens zehn Kilogramm gekommen. Sie habe selbst bemerkt, dass ihre Beine angeschwollen seien und sie seltener Wasser lassen musste. An Vorerkrankungen waren unter anderem eine chronische Niereninsuffizienz mit einem Serumkreatinin von 1,4 mg/dl und eine koronare Herzerkrankung bekannt. Vor zwei Monaten war sie in stationärer Behandlung wegen einer Stauungs-Herzinsuffizienz mit Erstdiagnose einer schwergradigen Trikuspidalklappeninsuffizienz und pulmonaler Hypertonie. Die Vormedikation beinhaltete ACE-Hemmer, Betablocker und Schleifendiuretikum als Therapie der Herzinsuffizienz.
Diagnostik
Bei Aufnahme auffällig zeigte sich eine Sauerstoffsättigung von 93 Prozent unter Raumluft, die Vitalparameter waren unauffällig. Bei Auskultation der Lunge fand sich ein abgeschwächtes Atemgeräusch bds. basal sowie der klinische Verdacht auf Aszites. Peripher bestanden an den Beinen deutliche Ödeme (Abbildung 5). Der weitere Organstatus war unauffällig.
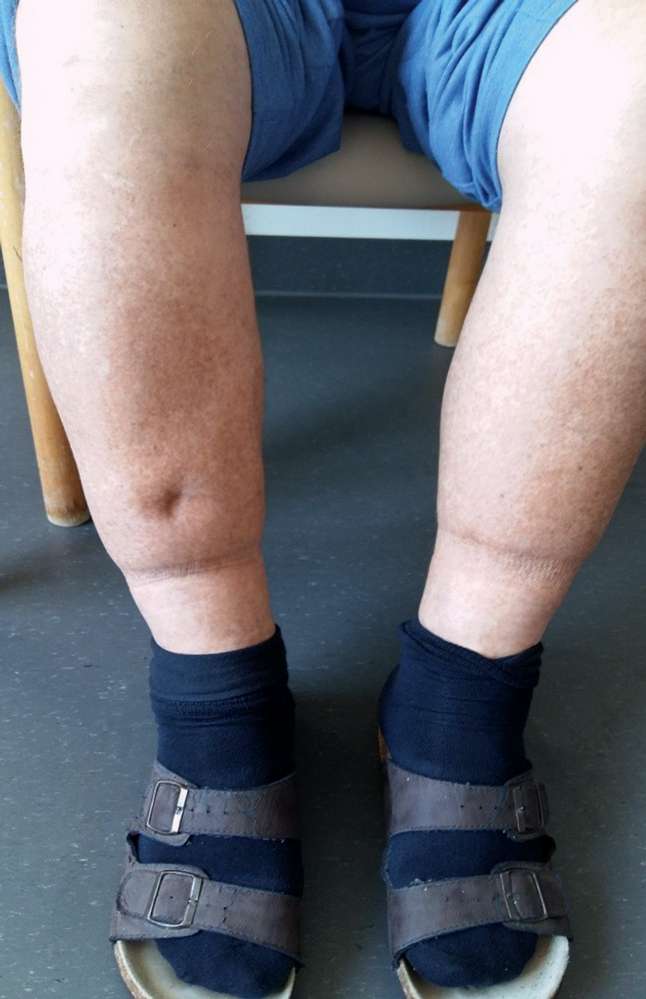
Abbildung 5: Ödematös geschwollene Unterschenkel bei dekompensierter Rechtsherzinsuffizienz und konsekutiver akuter Niereninsuffizienz (anderer Patient als im Text beschrieben). Die „Delle“ nach Palpation mit der Hand sowie die Schnürfurche durch die Socken zeigen das Ödem.
Die Labordiagnostik erbrachte ein Kreatinin i. S. von 5,4 mg/dl (0,7 bis 1,2), Harnstoff 161 mg/dl (19 bis 44), Kalium 6,2 mmol/l (3,5 bis 5,1), der Säure-Basen-Haushalt war ausgeglichen. Es erfolgte eine Sonografie der Nieren. Ein Harnstau konnte ausgeschlossen werden, die Nieren zeigten sich leicht verkleinert auf 9 cm im Längsdurchmesser mit einem verschmälerten, echovermehrten Parenchymsaum im Sinne eines chronischen Nierenschadens. Der klinische Verdacht auf Aszites bestätigte sich sonografisch, ebenso fand sich rechts ein großer Pleuraerguss. Die Vena cava war prall gefüllt und nicht atemmoduliert, die Lebervenen gestaut. Die Echokardiografie zeigte weiterhin die schwere Trikuspidalklappeninsuffizienz mit Hinweis auf einen pulmonalen Hypertonus.
Die Autoimmundiagnostik war unauffällig, ebenso die Untersuchung auf freie leichte Ketten im Serum. Im Urinsediment zeigte sich kein aktives Sediment. Die Eiweißausscheidung war nur geringfügig auf 300 mg/g Kreatinin erhöht (< 100).
Diagnose
Akut auf chronisches Nierenversagen cardio-renaler Genese bei Rechtsherzdekompensation.
Verlauf
Aufgrund der klinisch und sonografisch gesicherten Volumenüberladung erfolgte eine forcierte, intravenöse Diuretikatherapie. Hierdurch konnte die Diuresemenge deutlich gesteigert werden, sodass es unter gleichzeitiger Trinkmengenrestriktion zu einer guten Gewichtsabnahme kam. Parallel sanken die Nierenretentionsparameter und das Serumkalium ab. Über zehn Tage konnte die Patientin mit konservativer Therapie 14 kg negativ bilanziert werden und das Kreatinin i. S. lag zuletzt im vorbekannten Bereich von 1,4 mg/dl (geschätzte glomeruläre Filtrationsrate – eGFR 37 ml/min).
Der Begriff cardiorenales Syndrom (CRS) steht für das gleichzeitige Bestehen von Herz- und Nierenerkrankungen, wobei die akute oder chronische Erkrankung des einen Organs zu einer ebenfalls akuten oder chronischen Dysfunktion des anderen Organs führt. Die Prävalenz der Nierenfunktionsverschlechterung, definiert als die Abnahme der glomerulären Filtrationsrate (GFR), wird bei gleichzeitigem Bestehen einer Herzinsuffizienz mit 30 bis 60 Prozent angegeben. Die Mortalität steigt hierbei – Schätzungen zufolge – um 15 Prozent pro Jahr für jede Abnahme der GFR um 10 ml/min [5].
Die aktuelle Klassifikation des CRS unterscheidet derzeit nach pathogenetischen Gesichtspunkten und zeitlichem Verlauf fünf Typen (Tabelle 2).
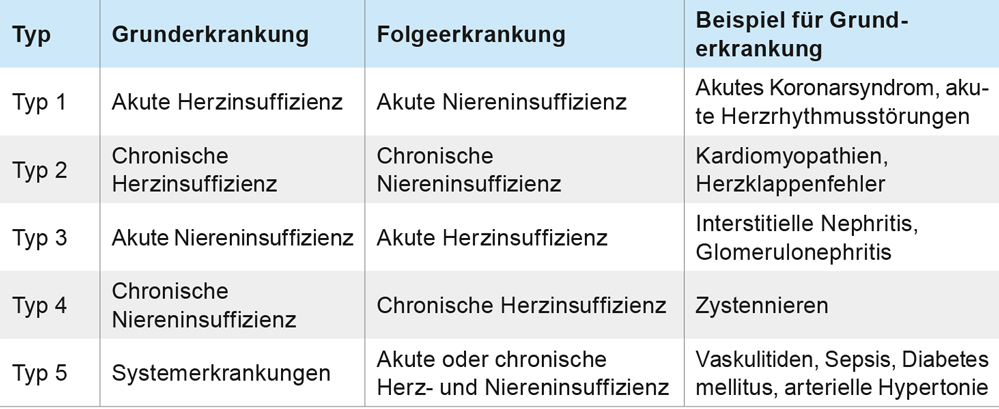 Tabelle 2: Aktuelle Klassifikation des cardiorenalen Syndroms (CRS), verabschiedet auf der Konsensuskonferenz der „Acute Dialysis Quality Initiative“ im September 2008 nach einem Vorschlag von Ronco et al. [6].
Tabelle 2: Aktuelle Klassifikation des cardiorenalen Syndroms (CRS), verabschiedet auf der Konsensuskonferenz der „Acute Dialysis Quality Initiative“ im September 2008 nach einem Vorschlag von Ronco et al. [6].
Eine eindeutige klinische Zuordnung zu einem der fünf Typen ist oft nicht möglich, häufig liegen auch Mischformen vor. So handelt es sich in dem geschilderten Fall beispielsweise um einen Typ 2, bei dem eine chronische Herzinsuffizienz durch einen pulmonal arteriellen Hypertonus und hochgradige Trikuspidalklappeninsuffizienz bereits zu einer chronischen Nierenfunktionsverschlechterung geführt hat. Darüber hinaus kam es durch die Volumenüberladung zu einer akuten Herzinsuffizienz und damit einer akuten Niereninsuffizienz, was Typ 1 zuzuordnen ist.
Pathophysiologisch sind eine Vielzahl von Faktoren beteiligt. Neben neurohumoraler Dysregulation spielt, wie in unserem Fall, ein erhöhter zentralvenöser Druck mit reduziertem venösem Rückstrom aus den Nieren eine Rolle. Es konnte konsistent gezeigt werden, dass der erhöhte zentrale Venendruck mehr mit dem Auftreten eines Nierenversagens korreliert als zum Beispiel ein reduziertes Herzzeitvolumen durch Vorwärtsversagen des linken Ventrikels. Entsprechend ist bei einem erhöhten zentralvenösen Druck von ca. 20 mmHg die GFR um ca. 25 Prozent reduziert [7].
Die Diagnose wird durch das gleichzeitige Vorhandensein einer Herz- und Niereninsuffizienz gestellt. Es sollten möglichst andere Formen der Niereninsuffizienz ausgeschlossen werden, wobei auch hier Mischbilder vorkommen. Befunde wie ein aktives Urinsediment oder eine signifikante Proteinurie von mehr als 1 g/g Kreatinin sprechen für eine primäre Nierenschädigung.
Eine spezifische Therapie des CRS bestünde in einer Verbesserung der kardialen Funktion oder einer Senkung des pulmonal-arteriellen Drucks. Da dies oft nicht möglich ist, steht die konsequente aber schonende Volumenrekompensation im Vordergrund. Oft müssen Diuretika hierbei intravenös gegeben werden, da die enterale Resorption aufgrund der Dekompensation eingeschränkt ist. Mit der erzielten Negativbilanz verbessert sich, wie im geschilderten Fall, der venöse Rückstrom aus den Nieren und es kommt konsekutiv zu einer Zunahme der Nierenfunktion. Bei Versagen der konservativen Therapie zur Volumenreduktion ist eine extrakorporale Ultrafiltration, zum Beispiel mittels Dialyse, der nächste Therapieschritt [8]. Bei chronischer Dialysepflichtigkeit aufgrund eines CRS kommt dem kontinuierlichen Verfahren der Peritonealdialyse eine besondere Bedeutung zu [9].
Merke
- Nieren- und Herzfunktion beeinflussen sich wechselseitig.
- Bei akutem Nierenversagen ist die Beurteilung des Volumenstatus therapieentscheidend.
- Bei Nierenversagen aufgrund eines „Rechtsherzversagens“ kann durch Negativbilanz die Nierenfunktion oft gebessert werden; eine Volumengabe ist bei dieser Befundkonstellation kontraproduktiv.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-ärzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Autoren

Dr. Victoria Zoellner
Klinik für Nieren-, Hochdruck- und Rheumaerkrankungen, München Klinik Harlaching

Professorin Dr. Kerstin Amann
Abteilung Nephropathologie, Pathologisches Institut, Universitätsklinikum Erlangen

Professor Dr. Clemens Cohen
KfH-Nierenzentrum München-Harlaching
Korrespondenzadresse:
Dr. Victoria Zoellner, Klinik für Nieren-, Hochdruck- und Rheumaerkrankungen, München Klinik Harlaching, Sanatoriumsplatz 2, 81545 München, E-Mail: victoria.zoellner(at)muenchen-klinik.de
Teilen:
Das könnte Sie auch interessieren:







