Dermatologie – highlighted
 Dermatologie – highlighted
Dermatologie – highlighted
Die Haut ist ein großes Organ mit wichtigen Funktionen. Mit einer Fläche von ca. zwei Quadratmetern und einem Gewicht von 15 Prozent des Körpergewichts bildet sie eine wichtige Barriere gegen chemische und physische Noxen, aber auch gegen Mikroorganismen.
Hauterkrankungen sind häufig, betreffen alle Altersgruppen, und einige sind lebensbedrohlich. Beispiele des letzteren sind die schweren kutanen Arzneimittelreaktionen und die zunehmenden Hautkrebserkrankungen. Zu den häufigsten dermatologischen Diagnosen gehören Ekzeme inklusiv Neurodermitis, Psoriasis, Rosazea und Karzinome der Haut sowie aktinische Keratosen.
Nachfolgend werden drei Kasuistiken von dermatologischen Patienten geschildert, mit denen sowohl niedergelassene sowie in der Klinik tätige Ärzte konfrontiert werden können, und das diagnostische Vorgehen wird erläutert.
Generalisierte Hautveränderungen mit vermindertem Allgemeinzustand – ein „akutes Hautversagen“
Anamnese
Ein 45-jähriger Patient stellte sich mit Fieber, Unwohlsein und einem erythematösen Exanthem in der Poliklinik der Dermatologie vor und wurde daraufhin stationär aufgenommen. Innerhalb weniger Stunden entwickelten sich an Haut und Schleimhäuten (oral, konjunktival) ausgedehnte, schmerzhafte Blasen auf gräulich-erythematösem Grund (Abbildungen 1 und 2). Die befallene Körperoberfläche (body surface area, BSA) betrug ca. 20 Prozent. Nach ausführlicher Anamnese gab der Patient an, aufgrund einer Prostatitis Cotrimoxazol 960 mg (Sulfamethoxazol/Trimethoprim) über zwei Wochen eingenommen zu haben.
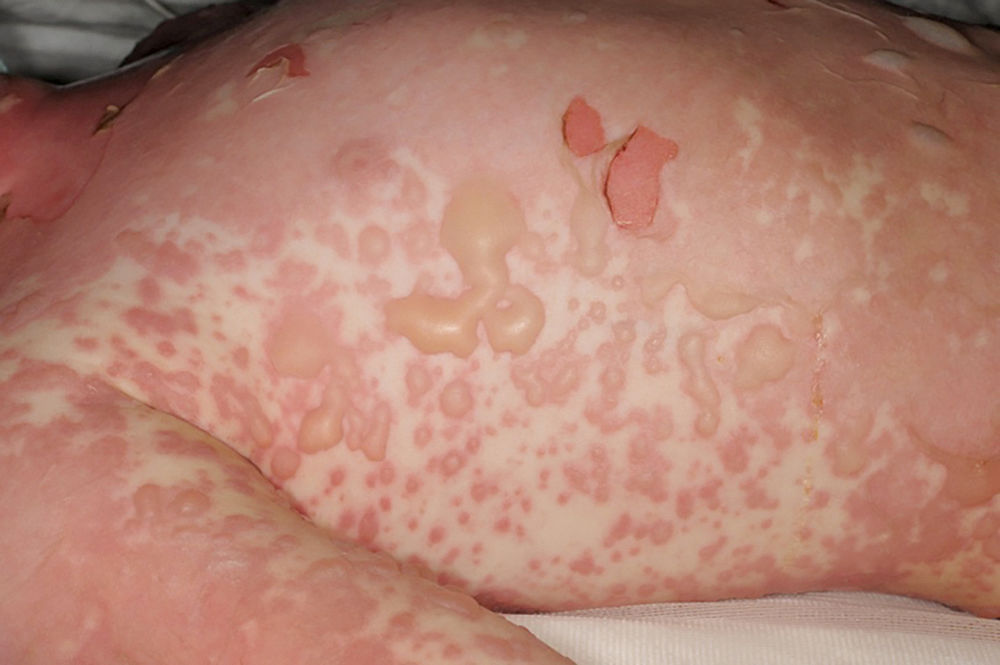 Abbildung 1: Generalisierte, kleine bis große Blasen und Erosionen auf gräulichem Erythem.
Abbildung 1: Generalisierte, kleine bis große Blasen und Erosionen auf gräulichem Erythem.
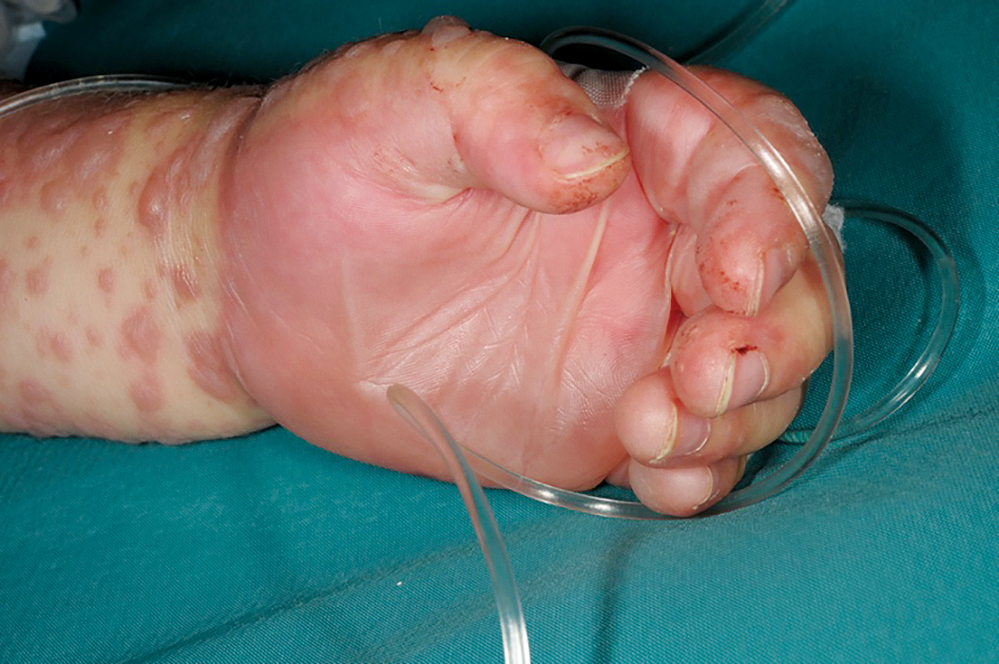 Abbildung 2: Großflächige und konfluerende Blasen auf gräulich-erythematösem Grund.
Abbildung 2: Großflächige und konfluerende Blasen auf gräulich-erythematösem Grund.
Diagnostik
Nach der Aufnahme wurde eine Hautbiopsie entnommen und im Schnellschnittverfahren aufgearbeitet. Histopathologisch zeigte sich eine subepidermale Blase mit ausgeprägt nekrotischer Epidermis und in der Dermis ein lymphohistiozytäres Infiltrat mit eosinophilen Granulozyten. Die Labordiagnostik zeigte leicht erhöhte Entzündungsparameter.
Diagnose
Stevens-Johnson-Syndrom (SJS) – Toxische epidermale Nekrolyse (TEN)
Verlauf
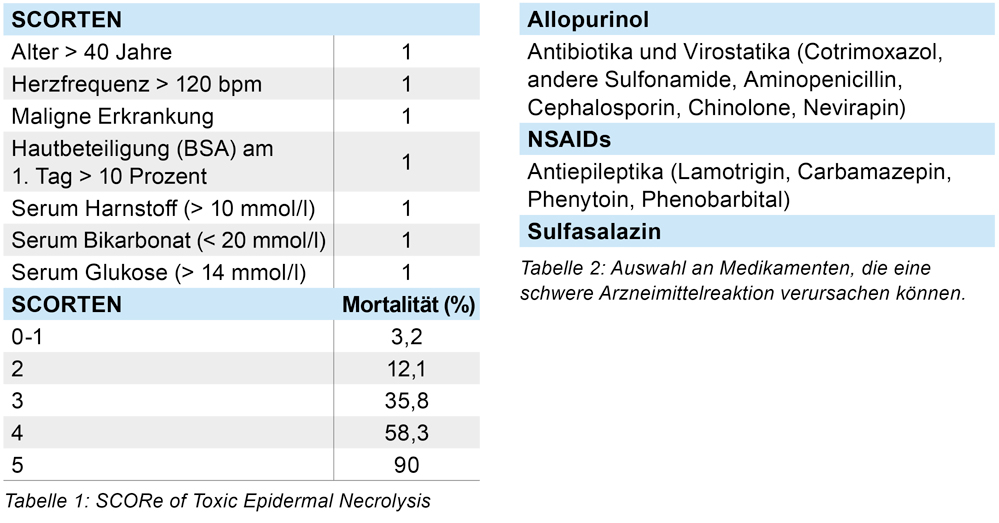
Nach Diagnosestellung wurde zunächst eine Abschätzung der Prognose mit dem SCORTEN (SCORe of Toxic Epidermal Necrolysis) durchgeführt. Dieser ergab einen Punktwert von 2 (siehe Tabelle 1).
Es erfolgte eine ausführliche Wundtherapie mit Petroleum-getränkten Gazen (Mull) nach desinfizierenden Umschlägen. Systemisch erhielt der Patient intravenös Flüssigkeit und Elektrolyte sowie intravenöse Immunglobuline (IVIG), 3 g/kg/Körpergewicht pro Tag über drei Tage. Hierunter kam es zu einer schnellen Stabilisierung und Verbesserung des Hautbefundes, sodass wir den Patienten nach neun Tagen entlassen konnten.
Per definitionem sind unerwünschte Arzneimittelreaktionen (AMR) „unbeabsichtigte und schädigende Reaktionen auf ein Medikament, das einem Patienten in normaler Dosierung und auf normaler Route in einer prophylaktischen, diagnostischen oder therapeutischen Absicht verabreicht wurde“ (WHO, 1972). Hierbei wird auf die Meldung unerwünschter Arzneimittelreaktionen gemäß den Empfehlungen der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) im Rahmen des § 6 der Berufsordnung ausdrücklich hingewiesen. AMR sind entweder pharmakologisch- bzw. medikamentenklassenbedingt vorhersehbar (Typ A) oder nicht vorhersehbar. Letztere Reaktionen werden als idiosynkratisch bezeichnet und sind durch eine allergische Reaktion oder Intoleranz zu erklären (Typ B). AMR sind häufig und können alle Organe betreffen, jedoch ist die Haut am häufigsten befallen. Schwere AMR sind hingegen seltene Krankheitsbilder mit einer Inzidenz von ca. ein bis zwei Fällen pro Millionen Einwohner pro Jahr. Hierzu gehören unter anderem das Stevens-Johnson-Syndrom (SJS) und die toxische epidermale Nekrolyse (TEN). Sie betreffen typischerweise Haut und Schleimhäute, aber auch andere Organe (Tabelle 2).
Es sind bestimmte Charakteristika zu beachten, die eine schwere AMR prognostizieren: Gesichts-ödem, starke Eosinophilie, Befall der Schleimhäute oder Bindehaut, brennende Augen oder schmerzende Haut, gräuliche Läsionen, epidermale Ablösung der Haut und Erosionen. In der Regel bricht eine AMR innerhalb von vier Wochen nach Einnahme des verursachenden Medikamentes aus. Zunächst treten prodromale Zeichen wie Fieber, brennende Augen, Pharyngitis und Lymphadenopathien auf. Danach manifestiert sich ein meist morbilliformes, schmerzhaftes, dunkelgraues makulopapulöses Exanthem mit Beginn im Gesicht sowie prästernal. Die Läsionen konfluieren und Hautablösungen mit Blasenbildung folgen. Erosionen der Schleimhäute und Konjunktiva werden in mehr als 90 Prozent der Fälle beobachtet. Nephritis und Hepatitis sind keine Seltenheit [1, 2, 3, 4].
Pathogenetisch wird TEN als eine schwere allergische Reaktion auf ein Medikament betrachtet. Diverse Faktoren spielen hierbei eine Rolle für die Entstehung von TEN wie zum Beispiel hohes Alter des Patienten, Anzahl von gleichzeitig eingenommenen Arzneimitteln (Polymedikation), die chemische Struktur der eingenommenen Medikamente und deren Metabolismus, Immunsuppression (zum Beispiel AIDS, Lymphome, Leukämien), virale Infektionen (zum Beispiel EBV, CMV, HIV, HHV6) sowie genetische Prädisposition (HLA-Typen) [5, 6].
Bezüglich des Pathomechanismus wird hier eine Immunantwort auf einen antigenen „drug-host“-Komplex vermutet. Es handelt sich hierbei wahrscheinlich um eine T-Zell-mediierte Immunreaktion mit CD8+ T-Zellen als Hauptmediatoren (zusammen mit NK-Zellen und Monozyten) der Nekrose der Keratinozyten: Die Zytotoxizität wird dabei mittels Granulysin, Perforin, Granzyme B und FAS/FASL (CD95/CD95L) Interaktionen vermittelt [7]. Die Immunantwort bzw. Antwort der Haut auf das verursachende Medikament ist variabel und reicht von einem makulopapulösen Exanthem bis hin zum schweren SJS/TEN Phänotyp [8].
Für die Diagnosestellung der TEN ist eine ausführliche Anamnese und vor allem eine Medikamentenanamnese essenziell. Neben den eindeutig verdächtigen Hauterscheinungen muss umgehend eine Hautprobe entnommen werden. Die dermatohistopathologische Begutachtung im Schnellschnittverfahren hat sich dabei als hochsensitive, jedoch wenig spezifische Methode bewährt [9].
Für die Klassifikation von SJS, SJS/TEN oder TEN werden die auslösenden Faktoren sowie die betroffene Körperoberfläche miteinbezogen. Zur Abschätzung der Krankheitsschwere und der Prognose erwies sich der SCORTEN als verlässlich [10]. Der SCORTEN ist einfach, schnell am Krankenbett durchführbar und erlaubt eine valide Aussage, wenn er innerhalb der ersten fünf Tage nach Diagnosestellung berechnet wird.
Die Identifikation des auslösenden Medikamentes und das sofortige Absetzen bzw. Karenz desselben haben die höchste Priorität in der Behandlung. Bei Patienten mit SCORTEN > 3 ist die schnelle Einweisung in ein spezialisiertes Zentrum (zum Beispiel Verbrennungszentrum) für eine intensivmedizinische Betreuung erforderlich. Dort sollte die Betreuung des Patienten interdisziplinär erfolgen (Dermatologen, Ophthalmologen, Urologen, Intensivmediziner). Die Aufrechterhaltung des Flüssigkeits- und Elektrolythaushalts ist das oberste Ziel. Lokal werden nicht-adhäsive und atraumatische Wundauflagen (zum Beispiel nanokristalline oder Petroleum-getränkte Gazen) empfohlen. Von einem Débridement der epidermolytischen Haut wird abgeraten [11].
Die Wirksamkeit der systemischen Therapie mit Glukokortikosteroiden ist umstritten. Eine in mehreren Studien nachgewiesene, gute Wirksamkeit wird den hochdosierten intravenösen Immunglobulinen (IVIG) zugeschrieben. Eine Metaanalyse aus 26 Studien zeigte eine kürzere Hospitalisierungszeit und eine schnellere Abheilung einer kombinierten Therapie (IVIG und Glukokortikosteroide) im Vergleich zu der alleinigen Therapie mit den Steroiden, sie hat jedoch keinen Einfluss auf die Mortalität [12]. Eine retrospektive Studie aus den USA zeigte allerdings eine signifikant bessere Prognose und niedrigere Mortalitätsrate der Patienten, die IVIG und Steroide erhalten haben [13]. Ferner können Immunsuppressiva wie zum Beispiel Ciclosporin A und Cyclophosphamid eingesetzt werden. Des Weiteren kommen Tumornekrosefaktor (TNF)-α Blocker (Etanercept) sowie Plasmapherese zum Einsatz. Allerdings gibt es bislang für keine dieser Therapien eine solide Evidenzbasis. Die Durchführung von klinischen Studien ist bei diesem seltenen Krankheitsbild quasi nicht möglich.
Merke
» Schwere AMR können lebensbedrohlich sein. Die rechtzeitige Erkennung sowie das Absetzen des verantwortlichen Medikaments sind von zentraler Bedeutung.
» Bestimmte klinische Charakteristika erhärten einen Verdacht auf eine schwere AMR: Gesichtsödeme, Eosinophilie, Schleimhaut- oder konjunktivale Läsionen, schmerzende Augen oder Haut, gräuliche Hautläsionen und epidermale Ablösung.
» Bei ausgedehntem Befund und hohem SCORTEN ist die schnelle Zuweisung an ein Spezialzentrum zu empfehlen.
Schwere Nebenwirkung durch Immuntherapie bei metastasiertem malignem Melanom
Anamnese
Ein 32-jähriger Patient stellte sich im Juni 2018 erstmalig in unserer onkologischen Ambulanz vor. Im April 2018 wurde ein Melanom (unklarer Primarius) aufgrund zerebraler, pulmonaler, subkutaner und lymphonodaler Metastasen mit nachweisbarer BRAF V600E Mutation (= onkogene Mutation der Proteinkinase B-Raf) diagnostiziert. Ein Melanom unklaren Primarius (so genanntes MUP) stellt einen Melanom-Subtyp dar, bei welchem aufgrund von symptomatischen Metastasen nach bildmorphologischer und histologischer Sicherung die Diagnose des Melanoms gestellt wird, ohne dass der Primärtumor nachgewiesen werden kann. Ab Mai 2018 hatte der Patient in einem anderen Krankenhaus eine Systemtherapie mit den Checkpoint-Inhibitoren Ipilimumab und Nivolumab, wie auch eine stereotaktische Bestrahlung der zerebralen Metastasen erhalten. Bei Erstvorstellung berichtete er über einen reduzierten Allgemeinzustand sowie anhaltende Diarrhoen mit einer Stuhlfrequenz von sechs bis acht pro Tag. Diese hätten nach der zweiten Infusion der Immunkombinationstherapie begonnen. Begleiterkrankungen seien nicht bekannt. Trotz mehrfacher täglicher Einnahme von Loperamid 4 mg wie auch Dexamethason
4 mg drei mal täglich, hätte sich die Diarrhoe kaum gebessert.
Diagnostik
Bei der klinischen Untersuchung zeigte sich ein Patient in reduziertem Allgemeinzustand und mit leicht ikterischem Hautkolorit.
Die Labordiagnostik erbrachte deutlich erhöhte Leber- (GPT 82 U/l [Norm ≤ 49], γGT 827 U/l [Norm ≤ 59], alkalische Phosphatase 152 U/l [Norm ≤ 109]) und Pankreaswerte (α-Amylase 126 U/l [Norm ≤ 109], Lipase 179 U/l [Norm 13 bis 60]). Weiterhin fand sich eine Leukozytose, Thrombozytose und milde Anämie. Der Tumormarker Protein S100 war mit 0,19 ng/ml (Norm ≤ 0,10) nur leicht erhöht.
Diagnose
Autoimmunkolitis, Autoimmunhepatitis und Autoimmunpankreatitis unter Checkpoint-Inhibitor-Kombinationstherapie mit Ipilimumab und Nivolumab.
Verlauf
Der Patient wurde umgehend hospitalisiert und erhielt eine parenterale Therapie mit Glukokortikosteroiden sowie Loperamid zwei bis vier mal täglich. Hierunter reduzierte sich zwar die Stuhlfrequenz und auch die Laborparameter hinsichtlich der Autoimmunhepatitis und -pankreatitis waren rückläufig, jedoch hielt die Diarrhoe mit ca. drei Stuhlgängen pro Tag weiterhin an. Die Systemtherapie des metastasierten Melanoms wurde bei vorliegender BRAF-Mutation auf den BRAF-Inhibitor Dabrafenib in Kombination mit dem MEK-Inhibitor Trametinib umgestellt. Aufgrund der anhaltenden Diarrhoe, wurde eine Koloskopie durchgeführt, mittels derer ein infektiöses Geschehen, insbesondere eine CMV-Reaktivierung, ausgeschlossen werden konnte. Es zeigte sich jedoch trotz der nunmehr mittlerweile mehr als vier Wochen durchgeführten Therapie mit Glukokortikosteroiden histologisch weiterhin Aktivität der Autoimmunkolitis. Daher wurde die immunsuppressive Therapie eskaliert und eine parenterale Therapie mit Infliximab
5 mg/kg Körpergewicht begonnen [14]. Die erste veranlasste Ausbreitungsdiagnostik mittels CT Hals/Thorax/Abdomen im August 2018 zeigte ein gemischtes Ansprechen auf die bisherige Systemtherapie. Im Februar 2019 ist eine „stable disease“ unter BRAF/MEK Inhibition eingetreten.
Unter einem interdisziplinär entworfenem, multimodalen Behandlungskonzept aus systemischen Glukokortikosteroiden per os sowie wiederholter Gabe von Tumornekrosefaktor α–Inhibition mit Infliximab, befindet sich der Patient bezüglich der autoimmunbedingten Nebenwirkungen in einem zufriedenstellenden Zustand, auch wenn weiterhin Beschwerden mit bis zu drei Stuhlgängen am Tag bestehen.
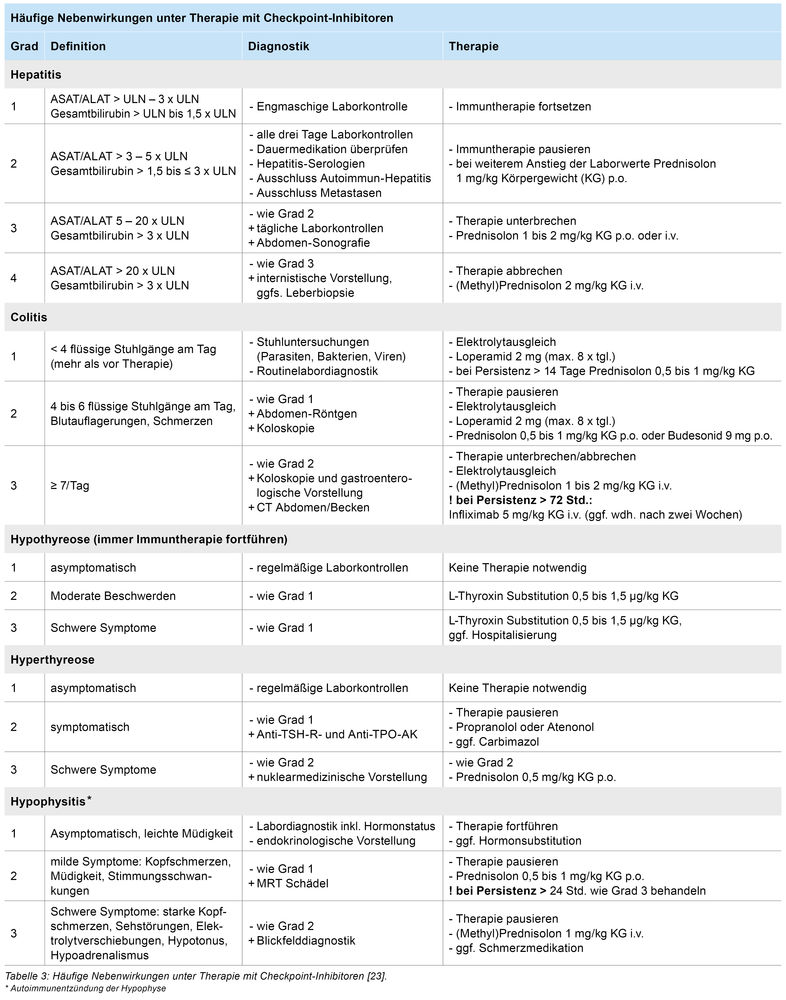
Klassische Nebenwirkungen im Rahmen von Immuntherapie sind mittlerweile hinlänglich bekannt und vielfach beschrieben. Es stehen hierfür verschiedene Diagnostik- und Therapiealgorithmen zur Verfügung, auf welche frei zugegriffen werden kann. Eine Einteilung des Schweregrades der Nebenwirkung erfolgt anhand der CTCAE-Einteilung (CTCAE = Common Terminology Criteria for Adverse Events), welche allgemeine Toxizitätskriterien festlegen. Die Schweregrade 1 bis 2 erlauben dabei meist eine Fortführung der Systemtherapie bei meist symptomatischer Therapie. Ab Schweregrad 3 ist der Abbruch der Systemtherapie indiziert, wie auch eine sofortige, intensive Behandlung der Nebenwirkungen (Tabelle 3) [14, 15]. Wichtig zu wissen ist, dass im Gegensatz zu den seit längerem eingesetzten Mono-Immuntherapien, im Rahmen der Kombinationstherapie aus CTLA4- und PD1-Inhibition Nebenwirkungen bereits nach dem ersten Infusionszyklus auftreten können.
Bei den häufigen Nebenwirkungen wie Autoimmunkolitis oder -hepatitis, besteht meist nicht die Schwierigkeit in der Diagnose, sondern in der Behandlung und vor allem in der Compliance und Wahrnehmung des Patienten. Es ist daher essenziell wichtig, die Patienten für erste Warnzeichen zu sensibilisieren und, sobald der Verdacht auf eine Nebenwirkung besteht, die entsprechende Diagnostik und frühzeitige, adäquate Therapie einzuleiten. Nur so können schwerwiegende Verläufe, wie bei unserem Patient, abgefangen und schwerwiegende Folgen der Nebenwirkungen vorgebeugt werden.
Merke
» Stetige Sensibilisierung der Patienten für frühe Warnzeichen von Nebenwirkungen
ist unabdingbar.
» Nebenwirkungsmanagement zielt auf frühzeitige Diagnose und rechtzeitige Therapie von Nebenwirkungen ab.
» Frühzeitige und adäquate therapeutische Reaktion auf Nebenwirkungen, führt zu besserer Behandelbarkeit der Nebenwirkungen, einer früheren Wiederaufnahme/Fortführung der folgenden Tumortherapie sowie insbesondere der Steigerung der Lebensqualität unserer Tumorpatienten.
Juckreiz und entzündete Haut
Ein 40-jähriger Patient stellte sich aufgrund eines seit der Kindheit bestehenden atopischen Ekzems in unserer Neurodermitis-Sprechstunde vor. Seit etwa fünf Jahren hätten die Ekzeme erheblich zugenommen. Es bestehe ein starker, quälender Juckreiz, der einen normalen Schlaf kaum ermögliche. Die Verrichtung der täglichen Aktivitäten und die Lebensqualität seien deutlich eingeschränkt. Der Patient gab an, seit einigen Jahren eine Katze zu besitzen. Die aktuelle Therapie bestehe aus einer täglichen Basistherapie mit rückfettenden Externa und einem topischen Steroid der Klasse II (Prednicarbat). Die Vortherapien des Ekzems umfassten diverse topische Steroide, Antihistaminika und Ciclosporin A. Im Rahmen eines individuellen Heilversuches habe der Patient den IgE-Antikörper Omalizumab erhalten. Keines der durchgeführten Therapien konnte das atopische Ekzem ausreichend behandeln. Als Begleiterkrankungen waren ein Asthma bronchiale, eine Rhinokonjunktivitis allergica, eine arterielle Hypertonie und eine Depression bekannt. Die Dauermedikation bestand aus Amlodipin 10 mg, Bisoprolol 10 mg, HCT 25 mg, Budesonid-Spray und Formoterol-Spray.
Diagnostik
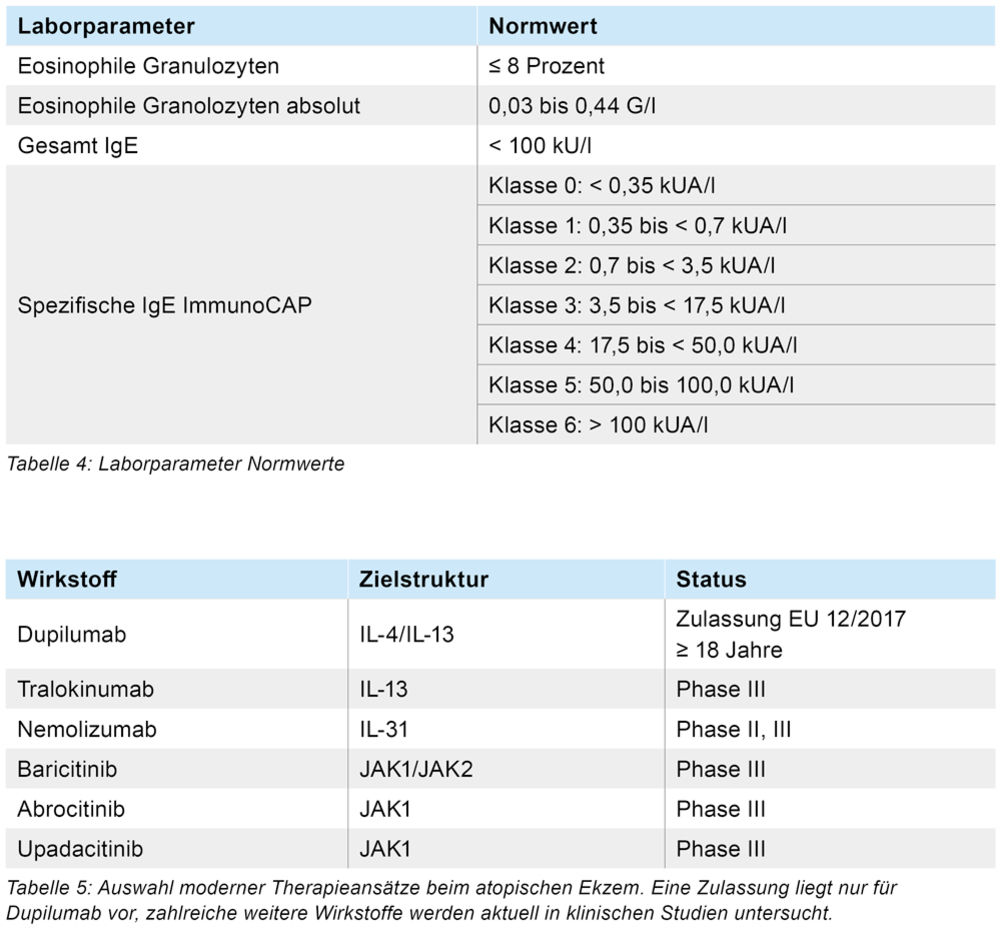
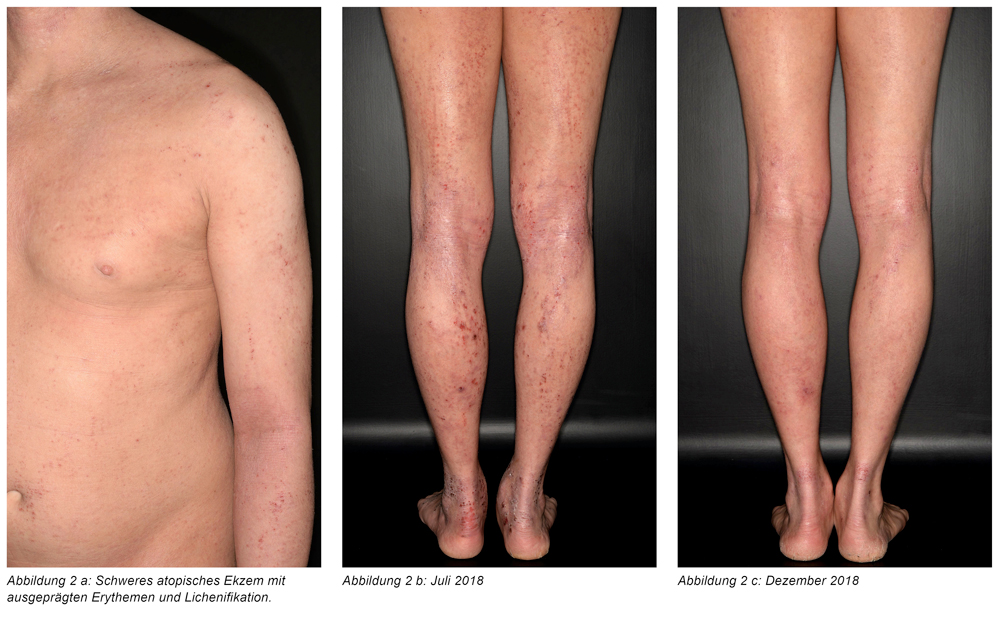
Bei Erstvorstellung zeigte sich ein schweres atopisches Ekzem am gesamten Integument. Unscharf begrenzte Erytheme, erythematöse, teils exkorierte Papeln und Lichenifikation prägten das klinische Bild (Abbildung 2 a). Insbesondere an den Unterschenkeln und in den Kniebeugen zeigten sich stark infiltrierte, dunkelrote bis livide Plaques mit tiefen Exkorationen (Abbildung 2 b). Begleitend bestand eine ausgeprägte Hauttrockenheit. Das Routinelabor zeigte 23 Prozent Eosinophile Granulozyten (Norm ≤ 8) und 1,56 G/l absolute Eosinophile Granulozyten (Norm 0,03 bis 0,44 G/l).
Das Gesamt IgE lag bei > 5.000 kU/l. Mittels Immuno-CAP konnten im Serum spezifische IgE-Antikörper der CAP-Klasse 6 (> 100 kUA/l) gegen Hausstaubmilbe (D. pyterossinus), der CAP-Klasse 4 gegen Katzen, der CAP-Klasse 5 gegen Birkenpollen, der CAP-Klasse 3 gegen Latex und der CAP-Klasse 3 gegen Ficus benjamina nachgewiesen werden (Normwerte siehe Tabelle 4).
Therapie und Verlauf
Aufgrund der Schwere des atopischen Ekzems bestand die Indikation zur Einleitung einer Systemtherapie. Zur Therapie des atopischen Ekzems sind systemische Steroide, Ciclosporin A und der monoklonale Antikörper Dupilumab zugelassen. Systemische Steroide sind aufgrund eines ungünstigen Nutzen-Risikoverhältnisses nicht zur Langzeittherapie des atopischen Ekzems geeignet [16, 17, 18]. Ciclosporin A konnte aufgrund der bestehenden arteriellen Hypertonie nicht verordnet werden. Somit erfolgte eine Therapieeinleitung mit dem monoklonalen Antikörper Dupilumab, der seit 2017 zur Therapie des schweren atopischen Ekzems zugelassen ist (Tabelle 5).
Durch eine Blockade des IL-4Rα-Rezeptors mittels Dupilumab wird eine Hemmung des IL-4 und IL-13 Signalweges erreicht. Über eine Aktivierung dieser Signalkaskade erfolgt eine Produktion zahlreicher inflammatorischer Zytokine und eine Reduzierung der Expression des Filaggrin Proteins mit nachfolgender Hautbarrierestörung. Eine Hemmung des Signalweges durch Dupilumab führt zu einer Reduzierung der Inflammation, der Ekzeme und des Juckreizes [19, 20].
Begleitend wurde eine intensive rückfettende Therapie durchgeführt und eine topische Therapie mit einem steroidhaltigen Externum der Klasse III (Mometason-furoat) eingeleitet. Zunächst erfolgte eine tägliche Anwendung des Steroids an den betroffenen Stellen für eine Woche, anschließend eine langsame Reduktion der Anwendung. Dem Patienten wurde geraten, die Katze aus dem Haushalt zu entfernen sowie eine gründliche Reinigung der Wohnung durchführen zu lassen. Bei bestehender Sensibilisierung gegenüber Hausstaubmilben wurden dem Patienten Milbenschutzbezüge (Encasings) für Matratze, Kissen und Bettdecken verordnet. Der Patient wurde zudem ausführlich über die Meidung von möglichen Provokationsfaktoren des atopischen Ekzems, wie Wolle oder Tabakrauch, aufgeklärt.
Im Dezember 2018 stellte sich der Patient erneut zur Kontrolle in unserer Sprechstunde vor. Die Fortführung der Therapie mit Dupilumab und die Entfernung und Reduzierung der bestehenden Allergene führte zu einer deutlichen Besserung des Hautbildes (Abbildung 2 c). Nebenwirkungen der Therapie, wie eine Konjunktivitis, traten nicht auf [21, 22]. Der Patient gab an, nicht mehr unter dem starken Juckreiz zu leiden. Auch die Schlafqualität habe erheblich zugenommen, ein Durchschlafen der Nächte war jetzt wieder möglich. Insgesamt berichtete der Patient über eine Zunahme seiner Lebensqualität und der Leistungsfähigkeit im Alltag. Begleitend besserte sich die klinische Symptomatik des Asthma bronchiale.
Die langfristige Therapie des Patienten beinhaltet eine weitere konsequente Meidung der Allergene, eine intensive, mindestens zweimal tägliche Rückfettung der Haut und die Fortführung der Therapie mit Dupilumab. Begleitend können die noch vorhandenen Ekzemherde mit einem topischen Calcineurininhibitor (Tacrolimus-Salbe) behandelt werden. Durch eine regelmäßige Vorstellung in der Sprechstunde alle drei bis sechs Monate kann eine Kontrolle des Hautbefundes und Anpassung der Therapie erfolgen. Im Verlauf kann zusätzlich eine Hyposensibilisierung gegen Birkenpollen erwogen werden.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Autoren

Professor Dr. (Univ. Genf) Lars French

Privatdozent Dr. Michael Flaig

Professor Dr. Dr. h. c. Andreas Wollenberg
Klinik und Poliklinik für Dermatologie und Allergologie, Ludwig-Maximilians-Universität München, Frauenlobstr. 9-11, 80337 München
Teilen:
Das könnte Sie auch interessieren: