Neu in der Nephrologie
Die Nephrologie ist seit jeher durch ein tiefes Verständnis von Pathophysiologie und Verlauf verschiedenster Nierenkrankheiten geprägt, allerdings standen nur begrenzt Therapieoptionen zur Verfügung. Abgesehen von ACE-Hemmern und AT1-Rezeptorblockern, die seit über 40 Jahren eingesetzt werden, fehlten lange Zeit echte Innovationen. Die Behandlung bestand vielfach eher aus Einschränkungen und Verboten („Reduzieren Sie Salz, Eiweiß, Kalium und Phosphat!“, „Vermeiden Sie Schmerzmittel wie Ibuprofen oder Diclofenac!“, „Bewegen Sie sich mehr!“ und „Trinken Sie mehr/weniger!“) als aus gezielten, wirksamen Therapieangeboten.
Dieses Bild hat sich in den vergangenen zehn Jahren grundlegend gewandelt. Wie in vielen Bereichen der Medizin erlebt auch die Nephrologie eine regelrechte therapeutische Revolution. Spätestens mit der Zulassung des ersten SGLT2-Hemmers im Jahr 2014 haben sich die Möglichkeiten deutlich erweitert. Mittlerweile stehen mindestens vier verschiedene Medikamentenklassen zur Verfügung, mit denen sich das Fortschreiten einer chronischen Nierenkrankheit (Chronic Kidney Disease – CKD) deutlich verlangsamen oder sogar aufhalten lässt.
Auch in anderen Bereichen wachsen die therapeutischen Möglichkeiten derzeit fast täglich. Durch den Einsatz präzisionsmedizinischer Ansätze können Erkrankungen gezielt behandelt werden, etwa mit siRNA bei primärer Hyperoxalurie oder mit Komplementtherapeutika bei aHUS, C3-Glomerulopathie und anderen Erkrankungen. Zelltherapien, wie etwa CAR-T-Zellen, werden im Rahmen klinischer Studien zur Behandlung immunvermittelter Prozesse eingesetzt, beispielsweise in der Transplantationsmedizin und bei Autoimmunerkrankungen. Zudem steht die Nephrologie an der Schwelle zu einem neuen Zeitalter des Organersatzes durch die Transplantation genmodifizierter Schweinenieren.
Auch auf diagnostischer Ebene gab es bahnbrechende Entwicklungen: So stehen neue Biomarker und die Untersuchung des gesamten Genoms mittels Next-Generation-Sequencing zur Verfügung. Zudem verfeinert der Einsatz von Künstlicher Intelligenz zunehmend die Diagnostik, wie wir es bereits aus der Radiologie und Pathologie kennen.
Fall 1: Progressionshemmung bei CKD
Ein 67-jähriger Patient stellte sich im Frühjahr 2024 mit langjährig bekannter arterieller Hypertonie und Diabetes mellitus Typ 2 in unserer Klinik vor. Die initiale Laboruntersuchung ergab ein Serum-Kreatinin von 1,4 mg/dL bei einer geschätzten glomerulären Filtrationsrate (eGFR) von ca. 52 mL/min/1,73 m2 sowie eine Albuminurie mit 320 mg/mmoL Kreatinin. Der Blutdruck lag bei 145/90 mmHg, das HbA1c bei 8,2 Prozent und das LDL-Cholesterin bei 110 mg/dl. Die bisherige Medikation bestand aus Metformin 1.000 mg und Ramipril 5 mg.
Die weltweite Prävalenz der CKD wird auf rund 13 Prozent geschätzt. Bei Personen über 60 Jahren liegt die Prävalenz sogar bei mehr als 19 Prozent [1]. Hierbei besteht ein enger Zusammenhang zwischen CKD und Risikofaktoren wie einem erhöhten Body-Mass-Index, Diabetes mellitus und Bluthochdruck. Aktuellen Prognosen zufolge wird die CKD im Jahr 2050 den 5. Platz unter den häufigsten Todesursachen weltweit einnehmen, nur übertroffen von ischämischer Herzkrankheit, Schlaganfall, COPD und Alzheimererkrankung [2].
Die CKD wird definiert als eine strukturelle oder funktionelle Veränderung der Nieren, die für mindestens drei Monate besteht. Die Klassifikation der CKD erfolgt anhand der Ursache, der glomerulären Filtrationsrate (GFR) in den Stadien G1 bis G5 sowie des Ausmaßes der Albuminurie in den Stadien A1 bis A3. Patientinnen/Patienten mit einer niedrigeren GFR und einer höheren Albuminurie, die mittels des Urin-Albumin-Kreatinin-Verhältnisses gemessen wird, weisen das höchste Risiko für eine progrediente CKD und das Fortschreiten zum Nierenversagen auf [3]. Letzteres erfordert eine Nierenersatztherapie, sei es durch Dialyse oder Nierentransplantation.
Das abgestufte Risiko kann in Form einer Heatmap visualisiert werden, die sowohl die Progression der CKD auf Bevölkerungsebene prognostiziert als auch das kardiovaskuläre Risiko und die Gesamtmortalität quantifiziert (Abbildung 1).
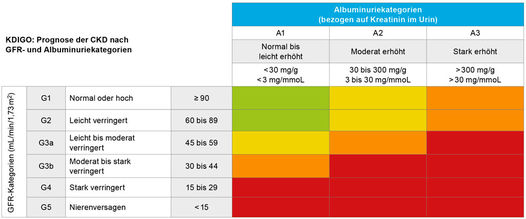
Abbildung 1: CKD-Stadien und Risiko der Progression. Grün: geringes Risiko (wenn keine anderen Marker der CKD vorliegen, dann liegt keine CKD vor),
gelb: mäßig erhöhtes Risiko, orange: hohes Risiko, rot: sehr hohes Risiko [3].
Hierbei ist von besonderer Bedeutung, dass sowohl das Progressionsrisiko als auch das Risiko für kardiovaskuläre Ereignisse nicht nur vom G-Stadium (also der geschätzten Nierenfunktion), sondern in gleichem Maße auch vom A-Stadium (also der Albuminurie) abhängig sind. Deshalb ist es enorm wichtig, dass Risikopatienten im hausärztlichen Umfeld frühzeitig auf das Vorhandensein einer Albuminurie untersucht werden, wie zum Beispiel Patienten mit kardiovaskulären Erkrankungen, arterieller Hypertonie, Diabetes mellitus oder einer positiven Familienanamnese für CKD.
Die Therapie der CKD hat sich in den vergangenen Jahren erheblich weiterentwickelt. Neben den etablierten Medikamenten ACE-Hemmern und Angiotensin-II-Rezeptorblockern (zusammen RAAS-Inhibitoren) gewinnen SGLT2-Hemmer, GLP-1-Rezeptoragonisten und nichtsteroidale Mineralokortikoid-Rezeptor-Antagonisten zunehmend an Bedeutung. Diese neuen Therapieansätze bieten zusätzliche Möglichkeiten, die Progression der CKD zu verlangsamen und das Risiko für kardiovaskuläre Ereignisse zu reduzieren.
Allgemeine Therapieprinzipien bei CKD
Unabhängig von der Art der Nierenkrankheit umfassen die Grundprinzipien der CKD-Therapie folgende Punkte [3, 4]:
Allgemeinmaßnahmen: Hierzu gehören unter anderem eine gesunde Ernährung, regelmäßige körperliche Aktivität und der Verzicht auf Tabak-Produkte.
Blutdruckkontrolle: Ein Zielblutdruck von ≤ 130/80 mmHg (nach Kidney Disease: Improving Global Outcomes – KDIGO – niedriger) wird empfohlen, um die Progression der CKD zu verlangsamen. Bei einer signifikanten Proteinurie und abhängig vom Patienten sollten gegebenenfalls niedrigere Zielwerte angestrebt werden.
Einsatz von ACE-Hemmern und AT1-Rezeptorblockern: Der Einsatz von RAAS-Inhibitoren ist zur Reduktion der Proteinurie und zum Schutz der Nierenfunktion Blutdrucksenker der ersten Wahl.
Einsatz von SGLT2-Hemmern: Diese neue Medikamentenklasse sollte als Teil der Erstlinientherapie in Kombination mit RAAS-Inhibitoren bei Patienten mit CKD und erhöhtem Risiko für eine Progression eingesetzt werden. Sie können auch bei Patienten mit niedrigeren eGFR-Werten (≥ 20 mL/min/1,73 m²) angewendet werden, sofern keine Kontraindikationen vorliegen. Vor Beginn der Behandlung ist der Patient über mögliche Nebenwirkungen, wie zum Beispiel das Risiko einer Ketoazidose, zu informieren.
Therapieprinzipien bei CKD mit Diabetes mellitus
Bei Patienten mit CKD und Diabetes sind zusätzlich spezifische Therapieansätze möglich und notwendig [5]:
Blutzuckerkontrolle: Ein HbA1c-Zielwert zwischen 6,5 und 7,5 Prozent wird empfohlen, wobei die Therapie individuell angepasst werden sollte, insbesondere bei kardiovaskulären Vorerkrankungen.
Antidiabetische Therapie: GLP-1-Rezeptoragonisten sind vorteilhaft, da sie den Blutzucker senken und organprotektiv wirken. Studien haben gezeigt, dass der GLP-1-Rezeptoragonist Semaglutid das Risiko für Nierenversagen, eine Verschlechterung der Nierenfunktion und den kardiovaskulären Tod signifikant reduzieren kann [6]. Kombinationstherapien von GLP-1-Rezeptoragonisten mit SGLT2-Hemmern (zum Beispiel Dapagliflozin) haben hierbei synergistische Effekte gezeigt, indem sie das Risiko für kardiovaskuläre Ereignisse und die Progression der CKD weiter senken [7].
Einsatz von nicht-steroidalen Mineralokortikoid-Rezeptor-Antagonisten: Nicht-steroidale Mineralokortikoid-Rezeptor-Antagonisten wie Finerenon haben sich ebenfalls als wirksam erwiesen, um bei CKD-Patienten mit Diabetes mellitus und dem Vorliegen einer Albuminurie die Progression der CKD zu verlangsamen und das Risiko für kardiovaskuläre Ereignisse zu reduzieren [8]. Die Kombination mit dem SGLT2-Hemmer Empagliflozin hat dabei synergistische Effekte gezeigt [9]. Es ist jedoch wichtig, die Patienten auf mögliche Nebenwirkungen wie Hyperkaliämie hinzuweisen und die Therapie entsprechend zu überwachen und gegebenenfalls anzupassen.
Eine frühzeitige Diagnose und eine individuell angepasste Therapie sind entscheidend, um das Fortschreiten der CKD zu verlangsamen und die Lebensqualität der Patienten dauerhaft zu erhalten. Hier ist es besonders wichtig, dass die primär betreuenden Hausärztinnen und Hausärzte sehr gut über diese neuen Therapiemaßnahmen informiert sind, da eine Progressionshemmung der CKD bereits in einem Stadium sinnvoll und wirksam ist, in dem die Patienten ganz wesentlich durch den Hausarzt betreut werden. So gehen Modellrechnungen bei Patienten mit chronischer Nierenkrankheit und frühzeitigem Therapiebeginn mit einem SGLT2-Hemmer zum Beispiel davon aus, dass die Notwendigkeit eines Nierenersatzverfahrens bis zu 26,6 Jahre hinausgezögert werden kann, im Vergleich zu einer Behandlung ohne SGLT2-Hemmer [4] (Abbildung 2).
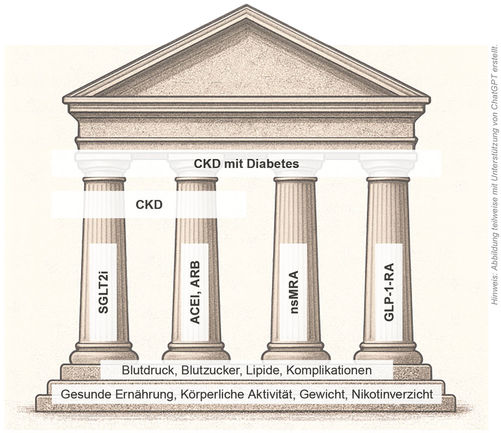
Abbildung 2: Therapiesäulen bei chronischer Nierenkrankheit. ACE-Hemmer und AT1-Rezeptorblocker sollten bei Vorliegen einer Albuminurie die Erstlinientherapie zur Blutdruckkontrolle sein, SGLT2-Hemmer sollten in allen CKD-Stadien bei (fast) allen Nierenkrankheiten ebenfalls primär eingesetzt werden, insbesondere bei gleichzeitigem Vorliegen einer Albuminurie. GLP-1-Agonisten und nicht-steroidale Mineralokortikoid-Rezeptor-Antagonisten kommen derzeit nur bei CKD-Patienten mit Diabetes zum Einsatz. Die medikamentösen Ansätze ersetzen jedoch nicht die Basismaßnahmen, wie zum Beispiel Lebensstilmodifikationen [3].
Zurück zu dem eingangs geschilderten Fall. Im Rahmen der leitliniengerechten Therapieoptimierung wurden der SGLT2-Hemmer Empagliflozin (10 mg) sowie der GLP-1-Rezeptoragonist Semaglutid (1 mg pro Woche) ergänzt. Zusätzlich wurde zur besseren Blutdruckkontrolle Amlodipin hinzugefügt sowie Atorvastatin 20 mg. Im Verlauf von sechs Monaten zeigten sich eine Stabilisierung des Blutdrucks auf 128/78 mmHg, eine Verbesserung der glykämischen Kontrolle (HbA1c 6,8 Prozent) sowie eine rückläufige Albuminurie von 90 mg/mmoL Kreatinin, die Nierenfunktion blieb stabil. Aufgrund des Rückgangs der Albuminurie wurde gegenwärtig auf eine Hinzunahme eines nicht-steroidalen Mineralokortikoid-Rezeptor-Antagonisten verzichtet. Das letzte LDL-Cholesterin lag bei 72 mg/dL.
Fall 2: Behandlung der Immunglobulin A-Nephropathie (IgAN)
Ein 36-jähriger, sportlicher Patient stellte sich im Jahr 2017 mit neu diagnostiziertem arteriellen Hypertonus in unserer Klinik vor. Unter einer antihypertensiven Therapie mit Ramipril 10 mg täglich zeigte die 24-Stunden-Blutdruckmessung einen mittleren Blutdruckwert von 150/89 mmHg. Im Rahmen der weiteren Abklärung ergaben sich normale Nierenfunktionswerte, jedoch zeigten sich auffällige Urinbefunde mit Mikrohämaturie, Proteinurie und einer erhöhten Albumin-Kreatinin-Ratio von 30 mg/mmoL Kreatinin. Eine relevante Vorerkrankung war nicht bekannt. Zur weiteren Abklärung wurde eine Nierenbiopsie durchgeführt, die die Diagnose einer IgA-Nephropathie (IgAN) bestätigte (Abbildung 3).
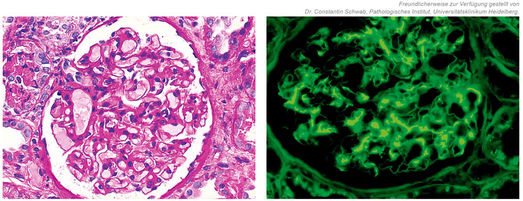
Abbildung 3: IgAN. Links PAS, rechts Immunfluoreszenz. Es zeigt sich eine mesangiale Proliferation mit den typischen mesangialen Ablagerungen von IgA.
Die IgAN ist die weltweit häufigste primäre Glomerulopathie. Sie ist histologisch gekennzeichnet durch eine mesangiale Zellproliferation und Matrixvermehrung sowie die Ablagerung von Immunglobulin A im Mesangium. Sie ist klinisch durch ein hohes Lebenszeitrisiko für das Fortschreiten bis zum Nierenversagen mit Notwendigkeit einer Nierenersatztherapie gekennzeichnet und geht mit einer beträchtlichen sozioökonomischen Belastung einher.
In der Vergangenheit konzentrierte sich die Therapie der IgAN vor allem auf die Optimierung der supportiven Behandlung, insbesondere auf eine strenge Blutdruckkontrolle – vorzugsweise durch die Blockade des Renin-Angiotensin-Aldosteron-System (RAAS) – sowie auf Maßnahmen zur Lebensstilmodifikation. Inzwischen kann die IgAN jedoch spezifisch und an verschiedenen Angriffspunkten angegangen werden. Dabei kommen zunächst die allgemeinen Prinzipien der Progressionshemmung, wie in Fall 1 und Abbildung 2 dargestellt, zur Anwendung. Insbesondere gilt der Einsatz von SGLT2-Hemmern mittlerweile als zentraler Bestandteil der Therapie. In einer Subgruppe von Patienten mit IgAN der DAPA-CKD-Studie (Die DAPA-CKD-Studie ist eine gut durchgeführte Studie, die bei Patienten mit CKD eine renale Protektion zeigt, egal ob gleichzeitig ein Diabetes mellitus Typ 2 vorliegt oder nicht), führte Dapagliflozin zu einer signifikanten Reduktion des primären Endpunkts (relative Risikoreduktion: 71 Prozent), einer Verlangsamung des Rückgangs der Nierenfunktion und einer Verringerung der Albuminurie [10].
Spezifische Besonderheiten der Therapie bei IgAN umfassen [11]:
1. Strenge(re) Blutdruckziele: Ein systolischer Zielwert von < 120 mmHg soll erreicht werden, um den Rückgang der eGFR (Ziel: ≤ -1 mL/min/1,73 m² pro Jahr) zu verlangsamen. Gleichzeitig wird eine möglichst geringe Proteinurie (idealerweise < 0,3 g/Tag) sowie ein Sistieren der Mikrohämaturie angestrebt.
2. Verzicht auf Dihydropyridin-Calciumkanalblocker in der Initialtherapie: Aufgrund ihrer ungünstigen glomerulären Hämodynamik – sie steigern im Gegensatz zur RAAS-Blockade den glomerulären Filtrationsdruck – sollten diese Substanzen in der Initialtherapie vermieden werden.
3. Einsatz von neuen Endothelin-Rezeptorantagonisten: Substanzen wie Sparsentan, ein dualer Blocker von Endothelin-1- und Angiotensin-II-Rezeptoren, zeigen vielversprechende Effekte auf Proteinurie und renale Progression. Bei Patienten mit IgAN und > 1 g Proteinurie pro Tag konnte Sparsentan im Vergleich zu Irbesartan den GFR-Verlust um 1,1 mL/min pro 1,73 m² pro Jahr und die Proteinurie um 40 Prozent reduzieren [12].
Obwohl die IgAN eine immunvermittelte glomeruläre Erkrankung ist, gab es bisher keine positiven Daten bezüglich des Nutzens klassischer Immunsuppressiva, wie sie etwa bei Lupusnephritis, ANCA-assoziierter Vaskulitis oder membranöser Nephropathie erfolgreich eingesetzt werden. Entsprechend beschränkte sich die immunologische Therapie lange Zeit auf die systemische Gabe von hochdosierten Glukokortikoiden über einen längeren Zeitraum, was mit entsprechenden Nebenwirkungen verbunden ist.
Dieses Bild hat sich durch ein tieferes Verständnis der Pathophysiologie der IgAN inzwischen deutlich gewandelt. Aktuell wird eine Vielzahl neuer zielgerichteter Therapien bei IgAN klinisch evaluiert. Einige davon sind bereits zugelassen, darunter:
TRF-Budesonid: Eine Formulierung mit gezielter Freisetzung von Budesonid im terminalen Ileum, die auf die mukosale Immunantwort abzielt, und Iptacopan: Ein oraler Inhibitor von Komplementfaktor B, der in die alternative Komplementaktivierung eingreift.
Weitere Substanzen befinden sich in fortgeschrittener Entwicklung und werden voraussichtlich in den nächsten Jahren zur Verfügung stehen (Abbildung 4).
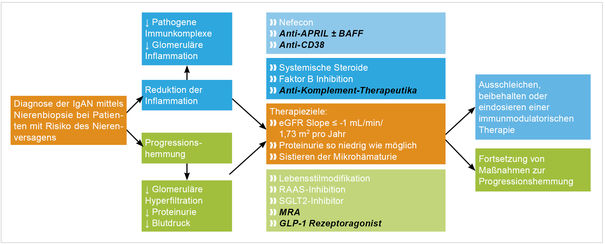
Abbildung 4: Zukünftige Therapie der IgAN [11]. Ein Model für die zukünftige Behandlung der Immunglobulin-A-Nephropathie (IgAN) zielt auf eine langfristige Unterdrückung der pathogenen IgA-Synthese, die sofortige Kontrolle der glomerulären Entzündung und idealerweise in Zukunft die Hemmung profibrotischer Signalwege. Dies geschieht mit einem vielschichtigen Ansatz mit Hemmung des RAAS, SGLT2-Hemmung, sowie Einsatz von dualen Endothelin-Angiotensin-Rezeptor-Antagonisten oder Endothelin- und Mineralokortikoid-Rezeptor-Antagonisten. GLP-1-Agonisten können bei adipösen Patienten mit IgAN in Betracht gezogen werden. Ob das Paradigma darin bestehen wird, die Substanzen seriell einzusetzen oder alle Wege gleichzeitig mit submaximalen Dosen jeden Wirkstoffs zu behandeln, muss noch festgelegt
werden. Die schwarz/kursiv markierten Medikamente befinden sich in klinischen Studien der Phasen II bis III bei Patienten mit IgAN oder nicht-diabetischer CKD [11].
Zurück zu dem eingangs geschilderten Fall. Bei der letzten Follow-up-Untersuchung zeigte sich bei dem eingangs geschilderten Patienten mit IgAN ein Blutdruck von 119/70 mmHg unter einer antihypertensiven Therapie mit Ramipril 10 mg, Bisoprolol 5 mg, Indapamid 2,5 mg, Spironolacton 25 mg sowie Amlodipin 10 mg. Amlodipin wurde hinzugenommen nach Blockade des RAAS aufgrund der immer noch unzureichend eingestellten Blutdrucksituation. Zusätzlich erhielt der Patient Dapagliflozin 10 mg (SGLT2-Hemmer) und Atorvastatin. Unter Blutdruckeinstellung (< 120 mmHg) und SGLT2-Hemmer zeigte sich eine über acht Jahre stabile Nierenfunktion, eine ebenfalls stabile Urin-Albuminausscheidung auf minimalem Niveau sowie minimale Mikrohämaturie, sodass aktuell auf eine weitere Therapie zum Beispiel mittels Endothelin-Rezeptorantagonist oder immunmodulierende Therapie verzichtet wurde. Dies kann sich jedoch im Verlauf und mit der Publikation evtl. neuer Studiendaten jederzeit ändern, wie auch in Abbildung 4 dargestellt.
Fall 3: Biomarker in der Nephrologie und nach Transplantation
Eine 65-jährige Patientin in reduziertem Allgemeinzustand mit bekannter Lungenfibrose und Zustand nach einem erlittenen Schlaganfall wird rezent aus der Augenklinik bei Sehstörungen im Rahmen einer hypertensiven Krise (systolische Blutdruckwerte bis 260 mmHg) in der Klinik vorgestellt. Die Patientin hat zu dem Zeitpunkt eine Therapie mit ASS 100 mg und dem Tyrosinkinase-Inhibitor Nintedanib 100 mg. Die Nierenfunktion zeigte sich zu diesem Zeitpunkt eingeschränkt mit einem Serum-Kreatinin von 1,86 mg/dL, das Urinsediment war unauffällig, allerdings zeigte sich eine deutliche Urineiweißausscheidung mit einer Albuminurie von 6.234 mg/g Kreatinin. Die serologischen Untersuchungen (unter anderem ANA, ANCA) brachten keinen wegweisenden Befund. Da die Patientin in deutlich reduziertem Allgemeinzustand war, wurde zunächst keine Nierenbiopsie durchgeführt, es erfolgte eine konservative Therapie mittels Furosemid und Antihypertensiva. Zudem wurde unter dem Verdacht auf eine Nintedanib-induzierte Hypertonie und Proteinurie dieses Medikament pausiert. Im weiteren Verlauf kam es zu einer weiteren Zunahme der Albuminurie auf 9.404 mg/g Kreatinin. Zudem kam der Befund eines hochpositiven Anti-PLA2R-Antikörpers aus dem Labor, sodass der hochgradige Verdacht auf auf eine membranöse Glomerulopathie geäußert wurde.
Biomarker kommen in der Nephrologie und Transplantationsmedizin vor allem in drei Szenarien zum Einsatz: Sie dienen 1. der Differenzialdiagnose von Krankheitsursachen (wie im obigen Fallbeispiel), 2. der Früherkennung von Nierenschäden, beispielsweise bei der Entwicklung einer akuten Nierenfunktionseinschränkung (AKI) sowie 3. der Therapieüberwachung und Prognoseabschätzung, insbesondere bei transplantierten Patienten. Fortschritte in den Bereichen Genomik, Proteomik, Metabolomik und bioinformatische Analyse eröffnen hierbei neue diagnostische Perspektiven – von der „Liquid Biopsy” bis hin zu KI-gestützten Vorhersagemodellen.
Differenzialdiagnose von Krankheitsursachen
Biomarker bei Glomerulonephritiden dienen der Diagnosestellung, Verlaufsbeurteilung und Prognoseeinschätzung. Klassische serologische Marker sind Antikörper wie Anti-GBM-Antikörper (bei Goodpasture-Syndrom), ANCA (zum Beispiel c-ANCA gegen Proteinase 3 bei Granulomatose mit Polyangiitis, p-ANCA gegen Myeloperoxidase (MPO) bei mikroskopischer Polyangiitis) oder ANA bei Lupusnephritis. Ergänzend liefern Komplementfaktoren (C3, C4) Hinweise auf die Aktivierung des Immunsystems, etwa bei postinfektiöser Glomerulonephritis oder membranoproliferativer Glomerulonephritis.
Neuere Biomarker haben das Verständnis und die Diagnostik bestimmter Glomerulonephritiden deutlich erweitert. Besonders bei der primären membranösen Nephropathie ist der Nachweis von Anti-PLA2R-Antikörpern, wie im eingangs beschriebenen Fall, im Serum wegweisend – sie sind bei etwa 70 bis 80 Prozent der Patienten positiv, sind hochspezifisch und korrelieren oft mit der Krankheitsaktivität. Seltener finden sich Anti-THSD7A-Antikörper, die für einen kleinen Anteil PLA2R-negativer Fälle relevant sind und teils mit Tumorassoziationen in Verbindung stehen. Weitere Zielantigene sind zum Beispiel NELL-1 und seltenere Sema3B.
Bei podozytären Erkrankungen wie minimal change Nephropathie oder FSGS (fokal segmentale Glomerulosklerose) werden zunehmend Anti-Nephrin-Antikörper untersucht [13]. Diese richten sich gegen ein Schlüsselmolekül der Schlitzmembran und könnten in einem Teil der Fälle pathogenetisch wirksam sein. Sie sind somit nicht nur Biomarker, sondern stellen auch ein zukünftiges therapeutisches Target dar.
Früherkennung von Nierenschäden
Gerade bei AKI ist der Einsatz von Biomarkern sinnvoll, da diese eine Schädigung bereits erkennen, bevor der Kreatininwert ansteigt. Hierzu zählen beispielsweise die Zellzyklusarret-Marker TIMP-2 und IGFBP7 im Urin, NGAL, KIM-1, IL-18, oder Proenkephalin A 119-159. Die Zellzyklusarret-Marker TIMP-2 und IGFBP7 im Urin weisen auf eine Stressreaktion renaler Tubuluszellen hin und zeigen so ein hohes Risiko für AKI in den nächsten Stunden bis Tagen an. Proenkephalin A 119-159 ist ein stabiler Plasmapeptidmarker, der die glomeruläre Filtrationsrate indirekt widerspiegelt und sich insbesondere bei septischen Patienten als früher und sensitiver Nierenfunktionsmarker erwiesen hat. Beide Marker ergänzen klassische Parameter, verbessern die Risikostratifizierung und können helfen, rechtzeitig präventive Maßnahmen einzuleiten [14, 15].
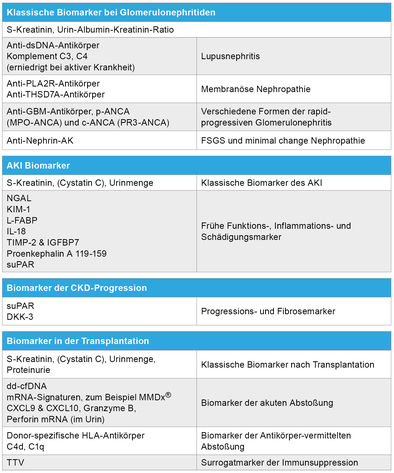
Tabelle: Ausgewählte Biomarker in der Nephrologie
Biomarker in der Transplantationsmedizin
Die Nierentransplantation ist die Therapie der Wahl für viele Patienten mit Nierenversagen. Trotz verbesserter Immunsuppressiva und Operationsmethoden bleibt die Abstoßung des Transplantats eine große Herausforderung. Eine frühzeitige Erkennung und Differenzierung von Abstoßungsreaktionen (akut vs. chronisch, zellulär vs. humoral) ist entscheidend, um die Überlebenschance des Transplantats zu erhöhen.
Die klassische Diagnostik mittels Biopsie ist jedoch invasiv und nicht ohne Risiko. Deshalb werden nicht-invasive Biomarker intensiv erforscht.
Immunologische Biomarker: Die Bestimmung von Donor-spezifischen HLA-Antikörpern im Serum ist schon seit vielen Jahren Standard bei der Überwachung von Transplantaten, da sie auf Antikörper-vermittelte Abstoßungen hinweisen.
Zwei neuere Biomarker sind die dd-cfDNA und das TTV.
TTV: TTV, das Torque-Teno-Virus, ist ein nicht-pathogenes, ubiquitär vorkommendes Anellovirus, dessen Viruslast bei Nierentransplantierten als Surrogatmarker der Immunsuppression genutzt werden kann. Hohe TTV-Konzentrationen deuten auf eine starke Immunsuppression hin und können mit erhöhtem Infektionsrisiko assoziiert sein, während niedrige Spiegel auf eine unzureichende Immunsuppression und damit ein erhöhtes Abstoßungsrisiko hindeuten können. Die Messung erfolgt meist mittels quantitativer PCR im Plasma. TTV bietet damit eine dynamische, patientenindividuelle Möglichkeit zur Überwachung des Immunstatus, um das Gleichgewicht zwischen Infektions- und Abstoßungsrisiko besser zu steuern und personalisierte Therapieanpassungen zu
unterstützen [16].
dd-cfDNA: Dieses Fragment zellfreier DNA aus dem Transplantat kann im Blut des Empfängers gemessen werden und steigt bei Transplantatschädigung an. Es gilt als vielversprechender Marker für frühe Abstoßungsprozesse, sowie das Monitoring unter Abstoßungstherapie [17].
Im Bereich der Nierentransplantation ist es bereits so weit, dass mithilfe von KI prädiktive Modelle entwickelt werden können – basierend auf Biomarkern wie der dd-cfDNA, aber auch auf klinischen und pathologischen Daten [18].
Zurück zu dem eingangs erwähnten Fall. Eine jetzt trotz erhöhtem Risiko durchgeführte Nierenbiopsie bestätigte den Verdacht auf eine membranöse Glomerulopathie, es erfolgte leitliniengerecht die zweimalige Gabe von 1.000 mg Rituximab, und die Albuminurie war zuletzt (mit noch sehr kurzem Follow-up) rückläufig auf 5.864 mg/g Kreatinin.

Vortragshonorare: Boehringer Ingelheim und Novartis, Patente und Lizenzen sowie Gesellschafter/CSO bei der TolerogenixX GmbH (deren Produkte hier nicht behandelt werden).
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autor
Professor Dr. Christian Morath

Facharzt für Innere Medizin, Schwerpunkt Nephrologie in der Inneren Medizin
Klinikum Süd, Chefarzt Nephrologie und Hypertensiologie, Breslauer Str. 201, 90471 Nürnberg
Teilen:
Das könnte Sie auch interessieren:






