Neu in der Angiologie
 Neu in der Angiologie
Neu in der Angiologie
Die Angiologie beschäftigt sich mit Erkrankungen der Arterien, Venen und Lymphgefäße. Im Kontext aktualisierter Leitlinien und neuer Studienergebnisse werden hier schwerpunktmäßig aktuelle Entwicklungen in Diagnostik und Therapie zweier sehr häufiger Gefäßerkrankungen (periphere arterielle Verschlusskrankheit und tiefe Venenthrombose) besprochen.
pAVK und Claudicatio intermittens
Fallbeispiel:
Ein 55-jähriger Raucher (ca. 40 pack years) stellt sich mit seit ca. zwölf Monaten bestehenden belastungsabhängigen Wadenschmerzen vor, welche sich wenige Wochen zuvor erheblich verschlechtert haben, mit nun Gehstreckeneinschränkung auf weniger als 150 Meter in der Ebene.
Diagnostik: Bildgebung nicht als Eingangsuntersuchung!
Die Diagnostik fußt auf Anamnese und klinischer Untersuchung und beinhaltet als apparative Eingangsuntersuchung die Bestimmung der systolischen Knöchelarteriendrucke mit Kalkulation des Knöchel-Arm-Index (Ankle-Brachial-Index – ABI). Bei belastungsabhängigen Beschwerden aber normaler Ruhedurchblutung ist die Wiederholung der Knöchelarteriendruckmessung nach Laufbandergometrie erforderlich (Abbildung 1) [1]. Ein Abfall des Knöchelarteriendrucks unmittelbar nach Belastung > 20 Prozent bestätigt die Diagnose pAVK, bei Abfall auf kritisch ischämische Werte nach Belastung (< 50 mmHg) ist der kausale Zusammenhang der Beschwerden zur pAVK zweifelsfrei. Die Gefäßbildgebung dient nicht der Diagnosestellung, sondern der Charakterisierung der zugrunde liegenden Obstruktionen zur Therapieplanung. Als bildgebendes Eingangsverfahren kommt die Duplexsonografie zum Einsatz, bedarfsweise (insbesondere zur Beurteilung des aortoiliakalen Segments) ergänzt durch MR- oder CT-Angiografie. Im vorliegenden Fall beträgt der ABI am betroffenen Bein 0,5, in der Bildgebung findet sich ein langstreckiger Verschluss der
A. femoralis superficialis mit Kollateralisierung über die A. profunda femoris.
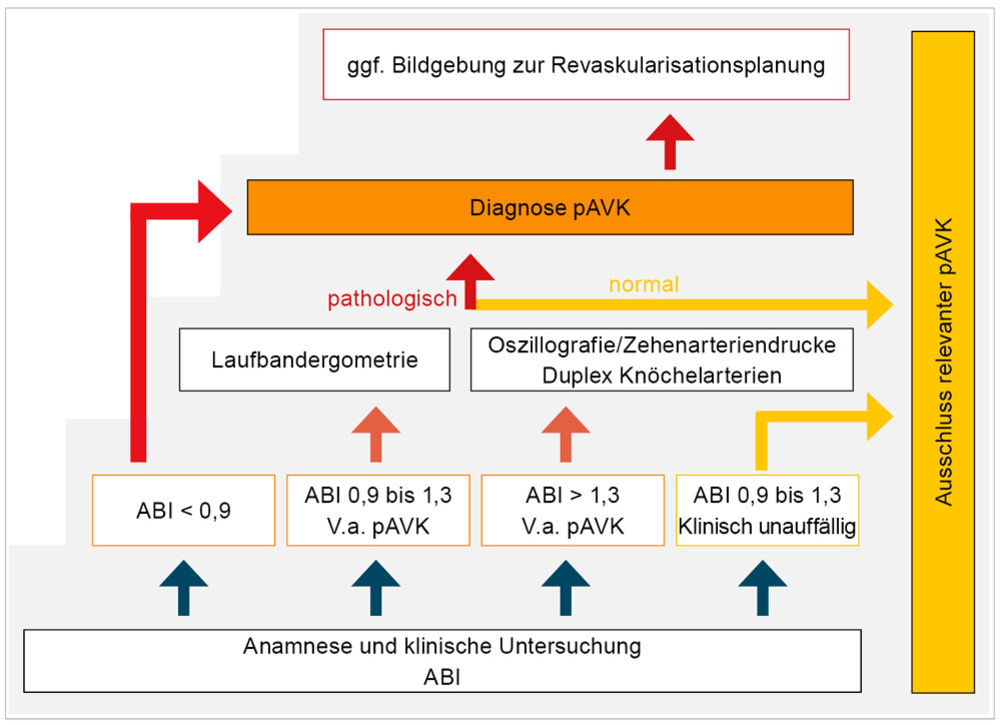
Abbildung 1: Stufendiagnostik der PAVK (Henke und Czihal, MMW 2023).
Therapie: Konservative Therapiemaßnahmen ausschöpfen, dies benötigt Zeit!
Unter prognostischen Aspekten (Progressionshemmung, Reduktion des Risikos für kardiovaskuläre Ereignisse) umfassen die konservativen Behandlungsmaßnahmen bei symptomatischer pAVK zwingend die Thrombozytenaggregationshemmung, erstmals mit einer Leitlinienempfehlung für den präferierten Einsatz von Clopidogrel, und eine intensive LDL-Cholesterinsenkung (mindestens 50 Prozent Reduktion des Ausgangswerts/Ziel-LDL < 55 mg/dl) unter Nutzung eines potenten Statins und mit präferentiell früher Kombinationstherapie (in erster Linie Ezetimib) [1]. Die Unterversorgung von pAVK-Patienten hinsichtlich der medikamentösen Sekundärprophylaxe in Deutschland ist nach wie vor eklatant [2]. Nikotinkarenz ist eines der am schwersten zu erreichenden Therapieziele; mit einer multimodalen Behandlung aus Nikotinersatzpräparaten, gegebenenfalls medikamentösen Ansätzen und Entwöhnungsprogrammen wird die Abstinenzrate gesteigert [1].
Unter dem Aspekt der Besserung von Gehleistung, Mobilität und Lebensqualität wird strukturiertes Gehtraining mit drei Trainingseinheiten pro Woche von jeweils 30 bis 60 Minuten nachdrücklich in der Leitlinie hervorgehoben. Es sollte mindestens drei bis sechs Monate durchgeführt werden, bevor überhaupt eine invasive Behandlung erwogen wird. Die Umsetzung strukturierten Gehtrainings bleibt in der Praxis jedoch eine Herausforderung, da vielerorts Gefäßsportgruppen fehlen. Monitoriertes häusliches Bewegungstraining mit klaren Zielvorgaben stellt hier eine vergleichbar effektive Alternative dar [1]. Nach Ergebnissen der randomisierten, kontrollierten LITE-Studie, sollte dies in einer Intensität erfolgen, die ischämische Symptome hervorruft, da effektiver als niedrigintensive Belastung ohne Beschwerdeinduktion in der Verlängerung der maximalen Gehstrecke [3].
Sollte die konservative Therapie keine ausreichende Symptomverbesserung erzielen, kann mit den Patientinnen und Patienten eine invasive Behandlung diskutiert werden (Tabelle 1). Alter, Komorbiditäten, Adhärenz zu den konservativen Therapiemaßnahmen und nicht zuletzt Stenose- bzw. Verschlusslokalisation und -morphologie sind in die Entscheidung einzubeziehen. Bei kurzstreckigen Stenosen und Verschlüssen der Becken- oder Oberschenkelarterien, die endovaskulär mit hoher technischer Erfolgsrate und Langzeitoffenheitsrate zu behandeln sind, wird eher die Entscheidung zugunsten einer Revaskularisation fallen. Im Bereich des femoropoplitealen Segments haben drug-eluting-Technologien (Ballons und Stents) die Offenheitsraten wesentlich verbessert, eine aktuell publizierte registerbasierte randomisierte kontrollierte Studie aus Schweden (SWEDEPAD-2) zeigte jedoch keinen klinisch relevanten Nutzen auf die Lebensqualität [4]. In dieser Studie zeigte sich eine tendenziell höhere Gesamtmortalität im mit drug-eluting-Devices (ganz überwiegend Paclitaxel) behandelten Studienarm, ein Befund der die Diskussion zur Sicherheit dieser Therapieform neu entfacht. Bei langstreckigen Verschlüssen der Oberschenkelarterie sowie bei Unterschenkelarterienobstruktionen ist im Stadium II der pAVK jedoch große Zurückhaltung geboten, insbesondere auch hinsichtlich der Bypasschirurgie. Ein prognostischer Nutzen einer Revaskularisation im Stadium II ist nicht evident [1]. Es gibt im Gegenteil Hinweise, dass Gefäßeingriffe früh in der Erkrankungshistorie den Extremitätenerhalt nachteilig beeinflussen [5].
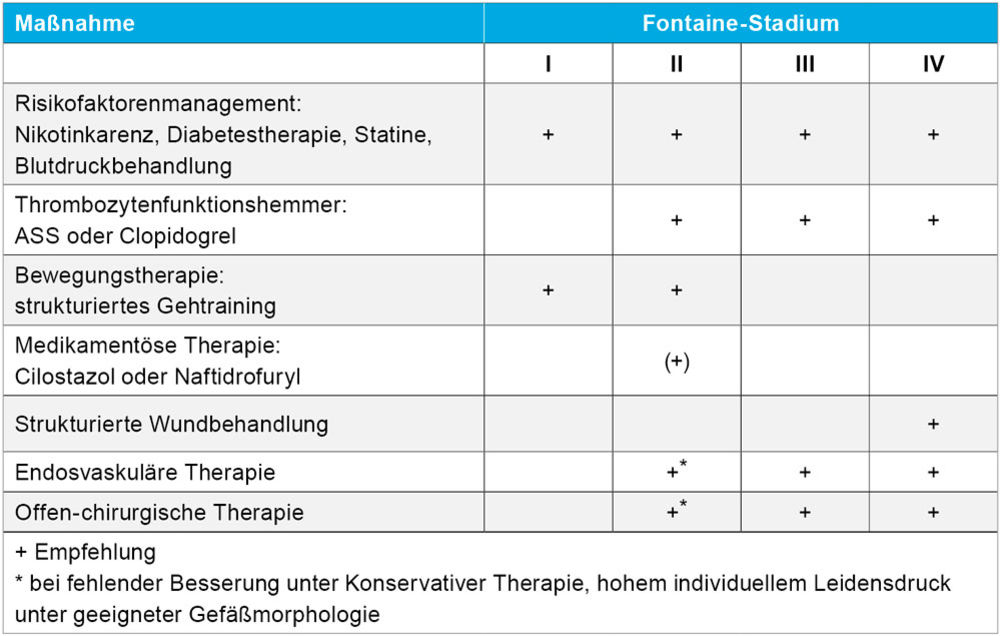
Tabelle 1: Stadienadaptierte Therapie der pAVK [1] in Abhängigkeit vom Stadium nach Fontaine (I bis IV).
Während nach drei Monaten konservativen Therapiemaßnahmen die schmerzfreie Gehstrecke verlängert, im Alltag aber noch einschränkend war, konnte nach sechs Monaten Behandlungsdauer eine deutliche Verbesserung mit Gehen in der Ebene ohne Einschränkung erzielt werden. Der ABI wurde mit 0,7 gemessen.
Kritische Extremitätenischämie/ Diabetischer Fuß
Fallbeispiel:
Eine 79-jährige Patientin mit Typ-2-Diabetes bei Adipositas permagna sowie chronischer Niereninsuffizienz wird mit einer nicht heilenden, schmerzlosen Wunde an der linken Großzehe vorgestellt. Klinisch imponiert eine eitrig sezernierende Wunde des Endglieds der Großzehe mit Rötung und Schwellung des Digitus 1. Die Messung des ABI ergibt links einen Wert von 1,0 und rechts von > 1,3.
Diagnostik: ABI häufig nicht aussagekräftig!
Gemäß Leitlinienempfehlung soll die strukturierte Einschätzung des Amputationsrisikos bei Patienten mit Wunden mit dem „Wound, Ischemia and foot Infection“ (WIfI)-Score vorgenommen werden (Tabelle 2) [1, 6]. Für die Beurteilung der Fußperfusion ist der ABI im vorliegenden Fall aufgrund der diabetischen Mediasklerose nicht aussagekräftig. Eine erweiterte hämodynamische Diagnostik ist erforderlich, zum Beispiel durch Bestimmung der Zehenarteriendruckwerte mit Kalkulation des Zehen-Arm-Index (Toe-Brachial-Index“ (TBI), die segmentale Oszillografie sowie die Analyse der Dopplerfrequenzprofile der Knöchelarterien (Abbildung 2) [7].
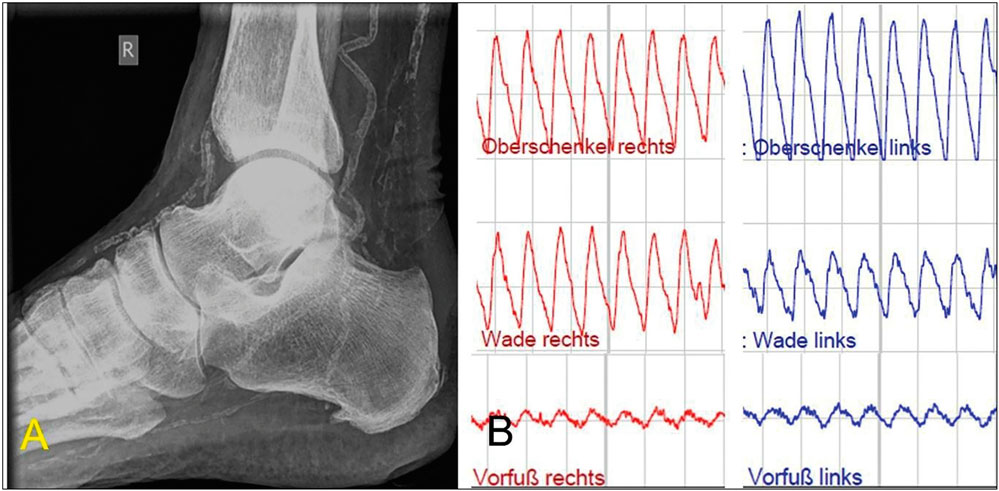
Abbildung 2: A: Mediasklerose im Röntgenbild bei einem Patienten mit diabetischem Fußsyndrom, B: Darstellung der reduzierten Vorfußperfusion bei pAVK vom Unterschenkeltyp bds. mittels Oszillografie
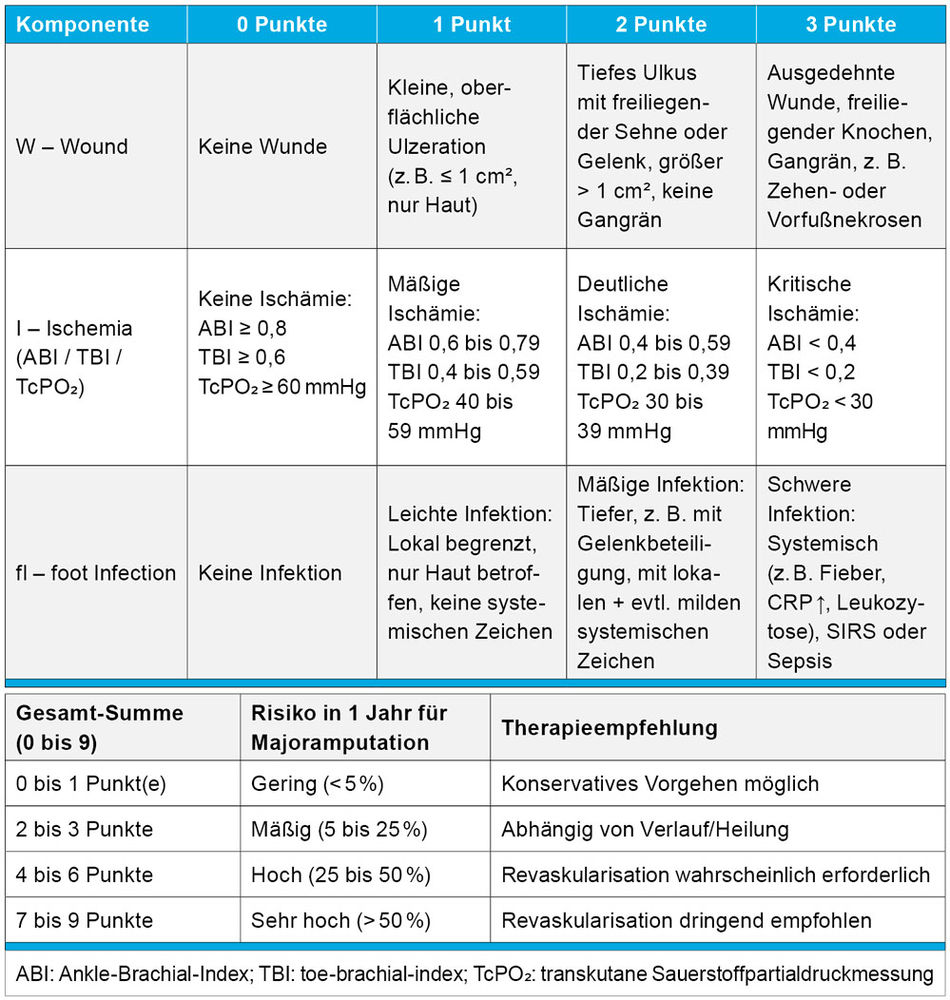
Tabelle 2: WIfI-Klassifikation von Fußwunden.
Bei unserer Patientin (nicht pulsatiles Vorfußoszillogramm, Zehenarteriendruck 30 mmHg am rechten Fuß) erhärtet sich der Verdacht auf eine kritische Durchblutungsstörung, die in aktuellen Empfehlungen als „critical limb threatening ischemia“ (CLTI) bezeichnet wird [1]. Der WIfI-Score von sechs Punkten prognostiziert ein hohes 1-Jahres-Risiko für eine Majoramputation. Duplexsonografisch zeigt sich die femoropopliteale Achse frei, bei fehlendem Fluss in der A. tibialis anterior und monophasischem Flussprofil in der A. tibialis posterior besteht der V. a. eine pAVK vom Unterschenkeltyp.
Therapie: Multimodale Behandlung unabdingbar!
Bei Typ 2-Diabetikern mit manifester kardiovaskulärer Erkrankung sollten neben einer intensiven LDL-Cholesterinsenkung orale Antidiabetika mit nachgewiesenem Nutzen in Endpunktstudien (GLP1-Analoga oder SGLT2-Inhibitoren) zum Einsatz kommen. Während in der randomisierten, kontrollierten STRIDE-Studie Semaglutid gegenüber Plazebo bei Typ 2-Diabetikern mit pAVK im Stadium II auch eine signifikante Verbesserung der maximalen Gehstrecke erzielte [8], gibt es schwache Evidenz aus retrospektiven Kohortenstudien für eine möglicherweise verbesserte Wundheilung und reduzierte Amputationsrate bei diabetischen Fußwunden [9]. Aktuelle Metaanalysen konnten die Befürchtung, dass unter SGLT2-Inhibitoren ein erhöhtes Amputationsrisiko besteht, nicht erhärten [10].
Adäquate Wundbehandlung, antibiotische Therapie bei klinischen Zeichen der Infektion und konsequente Druckentlastung gemäß spezifischer Empfehlungen zum diabetischen Fuß sind obligat [11]. Bei Vorliegen einer CLTI besteht, im Gegensatz zur Claudicatio intermittens, die absolute Indikation zur Revaskularisation mit dem Ziel der Wundheilung und mittelbar des Extremitätenerhalts bzw. der Amputationsvermeidung [1]. Revaskularisierende Maßnahmen sollten interdisziplinär diskutiert werden, da aufgrund der komplexen Datenlage keine generelle Empfehlung für eine „bypass first“ oder „endovascular first“-Strategie bei CLTI möglich ist. Die BEST-CLI-Studie (2022) zeigte bei weit über 1.000 Patienten mit CLTI und infrainguinaler Bypasschirurgie eine reduzierte Rate an extremitätenbezogenen Ereignissen/Tod (42,6 Prozent) gegenüber endovaskulär behandelten Patienten (57,4 Prozent) dann, wenn ein Segment der V. saphena magna als Material für die Bypasschirurgie tauglich war [12]. Hingegen zeigte die kleinere, überwiegend in Großbritannien durchgeführte BASIL-2-Studie (2023) an Patienten mit CLTI und Erfordernis zur Revaskularisation der Unterschenkelarterien (und gegebenenfalls proximaler Arterien) eine höhere Rate an amputationsfreiem Überleben nach endovaskulärer Therapie vs. Bypasschirurgie (47 Prozent vs. 37 Prozent), allerdings bei einer höheren Rate an Re-Interventionen [13]. Bei isolierten Unterschenkelarterienobstruktionen wird meist eine primäre endovaskuläre Strategie konsentiert, so auch im aktuellen Fall (Abbildung 3). Die SWEDEPAD-1-Studie konnte jedoch auch bei CLTI-Patienten keinen Nutzen von drug-eluting-Technologien hinsichtlich einer Reduktion der Amputationsrate zeigen [14]. Für Fälle, bei denen mangels pedaler Zielgefäße eine Revaskularisation nicht sinnvoll möglich ist, steht mit der katheterbasierten Arterialisierung tiefer Venen ein Alternativverfahren mit potenziellem Nutzen in Kohortenstudien zur Verfügung [15], welches seitens des G-BA einer Nutzenbewertung unterzogen wird.
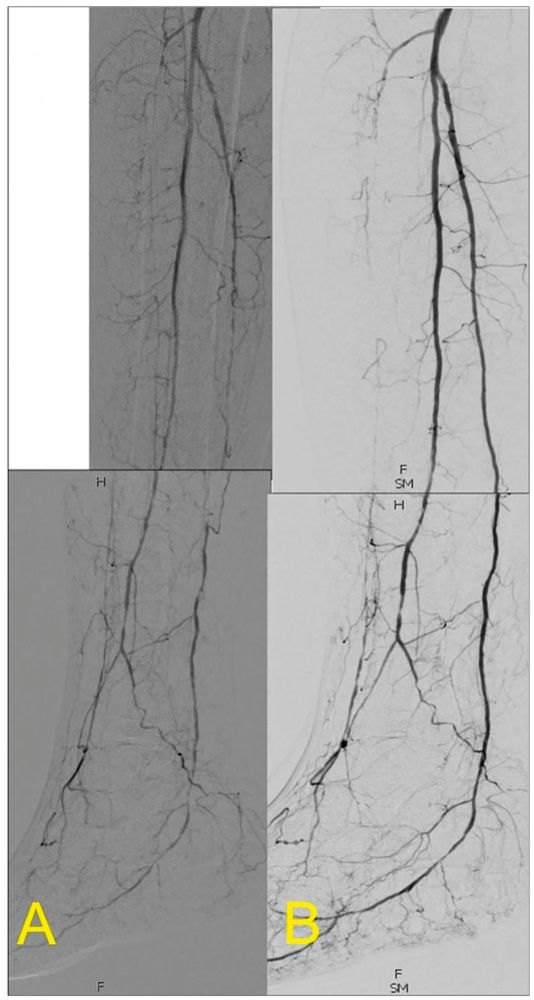
Abbildung 3: Rekanalisation der A. tibialis posterior mittels PTA, mit Wiederherstellung eines ungehinderten Blutflusses zum Fuß.
Nachsorge: Differenzierte antithrombotische Therapie!
Postinterventionell zeigte sich die Perfusion normalisiert, es stellt sich die Frage nach der antithrombotischen Behandlung in der Sekundärprophylaxe nach Revaskularisation. Die sogenannte „Dual Pathway Inhibition“ mit Kombinationstherapie aus ASS 100 mg und Rivaroxaban 2 × 2,5 mg/Tag konnte in der VOYAGER-PAD-Studie nach infrainguinaler Revaskularisation eine Reduktion vaskulärer Ereignisse, einschließlich akuter Extremitätenischämien und Majoramputationen zeigen, jedoch auf Kosten einer erhöhten Rate an schwerwiegenden Blutungen [16]. Ein direkter Vergleich dieses Regimes zur Clopidogrel-Monotherapie ist nicht verfügbar, ein indirekter Vergleich verfügbarer Daten deutet zumindest bei Patienten mit stabiler pAVK jedoch auf eine vergleichbare Effektivität hin [17].
Tiefe Venenthrombose
Fallbeispiel:
Ein 64-jähriger Patient mit einem metastasierten nicht-kleinzelligen Lungenkarzinom (NSCLC) unter Immun-/Chemotherapie wird mit rechtsseitiger Beinschwellung vorgestellt. Das rechte Bein ist im Seitenvergleich umfangsvermehrt, livide verfärbt und druckschmerzhaft. Der Patient ist hämodynamisch stabil, akute thorakale Beschwerden werden verneint.
Diagnostik: Bei V.a. Venenthrombose – Ultraschall zuerst und bei allen Patienten!
In der 2023 aktualisierten S2k-Leitlinie wurde die Empfehlung zur Primärdiagnostik der tiefen Beinvenenthrombose geändert. Bei weiterhin erforderlicher Beurteilung und Dokumentation der klinischen Wahrscheinlichkeit (KW) wird als Erstliniendiagnostik nun die duplexunterstützte Kompressionssonografie (dv-KUS) bei allen Verdachtsfällen empfohlen, mit Einsatz der D-Dimer-Bestimmung nur bei sonografisch unklaren Fällen (Abbildung 4) [18]. Die zuvor jahrelang praktizierte, an der KW ausgerichtete Stufendiagnostik kann, unter Einsatz limitierter Ultraschallprotokolle (Untersuchung nur proximaler tiefer Beinvenen) bei mangelnder Expertise für eine Sonografie des kompletten Venensystems alternativ angewandt werden, zum Beispiel in der Notaufnahme nachts und am Wochenende. Dieses Vorgehen beinhaltet bei negativem Befund aber zwingend eine Kontrolluntersuchung nach vier bis sieben Tagen, dann mit dv-KUS. Neu in der Leitlinie wird empfohlen, bei Thrombosenachweis an einem Bein auch unabhängig davon, ob eine Symptomatik besteht, auch das kontralaterale Bein mit zu untersuchen.
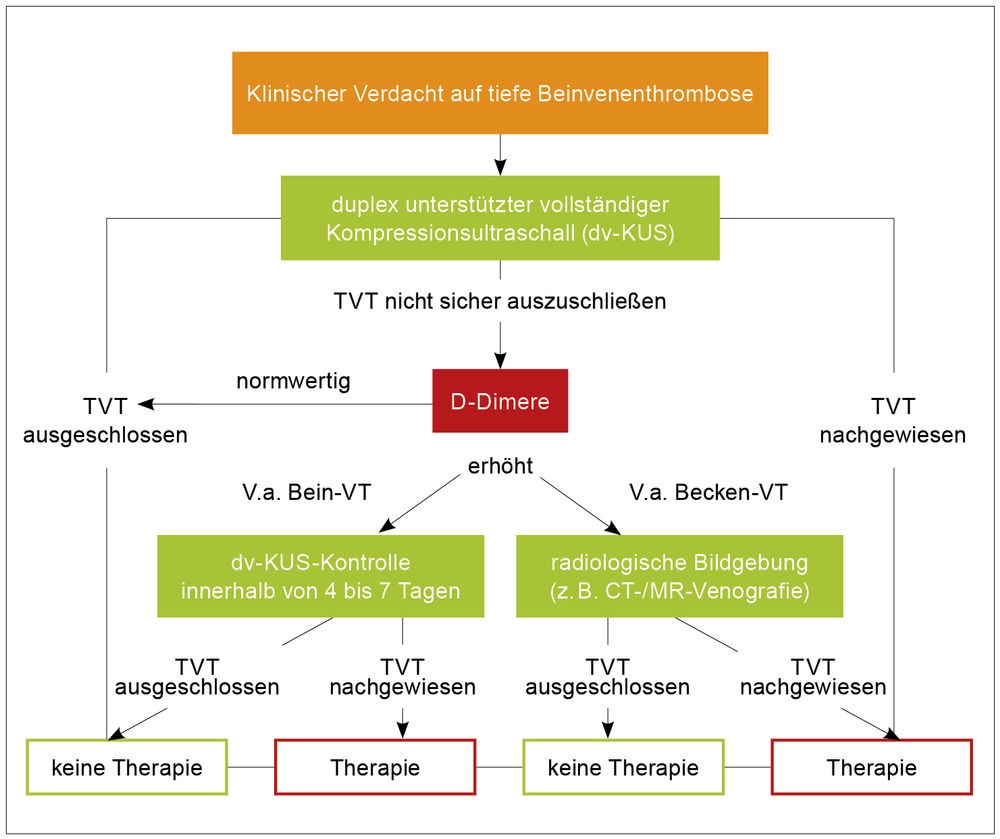
Abbildung 4: Diagnostischer Algorithmus bei V.a. tiefe Beinvenenthrombose [aus 16].
Bei unserem Patienten wurde sonografisch eine ausgedehnte proximale tiefe Beinvenenthrombose mit Thrombusende in der V. femoralis communis diagnostiziert.
Akuttherapie: DOAK bei den meisten und Thrombektomie bei ausgewählten Patienten!
Die in den vergangenen 15 Jahren gewonnene Evidenz und Erfahrung in der Behandlung der venösen Thrombembolie (VTE) mit direkten oralen Antikoagulantien (DOAK) schlägt sich auch in den Leitlinienempfehlungen nieder. Unverändert gilt, dass für eine orale Einzelsubstanzstrategie zugelassene Substanzen (Rivaroxaban, Apixaban) in erhöhter Initialdosierung einzusetzen sind, mit Dosisreduktion in der Phase der Erhaltungstherapie. Edoxaban und der Thrombininhibitor Dabigatran setzt hingegen jeweils einen fünftägigen lead-in mit parenteralen Antikoagulantien (in der Regel niedermolekulares Heparin) voraus [18].
Für den Fall ausgedehnter tiefer Venenthrombosen mit Beteiligung der Beckenvenen kann für ausgewählte Patienten (insbesondere jüngere Patienten mit ausgeprägter Symptomatik und hohem Risiko für ein postthrombotisches Syndrom – PTS) die mechanische Katheterthrombektomie mit Stentretrievern angewandt werden, mit vielversprechenden Erfolgsraten und geringem Komplikationsrisiko in ersten Registerdaten [19]. Die Basismaßnahme zur Verhinderung des PTS ist und bleibt jedoch in allen Fällen die korrekt durchgeführte Kompressionstherapie [18].
Verlängerte Sekundärprophylaxe: Individualisierte Entscheidungsfindung!
Nach der je nach Risikokonstellation und Thromboseausdehnung drei bis sechs Monate dauernden Erhaltungstherapie stellt sich die Frage nach Beendigung der Antikoagulation vs. Fortführung einer verlängerten medikamentösen Sekundärprophylaxe. Hilfreich für diese Entscheidung ist hier die Antikoagulationsampel, die auch Patientengruppen identifiziert, die angiologisch vorgestellt werden sollten (Abbildung 5) [18].
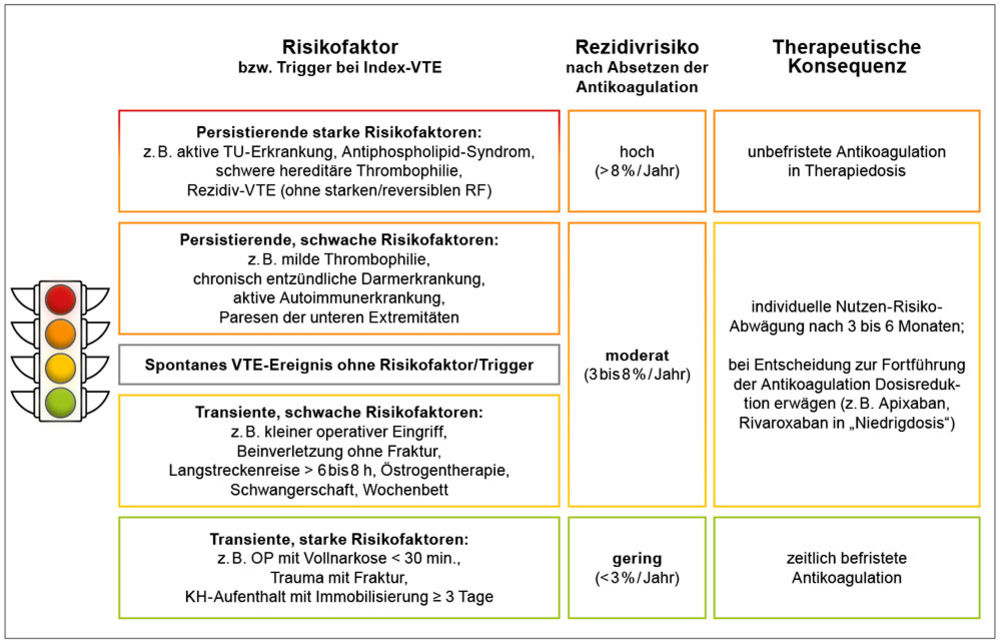
Abbildung 5: Antikoagulationsampel [aus 16].
Bei Patienten mit unerklärten Thrombosen und identifizierbaren Triggerfaktor hat sich schon vor etwa einem Jahrzehnt eine verlängerte Behandlung mit DOAK in reduzierter Dosierung als effektiv und sehr sicher erwiesen. Für die Besprechung und Visualisierung des statistischen Nutzen-Risiko-Verhältnisses (Risikoverhinderung vs. Blutungsgefahr) kann der sogenannte VTE-PREDICT-Score mithilfe eines Online-Rechners (https://vtepredict.com) kalkuliert und dem Patienten visualisiert werden; der tatsächliche Vorhersagewert für den Einzelfall ist jedoch bestenfalls nur moderat [20].
Ganz aktuell wurde nun eine randomisierte kontrollierte Studie (HI-PRO) publiziert, die den Nutzen einer verlängerten Antikoagulation in reduzierter Dosierung mit Plazebo verglich, nach abgeschlossener Erhaltungstherapie bei Patienten mit proximaler tiefer Venenthrombose/symptomatischer Lungenembolie infolge eines provozierenden Faktors (zum Beispiel Immobilisation, chirurgischer Eingriff) und zusätzlichen fortbestehenden internistischen Risikofaktoren (zum Beispiel Herz- oder Niereninsuffizienz, Adipositas). Im Apixabanarm wurde die Rate rez. VTE gegenüber Plazebo hochsignifikant reduziert, jedoch auf Kosten einer erhöhten Rate an klinisch relevanten Nicht-Majorblutungen (nur eine traumatische Majorblutung im Interventionsarm) [21].
Antikoagulation bei Malignompatienten: Besonderheiten beachten!
Aufgrund des häufig gleichermaßen erhöhten Rezidiv- wie auch Blutungsrisikos ist die Behandlung von Krebspatienten mit VTE, wie im vorliegenden Fall, besonders schwierig. Während noch Anfang des Jahrtausends eine Überlegenheit der Therapie mit niedermolekularem Heparin (NMH) gegenüber Vitamin-K-Antagonisten in der VTE-Behandlung bei Malignompatienten gezeigt werden konnte, wurde in den vergangenen Jahren eine den NMH vergleichbare Effektivität einer oralen Antikoagulation mit DOAK gezeigt. Insbesondere bei Patienten mit Tumoren der Schleimhäute (zum Beispiel Kolonkarzinom, Urothelkarzinom, etc.) ist jedoch unter DOAK die Rate an Schleimhautblutungen erhöht. Die S2k-Leitlinie gibt eine pragmatische Empfehlung zur Differenzialtherapie der krebsassoziierten VTE (Abbildung 6). Im Falle eines hohen Blutungsrisikos, eines luminalen Tumors, einer Mukosaläsion, sowie bei relevanten Medikamenteninteraktionen oder Problemen bei oraler Medikamenteneinnahme wird die NMH-Therapie präferiert [18].
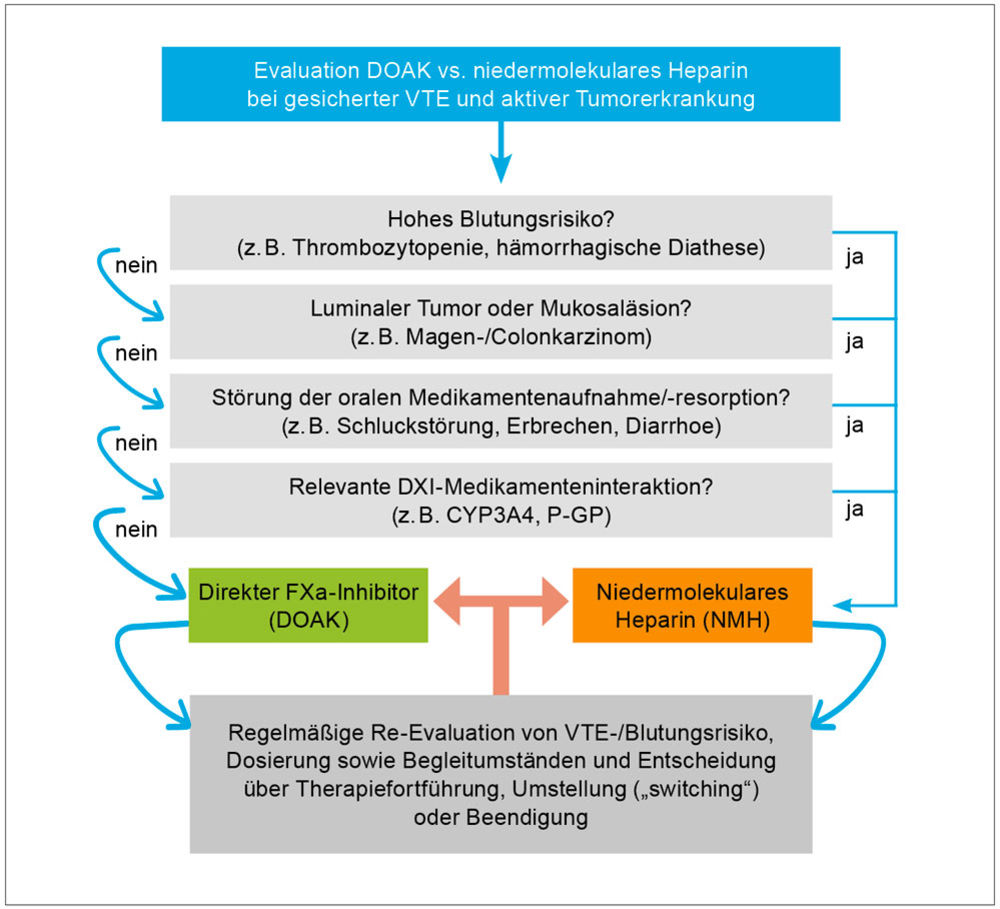 Abbildung 6: Therapieentscheidung DOAK vs. NMH bei Malignompatienten mit venöser Thromboembolie [aus 16].
Abbildung 6: Therapieentscheidung DOAK vs. NMH bei Malignompatienten mit venöser Thromboembolie [aus 16].
Patienten mit fortbestehender Malignomerkrankung sind langfristig (indefinitiv) zu antikoagulieren, wobei bislang auch in der verlängerten Behandlung die volle therapeutische Dosierung empfohlen wurde. Aktuell nun wurde eine randomisierte, kontrollierte Studie (API-CAT) publiziert, die bei Patienten mit krebsassoziierter Venenthrombose/Lungenembolie eine Dosisreduktion von Apixaban nach sechs Monaten Behandlung mit der Erhaltungstherapie in Standarddosis verglich [22]. Bei Nichtunterlegenheit hinsichtlich der Rezidivrate (2,1 vs. 2,8 Prozent), war die Rate klinisch relevanter Blutungen im Arm mit reduzierter Dosierung signifikant niedriger (12,1 vs. 15,6 Prozent). Im vorgestellten Fall behandelten wir, nach Ausschluss zellulärer (Thrombozytopenie) oder plasmatischer Gerinnungsstörung, mit Apixaban, zunächst in hoher Initialdosierung (5 mg 2-0-2) für sieben Tage, dann in Standarddosierung (5 mg 1-0-1). Nach sechs Monaten Behandlung kann die Dosisreduktion auf 2,5 mg 1-0-1 erwogen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autorin und Autoren:

Univ.-Professor Dr. Michael Czihal
Sektion Angiologie, Med. Klinik und Poliklinik IV, LMU Klinikum, München
Korrespondenz:
Univ.-Prof. Dr. Michael Czihal, Sektion Angiologie, Med. Klinik und Poliklinik IV, LMU Klinikum, Ziemssenstraße 5, 80336 München, E-Mail: michael.czihal@med.uni-muenchen.de
Teilen:
Das könnte Sie auch interessieren:










