Neu in der Anästhesie und Notfallmedizin
 Anästhesie und Notfallmedizin
Anästhesie und Notfallmedizin
Die Anästhesiologie hat sich während der vergangenen 20 Jahre durch die Entwicklung neuer diagnostischer und therapeutischer Möglichkeiten grundlegend weiterentwickelt. Auch in den kommenden Jahren ist viel Neues zu erwarten, was klinische Abläufe weiter ökonomisieren und die Patientensicherheit weiter erhöhen wird. Der folgende Artikel stellt anhand fünf praxisrelevanter Kasuistiken aktuelle Entwicklungen rund um die Integration sonografiegestützter Techniken in Anästhesie und Notfallmedizin vor und beschreibt die mögliche künftige Rolle der künstlichen Intelligenz (KI) für unser Fachgebiet.
Ultraschallgestützte periphere Regionalanästhesie-Verfahren
Die ultraschallgestützte periphere Regionalanästhesie hat die traditionelle landmarken- und nervenstimulationsbasierte Herangehensweise mittlerweile nahezu ersetzt [1]. Durch die direkte sonografische Visualisierung der anatomischen Zielstrukturen können Anästhesiologinnen und Anästhesiologen Lokalanästhetika exakt im Gewebe platzieren, was zu einer erhöhten Erfolgsrate bei reduzierter Gesamtdosis führt [2]. Der früher häufig erforderliche Verfahrenswechsel von der Regional- auf eine Allgemeinanästhesie ist dadurch seltener geworden. Dies ist zum Beispiel bei älteren und multimorbiden Patientinnen und Patienten von Bedeutung, da die Vermeidung einer Vollnarkose, und damit auch von Opioiden, das Risiko von postoperativem Delir und kognitiver Dysfunktion reduziert [3]. Auch Kooperativität und Aufklärungsfähigkeit bleibt peri- und postinterventionell erhalten, eine Einwilligung in eventuelle Folgeeingriffe bleibt somit möglich. Weitere Vorteile sind der schnellere Wirkeintritt, eine größere Patientenzufriedenheit und ein reduzierter Bedarf an systemisch wirksamen Analgetika im Vergleich zu Verfahren ohne Verwendung der Sonografie [1, 4]. Boezaart und Mitarbeiter konnten zudem zeigen, dass die sonografische Steuerung der Regionalanästhesie aufgrund der verbesserten „Zielgenauigkeit“ die Rate an neurologischen Komplikationen reduziert [5]. Ultraschallverfahren erlauben eine bessere Nadelkontrolle und steigern so nicht nur die Erfolgsrate, sondern verringern auch die Wahrscheinlichkeit für schwerwiegende Nebenwirkungen, vor allem auch im Notfall [6].
Der Einsatz ultraschallgestützter Regionalanästhesieverfahren erhöht die Patientensicherheit maßgeblich [6, 7, 2].
Ultraschallgestützte Blockade des Truncus superior des Plexus brachialis
Kasuistik
Ein multimorbider 69-jähriger nicht nüchterner Patient stellt sich in der Notaufnahme mit einer anterioren Luxation der rechten Schulter nach Sturz vor. Die Indikation zur sofortigen Reposition wird gestellt. Um eine suffiziente periprozedurale Schmerzausschaltung zu gewährleisten und zugleich die Risiken der Allgemeinanästhesie zu vermeiden, wird durch den hinzugerufenen diensthabenden Anästhesiologen eine ultraschallgestützte Blockade des Truncus superior des Plexus brachialis vorgenommen.
Hintergrund
Der Truncus superior des Plexus brachialis wird durch die Vereinigung der Nervenwurzeln C5 und C6 gebildet, alle die Schulterregion innervierenden Endäste entspringen distal davon. Ein wesentlicher Vorteil gegenüber der interskalenären Blockade des Plexus brachialis liegt in der deutlich reduzierten Inzidenz von Zwerchfellparesen, da erst auf Höhe des Truncus in der Regel eine ausreichende Distanz zum Nervus phrenicus besteht [8].
So beobachteten Kim und Mitarbeiter in nur 4 bis 7 Prozent der Truncus-superior-Blockaden eine Phrenikusparese, verglichen mit in bis zu 70 Prozent nach interskalenärer Blockade [9, 10]. Gerade bei geriatrischen Patienten mit relativ großem Delirrisiko, einer insgesamt erhöhten Morbidität und „Frailty“ (Gebrechlichkeit) stellt der Truncus-superior-Block eine gute Alternative zur Allgemeinanästhesie dar.
Die präzise Darstellung und Lokalanästhetika-sparende, gezielte Blockade des Truncus superior ist nur unter Verwendung des Ultraschalls möglich (Abbildungen 1 und 2) [11].
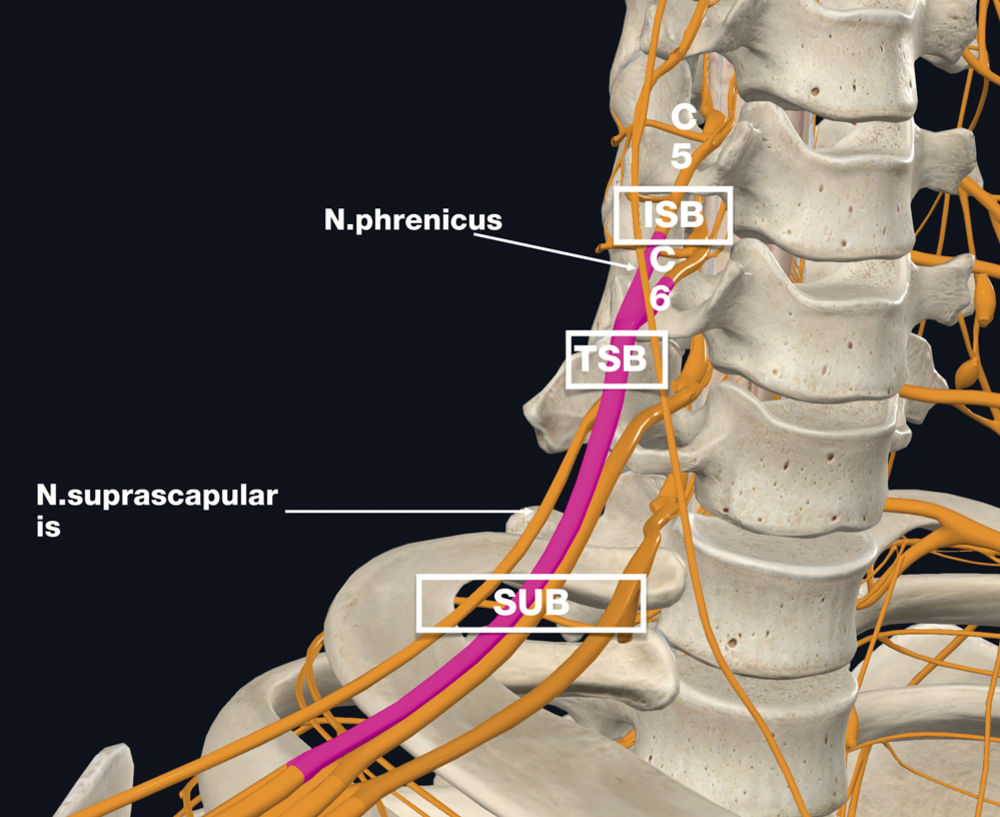
Abbildung 1: C5 = Ramus anterior C5, C6 = Ramus anterior C6, TSB = Truncus- superior-Blockade, ISB = Interskalenärer
Block, SUB = Supraclavikulärer Block.
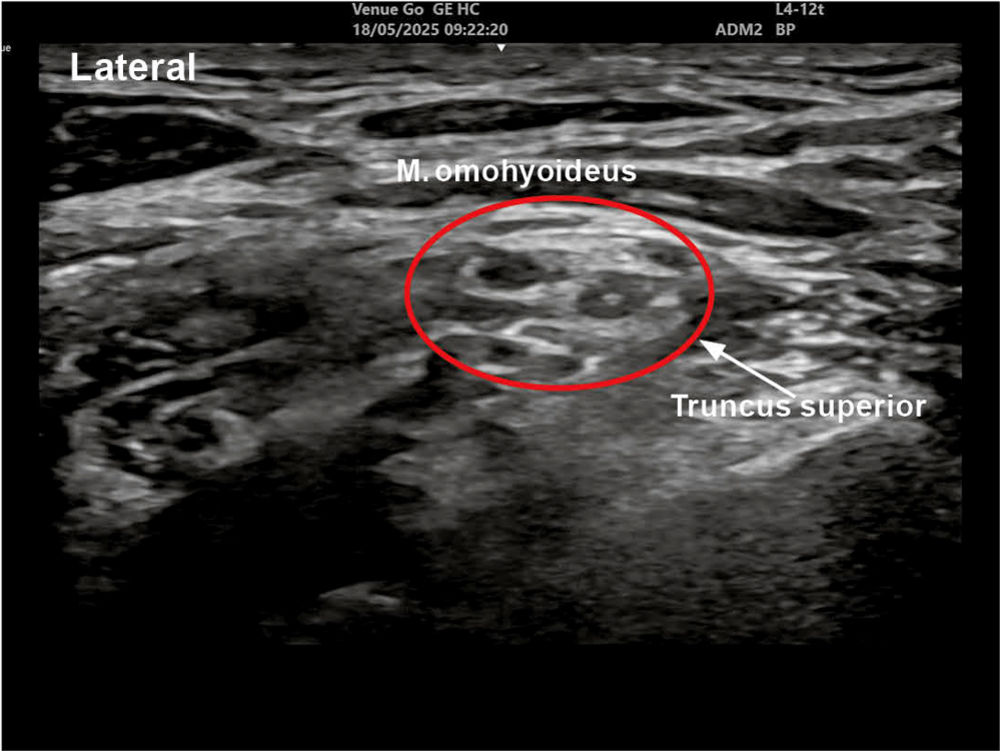
Abbildung 2: Sonoanatomie Truncus superior links
Technik
Unter aseptischen Bedingungen erfolgt in Rückenlage mit leicht erhöhtem Oberkörper bei Kopfwendung zur Gegenseite in der oberen interskalenären Region, etwa auf Höhe des Krikoids, mit einem hochfrequenten linearen Schallkopf (10 bis 15 MHz) die sonografische Darstellung. Die Rami anteriores der Spinalnervenwurzeln C5 und C6 werden innerhalb der interskalenären Lücke identifiziert. Anstatt sie jedoch auf dieser Höhe zu blockieren, verfolgt man ihren Verlauf nach distal bis zu dem Punkt, an dem sie sich zum Truncus superior vereinigen. Die 50 mm lange 22G-Blockade-Nadel (Abbildung 3) wird idealerweise in „in-plane“-Technik, also unter kontinuierlich direkter Sichtführung, von lateral nach medial unter der tiefen zervikalen Faszie und oberhalb des Musculus scalenus medius vorgeschoben, bis die Spitze direkt an der lateralen Begrenzung des Truncus superior liegt. Alternativ kann grundsätzlich auch ein Out-of-Plane-Zugang („Out-of-Plane“ bedeutet, dass die Nadel oder Struktur quer zur Bildebene verläuft – also nicht vollständig im Ultraschallbild sichtbar ist) verwendet werden. Die Injektion von Lokalanästhetikum führt bei korrekter Nadelposition zu einer gut sichtbaren „Hydrodissektion“, das Gewebe um die neuronale Zielstruktur wird also durch das Lokalanästhetikum unter sonografischer Sicht „aufgespritzt“ und so die extravasale Lage bestätigt.

Abbildung 3: NRFIT 50 mm 22G-Punktionsnadel
Für den Erfolg der Blockade ist entscheidend, den Truncus superior proximal der Abzweigung des für die Innervation der Schulter wichtigen Nervus suprascapularis zu blockieren. Dieser Nerv ist sonografisch als kleiner hypoechogener Kreis erkennbar, der sich von der lateralen Seite des Truncus superior abzweigt und unter dem Musculus omohyoideus lateral vom Plexus brachialis wegzieht (Abbildung 1). Diese frühe Abzweigung nach dem Truncus erklärt, warum weiter distale Techniken wie zum Beispiel die supraklavikuläre Plexusblockade den Nervus suprascapularis oft verfehlen und durch eine unzureichende Anästhesie der dorsalen Schulterregion klinisch zu „Versagern“ führen [8].
Die empfohlene Initialdosis für die Truncus-superior-Blockade beträgt 10 bis 15 ml Ropivacain 0,5 Prozent, abhängig von Patientenkörpermasse und OP-Dauer [9, 10, 11]. In aller Regel tritt innerhalb von 5 bis 10 Minuten eine suffiziente sensorische Blockade im Bereich der Schulter auf, welche oft bereits eine Reposition oder sogar kleine Operation ohne zusätzliche Analgosedierung erlaubt [8, 10].
Fazit
Der Ultraschall hat Sicherheit, Präzision, Effektivität und Effizienz peripherer regionalanästhesiologischer Verfahren erheblich verbessert. Insbesondere im Hinblick auf Erfolgsrate und Vermeidung intraneuraler und intravasaler Injektionen, die mit schwerwiegenden Nebenwirkungen und Schädigungen assoziiert sind, bietet die Echtzeitkontrolle der Nadel via Sonografie einen entscheidenden Vorteil gegenüber der traditionellen „Landmarkentechnik“, die zumindest innerklinisch heute als nahezu obsolet betrachtet werden muss.
Ultraschall zur Unterstützung rückenmarksnaher Regionalanästhesieverfahren
Die Verwendung des Ultraschalls im Rahmen rückenmarksnaher Regionalanästhesieverfahren erscheint derzeit vielen Kolleginnen und Kollegen noch ungewöhnlich, manchen vielleicht sogar übertrieben. Tatsächlich dürfte rückenmarksnah die Häufigkeit anatomischer Variationen, die sich auf den Erfolg regionalanästhesiologischer Verfahren auswirken können, geringer sein als im Bereich peripherer Nervenstrukturen. Trotzdem entspricht die Anwendung der neuroaxialen Sonografie nur der konsequenten Fortführung der für die periphere Regionalanästhesie bereits weitgehend akzeptierten Gedanken rund um die Erhöhung der Patientensicherheit: unsere Vermutungen zur Anatomie durch Wissen bezüglich des individuellen Patienten zu ersetzen.
Kasuistik 1
Ein 78-jähriger Patient mit Adipositas permagna (BMI 42) und Coxarthrose wird zur Hüft-Totalendoprothese in Spinalanästhesie geplant. Nach mehreren Fehlpunktionen im Rahmen der klassischen „blinden“ Landmarkentechnik durch die erfahrene Kollegin erfolgt durch einen kurzen Planungs-Ultraschallscan die exakte Charakterisierung des Zwischenwirbelraumes L3/L4 (Lokalisation, Größe und Winkel der Dornfortsätze), eine weitere Punktion gelingt im ersten Versuch (Abbildungen 4 und 5).
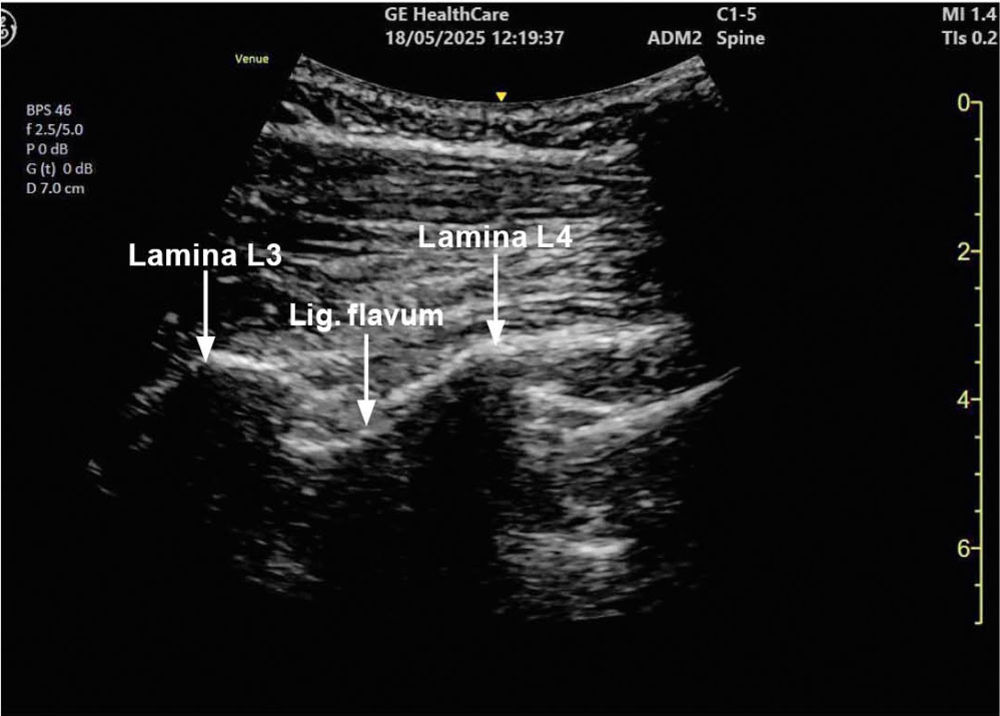
Abbildung 4: Sagittalschnitt mit Konvexschallkopf in Höhe L3/L4
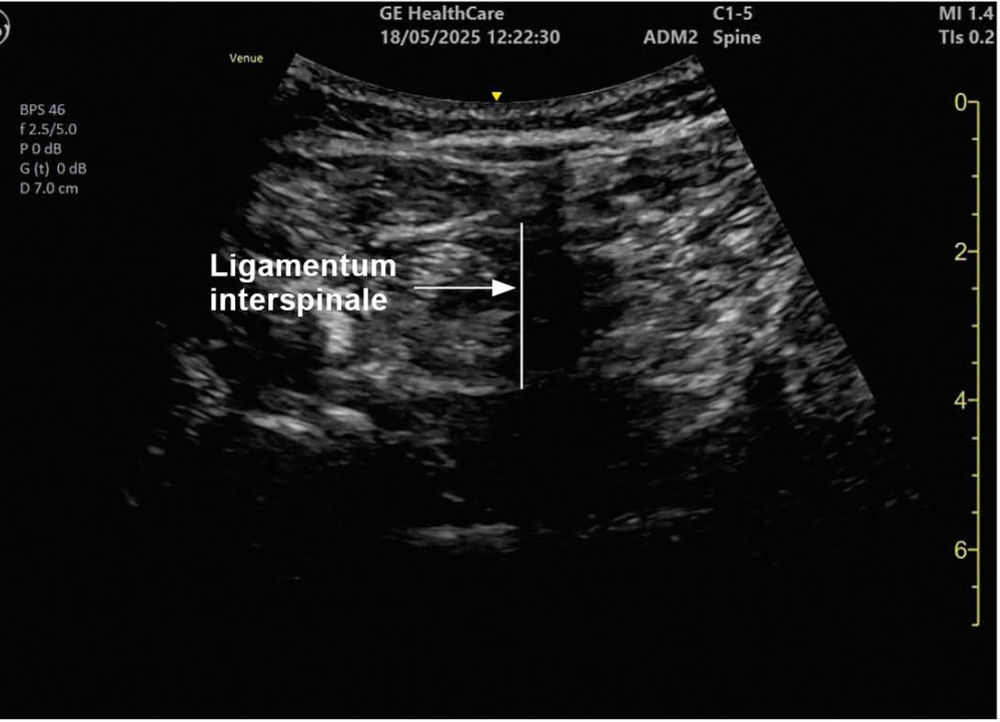
Abbildung 5: Transversalschnitt auf Höhe L3/L4
Kasuistik 2
Ein 65-jähriger Patient mit ausgeprägter degenerativer Skoliose wird zur Leberteilresektion vorgestellt. Die präinterventionelle Ultraschall-gestützte Abschätzung der idealen Punktionslinie, des erforderlichen Einstichwinkels und der zu erwartenden Tiefe des Periduralraumes ermöglicht eine komplikationsfreie Periduralkatheteranlage im ersten Versuch.
Hintergrund
Während die extradural verbleibende Periduralanästhesie im Prinzip auf jeder Höhe der thorakolumbalen Wirbelsäule durchgeführt werden kann, erfolgt die spinale Punktion des lumbalen Liquorraumes unterhalb des kaudalen Endes des Rückenmarks und damit beim Erwachsenen unterhalb des zweiten Lendenwirbels (L2). Die Periduralanästhesie leistet zum Beispiel im Bereich der Geburtshilfe, aber auch, oft in Kombination mit der Allgemeinanästhesie, peri- und postoperativ wertvolle Dienste. Die Spinalanästhesie ist vor allem als Mono-Alternativverfahren zur Allgemeinanästhesie bei geeigneten, auch abdominellen Eingriffen, von großer Bedeutung.
Die Verwendung sonografischer Techniken erlaubt im Lumbalbereich die exakte Darstellung von Dornfortsätzen, Ligamentstrukturen und Epiduralraum. Dies ist insbesondere bei Patienten mit schwierigen anatomischen Verhältnissen relevant. Ein Review durch Perlas und Mitarbeiter ergab, dass die vorherige anatomische Orientierung mit Ultraschall die „First-Pass-Erfolgsrate“ rückenmarksnaher Verfahren deutlich erhöht und gleichzeitig die Inzidenz von Gefäß- und Nervenschädigungen reduziert [12]. Im Rahmen der Spinalanästhesie verbesserte die Verwendung des Ultraschalls Sicherheit und Effektivität der Punktion.
Technik
Der Ultraschall dient im Rahmen rückenmarksnaher Verfahren vor allem der präprozeduralen Planung der Punktion. Nach einer Kombination aus longitudinalen und transversalen Scans zur Identifizierung des „besten“ Zwischenwirbelraumes sowie zur Abschätzung des erforderlichen Punktionswinkels und der plausiblen Zieltiefe [13] erfolgt die Punktion in konventioneller Technik. Bei Unsicherheit kann der Ultraschall zudem zur Bestätigung der korrekten Nadellage, zum Beispiel vor einer Periduralkathetereinlage, eingesetzt werden [14].
Fazit
Im Rahmen neuroaxialer Blockaden kann der Ultraschall, vor allem bei konstitutionellen Besonderheiten, vorab dabei helfen, die Erwartungen aus der Lehrbuchanatomie mit den Gegebenheiten des individuellen Patienten abzugleichen. Insbesondere bei dieser Anwendung dürfte aber auch die Vorerfahrung des Anästhesiologen mit der konventionellen Durchführung rückenmarksnaher Verfahren eine erfolgsentscheidende Rolle spielen.
Nüchternheits-Grenzen – noch zeitgemäß?
Die traditionell präoperative „über-Nacht“-Nüchternheit ab 22:00 Uhr vor operativen Eingriffen gehört mittlerweile der Vergangenheit an [15]. Aber auch unsere heutigen, deutlich liberaleren Vorgaben (zum Beispiel 6 Stunden für feste Nahrung, 1 bis 2 Stunden für klare Flüssigkeiten) sind noch weit von einer „individualisierten Medizin“ entfernt. Auch hier könnte der Ultraschall, zumindest perspektivisch, gute Dienste leisten.
Präoperative Nüchternheit – was soll erreicht werden?
Die präoperative Nüchternheit soll grundsätzlich die Inzidenz der pulmonalen Aspiration von Mageninhalt vermeiden. Pulmonale Aspiration geschieht dann, wenn sich im Magen potenzielles Aspirat befindet und wenn dieses regurgitiert wird [16]. Während die Frage, ob grundsätzlich vorhandenes potenzielles Aspirat im Rahmen anästhesiologischer Maßnahmen regurgitiert werden wird oder nicht, nur schwer zu beantworten ist und von vielen Faktoren abhängt, ist man sich sicher, dass bei leerem Magen hingegen keine Aspirationsgefahr bestehen dürfte. Um „auf Nummer sicher“ zu gehen ließ man daher Patienten traditionell lieber „etwas länger“ nüchtern, denn man konnte ja nicht in die Patienten „hineinsehen“. Mittlerweile weiß man, dass lange Nüchternzeiten ihr eigenes „outcomebezogenes“ Risiko bergen, wie Durst, Delir, postoperative Übelkeit, Unwohlsein, postoperative Kreislaufinsuffizienz, Insulinresistenz sowie Verlangsamung der Heilungsprozesse [17]. Und: mittlerweile kann man dank Ultraschall in die Patienten „hineinsehen“.
Exkurs: Das postoperative Delir – Nüchternheit als bedeutender Risikofaktor
Das postoperative Delir ist eine schwere und potenziell tödliche OP- und Narkose-Komplikation vor allem des älteren Menschen, bei der neuroinflammatorische Prozesse eine zentrale Rolle spielen [18]. Die Ursachen sind vielfältig. So führen periphere Entzündungsreaktionen, ausgelöst zum Beispiel durch chirurgischen Stress, zur Freisetzung proinflammatorischer Zytokine, wie Interleukin-1β, Interleukin-6 und TNF-α. Diese Zytokine können die Blut-Hirn-Schranke überwinden und eine neuroinflammatorische Kaskade im zentralen Nervensystem in Gang setzen, was zu kognitiven Beeinträchtigungen und letztlich zum Delir führen kann [19]. Verletzung und Trauma führen zudem zur Aktivierung der Hypothalamus-Hypophysen-Nebennierenrinden-Achse, mit konsekutiver Ausschüttung von Glukokortikoiden wie Kortisol. Ein anhaltend erhöhter Kortisolspiegel im Serum wirkt neurotoxisch und erhöht die Wahrscheinlichkeit der Entstehung eines Delirs [20]. Auch perioperativ noch immer häufige metabolische Noxen wie Hypoglykämie und Dehydratation gelten als Risikofaktoren. Hypoglykämie beeinträchtigt die Synthese und Freisetzung von Acetylcholin, einem essenziellen Neurotransmitter im Rahmen von Kognition und Vigilanz. Eine verminderte synaptische Verfügbarkeit von Acetylcholin gilt als wichtiger pathophysiologischer Mechanismus beim Delir [21, 22]. Dehydratation kann Elektrolytstörungen verursachen, die die neuronale Erregbarkeit und die synaptische Übertragung beeinflussen – besonders bei älteren Menschen, die oft zudem ein vermindertes Durstempfinden haben.
Perioperativer Flüssigkeits- und Substratmangel sind nicht nur unangenehm für Patienten, sondern auch gut bekannte und im Zeitalter der Sonografie oft vermeidbare Auslöser des postoperativen Delirs [23, 24, 25]. Die ESAIC Guideline Task Force empfiehlt in der kurz vor Veröffentlichung stehenden Leitlinie „Perioperative Fasting in Adults“ das Trinken von klaren Flüssigkeiten bis 2 Stunden vor dem Eingriff. Die Aufnahme von festen Nahrungsmitteln ist weiterhin bis 6 Stunden vor dem Eingriff für Erwachsene möglich. Allerdings liegt der Fokus hier ganz klar auf der dringenden Empfehlung bis 2 Stunden vor dem Eingriff klare Flüssigkeiten zu trinken.
Gastraler Ultraschall als Ergänzung der heutigen Nüchternzeiten?
Der gastrale Ultraschall bietet die Möglichkeit, die tatsächliche Magenfüllung visuell zu beurteilen.
Kasuistik
Der Rettungsdienst bringt einen 85-jährigen Patienten mit offener Unterschenkelfraktur nach Sturz, zwei Stunden nach einem kleinen Mittagessen, in die Notaufnahme. Der Patient soll zeitnah operiert werden. Aufgrund eines chronischen Vorhofflimmerns steht er unter DOAK-Dauertherapie, der hinzugerufene Anästhesiologe entscheidet sich daher gegen ein Regionalverfahren. Im Anästhesie-Einleitungsraum erfolgt ein präoperativer gastraler Ultraschall (Abbildung 6 und 7) zur individuellen Einschätzung des Aspirationsrisikos. Dabei ist kein gastrales Restvolumen nachweisbar. Auf Grundlage dieses Befundes entschließen wir uns trotz des erst drei Stunden zurückliegenden Mittagessens zur schonenden, konventionellen Einleitung einer Allgemeinanästhesie mit Zwischenbeatmung. Postoperativ zeigt sich der Patient stabil und delirfrei und kann nach zwei Stunden mit Fixateur externe auf Normalstation verlegt werden.
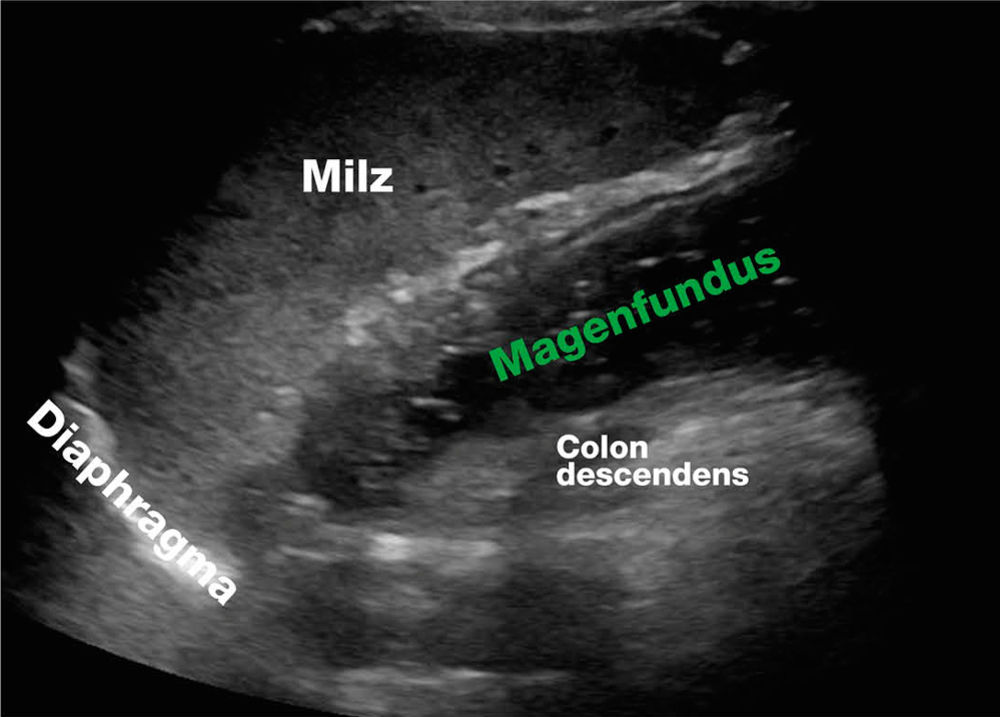
Abbildung 6 und 7: Translienaler Fundus-View in Rückenlage, links: original; rechts: beschriftet.
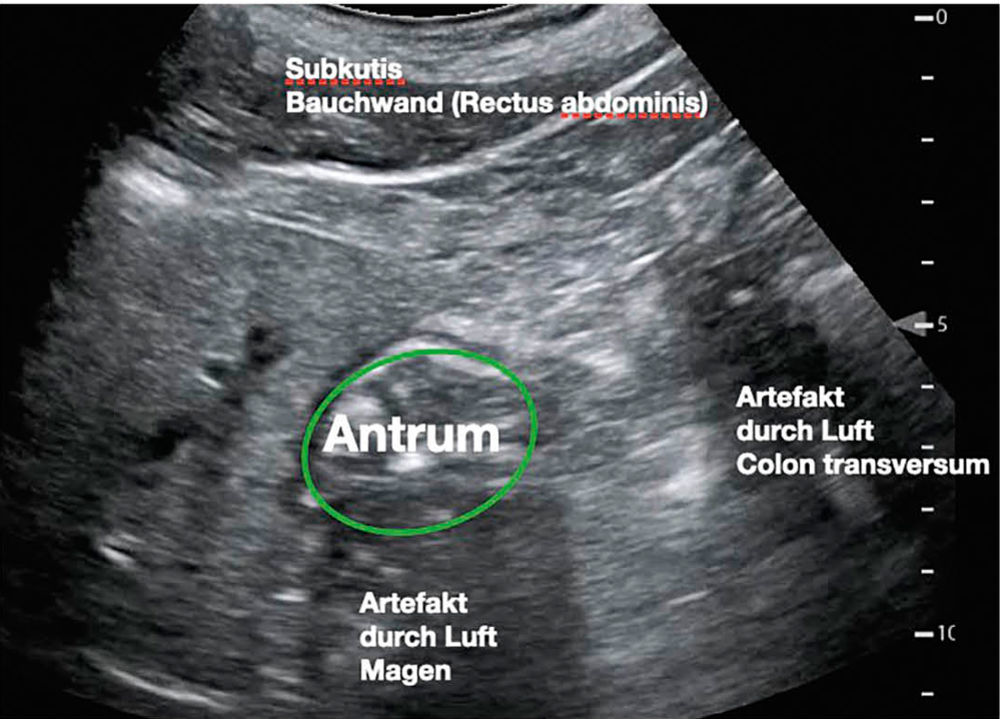
Abbildung 8 und 9: Antrum-View in Rechtsseitenlage/Rückenlagerung; links: original; rechts: beschriftet
Hintergrund
Der präoperative gastrale Ultraschall hat sich in den vergangenen Jahren als valides diagnostisches Verfahren etabliert. Vorgeschlagen wurde zum Beispiel folgende Einteilung des Ultraschall-Befundes nach Perlas [26]:
Grade 0: kein sichtbarer Mageninhalt niedriges Aspirationsrisiko
Grade 1: kleine Flüssigkeitsmenge (< 100 ml) moderates Aspirationsrisiko
Grade 2: große Flüssigkeitsmenge oder feste Nahrung hohes Aspirationsrisiko (siehe Abbildung 10)
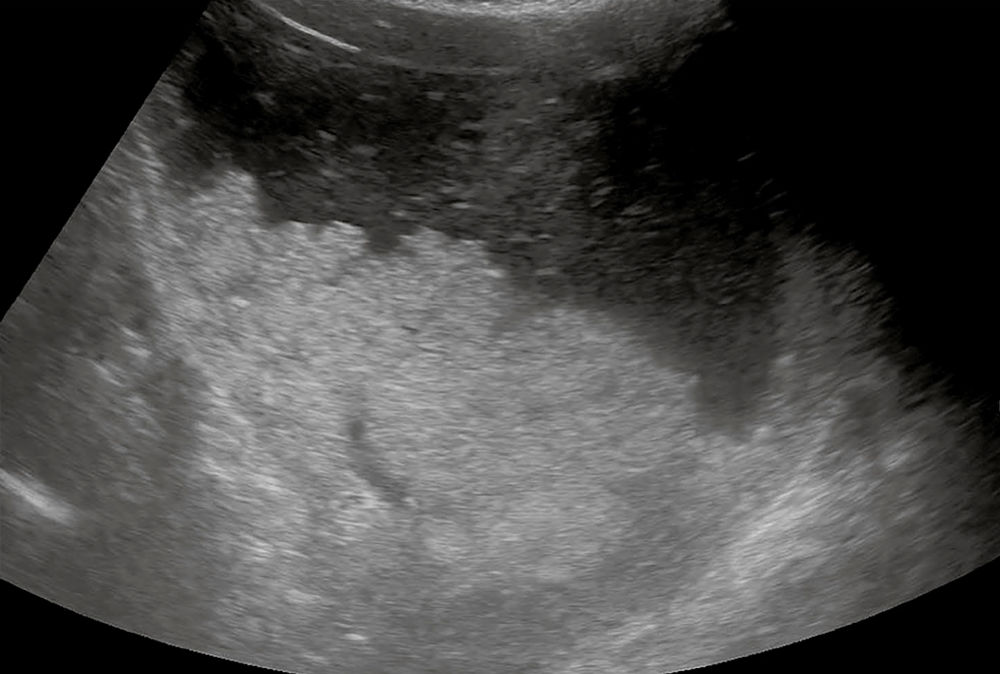
Abbildung 10: Voller Magen mit Fest und Flüssigbestandteilen.
Bereits heute scheint die Ergänzung der perioperativen Standards um den gastralen Ultraschall, gerechtfertigt, da nur er in der Lage ist, valide Informationen zum individuellen Aspirationsrisiko zu liefern. Insbesondere bei Patienten, denen heute noch generell ein erhöhtes Aspirationsrisiko unterstellt wird, zum Beispiel Nicht-Nüchterne gemäß der etablierten Nüchternzeiten, Schwangere oder „Notfallpatienten“, kann das Ergebnis der präoperativen gastralen Ultraschalluntersuchung damit relevante Konsequenzen für das anästhesiologische Vorgehen haben und damit zur individuellen Patientensicherheit beitragen [27, 28].
Unser hier skizziertes Vorgehen (Grafik) entspricht der aktuellen Literatur, die eine individualisierte präoperative Risikostratifizierung zur Verbesserung des perioperativen Managements insbesondere älterer und/oder multimorbider Patienten, auch unter Verwendung des gastralen Ultraschalls, nahelegt [29]. Es ist derzeit unklar, ob der gastrale Ultraschall bereits Eingang in die derzeit in Aktualisierung befindliche Leitlinie „Guideline on Perioperative Fasting in Adults“ finden wird [30].
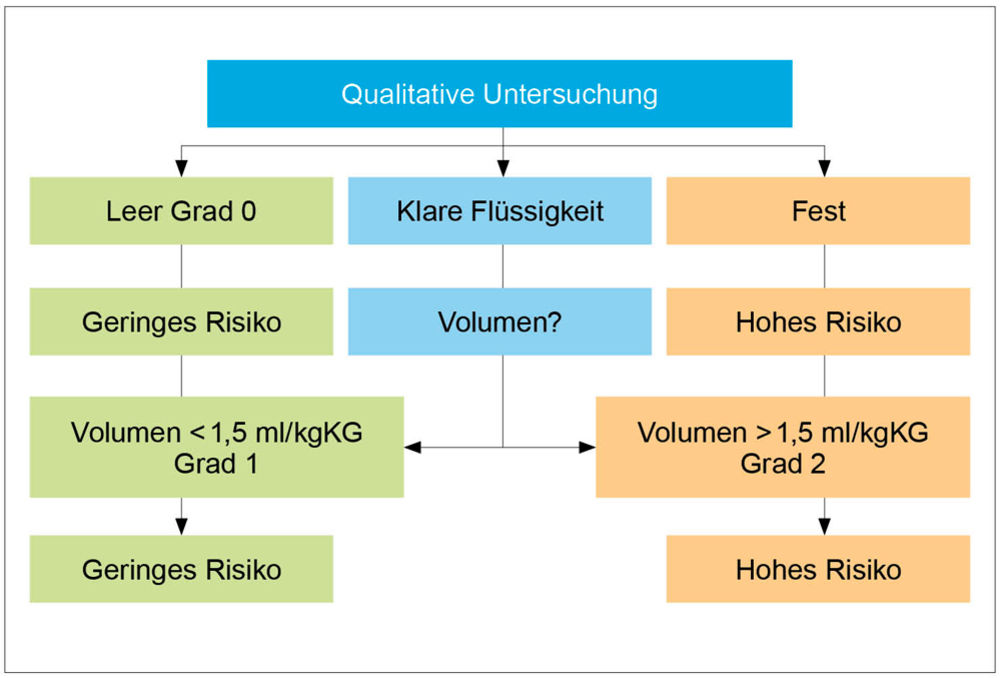
Grafik: Flowchart für die Risikoanalyse des gastralen Ultraschalls, modifiziert gemäß Perlas et al. 2017
Handheld-Ultraschallgeräte in Anästhesie und Notfallmedizin
Durch die Entwicklung und immer weitere Verbreitung der sogenannten „Handheld-Ultraschallgeräte“ wurde es in den vergangenen Jahren zunehmend möglich und sinnvoll, die Sonografie auch in die präklinische Notfallmedizin hinein zu denken. Im Gegensatz zu den herkömmlichen klinischen Geräten sind diese kleinen Helfer hochmobil, kabellos, klein und leicht und damit extrem praktisch und mittlerweile auch zunehmend erschwinglich. Handheld-Geräte erlauben in vielen Fällen eine ausreichend zuverlässige erste Orientierung im Notfall direkt am Patientenbett, auch außerhalb klassischer OP- oder Intensivumgebungen [31].
Handheld-Geräte und deren Anwender sind keinesfalls Konkurrenten der hochgradig leistungsfähigen Geräte der Fachdisziplinen und deren Anwenderinnen und Anwender, sondern erschließen dem Ultraschall ein komplett neues Anwendungsfeld.
Schnell und sicher – Gefäßzugänge
Die Anlage zentraler oder peripherer Gefäßzugänge stellt insbesondere bei adipösen oder hypovolämen Patienten eine Herausforderung dar. Der Einsatz von Handheld-Ultraschallgeräten ermöglicht eine präzise Gefäßpunktion und reduziert signifikant Fehlversuchs- und Komplikationsrate, zum Beispiel arterielle Punktionen und/oder Hämatome [32].
Regionalanästhesie
Regionalanästhesieverfahren sind besonders in der perioperativen Medizin gut etabliert, wobei wie beschrieben insbesondere ultraschallgestützte periphere Verfahren aufgrund ihrer hohen Sicherheit und Effektivität zunehmend Verwendung finden [33]. In Deutschland stellen Regionalanästhesieverfahren in der Notfallmedizin bislang keinen Leitlinienstandard dar, könnten jedoch bald in die S2k-Leitlinie zur Katastrophenmedizin aufgenommen werden, da bereits auf europäischer Ebene entsprechende Verfahren in Leitlinien enthalten sind [34] und in bestimmten Situationen routinemäßig eingesetzt werden. Beispielsweise kommt der Fascia-iliaca-Block (Abbildungen 11 und 12) bei hüftgelenksnahen Frakturen in 60 Prozent der Einrichtungen des National Health Service (NHS) zum Einsatz. Gleiches gilt für die USA, wo 2022 sowohl Verfahrensrichtlinien zu standardisierten Abläufen [35] als auch evidenzbasierte Empfehlungen zur Anwendung regionalanästhesiologischer Techniken in der pädiatrischen Notfallmedizin veröffentlicht wurden [36]. Fichtner und Kollegen haben in einer Review-Arbeit herausgestellt, dass Regionalverfahren den gesamten Behandlungsprozess deutlich effizienter gestalten, wenn sie bereits in der präklinischen Phase angewendet werden [37]. Erst die flächendeckende Verfügbarkeit von tragbaren Handheld-Ultraschallgeräten im Rettungs-/Notarztdienst macht die Regionalanästhesie der präklinischen Notfallmedizin mit der erforderlichen Sicherheit zugänglich [38].
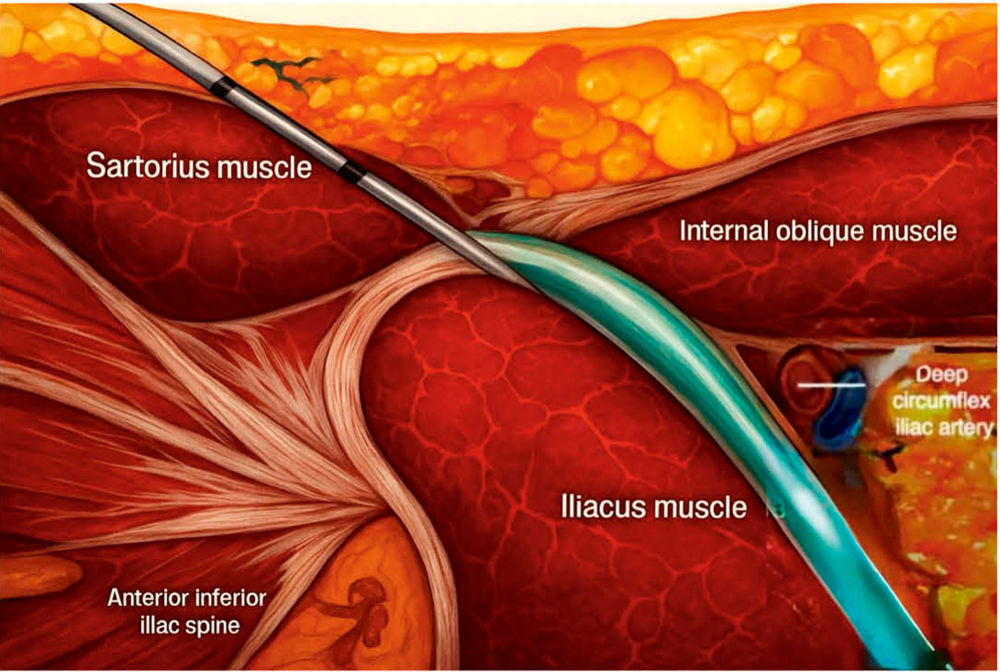
Abbildung 11: Illustration Fascia iliaca Blockade – generiert mit Hilfe von KI.
Abbildung 12: Sonoanatomie Fascia-iliaca-Blockade
Notarzteinsatz und Schockmanagement
In der präklinischen Notfallmedizin und im Schockraum werden mobile Ultraschallgeräte mehr und mehr zum festen Bestandteil der primären Diagnostik hämodynamisch instabiler Patienten. Verfahren wie FAST (Focused Assessment with Sonography for Trauma) oder TTE (Transthorakale Echokardiografie) ökonomisieren Entscheidungsprozesse und ermöglichen so schneller potenziell lebensrettende Therapien.
Perioperative und postanästhesiologische Diagnostik
Handheld-Ultraschallgeräte erlauben die schnelle perioperative Point-of-Care-Diagnose von zum Beispiel Pneumothorax, Pleuraerguss oder Atelektase.
Kasuistik
Ein 20-jähriger, primär gesunder Radfahrer ohne Vormedikation wird von einem Auto angefahren. „Primary Survey“ (Primary Survey dient der Identifikation lebensbedrohlicher Verletzungen bei Traumapatientinnen/-patienten mit dem Ziel, diese zu therapieren) und Trauma-Scan im Schockraum ergeben bei dem bewusstseinsklaren, notärztlich analgosedierten Patienten eine isolierte offene Oberschenkelfraktur. Er ist bewusstseinsklar, die Indikation zur sofortigen operativen Versorgung wird gestellt. Intraoperativ fällt die arterielle Sauerstoffsättigung ab, die Beatmungsdrucke steigen, die Patient wird tachykard und der arterielle Blutdruck fällt ab. Der narkoseführende Anästhesiologe setzt ein Handheld-Sonografiegerät ein und bestätigt via Pleurasonografie seine auskultatorische Verdachtsdiagnose eines rechtsseitigen Pneumothorax, den er umgehend durch die Anlage einer Bülaudrainage entlastet. Die Operation kann ohne Unterbrechung fortgeführt werden.
Fazit
Handheld-Ultraschallgeräte werden immer leistungsfähiger, durch immer praktischere Unterstützungsfunktionen, die ihre Verwendung auch den weniger Geübten ermöglicht. Nichtsdestotrotz erfordert die Anwendung des Point-of-Care-Ultraschalls regelmäßige Schulungen mittels zertifizierter Kurse und häufige Anwendung des Gelernten im täglichen Patientenkontakt. Bereits heute gibt es Geräte mit automatisierten Volumenmessungen, cloudgestützter Dokumentation und sogar unterstützender KI-basierter Bildanalysemöglichkeit. Die Sonografie wird schon bald auch aus der präklinischen Notfallmedizin nicht mehr wegzudenken sein.
KI in der Anästhesiologie
KI hat das Potenzial, den perioperativen Prozess zu revolutionieren. Insbesondere im Rahmen der präoperativen Risikostratifizierung könnten KI-gestützte prädiktive Modelle die Erstellung individualisierter Risikoprofile ermöglichen. So konnten klinische Studien bereits zeigen, dass sogenannte Deep Learning-Algorithmen, die mittels großer Datenbanken trainiert werden, „outcomerelevante“ perioperative Ereignisse wie zum Beispiel Hypotension oder Hypoxie vorhersagbar und damit potenziell vermeidbar machen [36, 37]. Auch KI-basierte klinische Entscheidungsunterstützungssysteme (CDS) bieten großes Potenzial, ärztliches Handeln zu strukturieren und zu standardisieren und die Versorgungsqualität insgesamt weiter zu verbessern. Eine Vorreiterrolle hat hier das deutsche Forschungsprojekt KIPeriOP (KIPeriOP ist ein vom Bundesministerium für Gesundheit gefördertes Forschungsvorhaben mit dem Ziel, das perioperative Risikomanagement zu verbessern sowie perioperative Sterblichkeit und dauerhafte Schädigungen zu reduzieren) unter der wissenschaftlichen Leitung von Patrick Meybom. Durch Integration eines Clinical-Decision-Support-System (CDS-System) in den Prozess der präoperativen anästhesiologischen Risikostratifizierung die Leitlinien-Adhärenz zu erhöhen versucht, aber auch KI-basierte prädiktive Modelle entwickelt, um das Management perioperativer Komplikationen zu verbessern.
Fazit
KI-basierte Modelle zur Risikostratifizierung könnten künftig eine wertvolle Ergänzung zur klinischen Entscheidungsfindung darstellen [39, 40]. Die frühzeitige Identifikation vulnerabler Patientengruppen und der gezielte Einsatz präventiver Maßnahmen könnte so zu einer weiteren Reduktion nicht nur der perioperativen Morbidität und Mortalität, sondern durch eine optimierte Ressourcenallokation auch der Kosten beitragen. Dieser Aspekt gewinnt vor dem Hintergrund der zunehmenden Ressourcenknappheit eine immer größere Bedeutung [41].
Schlusswort
Natürlich ist der Ultraschall nicht neu im eigentlichen Sinn. Eine Errungenschaft der vergangenen 20 Jahre aber ist die großflächige Etablierung in der klinischen Anästhesiologie und zunehmend auch in der präklinischen Notfallmedizin. Ultraschall ist heute keine Angelegenheit für Spezialisten mehr, er ist das „Stethoskop des 21. Jahrhunderts“ und unsere Patienten können heute von jeder Akutmedizinerin/jedem Akutmediziner erwarten, dass sie oder er die grundlegenden sonografischen Schnitte zur Ersteinschätzung und Unterstützung wichtiger therapeutischer Erstmaßnahmen beherrscht. Wir dürfen darüber hinaus gespannt auf die großen Veränderungen sein, die die KI für unsere tägliche Arbeit schon bald mit sich bringen wird.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autoren:
Klinik für Anästhesiologie, Operative
Intensivmedizin und Schmerzmedizin,
Barmherzige Brüder –
Klinikum St. Elisabeth Straubing,
St.-Elisabeth-Str. 23, 94315 Straubing
Teilen:
Das könnte Sie auch interessieren: