S2k-Leitlinie Gastroösophageale Refluxkrankheit
 Magen und Speiseröhre
Magen und Speiseröhre
Die gastroösophageale Refluxkrankheit (GERD) ist eines der häufigsten gastroenterologischen Krankheitsbilder und weit verbreitet. Prävalenz und Inzidenz scheinen in den vergangenen Jahrzehnten anzusteigen, die Prävalenz erreicht bis zu 15 Prozent. Das klinische Spektrum reicht von gelegentlichen Symptomen bis hin zu schwerwiegenden Komplikationen, die eine invasive Therapie erfordern. Auch extraösophageale Manifestationen kommen vor und stellen in Diagnostik und Therapie oft Herausforderungen dar. Aufgrund der Häufigkeit, der klinischen Vielfältigkeit und der häufig erforderlichen Dauertherapie hat sie eine erhebliche volkswirtschaftliche Bedeutung. Dies und die Entwicklungen der vergangenen Jahre haben dazu geführt, dass die Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten e. V. (DGVS) zur GERD im vergangenen Jahr auf den neuesten Stand gebracht wurde [1]. Der vorliegende Artikel fasst die darin enthaltenen Empfehlungen zusammen (AWMF Nr. 021-013).
Definitionen
Für die GERD-Definition wurde die ursprünglich verwendete Genval-Klassifikation verlassen und stattdessen die Montreal-Klassifikation [2] verwendet, die durch deutsche und italienische Expertengruppen validiert, auch von der American Gastroenterological Association übernommen wurde und der European Medicinal Agency als Definition in ihren Leitlinien dient. Als Refluxkrankheit wird jetzt ein Zustand definiert, bei dem der Reflux von Mageninhalt störende Symptome und/oder Komplikationen verursacht [2]. Der Vorteil dieser Definition ist, dass Patienten schon aufgrund der subjektiv störenden Symptomatik und auch asymptomatische Patienten mit Komplikationen (wie zum Beispiel einem asymptomatischen Barrett-Ösophagus) erfasst werden. Es werden verschiedene Ausprägungen der Refluxkrankheit unterschieden und die Unterteilung hat Bedeutung für Therapie und Prognose.
Nicht-erosive Refluxkrankheit (NERD)
Die NERD ist die häufigste Manifestationsform, mehr als 50 Prozent gehören in diese Gruppe [3]. Definiert ist sie als GERD ohne endoskopisch sichtbare Läsionen [4]. Relevant ist, dass die vorliegenden Symptome die Lebensqualität beeinträchtigen müssen. NERD ist häufiger bei Vorliegen folgender Faktoren: Jüngeres Alter, niedriger Body-Mass-Index (BMI), Fehlen einer Hiatushernie, weibliches Geschlecht, Helicobacter-pylori-Infektion.
Erosive Refluxkrankheit (ERD)
ERD ist definiert als endoskopisch sichtbare, durch Reflux ausgelöste, Läsionen. Dies sind meist Erosionen (Refluxösophagitis), können aber auch Strikturen oder ein Barrett-Ösophagus sein. Weniger als die Hälfte der Refluxkranken weist solche Läsionen auf [4].
Hypersensitiver Ösophagus
Das Vorliegen einer positiven Korrelation zwischen Symptomen und Refluxepisoden trotz quantitativ normalem Refluxanteil in pH-Metrie oder Impedanzmessung definiert den hypersensitiven Ösophagus [5]. Bei diesen Patienten scheint eine erniedrigte Schmerzschwelle im Ösophagus gegen physikalische Reize vorzuliegen, weshalb auch Refluxepisoden symptomatisch werden, die Gesunde nicht wahrnehmen. Viele Patienten sprechen auf eine säuresuppressive Therapie an, allerdings werden die Therapie und die Patientenführung häufig dadurch erschwert, dass ein erheblicher Anteil der Patienten psychische Begleitstörungen aufweist (Depression, Angst- und Panikstörungen).
Funktionelle Refluxbeschwerden
Patienten, bei denen weder eine positive Symptomkorrelation noch eine pathologische Refluxdiagnostik vorliegt, fallen in die Gruppe des funktionellen Sodbrennens. Eine säuresuppressive Therapie ist in aller Regel nicht wirksam. Es wird vermutet, dass eine Hypersensitivität gegen mechanische Reize vorliegt, möglicherweise sensibilisiert durch säuresensitive Chemorezeptoren [6].
Extraösophageale Manifestationen
Anerkannte mögliche extraösophageale Manifestationen einer Refluxkrankheit sind chronischer Husten, Asthma, Laryngitis und dentale Erosionen [2]. Der pathophysiologische Link zwischen Reflux und den extraösophagealen Manifestationen ist noch immer nicht ganz klar. Neben einem weit nach proximal reichenden Reflux von Mageninhalt mit der Folge von Mikroaspirationen [7] wird eine refluxbedingte Aktivierung vagaler Afferenzen mit Auslösung bronchialer Symptome diskutiert [8].
Barrett-Ösophagus
Eine der möglichen Folgen einer Refluxkrankheit stellt der Barrett-Ösophagus dar, der weiter hinten in einem eigenständigen Abschnitt behandelt wird.
Diagnostik
Anamnese
Eine genaue Anamnese hinsichtlich Art, Häufigkeit und Ausprägung der klinischen Symptome ist obligat. Typische Refluxsymptome sind Sodbrennen, saures Aufstoßen und Regurgitation von Mageninhalt. Unspezifische, aber bei GERD häufige Symptome und atypische Symptome zeigt die Tabelle 1.
Relevant sind neben der Art der Symptome auch die Häufigkeit und die zeitliche Verteilung der Symptomatik. Eine Refluxkrankheit gilt als wahrscheinlich, wenn typische Refluxsymptome mindestens ein- bis zweimal pro Woche auftreten; nächtliche Symptome sind häufig mit einer schwereren Ausprägung assoziiert als Symptome, die nur untertags bestehen. Zur Anamnese gehört auch eine detaillierte Medikamentenanamnese, da eine Vielzahl von Medikamenten eine Refluxkrankheit begünstigen kann (zum Beispiel Kalziumantagonisten, Nitrate, Anticholinergika und ß-Agonisten).
Bei Vorliegen typischer Refluxsymptome (insbesondere Sodbrennen) ist mit hoher Wahrscheinlichkeit von einer Refluxkrankheit auszugehen, sodass bei Fehlen von Alarmsymptomen (Tabelle 1) ohne weitere Diagnostik eine empirische Therapie mit Protonenpumpeninhibitoren (PPI) eingeleitet werden kann. Sind die Symptome nicht eindeutig, ist eine weitere diagnostische Klärung sinnvoll. Eine probatorische Therapie unter diagnostischer Intention („ex juvantibus“) wird dann nicht empfohlen. Einem möglichen kostensparenden Effekt [9] steht eine je nach Symptomatik möglicherweise unspezifische Wirkung einer säuresuppressiven Therapie gegenüber [10]. Zudem ist zu beachten, dass bei einer Vielzahl von Patienten nach Absetzen von PPI eine passagere Säurehypersekretion auftritt, die oft mit einer passageren Refluxsymptomatik einhergeht [11].
Endoskopie
Eine endoskopische Abklärung durch eine Ösophagogastroduodenoskopie (ÖGD) ist immer notwendig bei Vorliegen von Alarmsymptomen, bei unzureichendem Ansprechen auf eine empirische Standardtherapie, bei Verdacht auf morphologische Refluxfolgen und bei Wunsch des Patienten. In vielen Fällen erleichtert die initiale ÖGD die Therapieplanung und erhöht die Patientenzufriedenheit und -Compliance. Man muss sich allerdings bewusst sein, dass eine unauffällige ÖGD eine Refluxkrankheit keineswegs ausschließt. Findet sich hingegen eine ERD, sind diese Veränderungen so spezifisch, dass ohne weitere Diagnostik die Therapie eingeleitet werden kann. Die aktuelle Leitlinie empfiehlt jetzt zudem nach mehrjährigen Refluxbeschwerden eine einmalige ÖGD zur Suche nach einem Barrett-Ösophagus.
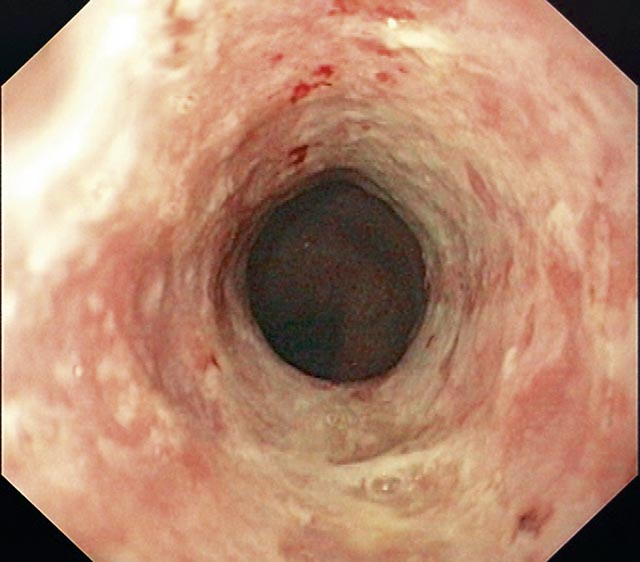
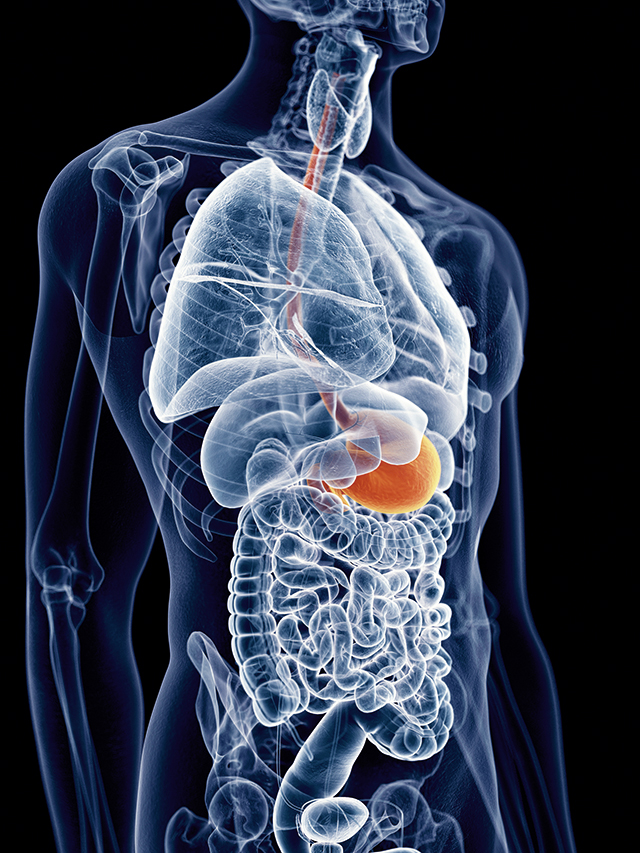
Abbildung 1: Refluxösophagitis LA-Grad D bei einem 76-jährigen Mann mit langjährigem Sodbrennen und hypochrom-mikrozytärer Anämie – Zirkuläre Erosionen im distalen Ösophagus.
Findet sich eine ERD, wird zur Beschreibung die Los-Angeles-Klassifikation empfohlen, da sie die geringste Interobservervariabilität aufweist [12] (Tabelle 2, Abbildung 1). Als ERD-Kriterien sollen nur fleckige, streifige oder konfluierende Epitheldefekte im distalen Ösophagus, nicht jedoch unspezifische Befunde wie Erythem, Granulation oder verwaschene Z-Linie verwendet werden. Eine Biopsie wird zur Diagnose einer GERD wegen der schlechten Spezifität nicht empfohlen, sie ist jedoch erforderlich zur Abgrenzung einer eosinophilen Ösophagitis und zur Diagnose eines Barrett-Ösophagus. Morphologische Begleitbefunde wie Ringe, Stenosen oder Hiatushernie sollen beschrieben werden.

Tabelle 2: Los-Angeles-Klassifikation der Refluxösophagitis [12].
24-Stunden-pH-Metrie und pH-Metrie-MII
Die höchste Sensitivität und Spezifität zur Diagnose einer Refluxkrankheit haben die 24-Stunden-pH-Metrie und die pH-Metrie-MII (= multikanale intraluminale Impedanzmessung) [13], da damit auch die NERD-Patienten erfasst werden können und eine Symptomkorrelation zu Refluxepisoden möglich ist. Sowohl die Sensitivität als auch die Spezifität erreichen Werte bis nahe 100 Prozent, wobei die Sensitivität bei NERD etwas niedriger liegt. Wenn beide verfügbar sind, empfiehlt die Leitlinie die pH-Metrie-MlI. Diese Verfahren erlauben es, auch bei atypischen Refluxbeschwerden, bei Nichtansprechen auf eine empirische PPI-Therapie oder bei Verdacht auf extra-ösophageale Manifestationen eine GERD zu diagnostizieren bzw. die Therapie zu überprüfen. In der Primärdiagnostik sollte die pH-Metrie bzw. die Impedanzmessung wegen der höheren Sensitivität ohne Säuresuppression durchgeführt werden. Wichtig in der Auswertung sind eine quantitative Angabe des Refluxausmaßes, in der Regel als prozentualer Refluxanteil mit einem pH-Wert < 4 an der Gesamtmesszeit, an der Messzeit im Liegen und in aufrechter Position. Für jeden dieser Anteile gibt es in der Literatur Normalwerte [zum Beispiel in 14], die allerdings insbesondere im Grenzbereich deutliche Überlappungen zwischen Normalpersonen und Refluxpatienten zeigen. Häufig verwendet wird auch der DeMeester-Score [14], der aus prozentualem Anteil der Zeit mit pH < 4 („fraction time“) für die gesamte Messdauer sowie für die Messung in aufrechter und liegender Position, Zahl der Refluxereignisse > fünf Minuten, Dauer des längsten Refluxereignisses und Gesamtzahl der Refluxepisoden errechnet wird. Auch für die pH-Metrie-MlI existieren in der Literatur Normwerte, die auch die Anteile schwach-saurer und nicht-saurer Refluxepisoden umfassen (zum Beispiel in [15]). Die Auswertung ist relativ zeitaufwendig und erfolgt meist automatisiert durch entsprechende Software. Wichtig ist bei beiden Verfahren, aber besonders bei der Bewertung von schwach-sauren und nicht-sauren Refluxepisoden eine Symptomkorrelation. Sie erlaubt eine Abgrenzung zwischen den Unterformen NERD, hypersensitiver Ösophagus und funktionellem Sodbrennen. Meist wird die Korrelation durch den Symp-tomindex angegeben (prozentualer Anteil symptomatischer Refluxespisoden an der Gesamtanzahl der Symptomereignisse, positiv ≥ 50 Prozent).
Die Sondenverfahren sind bei den Patienten wegen der Sonde wenig beliebt. Sondenlose pH-Metrieverfahren wie die Bravo-Kapsel sind zwar komfortabler, erlauben aber derzeit keine Impedanzmessung, sind deutlich teurer als die sondenbasierten Verfahren und werden von den meisten Krankenkassen nicht regelhaft bezahlt. Eine Übersicht bzw. Gegenüberstellung der verschiedenen funktionsdiagnostischen Refluxmessungsverfahren zeigt Tabelle 3.

Tabelle 3: Gegenüberstellung der funktionsdiagnostischen Refluxmessungsverfahren.
pH-Metrie oder Impedanzmessung? Diese Frage ist derzeit schwierig zu beantworten. Der besseren Sensitivität der Impedanzmessung und der Möglichkeit, auch nicht-saure Refluxepisoden mit Beschwerden korrelieren zu können, stehen die höheren Kosten, die schlechtere Verbreitung und die komplexere Auswertung gegenüber. In Zukunft wird aber sicherlich die Impedanzmessung an Bedeutung weiter gewinnen.
Ösophagusmanometrie und weitere diagnostische Verfahren
Die Ösophagusmanometrie (heutzutage in Form der high-resolution Manometrie) kommt in der Refluxkrankheit nur präoperativ und zur Abgrenzung von rein motilitätsbedingten thorakalen Beschwerden (zum Beispiel Spasmen oder Achalasie) zum Einsatz. Andere Verfahren haben wegen schlechter Sensitivität oder ungeklärter Relevanz aktuell keinen Stellenwert in der Refluxdiagnostik, mit Ausnahme der radiologischen Verfahren bei speziellen Fragestellungen in der prä- und postoperativen Diagnostik bei chirurgischer Refluxtherapie.
Therapie
Therapieziele
Die Leitlinie definiert drei Therapieziele, die unabhängig von der Therapiewahl erreicht werden sollten:
» Erreichen einer zufriedenstellenden Symptomkontrolle unabhängig vom Ausgangsbefund. Dies gilt sowohl für die Akuttherapie als auch für eine eventuelle Langzeittherapie, die bei einem Teil der Patienten (zum Beispiel bei bereits eingetretenen Komplikationen, bei schwerer Ösophagitis oder bei atypischen Symptomen) erforderlich ist, je nach Ausprägung in Form einer kontinuierlichen, einer intermittierenden oder einer Bedarfstherapie.
» Abheilung einer nachgewiesenen Reflux-ösophagitis.
» Verhinderung von GERD-Komplikationen (wie Blutung, Stenose oder Karzinom).
Therapieformen
Nicht-medikamentöse Therapie
Nicht-medikamentöse Allgemeinmaßnahmen (Tabelle 4) haben einen gewissen Stellenwert [16]. Wichtig ist allerdings, dass man sich der Grenzen der Wirksamkeit bewusst ist.
Medikamentöse Therapie
Die medikamentöse Therapie stellt sowohl in der Akuttherapie als auch bei Notwendigkeit einer Langzeittherapie die wichtigste Therapieform dar. Aufgrund der unzureichenden säuresuppressiven Effekte kommen Antazida oder H2-Blocker hierfür in der Regel nicht in Betracht, sondern PPI [17]. Dosiswahl und Therapiedauer hängen einerseits davon ab, ob es sich um eine Akuttherapie oder eine Langzeittherapie handelt, andererseits aber auch von der klinischen und endoskopischen Ausprägung der GERD.
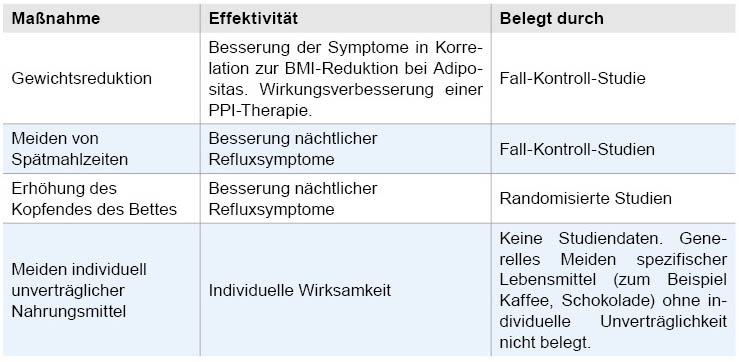
Tabelle 4: Nichtmedikamentöse Allgemeinmaßnahmen bei GERD.
Nicht-endoskopierter Patient, typische Refluxbeschwerden
Bei typischen Refluxbeschwerden ohne Alarmsymptome kann ohne Endoskopie eine empirische Therapie mit einem PPI in einfacher Standarddosis (Tabelle 5) begonnen und zunächst über vier Wochen fortgeführt werden. Dieses Vorgehen führt in knapp 90 Prozent der Fälle zur Beschwerdefreiheit [18]. Bei Erreichen einer adäquaten Symptomkontrolle kann dann auf eine Bedarfstherapie mit einem PPI in halber Standarddosis gewechselt werden. Klinisch und ökonomisch stellt dieses Vorgehen die beste Therapie dar, obwohl eine niedrig dosierte PPI-Dauertherapie geringfügig bessere Dauerergebnisse zeigt [18]. Stellt sich nach der Akuttherapie heraus, dass eine Dosisreduktion bzw. eine Bedarfstherapie wegen Symptomrekurrenz nicht möglich ist, sollte eine Endoskopie durchgeführt werden, da dann eine erhöhte Wahrscheinlichkeit für eine schwere Ösophagitis und/oder einen Barrett-Ösophagus vorliegt.
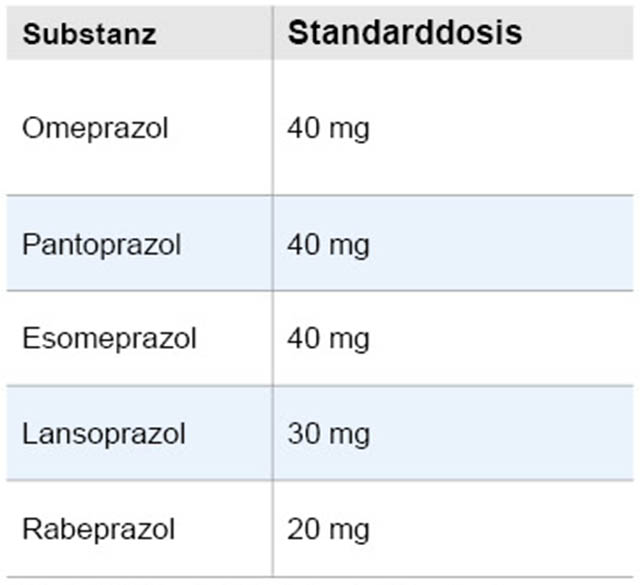
Tabelle 5: Standarddosis der fünf häufigst verwendeten PPI.
Endoskopierter Patient, typische Reflux-beschwerden, keine Ösophagitis (NERD)
Für diese Patientengruppe empfiehlt die Leitlinie eine PPI-Therapie in halber Standarddosis für zunächst zwei bis vier Wochen. Aufgrund der Heterogenität dieser Patientengruppe, die aus Patienten mit echtem pathologischem Reflux, hypersensitivem Ösophagus, aber auch funktionellem Sodbrennen besteht, muss allerdings mit einer erheblichen Rate an Therapieversagern gerechnet werden, und dies erklärt auch, warum NERD-Patienten insgesamt schlechter auf eine PPI-Therapie ansprechen als Patienten mit ERD. Andererseits scheint nach Daten mehrerer großer Studien bei der Mehrzahl der NERD-Patienten eine primär höhere PPI-Dosis nicht effektiver zu sein als die empfohlene halbe Standarddosis [19]. Kommt es hingegen nach vierwöchiger Therapie nicht zur gewünschten Symptomkontrolle, kann entweder die Therapie-dauer verlängert, die Dosis erhöht (bis auf maximal zwei Mal eine Standarddosis) oder der PPI gewechselt werden.
Die Langzeitstrategie bei NERD richtet sich nach dem Symptomverlauf. Bei erfolgreicher Akuttherapie wird eine PPI-Bedarfstherapie empfohlen, bei schubweisem Verlauf mit längeren beschwerdefreien Intervallen ist auch eine intermittierende Therapie analog zur Akuttherapie möglich, wobei hier auch bei milder oder seltener Symptomatik im Einzelfall eventuell auch eine Therapie mit niederpotenten Medikamenten (H2-Blockern oder Antazida) in Betracht kommt, sofern sie klinisch effektiv ist. Die Wirksamkeit der PPI-Bedarfstherapie ist bei NERD-Patienten durch mehrere placebo-kontrollierte Studien [20] abgesichert und stellt auch unter ökonomischen Gesichtspunkten die beste Langzeitstrategie dar [21]. Eine nicht selten von Patientenseite gewünschte chirurgische Therapie sollte bei NERD nur bei zweifelsfrei nachgewiesener Refluxgenese der Beschwerden erwogen werden.
Endoskopierter Patient mit Refluxösophagitis
Die Standard-Akuttherapie liegt hier in einer säuresuppressiven PPI-Therapie in einfacher Standarddosis, die Dauer ist dabei abhängig vom Schweregrad: leichte Refluxösophagitis (LA-Grade A und B) über vier Wochen, schwere Refluxösophagitis (LA-Grade C und D) über acht Wochen. Dies gilt auch für asymptomatische zufällig entdeckte Refluxösophagitiden, zumindest bei höherem Schweregrad.
Problematisch bleibt in dieser Patientengruppe die Langzeitstrategie, da Rezidivraten nach Absetzen der PPI-Medikation bis zu 70 Prozent beschrieben wurden [22]. Bei leichter Refluxösophagitis sollte nach der Akuttherapie ein Auslassversuch unternommen werden. Bei Symptomrekurrenz erfolgt die dann notwendige Langzeittherapie symptomorientiert, das heißt kontinuierlich (dann in der für die Symptomkontrolle minimal erforderlichen Dosis, die durch schrittweise Dosisreduktion ermittelt wird), intermittierend oder eventuell auch on demand. Bei schwerer Refluxösophagitis ist ein sofortiger Auslassversuch in der Regel nicht sinnvoll, sondern es sollte sich an die Akuttherapie eine Dauertherapie mit Versuch einer Dosisreduktion anschließen. Bei langfristig stabilem Verlauf kann dann nach einem Jahr ein Auslassversuch unternommen werden, und dann möglichst mit gradueller Dosisreduktion zur Vermeidung eines Säurerebounds. Dies gilt nicht für den Fall, dass es bereits zu Komplikationen wie Blutung oder Stenose gekommen ist, hier sollte die Langzeittherapie dauerhaft weitergeführt werden.
Chirurgische Therapie
Ca. vier bis sieben Prozent der Refluxpatienten eignen sich für eine chirurgische Therapie. Vier randomisierte Studien vergleichen die medikamentöse und die operative Therapie. Dabei bescheinigt die europäische LOTUS-Multicenterstudie beiden Therapiestrategien eine sehr gute Effektivität mit einer Ansprechrate von über 85 Prozent gemessen nach fünf Jahren [23]. Die laparoskopische Antirefluxoperation wies bei den drei anderen Untersuchungen Vorteile gegenüber der PPI-Therapie bezüglich der Verbesserung der Refluxsymptomatik und der Lebensqualität auf [24, 25, 26].
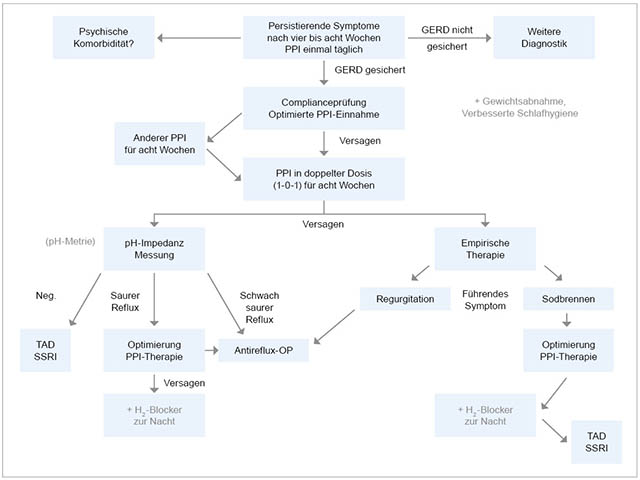
Abbildung 4: Algorithmus zum Vorgehen bei Versagen der Standard-PPI-Therapie bei NERD-Patienten [1].
Voraussetzung für eine Operation ist eine strenge Indikationsstellung durch Experten. Die besten Ergebnisse werden erzielt, wenn möglichst viele Indikationskriterien erfüllt sind (Tabelle 6). Diese umfassen eine langfristige Therapiebedürftigkeit, typische Symptome mit reduzierter Lebensqualität und einen positiven PPI-Response. Häufig ist im Krankheitsverlauf eine Steigerung der Medikamenten-Dosis nötig oder es verbleiben intolerable refluxinduzierte Restbeschwerden, wie beispielsweise ein sogenannter Volumenreflux. Hier kommt es zu einer Regurgitation des neutralisierten Magensaftes bis hin zur Aspiration, was medikamentös nicht zu beeinflussen ist, sodass sich ein operatives Verfahren empfiehlt. Dasselbe gilt, wenn die Lebensqualität der Patienten durch Nebenwirkungen der PPI-Therapie beeinträchtigt wird. Da klinische Symptome als alleiniges Kriterium für eine Operationsindikation nicht ausreichend zuverlässig sind, wird zudem ein objektiver Nachweis einer pathologischen Säureexposition der Speiseröhre gefordert. Deshalb gibt es in der Leitlinie von 2014 eine „Soll“-Empfehlung für die Durchführung einer pH-Metrie. Dies stellt eine Änderung gegenüber der Leitlinie von 2005 dar, bei der bereits ein endoskopisch erhobener, pathologischer Befund wie eine Refluxösophagitis alleinig zur Objektivierung der Diagnose als ausreichend erachtet wurde. Die Manometrie hat einen Stellenwert in der Beurteilung von Motilitätsstörungen und damit der operativen Verfahrenswahl.
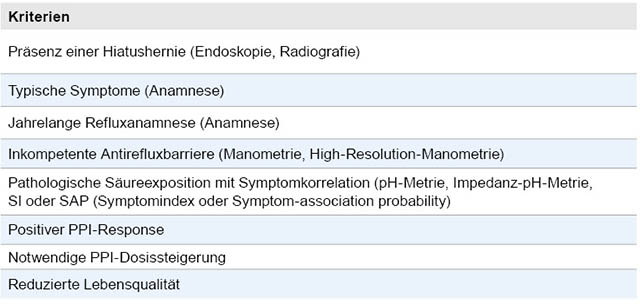
Tabelle 6: Indikationskriterien zu einer Antirefluxoperation.
Die laparoskopische Fundoplicatio hat gegenüber dem offenen Zugang klare Vorteile in Bezug auf postoperative Schmerzen, Liegedauer und Outcome [27, 28]. Elementare Teilschritte der Operation sind eine Rekonstruktion der Anatomie durch eine mediastinale Mobilisierung des distalen Ösophagus und eine hintere Hiatoplastik. Bezüglich der optimalen Manschettenform gibt es kontroverse Ansichten. Während die Nissen-Fundoplikatio (360°-Vollmanschette, Abbildung 2) mit einer höheren Re-Operationsrate insbesondere wegen Dysphagie assoziiert ist [29], scheint sie Vorteile gegenüber der Toupet-Fundoplikatio (270°-Teilmanschette, Abbildung 3) bei der Langzeiteffektivität zu haben [30]. In erfahrenen Zentren liegt die Komplikationsrate unter fünf Prozent und die Letalität unter 0,2 Prozent. Refluxrezidive ohne weitere komplizierende Faktoren nach einem operativen Eingriff sollten zunächst medikamentös behandelt werden. Dysphagie und Schmerzen bedürfen jedoch einer gezielten Abklärung und gegebenenfalls einer Revisionsoperation. Diese sollte wegen des erhöhten Operationsrisikos durch einen erfahrenen Refluxchirurgen vorgenommen werden.

Abbildung 2: 360°-Fundoplikatio nach Nissen und Abbildung 3: 270°-Fundoplikatio nach Toupet.
Extraösophageale Manifestationen
Bei Verdacht auf extraösophageale GERD-Manifestationen mit typischen GERD-Symptomen oder durch funktionsdiagnostisch gesicherte GERD ist eine empirische PPI-Therapie indiziert. Wünschenswert ist auf alle Fälle eine funktionsdiagnostische Sicherung, da nur ein kleiner Teil der extraösophagealen Symptome tatsächlich refluxbedingt ist [2]. Eine eindeutige Therapieempfehlung kann mangels eindeutiger Studiendaten derzeit nicht abgegeben werden, die Leitlinie empfiehlt primär eine empirische PPI-Therapie über acht Wochen in doppelter Standarddosis. Bei Nichtansprechen erscheint ein Zusammenhang der Symptome mit einer GERD zumindest unwahrscheinlich.
Strategien bei Therapieversagen
Generell muss bei Therapieversagen ein individualisiertes Vorgehen angeraten werden. Bei Versagen der Primärtherapie, das heißt bei persistierenden Refluxbeschwerden oder persistierender Refluxösophagitis nach achtwöchiger PPI-Therapie sollte zunächst überprüft werden, ob tatsächlich eine GERD vorliegt. Während dies bei typischer ERD in der Regel der Fall ist, gilt dies nicht zwingend für die Gruppe der NERD-Patienten. Insofern ist das Vorgehen bei Therapieversagen der Standardtherapie etwas unterschiedlich.
Therapieversagen bei NERD-Patienten
Erster Schritt bei Therapieversagen bei NERD-Patienten ist die Sicherung der GERD. Hierzu sollten eine Endoskopie mit Biopsie sowie eine Funktionsdiagnostik erfolgen, wenn möglich in Form einer pH-Impedanzmessung (MII). Ergibt sich kein Nachweis einer GERD, ist eine weitere Diagnostik zur Abklärung der Beschwerden erforderlich, gegebenenfalls unter Einschluss einer Diagnostik hinsichtlich psychischer Komorbiditäten. Ist eine GERD gesichert, sollte strukturiert nach dem in Abbildung 4 gezeigten Algorithmus vorgegangen werden.
Bei gesicherter GERD muss zunächst die Compliance und die korrekte PPI-Einnahme geprüft werden. Ein häufiger Fehler ist zum Beispiel die Einnahme der PPI vor dem Zubettgehen und nicht 30 Minuten vor dem Frühstück. Führt eine optimierte Einnahme nicht zum Erfolg, kann entweder der PPI gewechselt werden oder eine Dosissteigerung auf zwei Mal eine PPI-Standarddosis erfolgen. Zeigt dies weiterhin keine zufriedenstellende Symptomkontrolle, wird eine pH-Impedanzmessung (MII) unter laufender PPI-Medikation empfohlen. Fällt diese negativ aus, wird unter der Vorstellung einer hypersensitiven Komponente eine Therapie mit einem trizyklischen Antidepressivum (TAD) oder einem selektiven Serotonin-Wiederaufnahmehemmer (SSRI – Selective Serotonin Reuptake Inhibitor) empfohlen; dies kann allein oder in Kombination mit einem PPI erfolgen [31]. Bei persistierendem Nachweis eines Säurerefluxes trotz optimierter PPI-Einnahme ist eine zusätzliche Gabe von H2-Blockern möglich, allerdings häufig mit geringem oder nur vorübergehendem Effekt; eine weitere Dosissteigerung der PPI-Medikation über die doppelte Standarddosis hinaus ist in der Regel nicht effektiv. Führt der zusätzliche H2-Blocker nicht zum Erfolg oder findet sich ein symptomatischer schwach saurer Reflux, ist eine Antireflux-OP zu diskutieren; es muss aber nochmals betont werden, dass eine Antireflux-OP bei NERD-Patienten nur dann erfolgen sollte, wenn die Refluxgenese der anhaltenden Symptome zweifelsfrei durch Funktionsdiagnostik belegt ist. Ist eine Funktionsdiagnostik bei Therapieversagern nicht möglich oder wird sie abgelehnt, kann man symptomoriertiert empirisch vorgehen. Bei Regurgitation als führendem Symptom ist eine eher großzügige Indikationsstellung zur chirurgischen Therapie berechtigt, da Volumenreflux medikamentös kaum beeinflussbar ist.
Therapieversagen bei Refluxösophagitis
Auch bei therapierefraktärer Refluxösophagitis kann nach Prüfung der Compliance und Optimierung der PPI-Einnahme entweder der PPI gewechselt oder besser die Dosis auf zwei Mal eine Standarddosis erhöht werden. Persistiert die Refluxösophagitis dann nach weiteren acht Wochen immer noch, entscheiden Symptomatik und Schwere der Restösophagitis über das Vorgehen. Bei akzeptabler Symptomkontrolle und nur leichter Restösophagitis wird die Therapie unverändert fortgesetzt, bei unzureichender Symptomkontrolle oder schwerer Restösophagitis werden eine diagnostische Klärung und eine Therapieoptimierung anhand der individuellen Untersuchungsergebnisse empfohlen. Hierzu gehört auch die Prüfung einer Operationsindikation.
Barrett-Ösophagus
Die Diagnose Barrett-Ösophagus wird bei endoskopisch-makroskopischem Verdacht histologisch durch Nachweis von spezialisiertem intestinalem metaplastischem Zylinderepithel gestellt. Künftig soll zur Beschreibung des Barrett-Ösophagus die sogenannte „Prag“-Klassifikation zum Einsatz kommen.
Endoskopische Diagnosesicherung
Als Standard für die endoskopische Diagnostik bei Patienten mit Barrett-Ösophagus soll die hochauflösende Videoendoskopie gelten. Bei endoskopischem Verdacht oder bereits gesichertem Barrett-Ösophagus soll eine gezielte Biopsie aller suspekten Areale und anschließender 4-Quadranten-Biopsie (4-QPE) alle ein bis zwei Zentimeter erfolgen. Suspekte Areale sollen getrennt asserviert und histopathologisch untersucht werden. Ansonsten bedarf es keiner getrennten Asservierung der Biopsien. Neue Methoden wie Chromoendoskopie (Indigokarmin, Essigsäure) sowie die computergestütze Chromoendoskopie (NBI, FICE und I-scan) können zusätzlich im Rahmen einer Überwachungsendoskopie angewandt werden [32]. Bei Nachweis entzündlicher Veränderungen sollte vor Biopsieentnahme eine vierwöchige PPI-Therapie mit anschließender 4-QPE erfolgen.
Therapie des Barrettösophagus und Überwachung
Die endoskopische Therapie von frühen Barrett-Neoplasien sollte nur in erfahrenen Zentren mit Verfügbarkeit aller diagnostischer und therapeutischer Verfahren und Zugang zu einer erfahrenen Ösophaguschirurgie erfolgen. Eine Empfehlung zur medikamentösen Prävention der Entwicklung von Neoplasien im Barrett-Ösophagus kann derzeit nicht abgegeben werden. Ebenso soll eine endoskopische Therapie/Ablation von nicht-neoplastischer Barrettschleimhaut nicht erfolgen.
Die endoskopische Behandlung von Barrettneoplasien mittels endoskopischer Resektion ist die Methode der Wahl. Voraussetzung dafür ist eine minutiöse endoskopische Diagnostik, um die Läsion gut abzugrenzen und um eine schwergradig intraepitheliale Neoplasie (HGIN) oder ein mukosales Karzinom R0 en-bloc zu resezieren. Kleine Läsionen (< zehn Millimeter) können dabei mit der Kappenresektionstechnik in der Regel en-bloc R0-reseziert werden. Bei größeren und polypoiden Läsionen oder Verdacht auf Submukosainfiltration ist wahrscheinlich die endoskopische Submukosadissektion (ESD) von Vorteil [33, 34].
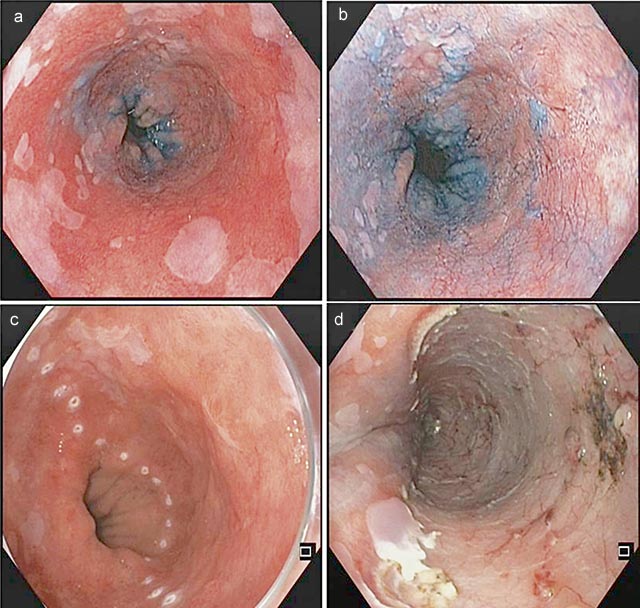
Abbildung 5: Long Segment Barrett im Weißlichtmodus (a), nach Anfärben mit Indigokarmin demarkiert sich auf der rechten Zirkumferenz das neoplastische Areal (b), Markierung der Resektionsgrenzen nach zusätzlicher Betrachtung im NBI-Modus und Anfärben mit Essigsäure. Die Neoplasie erstreckt sich etwa auf die halbe Zirkumferenz des Barrett-Ösophagus (c), mittels ESD konnte die Neoplasie en-bloc R0 (Mukosales Karzinom, R0, V0, L0) entfernt werden (d).
Bei Nachweis einer niedriggradigen intraepithelialen Neoplasie (LGIN) im Barrett-Ösophagus, die endoskopisch detektierbar ist und die durch einen Referenzpathologen zu bestätigen ist, und Vorliegen sichtbarer Veränderungen soll die endoskopische Resektion erfolgen. Ist die LGIN endoskopisch nicht nachweisbar, sollen Verlaufskontrollen nach sechs Monaten und dann jährlich erfolgen, alternativ kann man das Barrettsegment mittels Radiofrequenzablation behandeln [35].
Kann eine hochgradige intraepitheliale Neoplasie oder ein mukosales Karzinom im Barrett-Ösophagus endoskopisch detektiert werden, soll eine endoskopische Resektion erfolgen, da hierdurch neben der Therapie auch ein Staging der Läsion mit der Frage der Tiefeninfiltration erfolgt. Ist eine HGIN endoskopisch nicht nachweisbar, soll eine Radiofrequenzablation erfolgen [36].
Nach erfolgreicher Resektion von Neoplasien im Barrett-Ösophagus soll der nicht neoplastische Barrett-Ösophagus abladiert werden, um die Rate an metachronen Neoplasien zu senken [37].
Eine Indikation zur Operation besteht nach wie vor, wenn eines der folgenden Kriterien vorliegt:
1. Lymph- (L1) oder Blutgefäßinfiltration (V1)
2. Infiltration des oberen Drittels der Submukosa (T1sm1) und Vorliegen eines der folgenden Risikofaktoren: Größe > 20 Millimeter, schlechter Differenzierungsgrad (G3), L1, V1
3. tiefe Infiltration in die Submukosa (≥ 500 µm)
4. Tumorrest am basalen Resektionsrand
(R1 basal)
Bei Patienten mit oberflächlicher Submukosainfiltration und ohne Risikokriterien (pT1sm1; < 500 µm, L0, V0, G1/2, < 20 mm, keine Ulzeration) kann jedoch die endoskopische Resektion eine Alternative zur Ösophagusresektion darstellen [38].
Die Überwachungsintervalle richten sich nach dem Vorhandensein und dem Schweregrad der intraepithelialen Neoplasien. In Abhängigkeit vom Vorhandensein von intraepithelialen Neoplasien werden folgende Überwachungsintervalle empfohlen:
1. Keine intraepitheliale Neoplasie: Kontrolle nach einem Jahr, bei Bestätigung kann alle drei bis vier Jahre eine Kontroll-ÖGD erfolgen;
2. Leichtgradige intraepitheliale Neoplasie: falls sichtbar endoskopische Therapie, sonst im ersten Jahr halbjährlich, dann jährlich; alternativ kann eine Ablation mit Röntgenfluoreszenzanalyse (RFA) erfolgen
3. Hochgradige intraepitheliale Neoplasie: endoskopische Therapie.
Das Literaturverzeichnis kann bei den Verfassern angefordert oder im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Teilen:
Das könnte Sie auch interessieren: