Neu in der Nuklearmedizin
 Neu in der Nuklearmedizin
Neu in der Nuklearmedizin
Die Nuklearmedizin hat in den vergangenen Jahren sowohl in der Diagnostik als auch Therapie zunehmend an Bedeutung gewonnen. Dies liegt zum einen an einer weiteren Verbesserung der Gerätetechnik, zum anderen aber auch daran, dass es mittels prospektiver klinischer Studien gelungen ist, die Effektivität und gleichzeitig gute Verträglichkeit neuer nuklearmedizinischer Therapien zu zeigen. Die unmittelbare Integration von Diagnostik und Therapie – die Theranostik – spielt hierbei eine wichtige Rolle. In diesem Konzept werden dieselben Schlüsselmoleküle für diagnostische Bildgebung als auch Radionuklidtherapie verwendet, variiert wird das gebundene Radioisotop – ein Gammastrahler oder Positronen-Emitter für die Bildgebung, ein Beta- oder zunehmend auch Alphastrahler für die Therapie. Durch diesen Ansatz kann eine nicht-invasive Ganzkörper-Charakterisierung der jeweiligen Erkrankung erfolgen und eine individualisierte, zielgerichtete Therapie angeboten werden. Mit den folgenden Fällen wollen wir Ihnen die theranostischen Entwicklungen der jüngsten Vergangenheit vorstellen.
Erster Fall – PSMA-gerichtete Radioligandentherapie beim metastasierten, kastrationsresistenten Prostatakarzinom
Fallbeschreibung
Ein 76-jähriger Patient stellte sich mit progredientem metastasiertem kastrationsresistentem Prostatakarzinom (mCPRC) vor. Initial war eine radikale Prostatektomie mit adjuvanter Bicalutamid-Therapie (Antiandrogen) erfolgt. Im ersten Rezidiv nach sieben Jahren erfolgte eine Therapie mit Abirateron (CYP17A1-Enzymhemmer, hemmt die Testosteronproduktion), die jedoch aufgrund von Nebenwirkungen abgebrochen werden musste. Die anschließende Umstellung auf Leuprorelin (Synthetisches Hormon, reduziert Testosteron/Östrogen) führte zu einer Stabilisierung der Situation für zwei weitere Jahre, bei erneutem Progress erhielt der Patient insgesamt zwölf Zyklen einer Taxan-basierten Chemotherapie mit Docetaxel. In einer zum Staging durchgeführten, gegen das Prostataspezifische Membranantigen (PSMA) gerichteten Positronen-Emissions-Tomografie/Computertomografie (PET/CT) ergab sich ein Progress mit einem lokalen Rezidiv im linken Samenbläschen sowie größenprogredienten und neuen lymphonodalen und ossären Metastasen (Abbildung 1 A).
Therapie und Verlauf
Nach Erörterung des Falles in der interdisziplinären Tumorkonferenz konnte dem Patienten bei intensiver Rezeptorexpression der Tumormanifestationen eine PSMA-gerichtete Radioligandentherapie (RLT) angeboten werden. Im Therapieverlauf konnte ein sehr gutes Therapieansprechen mit signifikanter Rückbildung der multifokalen Metastasen dokumentiert werden (Abbildung 1 B),
hierzu konkordant zeigte sich ein gutes biochemisches Therapieansprechen mit einem Abfall des prostataspezifischen Antigens (PSA) von initial
20 ng/ml auf 0,15 ng/ml. Die Therapie wurde ohne relevante Nebenwirkungen gut vertragen. Aktuell, elf Monate nach dem Beginn der RLT, findet sich bei dem Patienten erfreulicherweise eine anhaltende partielle Remission (Abbildung 1 C).
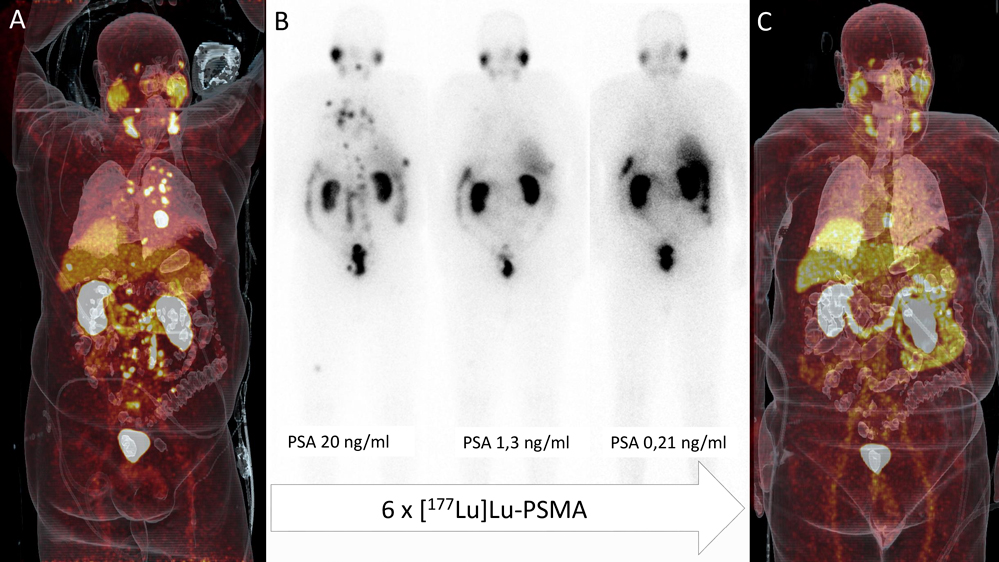
Abbildung 1: A) prätherapeutische PSMA-PET/CT in Fusionsdarstellung mit intensivem Signal der ausgedehnten Metastasen, zum Beispiel retroperitoneal (physiologisch-intensive Nuklidbelegung von Speicheldrüse, Niere und Harnblase). B) Post-therapeutische Ganzkörperszintigrafien zur Dokumentation der PSMA-RLT, von links 1., 2. und 6. Zyklus mit abnehmender Intensität der Nuklidspeicherung der Metastasen. C) Re-Staging mittels PSMA-PET/CT, einzig eine Metastase im Sternum zeigt weiterhin eine intensive Rezeptorexpression (weißer Pfeil).
Diskussion
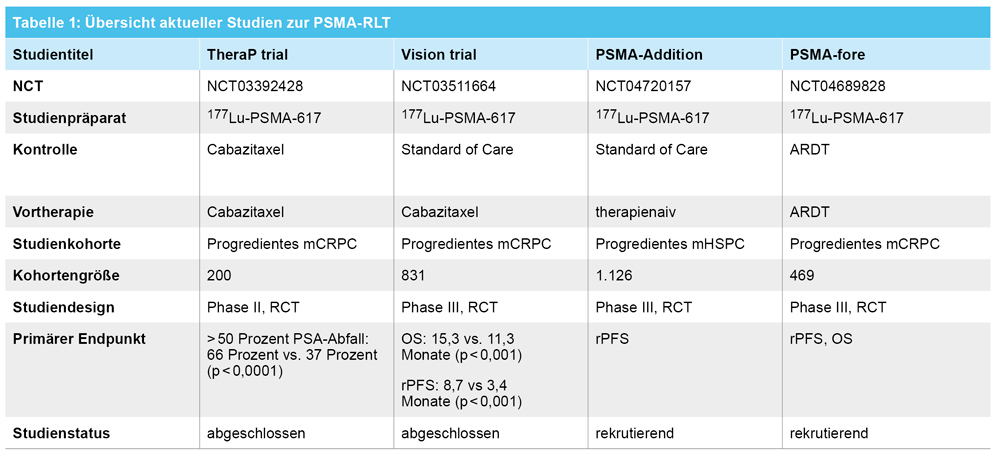
Für die Theranostik des Prostatakarzinoms stehen seit einigen Jahren radiomarkierte Liganden des PSMA zur Verfügung. Dabei steigt die Expression von PSMA in Prostatakarzinomen mit steigendem Gleason-Score sowie in Metastasen [1]. Ergebnisse einer aktuellen prospektiven Phase-III-Studie (proPSMA) demonstrierten im Rahmen des Primär-Stagings des Hochrisiko-Prostatakarzinoms eine hochsignifikante Verbesserung der diagnostischen Genauigkeit durch den Einsatz der PSMA-PET/CT im Vergleich zur konventionellen Bildgebung mit Skelettszintigrafie und CT (92 Prozent vs. 65 Prozent; p < 0,001) [2]; in 28 Prozent aller Fälle führte die Hinzunahme der PET zu einer Änderung des Therapiemanagements [2]. Im Rahmen der Tumorlokalisation im frühen biochemischen Rezidiv ergeben sich, abhängig vom PSA-Wert Detektionsraten von 50 Prozent für PSA-Werte < 0,5 ng/ml bis zu 86 Prozent bei PSA-Werten > 2 ng/ml [1]; die PSMA-PET/CT ist seit 2019 im Rahmen der ambulanten spezialfachärztlichen Versorgung (ASV) zur Diagnostik als Kassenleistung verfügbar.
Zu therapeutischen Zwecken werden PSMA-Liganden meist mit Betastrahlern markiert. Eine 2018 veröffentlichte prospektive einarmige Phase-II-Studie zu dem an den Betastrahler Lutetium-177 (177Lu) gekoppelten Liganden PSMA-617 (177Lu-PSMA-617) schloss 30 Patienten mit mCRPC ein, die zuvor eine Taxan-basierte Chemotherapie und/oder eine Therapie mit Abirateron oder Enzalutamid erhalten hatten. Dabei zeigten 57 Prozent der Patienten einen PSA-Abfall > 50 Prozent sowie eine signifikante Verbesserung der Lebensqualität [3]. Die Erweiterung dieser Studienkohorte auf 50 Patienten dokumentierte ein signifikant längeres Gesamtüberleben bei Patienten mit einem PSA-Rückgang von > 50 Prozent auf 18,4 Monate (95 Prozent CI, 13,8-23,8) vs. 13,3 Monate (95 Prozent CI, 10,5-18,7) bei Patienten, die kein biochemisches Ansprechen zeigten [4]. Eine aktuelle, multizentrische australische Studie (TheraP) randomisierte 200 Patienten mit mCRPC nach Erstlinienchemotherapie 1:1 in die Studienarme 177Lu-PSMA-617 oder Cabazitaxel als Zweitlinien-Taxan-Therapie. Als primärer Endpunkt diente ein 50-prozentiger PSA-Abfall, den 66 Prozent der Patienten im 177Lu-PSMA-617-Arm gegenüber 37 Prozent im Cabazitaxel-Arm erreichten (p < 0,0001). Ein Progress der Erkrankung trat im 177Lu-PSMA-617-Arm gegenüber dem Cabazitaxel-Arm signifikant später ein (HR 0.63 [95 Prozent] CI 0,46-0,86; p = 0,0028). Höhergradige Nebenwirkungen traten in dem nuklearmedizinisch behandelten Studienarm signifikant seltener auf [4]. Ende 2022 erfolgte die Zulassung von 177Lu-PSMA-617 (Pluvicto®) zur Therapie des metastasierten kastrationsresistenten Prostatakarzinoms. Die als Grundlage dienende Phase-III Zulassungsstudie (VISION) randomisierte 831 Patienten 2:1 auf die Kombination aus 177Lu-PSMA-617 und den Standard of Care vs. den Standard of Care, wobei hier zytotoxische Chemotherapien, Immuntherapien, systemische Radionuklidtherapien oder zum Zeitpunkt der Therapie noch nicht zugelassene Therapeutika wie zum Beispiel Olaparib ausgeschlossen waren. Dabei zeigte sich im Studienarm eine hoch signifikante Verlängerung des radiologischen progressionsfreien als auch des Gesamtüberlebens (15,3 Monate vs. 11,3 Monate; p < 0,001). Die Zulassung setzt aktuell ein inoperables, hormonrefraktäres Prostatakarzinom nach mindestens einem Androgenrezeptorinhibitor (androgen receptor deprivation therapy; ARDT) sowie einer Linie Taxan-basierten Chemotherapie voraus.
Diskutiert wird noch der Mehrwert der RLT in früheren Krankheitsstadien. Eine Studie, die den Einsatz der PSMA-Radioligandentherapie beim metastasierten hormonsensitiven Prostatakarzinom erforscht (PSMA-fore) rekrutiert aktuell und soll im Februar 2026 abgeschlossen sein. Eine Übersicht über die wichtigsten Studien finden Sie in der Tabelle 1.
Zweiter Fall – Somatostatinrezeptor-gerichtete Radiopeptidtherapie zur Behandlung neuroendokriner Neoplasien
Fallbeschreibung
Eine 45-jährige Patientin stellte sich mit dem Befund einer Metastasenleber mit Peritonealkarzinose bei einem neuroendokrinen Tumor des Pankreas (G2, Ki-67-Index 14 Prozent) vor
(Abbildung 2 A). Im Vorfeld waren insgesamt sechs Zyklen einer Chemotherapie mit Streptozotocin (500 mg/m2) und 5-Fluorouracil (400 mg/m2) sowie eine viermalige intraarterielle Partikelembolisation der Leber erfolgt. Bei, im Verlauf progredienter, Erkrankung wurde im Rahmen einer interdisziplinären Tumorkonferenz die Empfehlung zur intraarteriellen Somatostatin-Rezeptor (SSTR)-gerichteten Peptid-Rezeptor-Radionuklid-Therapie (PRRT) ausgesprochen. Bis dato konnten drei Zyklen einer 177Lu-HA-DOTATATE-Therapie (Lutetium-high-affinity-DOTATATE) erfolgreich intraarteriell appliziert werden (Abbildung 2 B). Aktuell befindet sich die Patientin in einer stabilen partiellen Remission der Erkrankung (Abbildung 2 C).
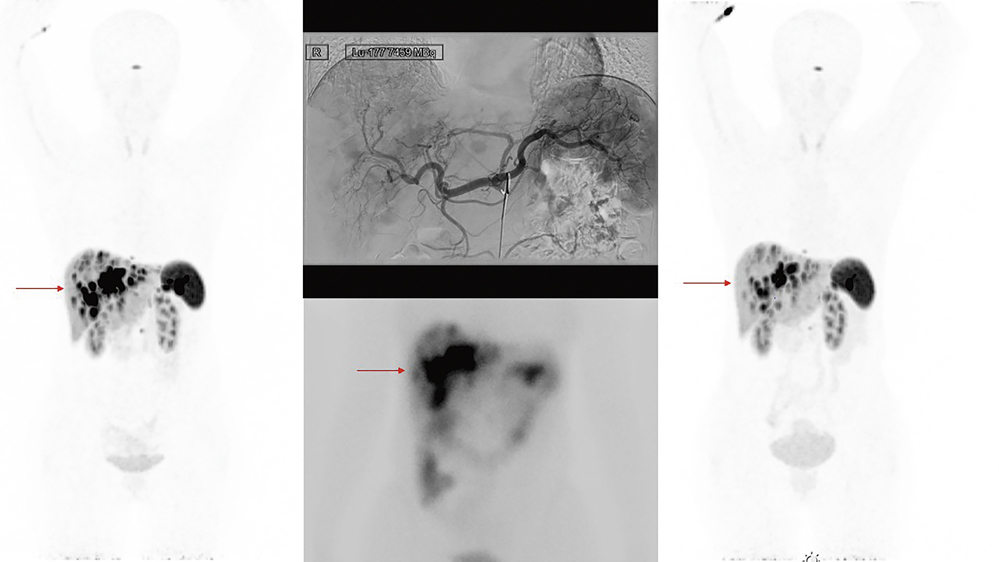
Abbildung 2: A) prätherapeutische SSTR-gerichtete PET-CT mit intensiver Rezeptorexpression der hepatischen Metastasen (physiologische Nuklidbelegung von Milz und Hypophyse). B) oben: angiografische Darstellung der intraarteriellen Therapie; unten: post-therapeutische Szintigrafie zur Dokumentation der wunschgemäßen Verteilung der PRRT. C) Re-Staging mittels SSTR-gerichteter PET-CT mit Darstellung einer partiellen Remission in der Leber (roter Pfeil).
Diskussion
Neuroendokrine Neoplasien (NEN) sind seltene Tumoren, die aus den sekretorischen Zellen des neuroendokrinen Systems entstehen und mit einer Inzidenz von ca. 7/100.000/a auftreten [5]. Während diese Tumoren in fast jedem Gewebe des Körpers auftreten können, machen die gastro-entero-pankreatischen NEN zusammengefasst ca. 50 bis 60 Prozent aller Fälle aus, wobei insbesondere die gut differenzierten Tumoren SSTR (insbesondere die Subtypen SSTR 2, 3 und 5) auf ihrer Oberfläche überexprimieren. Diese Rezeptor-Expression bildet die Grundlage für die funktionelle nuklearmedizinische Theranostik mit SSTR-gerichteten Radiopharmaka [6, 7]. Hinsichtlich der Bildgebung von NEN empfiehlt die S2K-Leitlinie „Neuroendokrine Tumore“ eine initiale SSTR-gerichtete PET/CT bei jedem gut differenzierten NET; Ausnahmen hiervon sind lediglich ein Magen-NET Typ I, Rektum-NET G1 (jeweils < 1 cm und ohne Risikofaktoren) und der Zufallsbefund eines Appendix-NET (< 1 cm) ohne Risikofaktoren [8]. Weitere Indikationen zur PET-Bildgebung umfassen unter anderem das Re-Staging, Therapiemonitoring und die Evaluation einer PRRT [9]. In der klinischen Routine werden hauptsächlich SSTR-Agonisten wie 68Ga-DOTATATE oder 68Ga-DOTATOC eingesetzt. Zwei Metaanalysen mit über 2.000 Patienten konnten eine exzellente Sensitivität von 93 Prozent und eine Spezifität von bis zu 96 Prozent für die SSTR-PET/CT belegen [10, 11].
Dem theranostischen Konzept folgend kann durch Nachweis eines ausreichenden SSTR-Besatzes der Tumorzellen in der Bildgebung eine PRRT erfolgen. Bereits seit den 1990er-Jahren wurde diese nuklearmedizinische Therapie mit vielversprechenden Ergebnissen bei der Behandlung von fortgeschrittenen NEN eingesetzt [12, 13]. Fast 25 Jahre später konnte die Wirksamkeit der PRRT bei NET des Mitteldarmes (Jejunum, Ileum und proximales Kolon) in einer prospektiven, multizentrischen, randomisierten Studie demonstriert werden (NETTER-1). In einer 1:1-Randomisierung wurden insgesamt 229 Patienten mit metastasiertem oder lokal fortgeschrittenem NET, die unter Standardtherapie mit max. 30 mg des langwirksamen Somatostatinanalogon Octreotid LAR einen Krankheitsprogress zeigten, verglichen. Der Studienarm erhielt eine Kombination aus vier Zyklen einer PRRT mit 30 mg Octreotid LAR, der Kontrollarm eine Therapie mit doppelter Dosierung Octreotid LAR
60 mg. Der Studienarm erzielte eine klinisch und statistisch signifikante Verbesserung des progressionsfreien Überlebens (primärer Endpunkt; HR: 0,18, p < 0,0001). Das mediane Gesamtüberleben (sekundärer Endpunkt) betrug 48,0 Monate in der PRRT-Gruppe und 36,3 Monate in der Kontrollgruppe (HR 0,84, p = 0,30; möglicherweise durch eine hohe Cross-over-Rate von 36 Prozent bedingt). Die Patienten der PRRT-Gruppe profitierten außerdem hinsichtlich der Lebensqualität [14], insgesamt wurde die PRRT sehr gut toleriert. Ausgehend von diesen Studienergebnissen wurde im Jahre 2017 Lutathera (177Lu-DOTATATE) zur Behandlung von nicht resektablen oder metastatischen, progredienten, gut differenzierten (G1 und G2), SSTR-positiven GEP-NET von der Food and Drug Administration (FDA) und der European Medicines Agency (EMA) zugelassen. Die Therapie wird intravenös über vier Zyklen in achtwöchigem Abstand in spezialisierten nuklearmedizinischen Zentren verabreicht.
Weitere laufende Studien untersuchen unter anderem die Wirkung der PRRT in GEP-NET im Vergleich zu Everolimus (COMPETE), die PRRT als Erstlinientherapie fortgeschrittener G2 und G3 GEP-NET (NETTER-2) oder die Kombination einer PRRT mit anderen Chemotherapeutika (Capecitabin). Eine weitere Potenzierung der anti-tumoralen Aktivität kann – wie in unserem Fall – insbesondere bei leberdominanter Metastasierung durch die intra-arterielle Applikation des Radiopharmakons erreicht werden, wobei Analysen größerer Datenmengen oder prospektive Studien noch ausstehen.
Eine zusätzliche Weiterentwicklung stellt der Einsatz von SSTR-Antagonisten mit einer vermehrten Bindung an die Rezeptorbindungsstellen im Vergleich zu den bekannten SSTR-Agonisten dar [15]. In der klinischen Bildgebung wurde eine im Vergleich zu den Agonisten nochmals verbesserte Tumordetektionsrate gezeigt [16]. Die therapeutische Wirksamkeit der Antagonisten erscheint vielversprechend [17], muss jedoch – wie der Einsatz von Alpha-Emittern – noch genauer untersucht werden.
Dritter Fall – CCK-2R-Ligand als neuer Vektor für das medulläre Schilddrüsenkarzinom und weitere moderne theranostische Ansätze
Fallbeschreibung
Ein 65-jähriger Patient stellte sich zum Re-Staging bei vorbekanntem Zustand nach lymphonodal metastasiertem medullärem Schilddrüsenkarzinom (MTC; T1a(m) pN1 cM0) bei familiärem Syndrom der multiplen endokrinen Neoplasien vom Typ IIa (familiäres MEN-IIa-Syndrom) vor. Nach totaler Thyreoidektomie mit zentraler Lymphknotendissektion vor 18 Jahren war bis dato keine weitere Therapie erfolgt. Seit mehreren Monaten wurde ein ansteigender Tumormarker Calcitonin (aktuell: 210 pg/ml) im Serum beobachtet. Die im Vorfeld durchgeführte Bildgebung inkl. 18F-FDG-PET/CT sowie 18F-DOPA-PET/CT zeigte keinen Nachweis eines Rezidivs, sodass dem Patienten eine weitere Untersuchung mittels eines Liganden an den Cholecystokinin-2-Rezeptor (CCK-2R), welcher von mehr als 90 Prozent der MTC exprimiert wird [18], angeboten wurde. Hierbei konnten jeweils eine links zervikal (Abbildung 3 A) als auch links mediastinal lateral des Aortenbogens gelegene, Lymphknotenfilia detektiert werden (Abbildung 3 B).
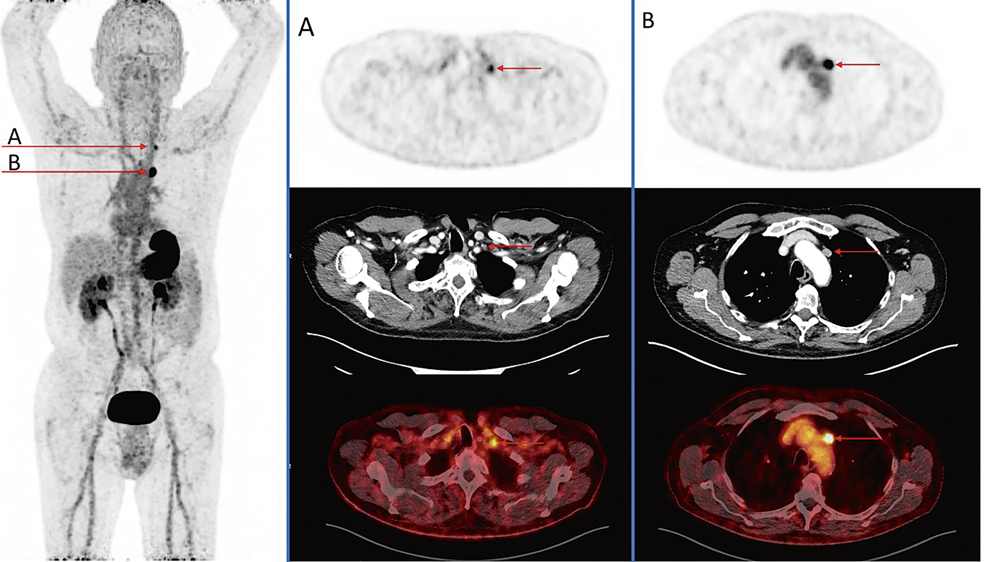
Abbildung 3: CCK-2R-PET-CT mit Darstellung von zwei lymphonodalen Metastasen mit intensiver Nuklidaufnahme (rote Pfeile): A zervikal links gelegene Metastase; B mediastinal gelegene Metastase
Diskussion
Das MTC macht nur ein bis zwei Prozent aller Schilddrüsenneoplasien aus [19], ist aber eine Herausforderung sowohl für die Diagnostik als auch die Therapie [20]. Insbesondere in der Nachsorge zeigt sich häufig ein erhöhter Tumormarker Calcitonin ohne sicheres morphologisches Korrelat; aktuelle Leitlinien empfehlen für die Bildgebung neben der zervikalen Sonografie, der CT und MRT primär 18F-FDG und 18F-DOPA - eine radiomarkierte Form von L-DOPA – für die nuklearmedizinische Bildgebung [21]. Leider besitzt selbst die 18F-DOPA-PET/CT als nuklearmedizinischer Goldstandard bei der Detektion von Tumormanifestationen in der Rezidiv-Situation nur eine eingeschränkte Sensitivität. Während bei Tumoren in der Schilddrüsenloge eine Nachweisrate von 86 Prozent vorliegt, ist diese bei Lymphknoten- und Fernmetastasen mit 57 Prozent bzw. sechs Prozent signifikant niedriger [22].
Der hier zum Einsatz kommende neuartige diagnostische Ligand an den CCK-2R besitzt analog zu den im ersten und zweiten Fall vorgestellten theranostischen Konzepten ebenfalls die Option zur zielgerichteten Anwendung, erste Studien in diesem Kontext sind bereits initiiert (LUMED).
Viele weitere theranostische Konzepte finden sich derzeit in der klinischen Erprobung. Jenseits der direkten Darstellung der Tumorzelle adressiert ein vielversprechender Ansatz das Tumormikromilieu und die dort ansässigen Tumor-assoziierten Fibroblasten. Letztere haben das sogenannte Fibroblasten-Aktivierungs-Protein (fibroblast activation protein; FAP) an der Zelloberfläche überexprimiert und sind somit einer zielgerichteten Bildgebung (und auch Therapie) zugänglich. Während FAP im gesunden Gewebe in vernachlässigbaren Mengen ausgebildet wird, findet sich eine relevante Zielstrukturexpression im Tumorstroma von über 90 Prozent der epithelialen Neoplasien. Durch diese Vielseitigkeit stellt die FAP-gerichtete Bildgebung eine gute Alternative zum Standard-Onkologie-Tracer 18F-FDG dar; aufgrund des geringeren Hintergrundsignals in, zum Beispiel Gehirn, (Herz-)Muskel, Leber oder Darm, kann sie sogar diagnostische Vorteile liefern. Hinsichtlich der therapeutischen Anwendung konnten kürzlich erste ermutigende Ergebnisse bei Patienten mit Sarkomen publiziert werden [23], eine genaue Beurteilung des therapeutischen Potenzials dieses Ansatzes ist zum aktuellen Stand jedoch noch nicht möglich.
Eine letzte Anwendung, die kurz erwähnt werden soll und insbesondere in der Theranostik hämatologischer Neoplasien eingesetzt werden kann, adressiert den C-X-C Chemokinrezeptor 4 (CXCR4). Hierbei handelt es sich um einen G-Protein-gekoppelten Transmembranrezeptor, der maßgeblich an der Embryogenese, Zellmigration, Zellproliferation und Angiogenese, aber auch Metastasierung von Tumorzellen beteiligt ist. Aufgrund der bereits physiologisch hohen CXCR4-Expression auf hämatopoetischen Zellen finden sich sehr hohe Rezeptordichten auf Zellen hämatologischer Neoplasien, zum Beispiel von Non-Hodgkin-Lymphomen (NHL), dem Multiplen Myelom (MM) oder akuten Leukämien, was für die Bildgebung und Therapie mittels CXCR4-gerichteter Endoradiotherapie ausgenutzt werden kann. Die größte Erfahrung besteht hierbei für das MM. Bei ansonsten austherapierten Patienten mit rezidivierter/refraktärer Erkrankung konnte mittels dieses neuen Therapieansatzes eine signifikante Reduktion der Tumorlast erreicht werden [24, 25, 26]. Eine multizentrische Phase I/II-Studie (COLPRIT; EudraCT 201500181728) wird die Wertigkeit der CXCR4-gerichteten RLT bei Patienten mit MM oder fortgeschrittenem NHL prospektiv an mehreren bayerischen Universitätsstandorten untersuchen.
Fazit für die Klinik
- Während im ersten Jahrzehnt des 21. Jahrhunderts in der Nuklearmedizin Fortschritte in der Gerätetechnik und Bildbearbeitung wegweisend waren, dominiert in den letzten Jahren die Entwicklung und Etablierung neuer diagnostischer aber auch therapeutischer Radiopharmaka.
- Insbesondere der Bereich der Theranostik als enge Verzahnung von Diagnostik und zielgerichteter (und somit sehr gut verträglicher) Therapie erlebt momentan eine große Dynamik.
- Die zielgerichtete Diagnostik und Therapie von Prostatakarzinomen mittels PMSA-gerichteter Liganden stellt zunehmend einen Standard im Management der Patienten dar. Insbesondere in der Diagnostik des frühen biochemischen Rezidivs und im Rahmen des Primärstagings des Hochrisikokarzinoms ist die PSMA-PET/CT in den S3-Leitlinien verankert und findet zunehmend Verwendung in der Routine.
- Die PSMA-Radioligandentherapie wurde Ende vergangenem Jahres von der EMA zur Behandlung von Patienten mit metastasiertem kastrationsresistentem Prostatakarzinom zugelassen.
- In der Zweitlinientherapie von nicht resektablen oder metastatischen, progredienten, gut differenzierten (G1 und G2) SSTR positiven GEP-NET stellt die Rezeptor-gerichtete PRRT eine etablierte, in Leitlinien erankerte Therapieoption dar.
- Viele weitere theranostische Ansätze finden sich derzeit in Entwicklung, zum Beispiel für das Tumorstroma mittels FAP-Inhibitoren oder für hämatologische Neoplasien mittels CXCR4-gerichteter Liganden
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Autoren

Dipl.-Ing. Alexander Gäble, Arzt
Klinik für Nuklearmedizin, Universitätsklinikum Augsburg, Stenglinstraße 2, 86156 Augsburg, Tel. 0821 4002050, E-Mail: alexander.gaeble@uk-augsburg.de
Teilen:
Das könnte Sie auch interessieren: