S3-Leitlinie Polytrauma / Schwerverletzten-Behandlung
 S3-Leitlinie Polytrauma / Schwerverletzten-Behandlung
S3-Leitlinie Polytrauma / Schwerverletzten-Behandlung
Am 21. September 2016 veröffentlichte die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF) die neu überarbeitete S3-Leitlinie Polytrauma/Schwerverletzten-Behandlung [1].
Der folgende Artikel gibt einen Überblick über die wichtigsten Neuerungen vor allem in den Abschnitten Präklinik und Schockraum. Wir verweisen jedoch ausdrücklich auch auf den Abschnitt „1. Operative Phase“.
Zielorientierung der Leitlinie
Ziel der Leitlinie ist es, die Versorgung von Polytrauma-Patienten bzw. Schwerverletzten zu verbessern. Die Empfehlungen sollen zur Optimierung der Struktur- und Prozessqualität in der Klinik sowie in der präklinischen Versorgung beitragen. Deren Umsetzung soll helfen, die Ergebnisqualität, gemessen an Letalität oder Lebensqualität, zu verbessern. Die Leitlinie soll außerdem aus interdisziplinärer Sicht Hilfe zur Entscheidungsfindung in spezifischen Situationen geben, die auf dem aktuellen Stand der Wissenschaft und auf Verfahren beruhen, die sich in der Praxis bewährt haben. Sie soll auch Grundlage für die interdisziplinäre Zusammenarbeit bei der Versorgung von Schwerverletzten sein und zur Optimierung der prä- und innerklinischen Struktur- und Prozessqualität beitragen.
Anwenderzielgruppe
Die Leitlinie richtet sich an die an der Versorgung polytraumatisierter oder schwer verletzter Patientinnen und Patienten beteiligten Ärztinnen und Ärzte sowie an alle anderen an der Versorgung beteiligten medizinischen Berufsgruppen. Die Empfehlungen beziehen sich in erster Linie auf erwachsene Patienten. Empfehlungen zur Versorgung von Kindern und Jugendlichen werden in der Leitlinie aber neuerdings an einigen Stellen gegeben.
Methodisches Vorgehen
Nach den Statuten der AWMF [2, 3] stehen Leitlinien der Stufe S3 an der Spitze der Hierarchie medizinscher Leitlinien und sind sowohl evidenz- als auch konsensbasiert. Leitlinien der Stufe S3 enthalten alle Elemente der systematischen Entwicklung. Dazu gehört auch, dass sie von einer Leitliniengruppe konsentiert werden, die repräsentativ für den Adressatenkreis ist. An dieser S3-Leitlinie waren 20 Fachgesellschaften/Organisationen (Tabelle) und insgesamt über 160 Autoren beteiligt. Methodisch wurde die Leitliniengruppe von Mitarbeitern des Instituts für Forschung in der Operativen Medizin (IFOM) unterstützt. Insgesamt wurden über 2.500 wissenschaftliche Arbeiten zitiert.
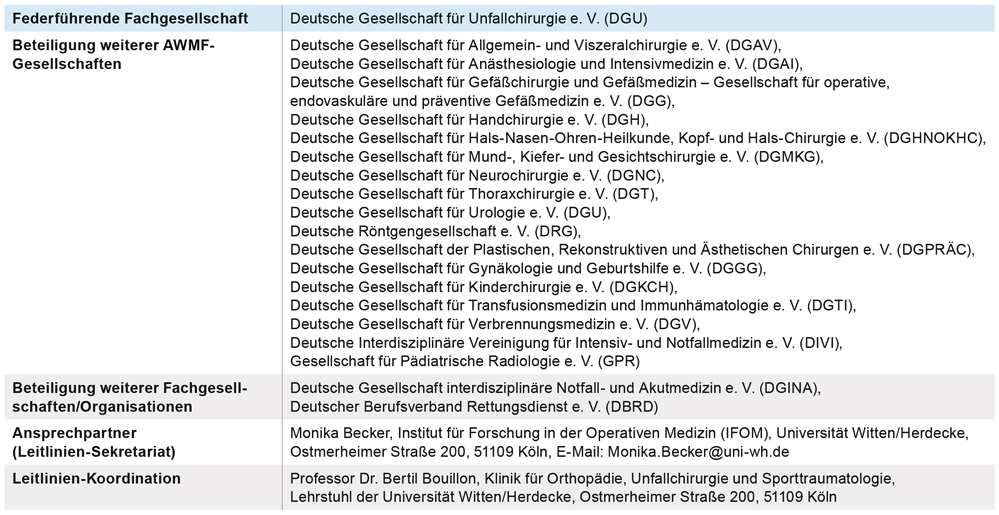
Tabelle: Mitwirkende Fachgesellschaften. Eine namentliche Liste aller beteiligter Autoren und deren Anschrift ist der Langfassung der Leitlinie zu entnehmen [1].
Die formale Konsensbildung folgt einer stringenten Methodik, die in der Einleitung der Langfassung [1] und begleitenden Leitlinien-Report [4] detailliert beschreiben ist.
Grundlage der Konsensbildung sind die in der wissenschaftlichen Literatur verfügbaren Belege zu den als relevant erachteten klinischen Fragen (sogenannte Evidenz). Die Evidenz wird nach definierten Kriterien hinsichtlich ihrer methodischen und wissenschaftlichen Qualität bewertet und mit sogenannten Evidenzgraden (Level of Evidence, LoE) klassifiziert [5].
Der Evidenzlevel ist ein Maß für die Sicherheit des Wissens und liefert die Grundlage für den Empfehlungsgrad (Grade of Recommendation, GoR). Der GoR ist das Maß der „Restunsicherheit“ bei der Bewertung der Evidenz durch die Leitliniengruppe ist und erfolgt in Abwägung erwünschter oder unerwünschter Konsequenzen bei der Anwendung alternativer Vorgehensweisen. Der Empfehlungsgrad wird aber nicht ausschließlich vom Evidenzlevel bestimmt. In den GoR fließt auch das klinische Werteurteil der Leitliniengruppe ein. Daraus ergibt sich, dass Evidenzgrad und Empfehlungsstärke in begründeten Fällen voneinander abweichen können.
Anhand des Empfehlungsgrades lassen sich drei Arten von Kernempfehlungen unterscheiden:
1. Starke Empfehlungen (GoR A; „soll“)
2. Empfehlungen (GoR B; „sollte“)
3. Empfehlungen, die nach Evidenzlage offen bleiben (GoR 0; „ist unklar“, „kann erwogen werden“).
In Fragen, zu denen keine Evidenz verfügbar ist, können Empfehlungen auf der Basis einer konsentierten Expertenmeinung formuliert werden, sogenannte Good (Clinical) Practice Point (GPP). Diese Empfehlungen verwenden aber auch die Wortwahl der evidenzgestützten Empfehlungen (soll/sollte/kann).
Die Langfassung der S3-Leitlinie Polytrauma/ Schwerverletzten-Behandlung enthält insgesamt 307 Kernempfehlungen, die hier nicht vollumfänglich abgehandelt werden können. Die komplette Leitlinie kann kostenfrei auf der Homepage der AWMF unter www.awmf.org/leitlinien/detail/ll/012-019.html heruntergeladen werden.
Ausgewählte Kernempfehlungen
Im Folgenden wird eine Auswahl der wichtigsten Änderungen in den Kernempfehlungen des Abschnittes „Präklinik“ und „Schockraum“ aufgelistet und kurz anhand einer Zusammenfassung des Begleittextes der jeweiligen Kernempfehlung erläutert. Für die vollumfänglichen Erläuterungen, die dazugehörigen Literaturstellen und alle übrigen Kernempfehlungen sei auf die Langfassung verwiesen [1].
Neben dem Empfehlungsgrad (GoR) wird auch angegeben, ob sie in der aktualisierten Leitlinie neu erschienen sind (neu 2016) oder modifiziert wurden (modifiziert 2016). Sofern zutreffend wird auch angegeben, ob sich der GoR aufgrund neuer Erkenntnisse verändert hat (Heraufstufung oder Herabstufung).
Schlüsselempfehlung 1.17: Atemwegsmanagement, Beatmung und Notfallnarkose
Die Videolaryngoskopie sollte zur besseren Einstellbarkeit der Stimmbandebene und Optimierung des primären Intubationserfolges präklinisch und innerklinisch großzügig in Betracht gezogen werden (GoR B, neu 2016).
Studien zeigen, dass der Intubationserfolg im ersten Versuch durch den primären Einsatz der Videolaryngoskopie (VL) deutlich verbessert werden kann. Er ist abhängig von der Einstellbarkeit der Stimmbandebene, was mittels VL offenbar besser gelingt. Ähnliche Ergebnisse werden für die prähospitale Anwendung berichtet. Auch konnte in einer prospektiven Beobachtungsstudie gezeigt werden, dass sich durch den Einsatz von VL die Häufigkeit kurzzeitiger ösophagealer Fehlintubationen bei der Intubation von Traumapatienten einer Notaufnahme signifikant reduzieren ließ. Die Experten formulierten daher zusätzlich noch einen GPP, nachdem die VL daher sowohl als Primär- bzw. Reserveverfahren prähospital als auch innerklinisch vorgehalten und eingesetzt werden soll.
Schlüsselempfehlung 1.36: Thorax
Die Verdachtsdiagnose Spannungspneumothorax sollte gestellt werden bei einseitig fehlendem Atemgeräusch bei der Auskultation der Lunge (nach Kontrolle der korrekten Tubuslage) und dem zusätzlichen Vorliegen von typischen Symptomen, insbesondere einer schweren respiratorischen oder zirkulatorischen Störung (GoR B, modifiziert 2016).
Ein Spannungspneumothorax ist eine akut lebensbedrohliche Störung, die bereits während der Prähospitalphase auch ohne Inanspruchnahme weiterer diagnostischer Mittel zu erkennen und durch die Dekompression der Pleurahöhle umgehend zu beseitigen ist. Die diagnostischen Kriterien dieser rein klinisch zu stellenden Diagnose wurden nun modifiziert: Dabei wurden die oberen Einflussstauungen in Kombination mit einer arteriellen Hypotension als ein typisches Symptom gestrichen. Grund für die Empfehlung ist eine aktuelle Meta-Analyse der klinischen Symptomatik des Spannungspneumothorax, nach der eine obere Einflussstauung tatsächlich nur selten beobachtet wird. Typisch sind hingegen respiratorische Insuffizienz und/oder Störungen der Kreislauffunktion zusammen mit einem abgeschwächten Atemgeräusch.
Schlüsselempfehlung 1.19: Volumentherapie
Bei schwer verletzten Patienten sollte eine Volumentherapie eingeleitet werden, die bei unkontrollierbaren Blutungen in reduzierter Form durchgeführt werden sollte, um den Kreislauf auf niedrig-stabilem Niveau zu halten und die Blutung nicht zu verstärken (GoR B, unverändert konsentiert 2016).
Schlüsselempfehlung 1.20: Volumentherapie
Bei hypotensiven Patienten mit einem Schädel-Hirn-Trauma sollte eine Volumentherapie mit dem Ziel der Normotension durchgeführt werden (GoR B, unverändert konsentiert 2016).
Aufgrund pathophysiologischer Überlegungen und retrospektiver Vergleiche wird bei massiv blutenden Patienten ein systolischer Blutdruck von 90 mmHg bzw. ein arterieller Mitteldruck (MAP; RRdiast + ⅓ (RRsyst – RRdiast)) von 65 mmHg als Zielwert empfohlen. Anhand von Daten des TraumaRegisters DGU® konnte gezeigt werden, dass mit zunehmender präklinischer Flüssigkeitstherapie häufiger eine Koagulopathie auftritt. Die Erkenntnis, dass eine forcierte Volumengabe sich ungünstig auf Gerinnungssituation und Überleben auswirkt, gilt als allgemein akzeptiert. Die verfügbaren Studien weisen jedoch ein hohes Risiko für einen Selektions-Bias auf und zeigen große klinische Heterogenität. Die Sicherheit einer restriktiven Flüssigkeitstherapie konnte in einer aktuelleren prospektiven, randomisierten Studie gezeigt werden, die aber nicht dafür geplant war, die Überlegenheit dieser Therapie zu belegen.
Bei Patienten mit unkontrollierbarer Blutung sollte eine moderate Volumentherapie mit einer kontrollierten (oder permissiven) Hypotension und einem systolischen Blutdruck um 90 mmHg angestrebt werden. Bei Patienten mit kardialer Schädigung oder Schädel-Hirn-Trauma (SHT) wird dies aber kritisch gesehen. Eine permissive Hypotension sollte bei älteren Patienten und solchen mit bekanntem arteriellem Hypertonus nur mit Vorsicht erwogen werden. Es handelt sich um eine zeitlich limitierte Option, die nur bis zur chirurgischen Blutstillung erfolgen soll. In Situationen mit unkontrollierbarer intrathorakaler oder intraabdomineller Blutung sollte so rasch wie möglich die chirurgische Therapie erfolgen und diese nicht durch präklinische Maßnahmen verzögert werden. Der Einsatz von Katecholaminen wird grundsätzlich kritisch gesehen und als ultima ratio betrachtet.
Schlüsselempfehlung 2.101: Damage Control Resuscitation
Bei der Kombination von hämorrhagischem Schock und Schädel-Hirn-Trauma (Glasgow Coma Scale/GCS < 9) und/oder spinalem Trauma mit neurologischer Symptomatik sollte der MAP 85 bis 90 mmHg betragen (GoR B, neu 2016).
Während es unstrittig ist, dass bei hämorrhagischem Schock in Kombination mit SHT (GCS ≤ 8) ein höherer Blutdruck zur Perfusion nötig ist, ist die Kombination mit spinalem Trauma und Neurologie nicht eindeutig klar. Retrospektive Datenauswertungen und andere Leitlinien sprechen sich jedoch für einen MAP von 85 bis 90 mmHg aus.
Schlüsselempfehlung 1.23: Volumentherapie
Zur Volumentherapie bei Traumapatienten sollten Kristalloide eingesetzt werden (GoR B, modifiziert 2016).
Schlüsselempfehlung 1.24: Volumentherapie
Isotone Kochsalzlösung soll nicht verwendet werden (GoR A, modifiziert 2016, Heraufstufung von GoR B).
Schlüsselempfehlung 1.25: Volumentherapie
Balancierte kristalloide, isotone Vollelektrolytlösungen sollten verwendet werden (GoR B, modifiziert 2016).
Schlüsselempfehlung 1.26: Volumentherapie
Balancierte Infusionslösungen mit Acetat oder Malat statt Lactat können erwogen werden (GoR 0, modifiziert 2016, Herabstufung von GoR B).
Die Empfehlungen für den Volumenersatz wurden umformuliert und damit die Bedeutung von kristalloiden, isotonen Vollelektrolytlösungen gestärkt. Einig waren sich die Experten, dass die Verwendung von isotoner Kochsalzlösung nicht empfohlen wird. Hier erfolgte sogar eine Heraufstufung der Empfehlung von GoR B auf GoR A. Vorteile für eine bestimmte Art des Anions basieren auf tierexperimentellen Daten. Neue Evidenz konnte nicht aufgeboten werden. Daher wurde die Empfehlung auf GoR 0 herabgestuft. Die Wahl der zu verwendenden Infusionslösung wurde über Jahre kontrovers diskutiert. Insbesondere der Einsatz von Kolloiden war Gegenstand intensiver Diskussionen. Im Jahr 2013 wurde der Einsatz von Hydroxyethylstärke (HES) in Infusionslösungen durch das Bundesinstitut für Arzneimittel und Medizinprodukte deutlich eingeschränkt. In der derzeitigen Leitlinie wurde die bisherige GoR B-Empfehlung von HES als kolloidales Volumenersatzmittel bei hypotensiven Traumapatienen gestrichen. Mit dem Rückzug der HES-Präparate hat sich auch die Verfügbarkeit der hypertonen Lösungen verändert und diese haben damit an Bedeutung verloren. Die Empfehlungen zum Einsatz hypertoner Lösungen beim penetrierenden Trauma wurde aufgrund dieser Entwicklung ebenfalls von GoR B auf GoR 0 herabgestuft.
Schlüsselempfehlung 1.62: Offene Frakturen
Aktive Blutungen sollen durch folgendes Stufenschema behandelt werden:
1. manuelle Kompression
2. Kompressionsverband
3. Tourniquet
(GoR A, modifiziert 2016, Heraufstufung von GoR B)
Schlüsselempfehlung 1.63: Offene Frakturen
Wenn vorangegangene Maßnahmen nicht erfolgreich sind, dann können Hämostyptika ergänzend angewendet werden (GoR 0, neu 2016).
Schlüsselempfehlung 1.64: Offene Frakturen
Ein Tourniquet sollte sofort angewendet werden bei:
- Lebensgefährlichen Blutungen/multiplen Blutungsquellen an einer Extremität,
- Nichterreichbarkeit der eigentlichen Verletzung,
- mehreren Verletzten mit Blutungen,
- schwerer Blutung der Extremitäten bei gleichzeitigem kritischem A-, B- oder C-Problem,
- Unmöglichkeit der Blutstillung durch andere Maßnahmen,
- schweren Blutungen an Extremitäten bei Zeitdruck unter Gefahrensituationen
(GoR B, modifiziert 2016).
Maßnahmen zur Kontrolle starker Blutungen an den Extremitäten sollen nach einem eskalierenden Schema folgen: Primär soll versucht werden, aktive Blutungen durch manuelle Kompression und Hochlagerung der Extremität zu stoppen. Anschließend soll ein Druckverband angelegt werden. Bei weiterer Persistenz soll versucht werden, eine Arterie proximal der Verletzung abzudrücken. Des Weiteren soll, sofern möglich, ein Tourniquet angelegt werden. Eine retrospektive Studie an Patienten mit traumatischer Amputation oder schwere Gefäßverletzung an den Extremitäten konnte zeigen, dass der präklinische Gebrauch von Tourniquets zu einer besseren Blutungskontrolle führt; dies trifft insbesondere für Patienten mit einem Injury Severity Score (ISS) über 15 Punkte zu. Eine verringerte Mortalität konnte allerdings nicht beobachtet werden. Eine andere Studie zeigt aber, dass der Einsatz von Tourniquets mit einer höheren Überlebenswahrscheinlichkeit verbunden ist, insbesondere, wenn die Anwendung frühzeitig, noch vor der Entstehung eines Schocks erfolgt. Die Anlage eines Tourniquets ist aber lediglich als temporäre Maßnahme anzusehen, um initial eine schnelle und effektive Blutstillung durchzuführen. Hinweise zur korrekten Anwendung von Tourniquets finden sich in der S3-Leitlinie oder der dort zitierten Literatur.
Hämostyptika sind additiv anwendbare, lokal wirksame Substanzen, die die Blutstillung beschleunigen sollen. Im Wesentlichen lassen sich zwei grundsätzliche Wirkweisen unterscheiden: physikalisch gewebe-adhärent und die Gefäßverletzung verschließend (mucoadhäsiv) oder gerinnungsfördernd durch Flüssigkeitsabsorption, Konzentration von prokoagulatorischen Faktoren und direkte Gerinnungsaktivierung. Eine Beurteilung des Nutzens von Hämostyptika ist schwierig und aufgrund der unterschiedlichen hämostatischen Wirksamkeit der Produkte bei unterschiedlichen Blutungsmodellen (arteriell, venös, arterio-venös) kaum zu vergleichen. Ernüchternd sind außerdem Studienergebnisse, nach denen auch einfache, kostengünstigere Verbandgazen, die gleichen positiven Ergebnisse erzielen wie die zu vergleichenden Hämostyptika. Diese Beobachtungen zeigen, dass das Hauptaugenmerk in der Behandlung von penetrierenden, blutenden Wunden auf das geschulte Einlegen („wound packing“) der Wundgazen oder des Hämostyptikums und des zu applizierenden Druckes liegen muss.
Schlüsselempfehlung 1.53: Wirbelsäule
Die Halswirbelsäule soll bei der schnellen und schonenden Rettung vor der eigentlichen technischen Rettung immobilisiert werden. Die Notwendigkeit zur Sofortrettung (zum Beispiel Feuer/Explosionsgefahr) stellt eine Ausnahme dar (GPP, modifiziert 2016, Herabstufung von GoR A).
Die Immobilisierung der Wirbelsäule orientiert sich am Zustand des Patienten. Obwohl eine Reihe von prähospital anwendbaren Entscheidungshilfen existieren, die helfen sollen eine Wirbelsäulenverletzung auszuschließen, wurden die bisherigen Empfehlungen, die Kriterien für einen sicheren Ausschluss solcher Verletzungen angeboten haben, gestrichen und finden sich nur noch im Erläuterungstext wieder. Bei akuter Lebensgefahr kann eine sofortige Rettung ohne Immobilisierung der Wirbelsäule durchgeführt werden. Bei der schnellen Rettung soll die Manipulation an der Wirbelsäule minimiert werden. Die Immobilisierung der Halswirbelsäule (HWS) sollte durch eine Zervikalstütze erfolgen, auch wenn der Nutzen dieses Vorgehens zur Vermeidung eines Sekundärschadens durch die Literatur bisher nicht belegt ist. Bei der schonenden Rettung (zum Beispiel durch Abnahme eines PKW-Daches) sollte eine strikte Immobilisierung der Wirbelsäule erfolgen.
Mangels Evidenz konnte aber keine Kernempfehlung für die Art der Durchführung der Wirbelsäulenimmobilisation bei der prähospitalen Versorgung ausgesprochen werden. Im Erläuterungstext wird ausgeführt, dass als erste präklinische Maßnahme am Unfallverletzten die Immobilisierung der HWS manuell oder mit einer Zervikalstütze erfolgen sollte, auch wenn es hierzu keine Studien mit hohem Evidenzlevel gibt. Bei der alleinigen Immobilisation der HWS durch eine Zervikalstütze verbleibt eine Restbeweglichkeit. Die Ruhigstellung der HWS kann durch Lagerung auf der Vakuummatratze zusätzlich verbessert werden. Die Experten bewerten die Vakuummatratze als das derzeit effektivste Mittel zur Immobilisation für die gesamte Wirbelsäule. Dabei wird durch Einbeziehung des Kopfes mit hohen Kissen oder Gurten die mögliche Restbewegung der HWS weiter eingeschränkt. Bisher liegt keine randomisierte Studie vor, die einen positiven Effekt der Immobilisierung der Wirbelsäule beweist. Andere Hilfsmittel wie die Schaufeltrage können die Wirbelsäule nur eingeschränkt immobilisieren. An anderer Stelle wird der Nutzen von Hilfsmitteln wie Schaufeltrage oder Spineboard nur als Erleichterung der Rettung eines Wirbelsäulenverletzten aus ungünstiger Schadensortlage bewertet.
Schlüsselempfehlung 1.67: Transport und Zielklinik
Die Luftrettung sollte zur präklinischen Versorgung Schwerverletzter primär eingesetzt werden. Einsatztaktische Gesichtspunkte und der Faktor Zeit sind zu berücksichtigen (GoR B, modifiziert 2016, Heraufstufung von GoR 0).
Ob der Einsatz der Luftrettung tatsächlich zu einer Reduktion der Mortalität führt, blieb lange umstritten. Neuere Arbeiten scheinen zumindest für Deutschland positive Effekte aufzuzeigen. Obwohl sich im Vergleich mit bodengebundener Rettung die präklinische Versorgungszeit bei Luftrettungseinsätzen um ca. 16 Minuten verlängert, finden sich einige Studien, die zeigen, dass sich aus dem Einsatz der Luftrettung klare Vorteile für das Überleben der Patienten ergeben, wenngleich die Ursachen unklar bleiben. Die Erreichbarkeit spezialisierter Zentren über größere Distanzen wird als eine mögliche Erklärung angeführt. Auch geht es nicht mehr darum, die Sinnhaftigkeit der Luftrettung als solche zu bestätigen, sondern zum Beispiel die Frage der Ausdehnung der Einsatzzeiten auf 24 Stunden zu untersuchen.

Die Luftrettung sollte zur präklinischen Versorgung Schwerverletzter primär eingesetzt werden.
Schlüsselempfehlung 2.46: Becken
Bei instabilem Beckenring und hämodynamischer Instabilität soll eine mechanische Notfallstabilisierung vorgenommen werden (GoR A, modifiziert 2016, Heraufstufung von GoR B).
Eine Aufwertung hat die Empfehlung zur Notfallstabilisierung des instabilen Beckenrings bei hämodynamischer Instabilität erhalten. Hier wurde als wesentliche Veränderung festgestellt, dass sich in den vergangenen Jahren die Anwendung von Beckengurten und anderen nicht-invasiven externen Stabilisierungen zunehmend auch in der Präklinik etabliert haben. Folge ist ein deutlich früherer Therapiebeginn durch eine effektive Notfallstabilisierung. Die Initiierung der nicht-invasiven Stabilisierung erfolgt meist bereits aufgrund der Unfallkinematik und hilft, den Patienten mit pelviner Blutung deutlich früher zu stabilisieren und zu therapieren.
Schlüsselempfehlung 2.47: Becken
Bei persistierender Blutung sollte eine chirurgische Blutstillung und/oder selektive Angiografie mit anschließender Angioembolisation erfolgen (GoR B, modifiziert 2016).
Aus Mangel an hochrangiger Evidenz sowohl auf Seiten der Tamponade als auch auf Seiten der Embolisation kann letztlich keine ausschließliche Empfehlung gegeben werden. Entscheidend ist vielmehr, dass ein Eingriff zur Stabilisierung des Patienten angewendet werden muss, da ein unnötiges Abwarten das Outcome des Patienten verschlechtert. Es ist letztlich zu postulieren, dass die chirurgische Blutstillung (packing + externe Stabilisierung) und die Angioembolisation keine konkurrierenden, sondern ergänzende Verfahren mit unterschiedlichem Fokus darstellen. Welchem Verfahren jeweils der Vorzug gegeben wird, ist sicherlich auch von den lokalen Verhältnissen abhängig. Besonders berücksichtigt werden sollte neben der Verfügbarkeit der Embolisation der Umstand, dass während dieses Vorganges keine anderen Maßnahmen an dem Patienten parallel durchgeführt werden können.
Schlüsselempfehlung 2.88: Reanimation
Wird ein Spannungspneumothorax vermutet, soll bei Patienten mit traumabedingtem Herzkreislaufstillstand eine beidseitige Entlastung mittels Minithorakotomie vorgenommen werden (GoR GPP, neu 2016).
Ein Spannungspneumothorax ist die häufigste behandelbare Ursache eines traumatisch bedingten Kreislaufstillstands (TCA) und soll während der kardiopulmonalen Reanimation (CPR) ausgeschlossen oder beseitigt werden. 13 Prozent der schwerverletzten Patienten mit Spannungspneumothorax entwickeln im Verlauf einen traumatisch bedingten Herzkreislaufstillstand. Die Befunde umfassen Symptome der hämodynamischen Instabilität (Hypotonie, Kreislaufstillstand) und Hinweise auf einen Pneumothorax (vorausgegangene Atemnot, Hypoxie, einseitiges Fehlen von Atemgeräuschen bei der Auskultation, subkutanes Emphysem) oder eine Mediastinalverlagerung (Tracheadeviation und Stauung der Jugularvenen). Während der CPR sind diese Zeichen nicht immer klassisch. Bei intubierten Patienten sollte gegebenenfalls die Tubuslage bei der Untersuchung verifiziert werden, um Fehlinterpretationen bei einseitig tiefer Tubuslage zu vermeiden. Zur effektiven Behandlung des Spannungspneumothorax bei traumatisch bedingtem Kreislaufstillstand gehören die endotracheale Intubation, eine Überdruckbeatmung und eine Form von Druckentlastung. Die Inzision und das rasche Eröffnen des Pleuraraumes bei überdruckbeatmeten Patienten ist zunächst ausreichend. Da für die Einlage der Thoraxdrainage mehr Material und Zeit benötigt wird, reicht es, sie erst nach der primären Wiederbelebung zu platzieren. Zudem können Thoraxdrainagen verstopfen (Blutgerinnsel, Lungengewebe) oder abknicken.
Schlüsselempfehlung 2.92: Reanimation
Vor Abbruch der Reanimationsmaßnahmen sollen alle potenziell reversiblen Ursachen eines traumatischen Herzkreislaufstillstandes ausgeschlossen oder behandelt sein (GoR GPP, neu 2016).
Der Erfolg einer kardiopulmonalen Reanimation bei TCA-Patienten ist zum einen abhängig von der bereits vorliegenden Dauer des Herzkreislaufstillstandes und zum anderen von der Möglichkeit, während der Reanimation traumaspezifische Ursachen des Herzkreislaufstillstandes zu beseitigen (Pneumothorax, Hypovolämie, Perikardtamponade, Lungenembolie). Trotz Umsetzung der zuvor aufgeführten therapeutischen Maßnahmen (zum Beispiel Minithorakotomie) zur Beseitigung traumaspezifischer Ursachen des Herzkreislaufstillstandes kann die kardiopulmonale Reanimation frustran verlaufen. Lassen sich während der kardiopulmonalen Reanimation keine reversiblen Ursachen feststellen oder führt deren Beseitigung nicht zum Wiedereintritt einer spontanen Kreislauffunktion, dann soll die Reanimation abgebrochen werden.
Schlüsselempfehlung 2.96: Reanimation
Im Einzelfall kann bei polytraumatisierten Patienten mit therapierefraktärem Kreislaufstillstand eine extrakorporale Zirkulation und Oxygenierung erwogen werden (GoR 0, neu 2016).
Studien zeigen an ausgewählten Patienten den erfolgreichen Einsatz extrakorporaler Unterstützungsverfahren (ECLS). Abhängig von der Verletzungsschwere kann das Verfahren bei therapierefraktärem Herzkreislaufstillstand und/oder pulmonalem Versagen überbrückend eine geeignete hämodynamische Unterstützung darstellen. Ein erfolgreiches ECLS-Programm benötigt eine adäquate Struktur und ein multidisziplinäres Team. Ausrüstung, Personal und weitere Ressourcen (zum Beispiel ausreichende Verfügbarkeit von Blutprodukten) müssen rund um die Uhr gewährleistet sein. Die Entscheidung zur ECLS-Implantation sollte sorgsam unter Berücksichtigung aller Fakten geplant werden. Patienten mit intrakranieller Blutung (zum Beispiel Blutungszunahme) oder Aortendissektion (zum Beispiel Herz-/Gefäßverletzungen) haben ein erhöhtes Risiko bei ECLS-Therapie.
Schlüsselempfehlung 2.112: Gerinnung
Bei massiv blutenden Patienten soll möglichst frühzeitig die Gabe von 1 g Tranexamsäure (TxA) über zehn Minuten, gegebenenfalls gefolgt von einer Infusion von 1 g über acht Stunden, erfolgen (GoR A, neu 2016).
Schlüsselempfehlung 2.113: Gerinnung
Bei massiv blutenden Patienten kann die prähospitale Gabe von Tranexamsäure sinnvoll sein (GoR 0, neu 2016).
Schlüsselempfehlung 2.114: Gerinnung
Mehr als drei Stunden nach dem Trauma sollte mit der Gabe von Tranexamsäure nicht mehr begonnen werden (außer bei nachgewiesener Hyperfibrinolyse) (GoR B, neu 2016).
Eine Hyperfibrinolyse scheint bei Polytraumata häufiger als bisher angenommen vorhanden zu sein (knapp 20 Prozent bis zu 60 Prozent). Deren Ausmaß korreliert mit der Schwere der Verletzung und einer höheren Sterblichkeit. Eine zeitnahe Diagnose einer Hyperfibrinolyse und auch der Effektivität einer antifibrinolytischen Therapie sind nur mittels Thrombelastografie/-metrie möglich. Die Gabe des Antifibrinolytikums muss in ein therapeutisches Gesamtkonzept der Therapie der Koagulopathie einbezogen werden, da es im Rahmen der Hyperfibrinolyse häufig zu einem starken Verbrauch von Fibrinogen bis hin zur vollständigen Defibrinierung des Patienten kommen kann. Dieser Fibrinogenmangel muss nach Durchbrechen der Hyperfibrinolyse entsprechend ausgeglichen werden, das heißt bei vermuteter Hyperfibrinolyse ist das Antifibrinolytikum vor dem Fibrinogen zu applizieren. Das Antifibrinolytikum Tranexamsäure ist ein synthetisches Lysin-Analogon, das die Umwandlung von Plasminogen in Plasmin hemmt, indem es die Bindung des Plasminogens an das Fibrinmolekül blockiert. In diesem Kontext wird auch der frühzeitige Einsatz viskoelastischer Testverfahren (Thrombelastographie) zur Diagnostik und Therapie der traumainduzierten Koagulopathie empfohlen. Der Vorteil besteht darin, dass das Testverfahren ohne Zeitverzögerung bereits im Schockraum durchführt werden kann.
Schlüsselempfehlung 2.126: Bildgebung
Im Rahmen der Diagnostik von Schwerverletzten soll eine zeitnahe Ganzkörper-Computertomografie (Kopf bis einschließlich Becken, kraniale Computertomografie (CCT) nativ) mit traumaspezifischem Protokoll durchgeführt werden (GoR A, neu 2016).
In einer multizentrischen Analyse von 4.621 Patienten des TraumaRegisters® DGU konnte 2009 erstmals gezeigt werden, dass die Durchführung einer Ganzkörper-Computertomografie (GKCT) im Rahmen der Schockraumphase einen signifikant positiven Effekt auf die Überlebenswahrscheinlichkeit hat. Hieraus errechnet sich eine „number needed to treat“ oder besser eine „number needed to scan“ von mindestens 32. Das bedeutet, dass jeder 32ste schwerverletzte Patient, bei dem eine GKCT durchgeführt wird, entgegen der Prognose überlebt. Im Rahmen einer weiteren Analyse des TraumaRegisters DGU® konnte im Jahr 2013 an einem Kollektiv von 16.719 Patienten bestätigt werden, dass schwer verletzte Patienten, bei denen initial eine GKCT durchgeführt wurde, eine Letalität von 17,4 Prozent aufwiesen verglichen mit 21,4 Prozent bei Patienten, bei denen keine GKCT durchgeführt wurde (p < 0,001).
Schlüsselempfehlung 2.128: Bildgebung
Der Computertomograf (CT) sollte im oder nahe am Schockraum lokalisiert sein (GoR B, neu 2016).
Anhand einer Analyse von 8.004 Patienten des TraumaRegisters DGU® und der TraumaNetzwerk-DGU®-Datenbank konnte nachgewiesen werden, dass die CT-Lokalisation einen signifikanten Effekt auf die Mortalität Polytraumatisierter hat. Je näher das CT im bzw. am Schockraum (< 50 m) lokalisiert ist, umso günstiger ist dieser Effekt. Die Lokalisation > 50 m Entfernung zum Schockraum hatte einen signifikant ungünstigen Effekt auf das Outcome. Im Rahmen von Neu- bzw. Umbauten von Notaufnahmen sollte das CT im oder baulich so nahe wie möglich (≤ 50 m) am Schockraum positioniert werden.
Schlüsselempfehlung 2.129: Bildgebung
Bei hämodynamisch instabilen Schwerverletzten kann unter bestimmten Voraussetzungen (hoher Organisationsgrad des Traumateams und entsprechende Infrastruktur) unmittelbar ein Ganzkörper-CT (GKCT) mit Kontrastmittel durchgeführt werden (Kopf bis einschließlich Becken, CCT nativ); (GoR 0, neu 2016).
Es konnte auch nachgewiesen werden, dass die Durchführung einer GKCT bei hämodynamisch instabilen Traumapatienten, also bei Patienten im Schock, sicher durchführbar ist. Die Überlebensrate der Patienten im schweren Kreislaufschock mit einem Blutdruck bei Klinikaufnahme von < 90 mmHg war bei den Patienten mit GKCT 42,1 Prozent verglichen mit 54,9 Prozent bei den Patienten ohne GKCT (p < 0,001). Es wird darauf hingewiesen, dass möglicherweise gerade Patienten im Schock von einer GKCT profitieren, da hierdurch die Ursache des Schocks schneller und umfassender detektiert werden kann. Daraus können dann rationale Therapiekonzepte, beispielsweise für oder auch gegen eine bestimmte Notfalloperation, abgeleitet werden. Es wird jedoch explizit darauf hingewiesen, dass eine derartige Diagnostik bei instabilen Patienten nur unter der Voraussetzung eines gut organisierten Traumateams und einer entsprechend guten Infrastruktur mit kurzen Wegen durchgeführt werden sollte.
Versorgung eines Schwerstverletzten im Schockraum des Klinikums rechts der Isar der Technischen Universität München.
Bewertung der S3-Leitlinie
Die Überarbeitung der S3-Leitlinie Polytrauma/Schwerverletztenversorung hat dazu geführt, dass über 90 Prozent der bisherigen Ausgaben dem aktuellen Stand der Wissenschaft angepasst und aktualisiert wurden. Die S3-Leitlinie erfüllt damit die Voraussetzungen, ein Instrument zur Verbesserung der Versorgung von Polytrauma-Patienten bzw. Schwerverletzten zu sein, Empfehlungen zur Optimierung der Struktur- und Prozessqualität in den Kliniken sowie in der präklinischen Versorgung auszusprechen und als Hilfsmittel für die Entscheidungsfindung in spezifischen Situationen und aus interdisziplinärer Sicht zu dienen. Es ist nun an allen an der Versorgung polytraumatisierter oder schwerverletzter Patienten beteiligten Ärztinnen und Ärzte sowie an allen anderen an der Versorgung beteiligten medizinischen Berufsgruppen, die Implementierung der Kernempfehlungen in die Versorgungspraxis voranzutreiben und ihren Beitrag zu leisten, die Versorgungsqualität der Versorgung von Polytrauma/Schwerverletzten weiter zu verbessern und diesen Anspruch zu überprüfen.
Leider musste sich der Überarbeitungsprozess auch der Realität wirtschaftlicher Zwänge unterwerfen. In der Konsequenz wurde zwar für die Kapitel „Massenanfall von Verletzten (MANV)“, „Schockraum – personelle und apparative Voraussetzungen“ und „Hand“ im Abschnitt „Erste operative Phase“ von der Leitliniengruppe ebenfalls ein Aktualisierungsbedarf angemeldet, jedoch konnte für diese Kapitel angesichts der schwindenden Finanzmittel und des durch die AWMF auferlegten Zeitplanes keine der Methodik genügenden Literaturbewertungen mehr vorgenommen werden. Hier wurden – ohne Anspruch auf Vollständigkeit – nur die Hintergrundtexte bearbeitet. Die Aktualisierung dieser Kapitel muss daher bis zum 30. Juni 2021, dem Tag des Ablaufs der Gültigkeit der aktuellen S3-Leitlinie, zurückgestellt werden. Für die nächste Überarbeitung ist außerdem die thematische Berücksichtigung der Kapitel „Analgesie“, „Damage Control Gefäße“ und ein gesondertes Kapitel zum Thema „Ausbildung (Hard & Soft Skills)“ geplant.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-ärzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Teilen:
Das könnte Sie auch interessieren: