Insgesamt ist die IPF eine seltene Erkrankung mit einer geschätzten Prävalenz von ca. 20 pro 100.000 Personen und einer geschätzten Inzidenz von fünf bis zehn pro 100.000 Personen pro Jahr. Bemerkenswert ist eine erhebliche Altersabhängigkeit, so kommt die Erkrankung kaum vor dem 40. Lebensjahr und häufig nach dem 65. Lebensjahr vor, im siebten Dezennium steigt die Prävalenz daher auf 150 bis 250 Fälle pro 100.000. Frauen sind seltener betroffen als Männer. Rauchen ist ein anerkannter Risikofaktor und erhöht die Wahrscheinlichkeit an einer IPF zu erkranken um den Faktor 2 bei einer kumulativen Belastung von mehr als 20 bis 30 Packungsjahren. Es ist hier allerdings erwähnenswert, dass etwa ein Drittel der IPF-Patienten Nie-Raucher sind und dass die Mehrzahl der tabakrauchbelasteten IPF-Patienten Ex-Raucher sind, die im Mittel bereits 20 Jahre nicht mehr aktiv rauchen [3]. Dies legt die Bedeutung weiterer prädisponierender, insbesondere genetischer Faktoren (zum Beispiel ein Polymorphismus des MUC5B Gens) nahe, die in letzter Zeit zunehmend identifiziert werden. Weitere exogene Faktoren, die potenziell das Risiko an einer IPF zu erkranken erhöhen, sind Holz- und Metallstäube. Darüber hinaus werden verschiedene Virusinfektionen mit der Ätiologie der IPF in Zusammenhang gebracht, ohne dass bisher Beweise für einen ätiologischen Zusammenhang vorliegen.
S2k-Leitlinie zur Diagnostik und Therapie der idiopathischen Lungenfibrose
 Lungenfibrose
Lungenfibrose
Die S2k-Leitlinie zur Diagnostik und Therapie der idiopathischen Lungenfibrose (idiopathische pulmonale Fibrose – IPF) befasst sich mit einer seltenen Lungenerkrankung, die sich jedoch durch einen besonders ungünstigen Verlauf auszeichnet (medianes Überleben nach Diagnosestellung zwei bis vier Jahre), und die in erhöhter Prävalenz (150 bis 250/100.000 Personen) in der siebten Lebensdekade eine erhebliche Relevanz im internistischen Patientengut aufweist [1].
Die Empfehlungen in der Leitlinie zur Diagnostik der IPF stellen einen wichtigen Fortschritt dar, da sie erstmals die Diagnosestellung anhand eines hochauflösenden Computertomogramms (HRCT) erlauben, während bisher die Histologie anhand einer chirurgischen Lungenbiopsie der diagnostische Goldstandard war. Die Komplexität des diagnostischen Algorithmus führt aber im Alltag zu Umsetzungsschwierigkeiten und zu Kritik.
Hinsichtlich der therapeutischen Angebote für IPF-Patienten stehen zwei zugelassene anti-fibrotische Medikamente zu Verfügung, sodass im Jahr 2017 ein Update der Empfehlungen zur pharmakologischen Therapie der IPF publiziert wurde, auf das aus Aktualitätsgründen Bezug genommen wird [2]. Erwähnenswert ist, dass auch eine Überarbeitung der Empfehlungen zur Diagnostik der IPF in einer internationalen Arbeitsgruppe vorbereitet wird, eine Neufassung ist für 2018 zu erwarten. Insgesamt ist das Thema der idiopathischen Lungenfibrose in raschem Wandel begriffen, weshalb die Leitlinien in immer kürzeren Intervallen überarbeitet werden.
Sind die Leitlinien aktuell? Wer gibt sie heraus?
Die aktuelle S2k-Leitlinie zur Diagnostik und Therapie der idiopathischen Lungenfibrose stammt vom Januar 2013 und wurde unter Schirmherrschaft der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin e. V. (DGP), von einer interdisziplinären Leitliniengruppe unter Einbeziehung von Vertretern der Deutschen Gesellschaft für Innere Medizin und der Deutschen Gesellschaft für Pathologie sowie von Patientenvertretern aus dem Lungenfibrose e. V. erarbeitet. Die Leitlinie wird von der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF) und der DGP herausgegeben. Aufgrund des raschen wissenschaftlichen Fortschritts bei dem Thema sind seit 2013 bereits viele neue Erkenntnisse hinzugekommen, sodass die Diagnosekriterien und der Algorithmus zur Diagnostik der IPF noch aktuell sind, während für die Pharmakotherapie seit Juli 2017 ein Update vorliegt.
Epidemiologie und Risikofaktor
Wie wird eine idiopathische Lungenfibrose diagnostiziert?
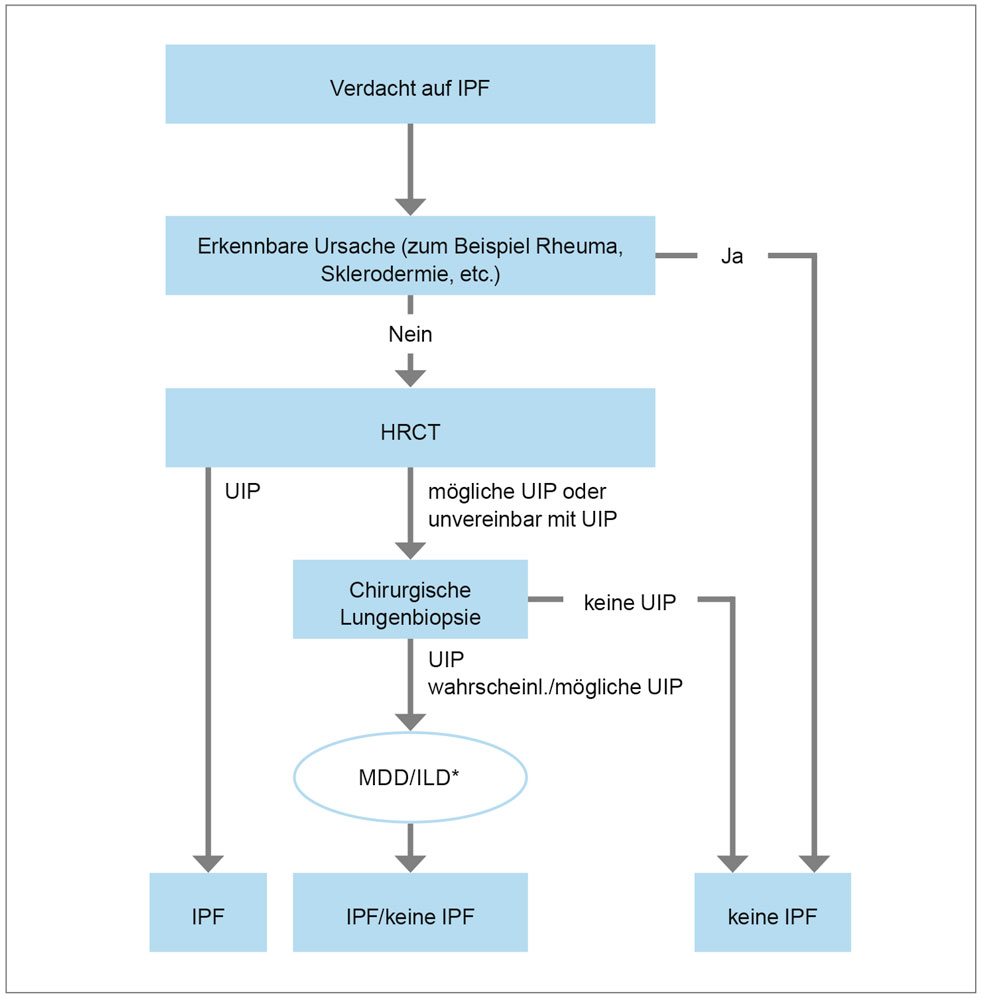
Abbildung 1: Diagnose-Algorithmus der IPF. * multidisziplinäre Diskussion unter Beteiligung von ILD-Experten
Klinisch geben die Patienten Atemnot bei Belastung und trockenen Husten an. Das inspiratorische Knisterrasseln, vor allem über der Lungenbasis auskultierbar, gibt einen wichtigen diagnostischen Hinweis und findet sich bei über 80 Prozent der IPF-Patienten. Die Basisdiagnostik umfasst neben der eingehenden körperlichen Untersuchung einschließlich Auskultation von Herz und Lungen, insbesondere eine Lungenfunktionsprüfung mit Diffusionsmessung und Blutgasanalyse sowie ein EKG und eine Röntgenaufnahme des Thorax in zwei Ebenen. Ausgangspunkt des diagnostischen Algorithmus auf eine IPF ist der Ausschluss möglicher bekannter Ursachen (Abbildung 1). Hierzu zählen insbesondere die Kollagenosen-assoziierten interstitiellen Lungenerkrankungen und die chronische exogen-allergische Alveolitis sowie Medikamenten induzierte pulmonale Veränderungen oder eine relevante Asbest Exposition. Ergeben sich hierfür belastbare Anhaltspunkte, so scheidet die Diagnose idiopathische Lungenfibrose aus. Andernfalls ist anhand des Befundmusters der hochauflösenden Computertomografie (HRCT) zu prüfen, ob ein typisches „Usual Interstitial Pneumonia“ (UIP)-Befundmuster vorliegt. Die hierfür erforderlichen Kriterien sind in Tabelle 1 aufgeführt und umfassen insbesondere das Vorliegen von interstitiellen retikulären Veränderungen, gegebenenfalls Traktionsbronchiektasen sowie Honigwabenbildung mit einer apico-basalen Zunahme in der Ausprägung der Veränderungen. Darüber hinaus sollten verschiedene andere Morphologien nicht vorgefunden werden; insbesondere ausgedehntes Milchglasmuster, Noduli oder Konsolidierungen sowie Zysten und Mosaikmuster sprechen gegen das Vorliegen einer IPF. Zeigt das HRCT ein typisches UIP-Muster, so kann nach Leitlinie bereits die Diagnose einer IPF gestellt werden. Dieser diagnostische Weg ist eine Neuerung gegenüber früheren Empfehlungen, bei denen eine sichere IPF-Diagnose nur anhand einer chirurgischen Lungenbiopsie mit UIP-Muster histologisch gestellt werden konnte. In der aktuellen Leitlinie ist die chirurgische Lungenbiopsie zur histologischen Diagnosesicherung nur für Patienten vorgesehen, bei denen das HRCT kein eindeutiges UIP-Muster ergibt. Dies ist für Patienten mit klassischem UIP-Muster im HRCT ein wichtiger Fortschritt, da er ihnen eine chirurgische Lungenbiopsie zur Diagnosesicherung erspart, welche mit einer relevanten perioperativen Morbidität und Mortalität (ca. zwei Prozent) assoziiert ist. Andererseits sieht der diagnostische Algorithmus für alle Patienten ohne typische UIP-Muster im HRCT die Durchführung der chirurgischen Lungenbiopsie vor, was in der klinischen Praxis häufig wegen der Schwere der Erkrankung oder wegen Co-Morbiditäten und Gesamtzustand der Patienten nicht durchführbar ist. Ein wesentlicher Kritikpunkt an der aktuellen IPF-Leitlinie hinsichtlich des diagnostischen Schemas ist daher die Tatsache, dass viele Patienten, bei denen im HRCT kein eindeutiges UIP-Muster vorgefunden wird, letztlich keine abschließende Diagnose gestellt werden kann, weil die geforderte chirurgische Lungenbiopsie zur Diagnosesicherung fehlt.
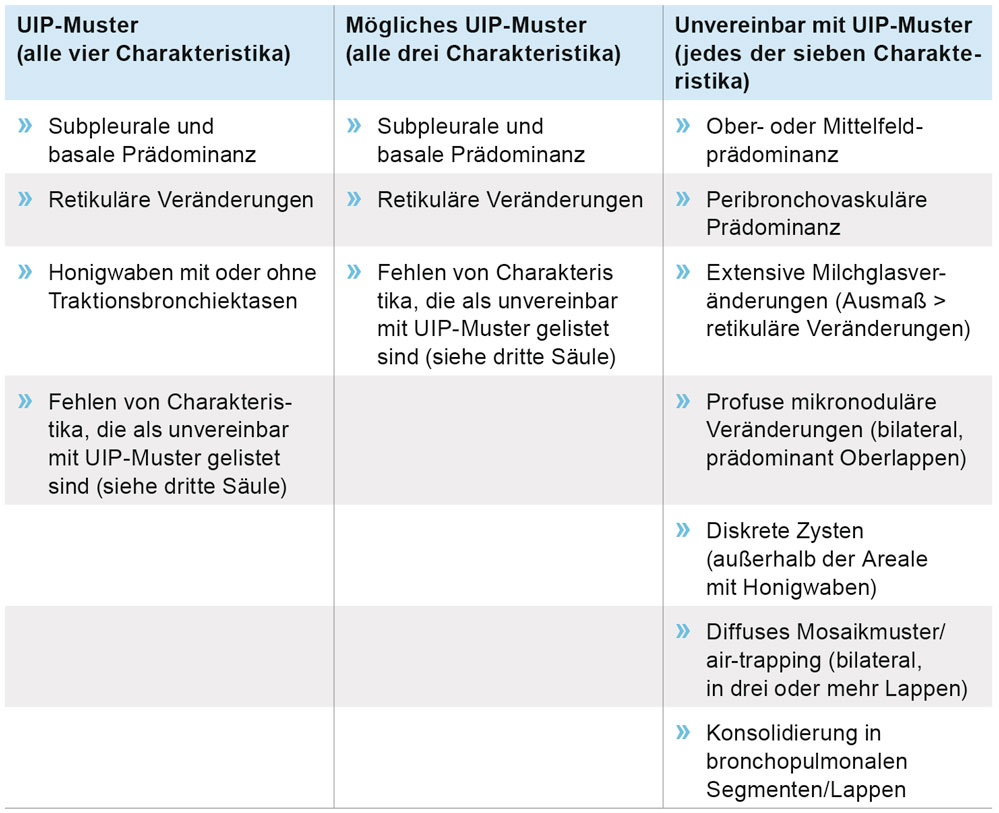
Tabelle 1: Hochauflösende CT-Kriterien für ein UIP-Muster. UIP = Usual interstitial Pneumonia
Darüber hinaus ergibt sich die Schwierigkeit wie mit Befunden umzugehen ist, wenn das Ergebnis der HRCT und der chirurgischen Lungenbiopsie nicht zur gleichen Aussage kommt. Dieses Problem wurde anhand einer Tabelle adressiert, die in Abhängigkeit vom Ergebnis der HRCT und der chirurgischen Lungenbiopsie Abstufungen in der Sicherheit der Diagnose einer IPF vornimmt (Tabelle 2). Demzufolge gibt es in Abhängigkeit von HRCT und Histologie die Diagnose einer IPF, aber auch die Diagnose einer wahrscheinlichen oder einer möglichen IPF. Hierbei lässt die Leitlinie offen, wie klinische Befunde, beispielsweise Alter und Geschlecht, die Vortestwahrscheinlichkeit von HRCT und Lungenbiopsie beeinflussen, was nach neueren Studien von großer Bedeutung ist [4]. Kritik an der Leitlinie wurde auch deshalb geäußert, weil für die Kategorien wahrscheinliche und mögliche IPF nicht klargestellt wurde, ob diese hinsichtlich therapeutischer Konsequenzen der idiopathischen Lungenfibrose gleichgestellt sind. Diese Entscheidung wurde letztendlich der zum Goldstandard erhobenen multidisziplinären Diskussion im „ILD-Board“ („Interstitial Lung Disease“ – Interstitielle Lungenerkrankung) übertragen. Zusammenfassend lässt sich daher feststellen, dass die aktuelle IPF-Leitlinie einen deutlichen Fortschritt hinsichtlich der Diagnostik der IPF erbracht hat, indem sie klare Kriterien für die Beurteilung des HRCTs und die Erkennung des UIP-Musters aufgestellt hat und so einen relevanten Teil der Patienten eine sichere Diagnose ermöglicht, ohne der Erfordernis einer chirurgischen Lungenbiopsie. Unklar bleibt die Leitlinie allerdings für Patienten, deren HRCT-Muster nicht eindeutig zu interpretieren ist, die aber auch einer chirurgischen Lungenbiopsie nicht unterzogen werden können, sodass die Diagnose nur mit eingeschränkter Wahrscheinlichkeit gestellt werden kann.
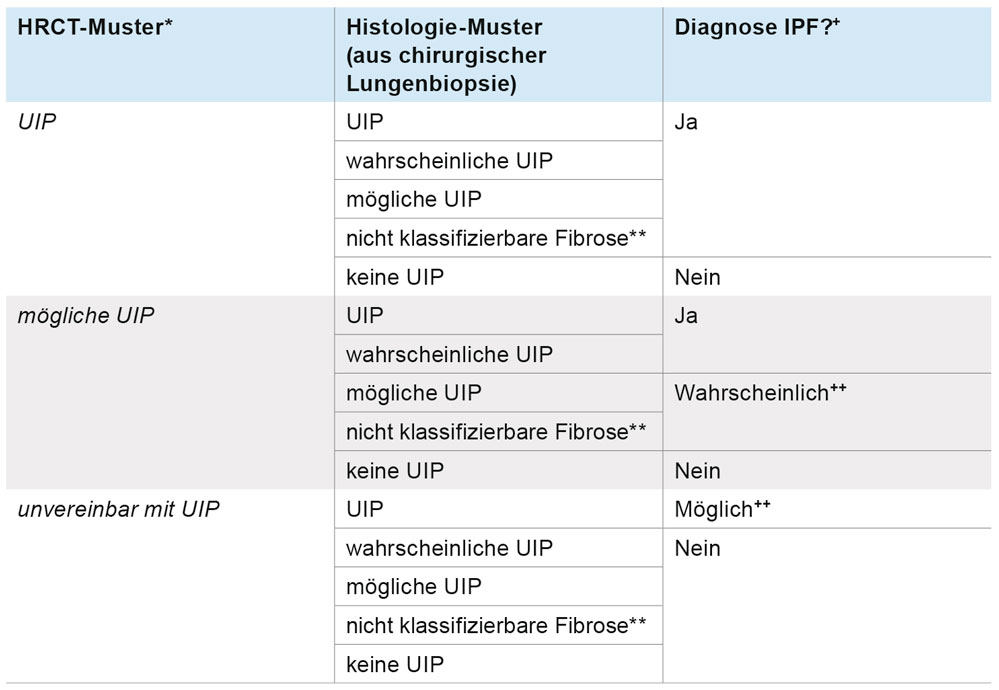
Tabelle 2: Kombination von HRCT und Histologie in der Diagnostik der IPF (multidisziplinäre Diskussion erforderlich). * HRCT-Muster siehe Tabelle 1; ** Nicht klassifizierbare Fibrose: Manche Biopsien können ein Fibrosemuster aufweisen, welches nicht den Kriterien des UIP-Musters oder der anderen idiopathischen interstitiellen Pneumonien entspricht. Diese Biopsien können als „nicht klassifizierbare Fibrose“ bezeichnet werden; + Die Sicherheit der IPF-Diagnose wird durch eine multidisziplinäre Diskussion verbessert. Dies ist besonders relevant in Fällen, bei denen die radiologischen und histologischen Muster diskordant sind (zum Beispiel HRCT unvereinbar mit UIP und histopathologisch UIP-Muster); ++ Die multidisziplinäre Diskussion sollte die Möglichkeit eines „sampling errors“ (einer nicht repräsentativen Biopsie) und die Möglichkeit einer unzureichenden HRCT-Technik diskutieren. Beachte: In Fällen mit einem HRCT-Muster, das als „unvereinbar mit UIP“ beurteilt wird, und einem UIP-Muster in der chirurgischen Lungenbiopsie, kann doch eine IPF-Diagnose vorliegen, und die Klärung durch eine multidisziplinäre Diskussion unter Beteiligung von ILD-Experten ist angezeigt.
Seit Publikation der aktuellen IPF-Leitlinie, welche die Bronchoskopie mit bronchoalveolärer Lavage im Rahmen der Differenzialdiagnose der idiopathischen Lungenfibrose empfiehlt, nicht jedoch die transbronchiale Zangenbiopsie aufgrund ihrer zu geringen Aussagekraft, ist mit der transbronchialen Kryobiopsie ein neues diagnostisches Verfahren in Erprobung. Die transbronchiale Kryobiopsie wird im Rahmen einer (meist starren) Bronchoskopie durchgeführt, wobei peripheres Lungengewebe an eine Kältesonde angefroren und aus dem Gewebeverbund gelöst wird. Dadurch werden größere Gewebestücke als mit der Zangenbiopsie geborgen, die eine Beurteilung der Lungenarchitektur erlauben, was für die Diagnosestellung eines histologischen UIP-Musters unabdingbar ist. Nach aktuellen Metaanalysen führt die transbronchiale Kryobiopsie in ca. 80 Prozent der Fälle zu einer histologischen Diagnose, Blutungen treten in ca. 40 Prozent und Pneumothoraces in ca. zehn Prozent der Untersuchungen auf. Die perinterventionelle Mortalität liegt weit unter einem Prozent [5].
Die Einbindung eines solchen Verfahrens in den Diagnosealgorithmus ist daher Gegenstand der aktuellen Diskussion in der Überarbeitung der bestehenden Leitlinie.
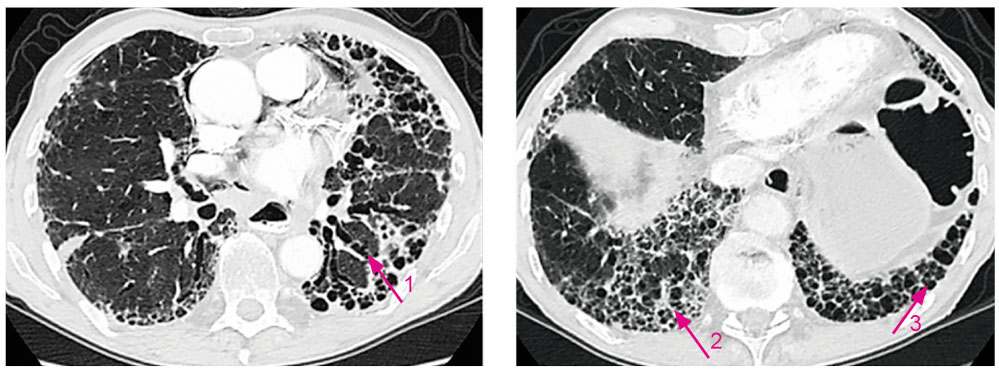
Abbildung 2: Typisches HRCT-Bild mit UIP-Muster. 1 = Traktionsbronchiektasie; 2 = Retikulation; 3 = Honigwaben
Verlauf und Prognose der IPF
Die idiopathische Lungenfibrose ist definiert als chronische, progredient verlaufende, fibrosierende interstitielle Pneumonie unbekannter Ursache, die auf die Lunge begrenzt ist und primär bei älteren Erwachsenen auftritt. Neben dem Ausschluss anderer Formen interstitieller Pneumonien ist der Nachweis des UIP-Musters in der hochauflösenden Computertomografie oder in einer chirurgischen Lungenbiopsie zur Diagnosestellung erforderlich. Der Spontanverlauf ist dementsprechend durch einen progressiven Umbau von normalem Alveolargewebe in Narbengewebe gekennzeichnet, der sich funktionell durch einen zunehmenden Verlust an Lungenvolumen, gemessen als forcierte Vitalkapazität (FVC), in seriellen Messungen erfassen lässt. Dieser jährliche Verlust an FVC beträgt beim Gesunden 25 bis 50 ml, beim IPF-Patienten jedoch 150 bis 250 ml [6]. Das mediane Überleben der Patienten nach Diagnosestellung liegt bei zwei bis vier Jahren, wobei die bestehende Funktionseinschränkung bei Diagnosestellung und der FVC-Verlust im Verlauf für die Prognose entscheidend sind [6]. Insbesondere ein Abfall der FVC um mehr als zehn Prozent des Sollwertes innerhalb von sechs bis zwölf Monaten erhöht das Mortalitätsrisiko in den folgenden zwölf Monaten um den Faktor 4 bis 8. Darüber hinaus ist zu beachten, dass es Schübe, sogenannte akute Exazerbationen, der IPF gibt, die innerhalb eines Monats zu einer starken Zunahme der Symptomatik mit Dyspnoe und neuauftretenden bilateralen Milchglastrübungen des Lungenparenchyms als Ausdruck eines Alveolarschadens eingehergehen [7]. Diese akuten Schübe der IPF treten mit einer Häufigkeit von fünf bis 15 Prozent pro Jahr auf und sind durch eine hohe Mortalität von ca. 50 Prozent in sechs Monaten und ca. 80 Prozent in zwölf Monaten gekennzeichnet. Es wird daher empfohlen, unabhängig von der therapeutischen Strategie Patienten mit IPF regelmäßig, möglichst alle drei Monate, klinisch und lungenfunktionell hinsichtlich des Progressionsverhaltens der Erkrankung zu kontrollieren und die Patienten über die Verlaufscharakteristiken und prognostischen Implikationen aufzuklären.
Welche Behandlungsmöglichkeiten bestehen bei der IPF?
Hinsichtlich der pharmakologischen Therapie ist die Leitlinie aus dem Jahr 2013 bereits wieder überholt, ein entsprechendes Update liegt seit Juli 2017 vor [2]. Diese empfiehlt bei Patienten mit idiopathischer Lungenfibrose nach Diagnosesicherung den Patienten über Erkrankung, Prognose, Verlauf und therapeutische Möglichkeiten zu informieren und ihm eine Behandlung mit einem anti-fibrotischen Medikament, Nintedanib oder Pirfenidon, anzubieten [2]. Nintedanib ist ein Tyrosinkinase-Inhibitor, der vor allem die Wachstumsfaktoren Fibroblast Growth Factor, Platelet Derived Growth Factor und Vascular Endothelial Growth Factor hemmt, während Pirfenidon ein sogenanntes „small molecule" ist, welches unter anderem den Wachstumsfaktor Transforming Growth Factor ß1 inhibiert. Beide Medikamente wirken in erster Linie antifibrotisch und werden als orale Dauertherapie eingesetzt. Hierbei ist es von Bedeutung, den Patienten auch über den zu erwartenden Therapieeffekt, nämlich die Reduktion der Krankheitsprogression, gemessen als Abfall der FVC, aufzuklären. Hierbei kann für Nintedanib auch eine Verlängerung der Zeit bis zur ersten akuten Exazerbation in den Studien belegt werden, während für Pirfenidon eine Verbesserung des Gesamtüberlebens nach einem Jahr und eine Stabilisierung der körperlichen Leistungsfähigkeit gemessen als Sechs-Minuten-Gehtest in den Studien gezeigt wurde. Die zu erwartenden Nebenwirkungen sind für beide Medikamente vor allem gastro-intestinaler Natur mit Übelkeit und Inappetenz sowie Gewichtsverlust. Nintedanib führt häufig zu Durchfällen während Pirfenidon Hautausschläge und Photosensibilisierung verursacht. Bei sachgerechter Betreuung sind die Nebenwirkungen jedoch meist beherrschbar, sodass bei 70 bis 80 Prozent aller Patienten die Medikamente auf Dauer eingesetzt werden können.
Eindeutig negative Empfehlungen werden ausgesprochen für die früher übliche Tripletherapie bestehend aus Prednisolon, Azathioprin und N-Acetylcystein, sowie für Endothelien-Rezeptor-Antagonisten, Imatinib, und Antikoagulation mit Vitamin K-Antagonisten. Für den Einsatz von Acetylcystein als Monotherapie, von Sildenafil und von Antacida ohne Hinweis auf Reflux ist die Datenlage unsicher, sodass weitere Studienergebnisse abgewartet werden müssen (Tabelle 3).
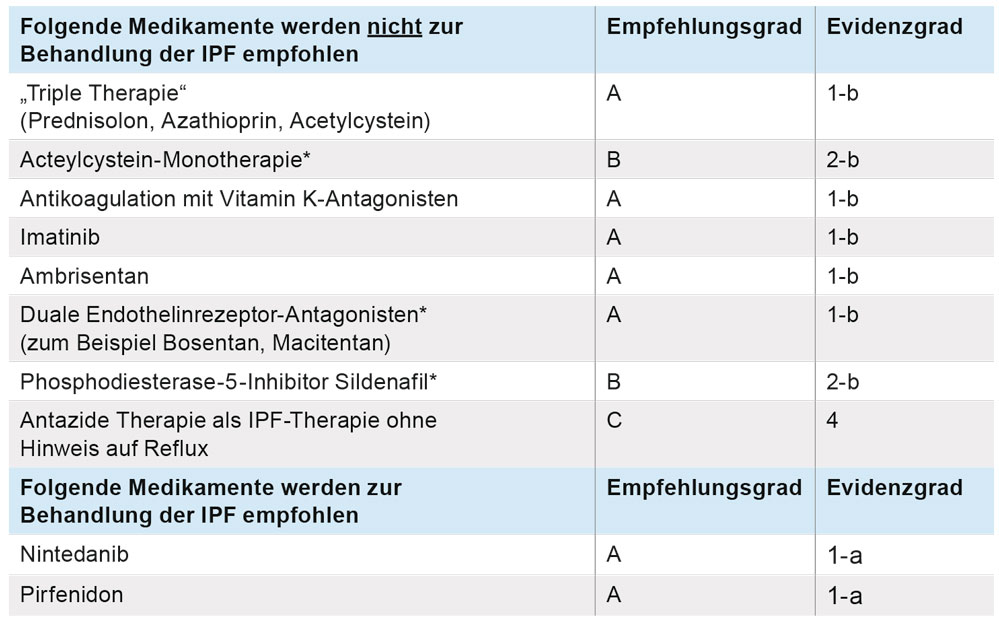 Tabelle 3: Empfehlungen zur medikamentösen Therapie der IPF [2]. * Bei den hier genannten Substanzen gibt es Hinweise aus klinischen Studien, dass IPF-Subgruppen von einer entsprechenden Therapie profitieren könnten, sodass weitere klinische Studien gerechtfertigt sind.
Tabelle 3: Empfehlungen zur medikamentösen Therapie der IPF [2]. * Bei den hier genannten Substanzen gibt es Hinweise aus klinischen Studien, dass IPF-Subgruppen von einer entsprechenden Therapie profitieren könnten, sodass weitere klinische Studien gerechtfertigt sind.
Neben der pharmakologischen Therapie werden jedoch weitere positive Empfehlungen für die Behandlung von IPF-Patienten mit Langzeitsauerstoff, für die Lungentransplantation, für die pneumologische Rehabilitation und für den Einsatz von Kortikosteroiden bei akuter Exazerbation der IPF ausgesprochen (Tabelle 4). Wichtig ist auch, den Patienten frühzeitig auf palliativmedizinische Maßnahmen hinzuweisen. Die Einleitung einer mechanischen Beatmung aus Gründen der fortschreitenden Lungenfibrose wird nicht empfohlen, sofern nicht bereits eine Listung zur Lungentransplantation besteht und somit der Einsatz eines Bridgingverfahrens (ECMO) sinnvoll sein könnte. Eine häufige Komplikation der idiopathischen Lungenfibrose ist die Entwicklung einer pulmonalen Hypertonie. Bisherige Studien, die den Einsatz einer gezielten Pulmonalen Hypertonie-Therapie bei Patienten mit idiopathischer Lungenfibrose getestet haben, verliefen jedoch negativ, sodass eine solche Behandlung außerhalb von klinischen Studien nicht empfohlen wird.
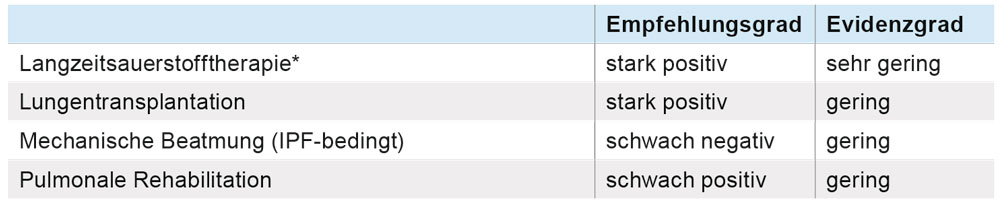
Tabelle 4: Nicht-pharmakologische Therapieoptionen [1]. * Unter Berücksichtigung der deutschen Leitlinie zur Langzeitsauerstofftherapie.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-ärzteblatt.de (Aktuelles Heft) abgerufen werden.
Der Autor erklärt, dass er keine finanziellen oder persönlichen Beziehungen zu Dritten hat, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Teilen:
Das könnte Sie auch interessieren: