Erste deutsche Leitlinie zur Divertikelkrankheit
 Divertikelkrankheit
Divertikelkrankheit
Hintergrund
Im Laufe des Lebens kommt es bei vielen Menschen zu Ausstülpungen der Kolonschleimhaut durch muskelschwache Lücken der Kolonwand (morphologisch Pseudodivertikel). Diese treten in Europa typischerweise im Bereich des Colon sigmoideum (linksseitig) auf und werden als Divertikulose bezeichnet. Die Prävalenz ist altersabhängig und liegt bei Personen unter 50 Jahren noch bei ca. zehn Prozent, steigt dann aber bis zum 80. Lebensjahr auf über 50 Prozent an. Im Gegensatz dazu sind in Asien die Divertikel typischerweise im Coecum und Colon ascendens (rechtsseitig) lokalisiert. Die Divertikel treten dabei häufig kongenital auf, sodass ein genetischer Zusammenhang vermutet wird. Zusätzlich scheint es jedoch auch einen Einfluss der Ernährung ähnlich zur linksseitigen Divertikulose zu geben.
Das alleinige Vorliegen einer Sigmadivertikulose besitzt an sich noch keinen Krankheitswert, erst bei Vorliegen von Symptomen oder dem Auftreten von Komplikationen spricht man von einer „Divertikelkrankheit“. Die Divertikelkrankheit ist in Deutschland weit verbreitet und zeigt in den vergangenen Jahrzehnten eine deutlich steigende Inzidenz. Jährlich werden über 125.000 Patienten stationär behandelt. Ein Drittel der betroffenen Patienten ist über 75 Jahre alt und die Mehrheit der betroffenen Patienten ist weiblich. Allerdings zeigt sich in den vergangenen Jahren auch eine deutliche Zunahme von jüngeren Patienten mit einer akuten Divertikulitis.
In den vergangenen Jahrzehnten hat es mit steigender wissenschaftlicher Evidenz eine stetige Weiterentwicklung in der Diagnostik und Therapie der Divertikelkrankheit gegeben, welche 2012 zur Initiierung einer Leitlinienerstellung durch die Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und die Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie (DGAV) führten. Die S2k-Konsensusleitlinie wurde 2014 veröffentlicht und beinhaltet eine neue umfassende Klassifikation der Divertikelkrankheit und hat zu einer deutlichen Änderung der Therapiestandards (siehe unten) geführt [1].
Klinisches Erscheinungsbild und Prognose
Unterschieden wird zunächst zwischen akuten und chronischen Formen der Divertikelkrankheit bzw. Divertikulitis. Eine Sonderform stellen Divertikelblutungen dar, welche die häufigste Ursache unterer gastrointestinaler Blutungen sind.
Der Krankheitsverlauf einer Divertikulitis ist interindividuell extrem variabel. So gibt es Patienten, die bereits bei dem ersten Schub einer akuten Divertikulitis eine freie Perforation entwickeln und ein akutes Abdomen präsentieren. Andere Patienten hingegen berichten über seit Jahren bestehende oder rezidivierende unspezifische Abdominalbeschwerden wie Obstipation, Meteorismus oder Unterbauchschmerzen. Die absolute Mehrheit der Patienten mit einer Divertikulose bleibt jedoch lebenslang symptomfrei.
Bei der akuten Divertikulitis kommt es zur Entzündung eines meist einzelnen Divertikels und angrenzender Strukturen. Von einer „akuten unkomplizierten Divertikulitis“ spricht man bei begrenzter lokaler Entzündungsreaktion ohne Hinweis auf eine gedeckte/offene Perforation. Die „akute komplizierte Divertikulitis“ ist durch eine gedeckte oder freie Perforation mit Ausbildung von Abszessen bzw. einer Peritonitis gekennzeichnet. Die Mehrzahl der akuten Divertikulitiden ist unkompliziert, nur ca. fünf Prozent der Patienten entwickeln eine freie Perforation. Das Risiko einer freien Perforation ist jedoch beim ersten Schub einer Divertikulitis am höchsten. Nach Abheilen der akuten Entzündung kommt es zur lokalen Bindegewebsvermehrung und Narbenbildung, welche das Risiko von Perforationen mit zunehmender Anzahl von Entzündungsschüben reduziert. Auch das Risiko einer Rezidivdivertikulitis ist nach dem ersten Schub einer akuten unkomplizierten Divertikulitis relativ gering. Über 80 Prozent der Patienten bleiben dauerhaft rezidivfrei. Kommt es jedoch zu einer Rezidivdivertikulitis so steigt das Risiko weiterer Entzündungsschübe mit zunehmender Anzahl der Entzündungsschübe stetig an [2]. Ganz anders dagegen stellt sich die Prognose nach einer „akut komplizierten Divertikulitis“ mit gedeckter Perforation und konsekutiver intraabdomineller Abszessbildung dar. Von dem betroffenen Patienten erleidet die Mehrzahl innerhalb weniger Monate einen erneuten Entzündungsschub, welcher bei etwa der Hälfte der Patienten schwerer verläuft als der erste Entzündungsschub [3].
Die chronische Divertikelkrankheit ist durch persistierende oder wiederkehrende Symptome definiert. Hierbei kommen auch Fälle ohne apparente Divertikulitis vor, welche als „symptomatische unkomplizierte Divertikelkrankheit“ bezeichnet werden und oftmals nur schwer von funktionellen Darmbeschwerden, wie dem Reizdarmsyndrom, abgegrenzt werden können. Kommt es zu rezidivierenden Entzündungsschüben spricht man von einer chronischen Divertikulitis, welche als Komplikation zur Ausbildung von Fisteln (zum Beispiel zur Harnblase) oder narbigen Stenosen mit entsprechendem Beschwerdebild führen kann.
Da eine Rückbildung der Divertikulose nicht möglich ist, gibt es im Gegensatz zur Primärprophylaxe keine generelle Empfehlung zu Ernährung, Lebensstil, körperlicher Aktivität, oder Einnahme von Mesalazin oder Probiotika.
Klassifikation der Divertikelkrankheit
Die Therapie der Divertikulitis erfolgt grundsätzlich stadienabhängig. In der Vergangenheit wurden hierzu eine Vielzahl unterschiedlicher Klassifikationssysteme entwickelt, welche jedoch bislang nicht das gesamte Spektrum der Erkrankung abdecken konnten. Die neue Leitlinie Divertikelkrankheit empfiehlt daher die Verwendung des neuen Klassifikationssystems Classification of diverticular disease (CDD, Tabelle 1). Die neue Klassifikation basiert auf den in Deutschland verbreiteten Stadieneinteilungen nach Hansen und Stock sowie der Hinchey-Klassifikation, differenziert allerdings genauer und fügt die in den bisherigen Systemen fehlenden Typen hinzu.
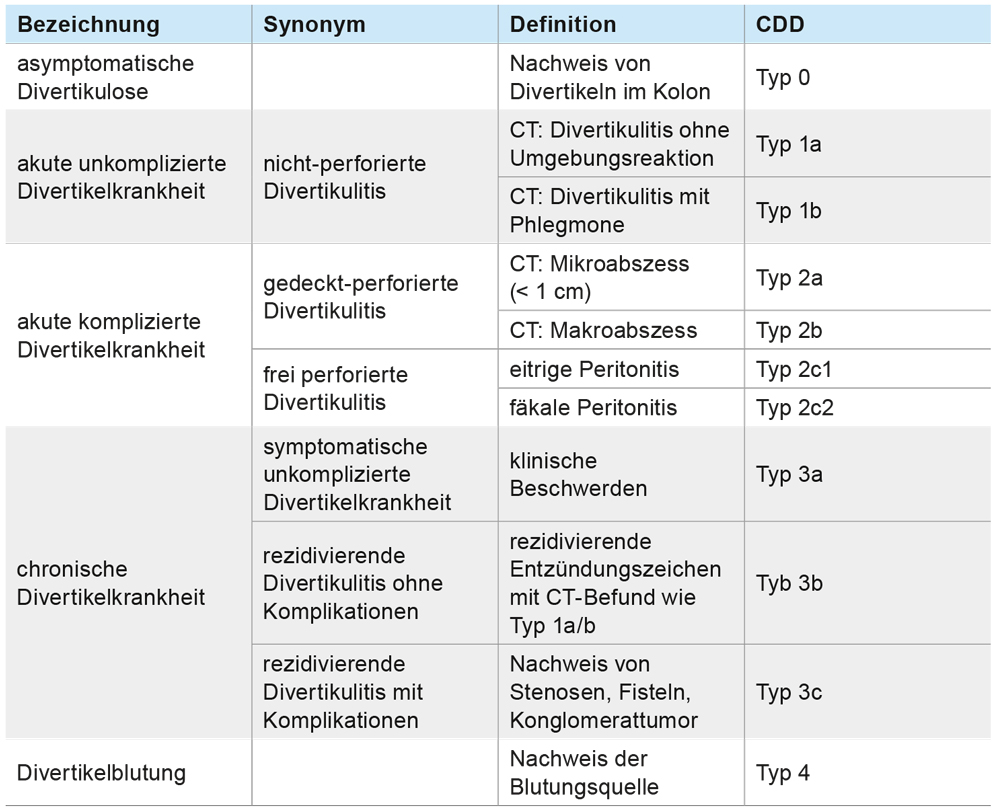
Tabelle 1: Klassifikation der Divertikelkrankheit (Classification of diverticular disease – CDD).
Zur Diagnosesicherung und Klassifikation einer akuten Divertikulitis ist ein Schnittbildverfahren erforderlich. Die Sonografie kann bei entsprechender Expertise als alleinige Methode zur Primärdiagnostik und Einteilung eingesetzt werden. Allerdings ist in Bezug auf besondere Lokalisationen wie mesenteriale oder im Becken gelegene Entzündungen oder Abszesse die Computertomografie mit intravenöser, oraler und rektaler Kontrastmittelapplikation der diagnostische Goldstandard (Abbildungen 1a bis 1d). MRT-Untersuchungen sollten nicht in der Akutdiagnostik durchgeführt werden. Als wesentliche Veränderung der Einteilung im Vergleich zur bislang verbreiteten Klassifikation nach Hansen und Stock wird die phlegmonöse Divertikulitis nun der unkomplizierten Divertikulitis (Typ 1b) zugeordnet. Daneben werden Mikro- und Makroabszesse als Zeichen einer gedeckten Perforation differenziert.
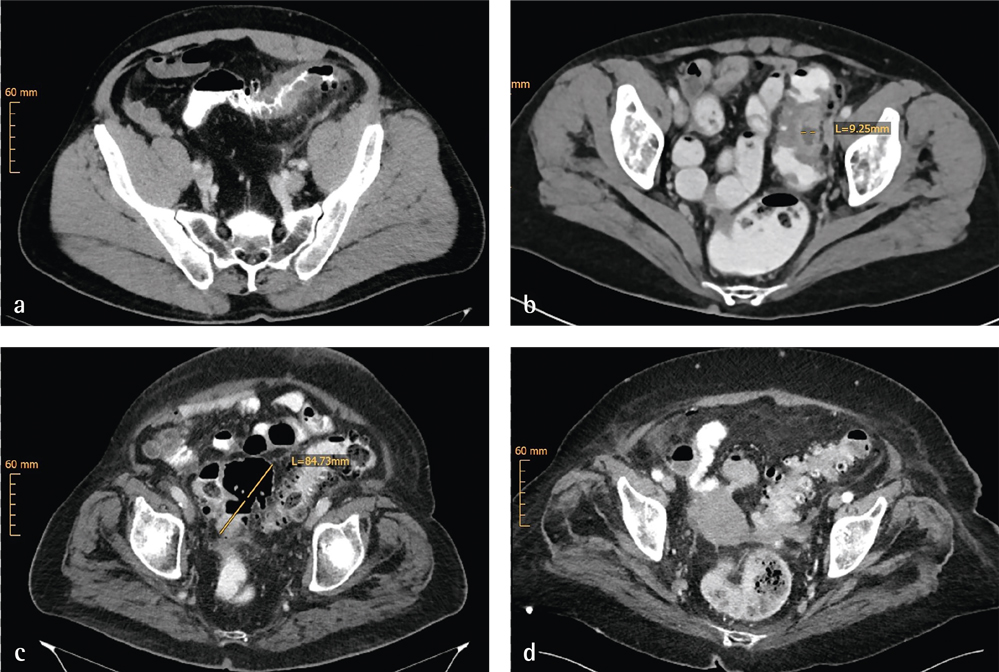
Abbildungen 1a bis d: Klassifikation der akuten Divertikulitis mittels Computertomografie des Abdomens mit intravenöser, oraler und rektaler Kontrastierung. a) CDD Typ 1B mit lokaler phlegmonöser Entzündung; b) CDD Typ 2A mit kleinem parakolischem Abszess; c) CDD Typ 2B mit gedeckter Perforation und großem pelvinen Abszess; d) CDD Typ 2C mit freier Perforation und Nachweis von intraperitonealer Luft (ventral)
Für die Klassifikation einer chronischen Divertikulitis ist die genaue Anamnese bezüglich vorausgegangener Entzündungsschübe erforderlich. Die chronische Divertikelkrankheit wird in eine unkomplizierte Form ohne Entzündungszeichen, eine rezidivierende Divertikulitis mit Entzündungszeichen und eine Form mit lokalen Komplikationen eingeteilt.
Akute Divertikulitis
Leitsymptom der akuten Divertikulitis ist der linksseitige Unterbauchschmerz. In Abhängigkeit der anatomisch variablen Lage des Sigmas kann der Schmerz jedoch auch im rechten oder mittleren Unterbauch lokalisiert sein. Laborchemisch führt die akute Divertikulitis typischerweise zu einem Anstieg der Leukozyten und des C-reaktiven Proteins (CRP). Die Höhe des CRP korreliert tendenziell mit komplizierten bzw. perforierten Entzündungen. Die Untersuchung von Patienten mit Verdacht auf eine akute Divertikulitis soll eine Palpation, Perkussion und Auskultation des Abdomens, sowie eine digitalrektale Untersuchung und Temperaturmessung beinhalten. Obwohl die Inzidenz der Divertikulitis mit höherem Patientenalter zunimmt, sollte die Divertikulitis auch als Differenzialdiagnose akuter Bauchschmerzen bei Patienten unter 40 Jahren erwogen werden.
Bei Vorliegen der Verdachtsdiagnose einer akuten Divertikulitis erfolgt die Diagnosesicherung und Klassifikation mittels Schnittbildgebung, zum Beispiel Ultraschall oder Computertomografie. Der Kolonkontrast-Einlauf soll nicht mehr zur Diagnose eingesetzt werden. Eine Koloskopie in der Akutphase sollte aufgrund des Risikos einer sekundären Perforation nicht durchgeführt werden. Patienten mit einer freien Perforation und Peritonitis müssen unmittelbar nach Diagnosestellung als Notfall operiert werden.
Die Prognose einer akuten unkomplizierten Divertikulitis ist überwiegend günstig. Randomisierte Studien konnten mittlerweile zeigen, dass beim ersten Schub einer unkomplizierten Sigmadivertikulitis, soweit kein Fieber > 39 °C, keine Sepsis, und keine Risikofaktoren wie zum Beispiel Immunsuppression vorliegen, unter engmaschiger klinischer Kontrolle auf eine Antibiotikatherapie verzichtet werden kann [4, 5]. Darüber hinaus kann auch eine orale Antibiotikatherapie durchgeführt und bei ausgewählten Patienten auf eine stationäre Aufnahme verzichtet werden. Voraussetzung zur ambulanten Behandlung sind eine suffiziente orale Nahrungs- und Flüssigkeitsaufnahme und eine engmaschige ambulante ärztliche Kontrolle. Bei Patienten mit Fieber, deutlich erhöhtem CRP und Leukozytose, oder Nachweis einer akuten komplizierten Divertikulitis erfolgt die stationäre Aufnahme und intravenöse antibiotische Therapie, zum Beispiel mit Cefuroxim bzw. Ciprofloxacin und Metronidazol oder Amoxicillin/Sulbactam. Eine strikte Nahrungskarenz ist in der Akutphase, soweit klinisch kein Ileusbild vorliegt, nicht erforderlich [6].
Gedeckte Perforationen, die zu Makroabszessen (CDD Typ 2b) führen, können, soweit perkutan erreichbar, zusätzlich interventionell drainiert werden, um eine primär konservative Therapie zu ermöglichen. Somit kann auf Resektion in der Akutphase, die mit einer entsprechend höheren Wahrscheinlichkeit einer Diskontinuitätsresektion bzw. Ileostoma-Anlage einhergehen, verzichtet werden.
Typisch im klinischen Verlauf ist ein deutlicher Rückgang der klinischen Symptomatik innerhalb von 48 Stunden. Bei Versagen der konservativen Therapie mit persistierender Entzündung und nur geringem Rückgang der klinischen Beschwerden sollte eine dringliche Sigmaresektion innerhalb weniger Tage durchgeführt werden.
Aufgrund des relativ geringen Rezidivrisikos stellt die erfolgreich konservativ behandelte akute unkomplizierte Divertikulitis keine generelle Operationsindikation dar. Dagegen sollte Patienten mit bestimmten Risikofaktoren, wie zum Beispiel nach Organtransplantation oder chronischer medikamentöser Immunsuppression, zur elektiven Sigmaresektion geraten werden, da bei diesen Patienten sowohl das Rezidivrisiko als auch die daraus resultierende Mortalität deutlich erhöht sind [7]. Falls nach Abklingen der akuten Entzündung weiterhin abdominelle Symptome, wie zum Beispiel intermittierende Passageprobleme, Meteorismus, Unterbauchschmerzen oder Koprostase persistieren, sollte die Indikation zur Sigmaresektion mit dem Patienten individuell diskutiert werden. Eine randomisierte Studie konnte eine deutlich verbesserte Lebensqualität von chronisch symptomatischen Patienten nach operativer Therapie gegenüber der konservativen Therapie nachweisen [8].
Patienten nach erfolgreich konservativ behandeltem ersten Schub einer akuten komplizierten Divertikulitis sollte aufgrund des hohen Rezidivrisikos zur elektiven Sigmaresektion nach ca. vier bis sechs Wochen geraten werden. Eine frühelektive Operation nach ca. einer Woche kann aufgrund des erhöhten Risikos insbesondere infektiöser postoperativer Komplikationen nicht als Standardvorgehen empfohlen werden [9].
Aufgrund der statistisch erhöhten Inzidenz von Kolonkarzinomen bei Divertikulitis und den potenziell ähnlichen Symptomen sollte die Indikation zur Koloskopie im Intervall großzügig bzw. präoperativ immer gestellt werden [10].
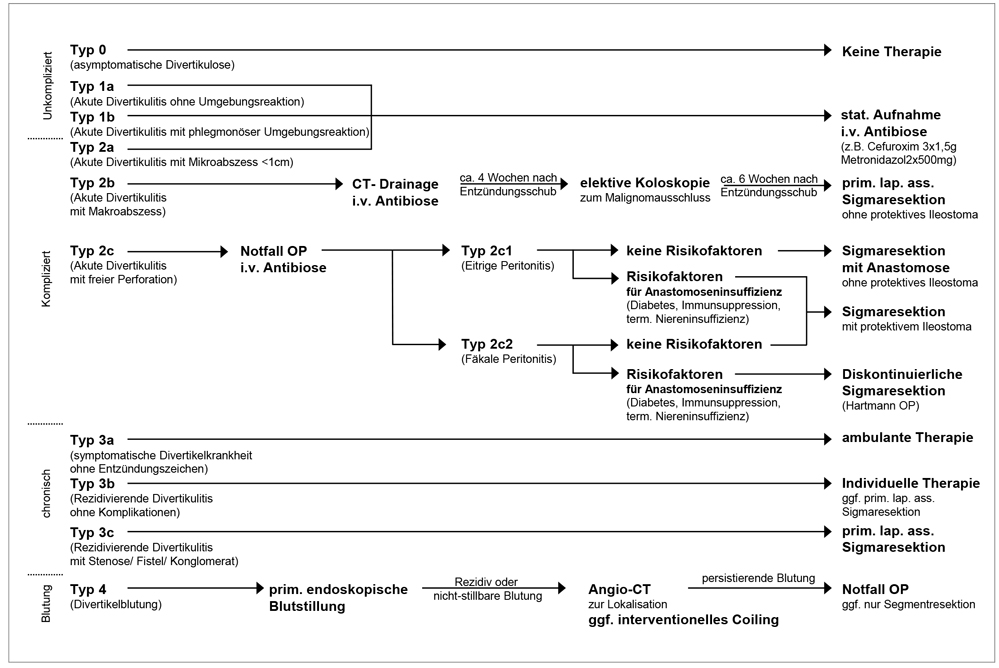
Abbildung 2: Stadiengerechte Therapie der Divertikelkrankheit.
Chronische Divertikulitis
Die Diagnostik und Therapie eines akuten Schubes einer chronischen Divertikulitis erfolgt analog zu den Empfehlungen der akuten Divertikulitis. In der Vergangenheit wurde Patienten oftmals schon nach dem zweiten Schub einer akuten unkomplizierten Divertikulitis zur elektiven Sigmaresektion geraten, um eine Perforation beim nächsten Schub zu vermeiden. Zahlreiche klinische Studien konnten jedoch zeigen, dass kein direkter Zusammenhang zwischen der Anzahl der Schübe und dem Risiko einer Perforation besteht. Daher empfiehlt sich bei einer chronisch-rezidivierenden Divertikulitis mit beschwerdefreien Intervallen ein individuell mit dem Patienten abzusprechendes Vorgehen. Sollten nach bzw. zwischen den Schüben Symptome wie zum Beispiel Schmerzen, Nahrungsmittelunverträglichkeit, Obstipation oder Meteorismus bestehen, so konnte in einer prospektiv randomisierten Studie gezeigt werden, dass sich die Lebensqualität der Patienten nach Sigmaresektion im Vergleich zur konservativen Therapie signifikant verbessert [8]. Auch bei Operationswunsch von Seiten des Patienten kann eine Sigmaresektion erwogen werden.
Kommt es hingegen im Verlauf der chronischen Divertikulitis zur Ausbildung von lokalen Komplikationen wie zum Beispiel Harnblasen- oder interenterischen Fisteln oder Stenosen, sollte eine Sigmaresektion empfohlen werden. Bei Verdacht auf eine Sigma-Blasenfistel, zum Beispiel bei unklaren rezidivierenden Zystitiden, kann bei fehlendem morphologischen Nachweis in Ultraschall oder Computertomografie eine Diagnosestellung mittels Mohnsamentest erfolgen.
Divertikelblutung
Bei unklarer Hämatochezie und bekannter Divertikulose sollte eine stationäre Aufnahme zur koloskopischen Lokalisationsdiagnostik erfolgen. Falls sich endoskopisch keine Blutungslokalisation zeigt, können zusätzlich eine CT-Angiografie, Angiografie oder Szintigrafie erfolgen [11].
Falls eine Blutungsquelle endoskopisch identifiziert werden kann, sollte auch eine endoskopische Blutstillung versucht werden. Sollte trotz einer sicheren Lokalisation der Blutungsquelle keine endoskopische Blutstillung möglich sein, besteht die Möglichkeit einer angiografischen Embolisation der Blutungsstelle. Bei Versagen dieser interventionellen Therapieversuche sollte dann eine dringliche Operation erfolgen. Allerdings besteht nach erfolgreicher angiografischer Embolisation das Risiko einer segmentalen Kolonischämie, sodass eine engmaschige klinische Kontrolle des Abdominal-befundes sowie laborchemischer Entzündungsparameter erforderlich sind.
Die überwiegende Mehrheit der Divertikelblutungen sind jedoch selbstlimitierend, sodass nach stattgehabten Divertikelblutungen keine generelle Indikation zur Sigmaresektion besteht. Falls es jedoch trotz adäquater konservativer Therapie zu rezidivierenden und klinisch relevanten Blutungen kommt, sollte eine frühelektive Operation erfolgen.
Chirurgische Therapie
Aufgrund der aktuellen Datenlage ist es zu einem gewissen Rückgang der Indikationen zur chirurgischen Therapie der Divertikulitis gekommen. Dennoch müssen die Aussagen der Leitlinien differenziert betrachtet werden und die chirurgische Therapie, zumeist in Form der Sigmaresektion, bleibt weiterhin integraler Bestandteil der Therapie über alle Stadien der Divertikelkrankheit hinweg. Die entsprechenden Indikationen und operativen Dringlichkeiten sind in Tabelle 2 dargestellt.
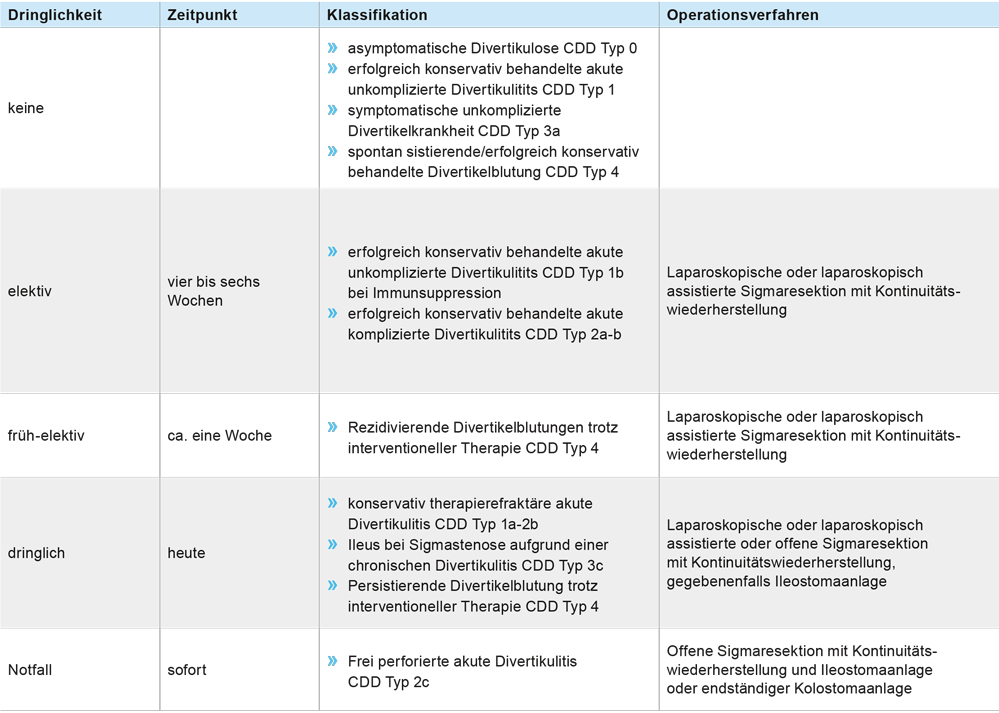
Tabelle 2: Indikationen und Dringlichkeit zur chirurgischen Therapie der Divertikelkrankheit.
Wie in vielen anderen Bereichen der Viszeralchirurgie hat sich auch in der chirurgischen Therapie der Divertikelkrankheit zunehmend ein laparoskopisches Vorgehen durchgesetzt. Ein laparoskopisches Vorgehen ist, eine entsprechende chirurgische Expertise vorausgesetzt, auch im Notfall bei frei perforierten Divertikulitiden von der Leitlinie zugelassen. Dennoch muss darauf hingewiesen werden, dass trotz anfänglicher Euphorie bezüglich der Vorteile einer laparoskopischen Sigmaresektion, die Vorteile anfangs überschätzt wurden. Grundsätzlich besteht bei laparoskopischen Operationen ein geringeres Risiko für Wundinfektionen und die Entstehung postoperativer Verwachsungen, und auch das Risiko von Narbenhernien ist reduziert. Jedoch konnte eine deutsche prospektiv randomisierte Studie zeigen, dass es bei identischem perioperativen Management nicht zu einer generellen Reduktion von schweren postoperativen Komplikationen oder einer verbesserten Lebensqualität kommt [12].
Bei frei perforierter Sigmadivertikulitis mit septischem Krankheitsbild wird aufgrund der kürzeren Operationszeit vielmals das primär offen chirurgische Vorgehen via Medianlaparotomie favorisiert. Jedoch wird die vormalig und auch heute noch in vielen Ländern häufig praktizierte Diskontinuitätsresektion nach Hartmann mit Anlage eines endständigen Descendostomas nicht mehr als Standardvorgehen empfohlen. Vielmehr sollte bei Patienten ohne entsprechende Risikofaktoren der Versuch einer Kontinuitätswiederherstellung mit Anastomose versucht werden. Im Zweifelsfall kann die Anastomose durch Vorschalten eines doppelläufigen Ileostomas geschützt werden.
Neben der Sigmaresektion wurden in den vergangenen Jahren intensiv alternative chirurgische Therapiekonzepte, insbesondere die laparoskopische Lavage des Abdomens ohne Resektion des perforierten Sigmas klinisch evaluiert. Die Metaanalyse der durchgeführten prospektiven randomisierten klinischen Studien ergab jedoch, dass dieses Vorgehen zu einer deutlichen Erhöhung von interventionspflichtigen Komplikationen im Vergleich zur bisherigen Standardtherapie führte [13].
Das Literaturverzeichnis kann im Internet unter www.bayerisches-ärzteblatt.de (Aktuelles Heft) abgerufen werden.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.

Professor Dr. Christoph-Thomas Germer
Korrespondenzadresse: Dr. Johan Friso Lock, Klinik & Poliklinik für Allgemein- und Viszeralchirurgie, Gefäß- und Kinderchirurgie, Universitätsklinik Würzburg, Oberdürrbacher Straße 6, 97080 Würzburg, E-Mail: Lock_J(at)ukw.de
Teilen:
Das könnte Sie auch interessieren: