Drei Highlights aus der Herzchirurgie
 Herzchirurgie
Herzchirurgie
Die Herzchirurgie ist eine relativ junge Disziplin, die sich seit der Erfindung der Herz-Lungen-Maschine und der Kardioprotektion vor etwa 50 Jahren ständig weiterentwickelt. Koronar-, Herzklappen- und Aortenchirurgie sind ebenso zur Routine geworden wie die Kinderherzchirurgie und die Herztransplantation. Die Indikationsspektren und operativen Techniken werden ständig erweitert bzw. verbessert, um auch die Patienten operieren zu können, die ein besonders hohes Risiko aufweisen oder bislang überhaupt nicht versorgt wurden. Hierbei ist anzumerken, dass die heutzutage operierten Patienten zu mehr als 50 Prozent über 70 Jahre alt sind.
Die drei Fälle zeigen komplexe Verläufe, wie sie sich aus dem Allgemeinkrankengut ergeben können.
Fall 1
Ein 56-jähriger Patient wurde mit dem Bild einer dekompensierten Linksherzinsuffizienz bei hochgradiger Aortenklappenstenose mit schlechter linksventrikulärer Pumpfunktion und begleitender pneumogener Sepsis in einem städtischen Klinikum aufgenommen. Anamnestisch war es vier Monate zuvor zu einem ST-Hebungsinfarkt gekommen, der mittels PTCA und Stent behandelt wurde. Zusätzlich war eine ICD-Implantation (Implantierbarer Defibrillator/Cardioverter) erfolgt. Außerdem war eine Aortenklappenendokarditis mit Actinomyces meyeri konservativ behandelt worden. Aufgrund der Vorbefunde wurde der Patient zum dringlichen Aortenklappenersatz übernommen. Nach Implantation einer mechanischen Herzklappe blieb das schwer vorgeschädigte Herz hochgradig kontraktionsgestört, sodass der Patient nur mithilfe eines ECMO-Systems (ECMO = Extrakorporale Membranoxygenierung) zu stabilisieren war. Das auch ECLS (Extracorporeal life support) genannte System entspricht einer Mini-Herz-Lungen-Maschine und besteht aus einer Kreiselpumpe (= Herzersatz) und einem sogenannten Oxigenator (= Lungenersatz). Venöses Blut wird über eine große Körpervene (meist Femoralvene) entnommen und nach Sauerstoffanreicherung über den Oxigenator in eine große Arterie (meist Femoralarterie) zurückgepumpt. Obwohl eine ECLS-Therapie bei kardialem Versagen über Wochen hinweg eingesetzt werden kann, wurde schnell klar, dass sich das Herz nicht mehr erholen würde. Nach drei Tagen wurde daher ein implantierbares Linksherzunterstützungssystem (LVAD) implantiert, wofür die mechanische Aortenklappe gegen eine biologische ausgetauscht werden musste. Da auch die Funktion des rechten Herzens kritisch war, wurde zusätzlich ein sogenanntes temporäres Rechtsherzunterstützungssystem implantiert, das nach einer Woche wieder entfernt werden konnte. Nach einem schwierigen postoperativen Verlauf erholte sich der Patient zusehends und wurde für eine Herztransplantation angemeldet. Mit seinem Kunstherzunterstützungssystem lebte der Patient drei Jahre zuhause ohne wesentliche Komplikationen. Als sich bei einer ambulanten Vorstellung eine irreparable Beschädigung des bereits infizierten Steuerkabels zeigte, erhielt der Patient die hochdringliche Priorität durch Eurotransplant auf der Warteliste. Nach 1.130 Tagen stand ein geeignetes Spenderherz zur Verfügung. Bei der Herztransplantation wurde auch das ICD-System wieder entfernt. Der postoperative Verlauf gestaltete sich komplikationslos, sodass der Patient bereits 14 Tage später entlassen werden konnte.
Dieser Fall zeigt, welche Entwicklung eine an sich nicht sehr problematische Aortenklappenstenose nehmen kann und mit welchen technischen Möglichkeiten heutzutage der Kreislauf bei Patienten mit schwerer Herzinsuffizienz oder drohendem Schock bzw. malignen Rhythmusstörungen zunächst akut und dann für lange Zeit stabilisiert werden kann. Hervorzuheben ist vor allem die Möglichkeit, verschiedene Therapieverfahren zu kombinieren – Koronarstent, implantierbare ICD und Klappenersatz gefolgt von ECLS und implantierbarem Linksherz- sowie temporärem Rechtsherzunterstützungssystem. Das LVAD kann hierbei als Dauerlösung verbleiben oder als Langzeitüberbrückung bis zu einer Herztransplantation dienen [1, 2, 3].
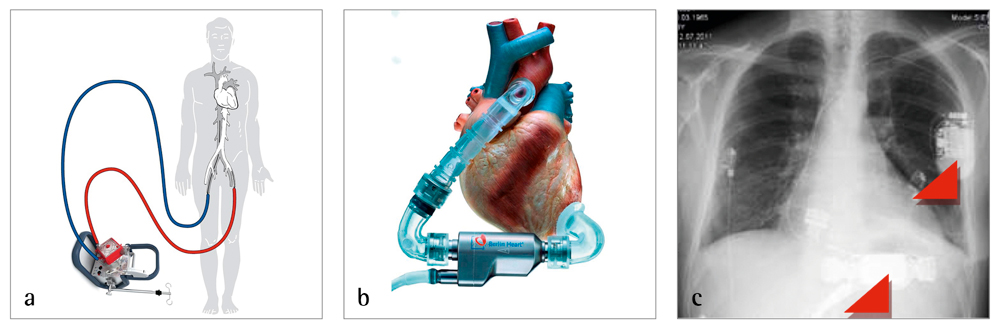
Abbildungen 1 a bis c: a) ECLS-System mit Kanülierung von Arteria und Vena femoralis (Cardiohelp, Maquet ®); b) implantierbares LVAD (Incor, BerlinHeart ®) (pumpt vom Apex des linken Ventrikels zur Aorta ascendens); c) Röntgenbild mit ICD (Defibrillationssonde im rechten Ventrikel) und LVAD.
Fall 2
Ein 74-jähriger Patient stellte sich notfallmäßig mit linksthorakalen Schmerzen vor. Der Patient gab an, am Vorabend akute Brustschmerzen gehabt zu haben und vor drei Wochen gestürzt zu sein und eine Rippenprellung davongetragen zu haben. Der Patient war kreislaufstabil und neurologisch unauffällig. Die orientierende echokardiografische Diagnostik ergab eine Aortendissektion Typ A mit einem sieben Zentimeter messenden Perikarderguss und einen Hämatothorax links. Die Infarktenzyme waren negativ, die D-Dimere (2,4 mg/dl), Leukozyten (12,8/ul) und CRP (11,3 mg/l) leicht erhöht. Da ein Infarktgeschehen unwahrscheinlich war, wurde der Patient sofort auf die Intensivstation der Herz-Thorax-Chirurgie verlegt und auf eine Herzkatheteruntersuchung verzichtet. Hier kam es zu einem erneuten Schmerzereignis mit nachfolgender Hypotonie, sodass der Patient notfallmäßig intubiert und hoch katecholaminpflichtig in den OP verbracht wurde. Bei zunehmender hämodynamischer Instabilität entschloss man sich dort unmittelbar, die Herz-Lungen-Maschine über die Leistengefäße (Arteria und Vena femoralis) anzuschließen. Normalerweise erfolgt dies über die rechte Arteria subclavia und den rechten Vorhof des Herzens. Der Patient wird mithilfe einer entsprechend ausgestatteten Herz-Lungen-Maschine auf 20 bis 25 Grad abgekühlt. Nach Eröffnung des Brustkorbs über eine mediane Sternotomie zeigte sich ein komplett eingeblutetes Mediastinum, jedoch kein frisches Blut im Perikard. An der Aorta fand sich ein großes periaortales Hämatom, insbesondere im Aortenbogen. Nach Einleitung eines Herzstillstands wurde die geklemmte Aorta ascendens bis zum sinotubulären Übergang reseziert. Die Aortenklappe war intakt, die disseziierten Schichten der Aortenwurzel konnten durch Verklebung stabilisiert und eine im Durchmesser 30 mm messende Dacronrohrprothese anastomosiert werden. Im nachfolgenden kompletten Kreislaufstillstand fand sich ein Einriss des gesamten Aortenbogens entlang aller Kopfgefäße, sodass der gesamte Aortenbogen reseziert werden musste. Die Wiederherstellung von Aorta ascendens und Aortenbogen erfolgte durch die sogenannte „Frozen Elephant Trunk“-Technik, das heißt mithilfe einer Stentgraftprothese (= Aortenstent + Dacronrohrprothese). Der Stentanteil (= „Elefantenrüssel“) wurde in der Aorta descendens fixiert, mit der Rohrprothese wurde der Aortenbogen ersetzt, wobei die Kopfgefäße einzeln wieder mit der Aorta verbunden wurden. Während dieser Zeit wurde ausschließlich das Gehirn mit Blut versorgt, während der restliche Körper nur durch die niedrige Temperatur geschützt wurde. Abschließend wurde die Stentgraftprothese mit der Aorta ascendens-Prothese verbunden und der Blutfluss im Körper wieder hergestellt. Nach Wiedererwärmen des Patienten wurde die Herz-Lungen-Maschine abgestellt und das Brustbein wieder verschlossen.
Die Typ A-Dissektion ist eine akut lebensbedrohliche Situation mit extrem hoher Letalität. In der Mehrzahl der Fälle genügt es, die Aorta ascendens und eventuell den proximalen Aortenbogen zu ersetzen. Bei einem Einriss der Dissektionsmembran im Aortenbogen wird heutzutage zumeist eine sehr umfangreiche operative Versorgung mithilfe einer Kombination aus Gefäßprothese und Aortenstent angestrebt. Die Rohrprothese dient dem Ersatz von Aorta ascendens und Aortenbogen, der anhängende Stent wird in der proximalen Aorta descendens platziert. Dies stabilisiert den besonders kritischen Bereich der Aorta am besten und ermöglicht die Implantation weiterer Gefäßstents in der Aorta descendens bei dort noch bestehender Aortendissektion [4, 5, 6].
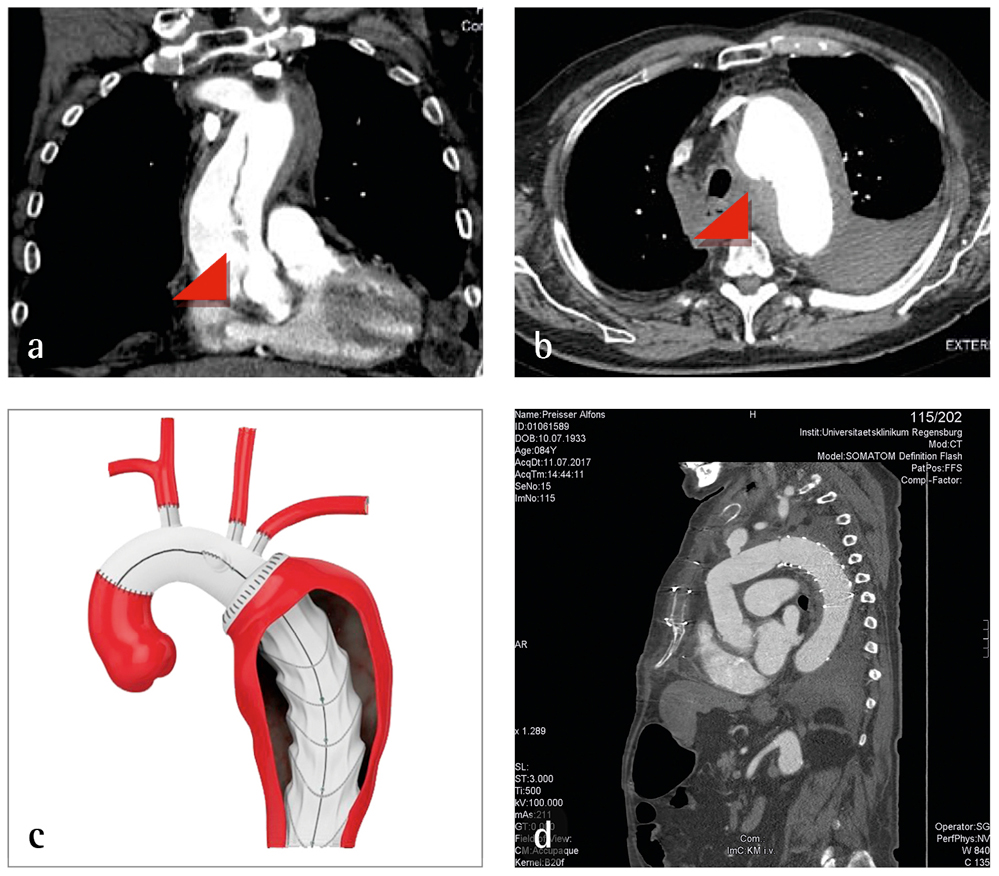
Abbildungen 2 a bis d: a) CT-Thorax mit Dissektionsmembran; b) Aortenbogenruptur; c) Stentgraftprothese (Evita Open, Jotec ®); d) postoperatives Ergebnis.
Fall 3
Ein 77-jähriger Patient mit bekannter hochgradiger Aortenklappenstenose wurde mit zunehmender Belastungsdyspnoe und Angina eingewiesen. Die Klappenöffnungsfläche der Aortenklappe betrug 0,6 cm2 (normal: 2 bis 3 cm2), der transvalvuläre maximale Druckgradient lag bei 77 mmHg (normal: kein Gradient) bei erhaltener linksventrikulärer Pumpfunktion. Anamnestisch bestanden ein Blasenkarzinom, ein Zustand nach Apoplex und eine kürzlich erfolgte Hüfttotalendoprothesenimplantation. Aufgrund des klinischen Zustands und des fortgeschrittenen Alters wurde im interdisziplinären Konsens des Heartteams ein Transkatheteraortenklappenersatz beschlossen. Die Klappenimplantation erfolgte transapikal über eine kleine anterolaterale Thorakotomie im 5. Intercostalraum. Über eine Tabaksbeutelnaht an der linksventrikulären Herzspitze wurde zunächst die Aortenklappenstenose mit einem Ballonkatheter gesprengt und anschließend eine „Sapien-XT-Klappe“ (29 mm) problemlos verankert. Nach unkompliziertem Verlauf konnte der Patient nach einer Woche in die Anschlussheilbehandlung entlassen werden.
Knapp fünf Jahre später wurde der Patient erneut mit einer kardialen Dekompensation vorstellig. Der inzwischen 81-jährige Patient wies eine Ruhedyspnoe und deutliche Ödeme auf. Die eingeleitete Diagnostik zeigte eine gute Funktion der Aortenklappenprothese mit noch normaler linksventrikulärer Pumpfunktion, eine koronare Herzerkrankung konnte ausgeschlossen werden. Als Ursache der Beschwerden fand sich eine hochgradige Mitralklappeninsuffizienz mit Prolaps des vorderen Mitralsegels. Im Heartteam wurde die Empfehlung für einen MitraClip ausgesprochen, was der Patient zunächst jedoch ablehnte. Erst nach einer weiteren Dekompensation drei Monate später willigte er ein und wurde nach einer weiteren Dekompensation durch die kardiologischen Kollegen erfolgreich mit einem MitraClip versorgt. Es wurden zwei MitraClips gesetzt, die das Mitralvitium bis auf eine leichtgradige Insuffizienz reduzierten. Trotz Harnwegsinfekts und Influenzanachweises erholte sich der Patient gut und konnte nach Vollmobilisierung entlassen werden.
Patienten mit erheblicher Komorbidität und damit assoziiertem erhöhten Risiko für ein konventionelles Operationsverfahren können heutzutage ab dem 75. Lebensjahr mit einem Transkatheteraortenklappenersatz versorgt werden. Die Entscheidung hierzu wird gemeinsam durch einen Herzchirurgen, einen Kardiologen und einen Anästhesisten im Heartteam getroffen. Der Eingriff erfolgt ebenfalls interdisziplinär in einem speziellen Hybrid-Operationssaal. Die Klappen können transfemoral (am häufigsten), transapikal über die Herzspitze des linken Ventrikels, über die Arteria subclavia und transaortal (nach Sternotomie) implantiert werden. Analog können MitraClips bei Patienten mit Mitralinsuffizienz und hohem Operationsrisiko platziert werden, auch wenn dieses Verfahren zumeist keinen vollständigen Klappenschluss wiederherstellen kann. Die Entscheidung für eine MitraClip-Implantation muss ebenfalls im Heartteam erfolgen, die Implantation erfolgt stets über eine Femoralvene. Somit können heutzutage auch als inoperabel geltende Patienten mit Aortenstenose und Mitralinsuffizienz interdisziplinär gut interventionell therapiert werden [7-10].
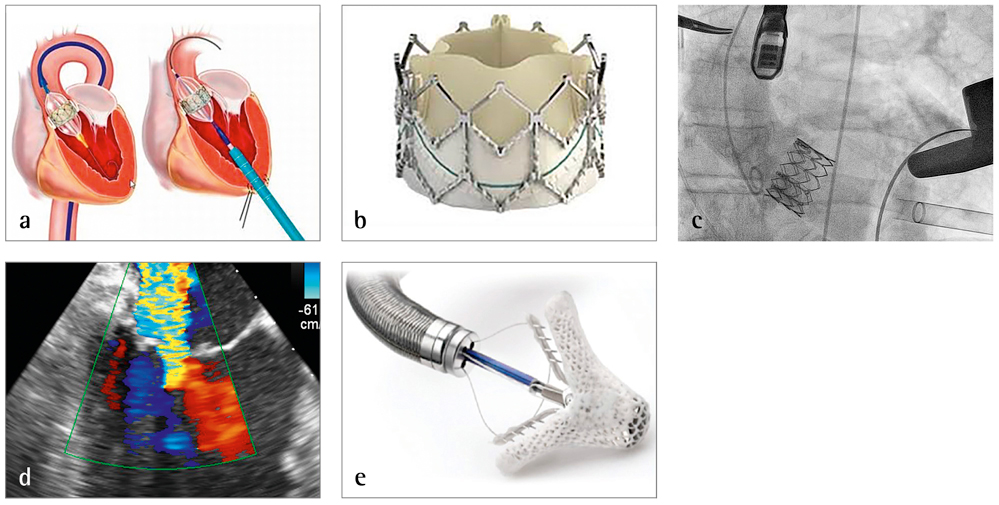
Abbildungen 3 a bis d: a) TAVI-Prinzip transfemoral (links) und transapikal (rechts); b) Sapien XT-Klappe (Edwards ®); c) der transapikale Klappenersatz (Durchleuchtung); d) hochgradige Mitralinsuffizienz (2D-Echo); e) MitraClip (auf Katheter montiert, fasst beide Mitralsegel und verbindet sie) (Abbott ®).
Das Literaturverzeichnis kann im Internet unter www.bayerisches-ärzteblatt.de (Aktuelles Heft) abgerufen werden.
Der Autor erklärt, dass er keine finanziellen oder persönlichen Beziehungen zu Dritten hat, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Autor
Direktor der Klinik und Poliklinik für Herz-, Thorax- und herznahe Gefäßchirurgie,
Universitätsklinikum Regensburg,
Franz-Josef-Strauß-Allee 11,
93053 Regensburg
Teilen:
Das könnte Sie auch interessieren: